Method Article
-Base de células madre Inmunidad Diseñado frente a la infección por VIH en el modelo de ratón humanizado
En este artículo
Resumen
This protocol describes the methods in constructing a humanized bone-marrow/liver/thymus mouse model with stem cell-based engineered immunity against HIV infection.
Resumen
Con el rápido desarrollo de terapias génicas basadas en células madre contra el VIH, no hay presión requisito de un modelo animal para estudiar la diferenciación hematopoyética y la función inmune de las células modificadas genéticamente. El humanizado de médula ósea / del hígado / timo (BLT) modelo de ratón permite la completa reconstitución de un sistema inmunológico humano en la periferia, que incluye las células T, células B, células NK y monocitos. El implante del timo humano también permite la selección tímica de las células T en el tejido tímico autólogo. Además del estudio de la infección por VIH, el modelo se presenta como una herramienta poderosa para estudiar la diferenciación, el desarrollo y la funcionalidad de las células derivadas de células madre hematopoyéticas (HSC). Aquí describimos la construcción de humanizado diabéticos no obesos (NOD) -severe inmunodeficiencia combinada (SCID) de la cadena gamma nocaut -común (c γ - / -) ratones -Bone ósea / hígado / timo (NSG-BLT) con HSC transducidas con receptor de antígeno quimérico CD4 (CD4CAR)vector lentivirus. Se demuestra que la CD4CAR HSC puede diferenciar con éxito en múltiples linajes y tienen actividad anti-VIH. El objetivo del estudio es demostrar el uso de modelo de ratón NSG-BLT como un modelo in vivo para la inmunidad contra el VIH ingeniería. Vale la pena señalar que, dado que se utiliza lentivirus y el tejido humano, los experimentos y las cirugías deben realizarse en una cabina de bioseguridad de clase II en un nivel de bioseguridad 2 (BSL2) con precauciones especiales instalación (BSL2 +).
Introducción
A pesar del éxito de la terapia anti-retroviral combinada, la infección por VIH sigue siendo una enfermedad de por vida. La respuesta inmune celular contra el VIH juega muy importante papel en el control de la replicación del VIH. Los recientes avances en la manipulación de células madre ha permitido para el rápido desarrollo de la terapia génica enfoques para el tratamiento del VIH 1-3. Como resultado de ello, es importante tener un modelo animal adecuado que permite el estudio in vivo de la eficacia de las terapias basadas en células contra el VIH.
Trabajando con el VIH en modelos animales se complica por el hecho de que el virus sólo infecta las células humanas. Para evitar esta limitación, los científicos han recurrido al uso de modelos de enfermedades como el virus de inmunodeficiencia de los simios (SIV) en macacos Rhesus 4,5. Por desgracia, existen importantes limitaciones en este modelo debido a las diferencias inherentes entre las especies y las diferencias entre SIV y el VIH. Además, sólo las instalaciones altamente especializados son capable de apoyar el trabajo con los primates no humanos y macacos cada uno requiere una gran inversión. Por lo tanto, hay una necesidad urgente de un modelo que utiliza el sistema inmunitario humano, que es susceptible a la infección por VIH / patogénesis, y es menos económicamente prohibitivo.
El diabético no obeso (NOD) -severe inmunodeficiencia combinada (SCID) de la cadena gamma nocaut -común (c γ - / -) (o NSG) Sangre / Hígado / timo (BLT) modelo de ratón humanizado se demuestra cada vez más como una herramienta importante para estudiar la infección por el VIH. Mediante la implantación de células madre hematopoyéticas (HSC) y timo fetal, los ratones son capaces de desarrollar y recapitular un sistema inmunológico humano 1-3. Un tipo de terapia génica basada en células madre implica 'redirigir "células T periféricas a diana del VIH mediante la reprogramación de las células madre hematopoyéticas (HSC) para diferenciarse en células T específicas de antígeno. Hemos demostrado previamente que las CMH de ingeniería con un anti-VIH específicos de células T re clonado molecularCeptor (TCR) contra el epítopo SL9 (aminoácido 77 a 85; SLYNTVATL) del VIH-1 Gag puede redirigir células madre en células formadoras de T maduras que suprimen la replicación del VIH en el GSN-BLT modelo de ratón humanizado 6. La advertencia de utilizar un TCR clonado molecular es que se limita a un subtipo específico del antígeno leucocitario humano (HLA) que limitar la aplicación de esta terapia. receptores de antígenos quiméricos (CAR), por el contrario, pueden aplicarse universalmente a todos los subtipos de HLA. Se llevaron a cabo estudios iniciales utilizando un CAR construido con los dominios extracelulares y transmembrana de CD4 humano fusionado al dominio intracelular de señalización CD3 ζ (denominado el CD4ζCAR). CD4ζCAR expresa en las células CD8 T pueden reconocer envoltura del VIH y desencadenar una respuesta de células T citotóxicas que es similar a la mediada por un receptor de células T 7. Recientemente hemos demostrado que HSCs humanas se pueden modificar con CD4ζCAR, que puede diferenciarse en múltiples li hematopoyéticoneages, incluyendo las células T funcionales capaces de suprimir la replicación del VIH en el modelo de ratón humanizado 8. Con el rápido avance en las terapias de los receptores de antígeno quiméricos para el cáncer de 9, y la caracterización en curso de anticuerpos neutralizantes amplias potentes 10-12 contra el VIH que permiten la construcción de las CAR de anticuerpos de cadena única, es perceptible que muchos nuevos constructos candidatos, además de CD4ζCAR , será generado y probado para la terapia génica basada en células madre de enfermedades de VIH y otras enfermedades. Además, el modelo de ratón humanizado GSN-BLT que contiene estos coches específicos de antígeno también puede proporcionar una herramienta útil para examinar de cerca las respuestas de células T humanas in vivo. Es importante destacar que nuestro protocolo difiere de los métodos anteriores descritos para la construcción de humanizada de ratones BLT 13-15 en que el HSCs en mezcla de proteína gelatinosa se utiliza en lugar de los troncos de hígado fetal 16. Este protocolo describe: 1) la construcción de humanilos ratones BLT zed ingeniería con CD4ζCAR; y 2) la caracterización de la diferenciación de las células modificadas genéticamente; y 3) la caracterización de la funcionalidad de las células modificadas genéticamente.
Protocolo
Declaración de ética: tejido fetal humano se obtuvo de Advanced Biosciences Recursos o desde Novogenix y se obtuvo sin identificar información y no requería la aprobación del IRB para su uso. La investigación con animales descritos en este manuscrito se llevó a cabo bajo la aprobación por escrito de la Universidad de California, Los Ángeles, y el Comité de Investigación (UCLA) Animal (ARC), de conformidad con todas las leyes federales, estatales y directrices locales. En concreto, estos estudios se llevaron a cabo en estricta conformidad con las directrices de la Guía para el Cuidado y Uso de Animales de Laboratorio del Consejo Superior de Investigaciones Científicas y la acreditación y directrices de la Asociación para la Evaluación y Acreditación de Laboratorio Animal Care (AALAC) Internacional en virtud de la UCLA ARC Protocolo Número 2010-038-02B. Todas las cirugías se realizaron bajo la ketamina / xilacina y anestesia con isoflurano y se hicieron todos los esfuerzos para minimizar el dolor y el malestar de los animales.
1. Construcción de ratones humanizados Diseñado con CD4 quimérico Receptor de Antígeno
- El procesamiento de timo fetal y el aislamiento de células madre hematopoyéticas CD34 + de hígado fetal
- Procesamiento timo
- Lave suavemente el timo en solución salina tamponada con fosfato (PBS), pH 7,4, en un tubo cónico de 15 ml. Repita el paso de lavado 3 - 4 veces.
- Añadir 7 ml de medio RPMI + 10% de FBS + penicilina / estreptomicina. Decantar todo en un 100 mm placa de Petri estéril.
- Utilice escalpelos para cortar el timo en pequeños trozos de aproximadamente 1 mm 2. Coloca cada pieza única del timo en un solo pozo en una placa de 96 pocillos. El uso de fórceps curvado contundentes al transferir piezas timo a la placa de 96 pocillos.
- Añadir una pequeña cantidad de medios de comunicación (100 - 200 l) a todos los pocillos de manera que el tejido no se seca. Visualizar bajo el microscopio (timos tienen lóbulos y debe mirar como sacos de células).
NOTA: Descarte cualquier piezas que parecen cuestionables en cualquier forma;a menudo existe tejido conectivo y esto no debe ser implantado.
- Añadir una pequeña cantidad de medios de comunicación (100 - 200 l) a todos los pocillos de manera que el tejido no se seca. Visualizar bajo el microscopio (timos tienen lóbulos y debe mirar como sacos de células).
- Retire las piezas-timo confirmada y ponerlo todo en un matraz de cultivo de células T25. Añadir 7 ml de medio RPMI suplementado con 10% de SFB y 450 mg / ml de piperacilina / tazobactam y anfotericina B. matraz de roca suavemente para mezclar. La cultura de la noche a la mañana matraz a 37 ° C / 5% de CO 2.
NOTA: Este paso es necesario para evitar la contaminación bacteriana del tejido. - (Paso opcional) Congelar el timo para su uso futuro. Equilibrar los trozos en 90% de suero humano AB con 10% sulfóxido de dimetilo (DMSO) durante 10 min. Congelación de ellos a una velocidad de 1 ºC / min a -50 ºC, a continuación enfriamiento rápido a -150 ºC. Cuando esté listo para descongelar, descongelar rápidamente en un baño de agua a 37 ° C y lavar suavemente 3x en medio RPMI completo sin DMSO.
- Procesamiento de hígado
- Lave suavemente el hígado en PBS en un tubo cónico de 50 ml. Repita el paso de lavado 3 - 4 veces.
- Añadir 10 ml (Modificado de Dulbecco Medios de Iscove) medios IMDM al tubo cónico de 50 ml. Decantar todo en una placa de Petri estéril 100 mm.
- Homogeneizar el tejido hepático usando dos escalpelos. Cortar el hígado en trozos pequeños de aproximadamente 3 mm 2. Cortar y desechar cualquier tejido conectivo blanco.
- Utilice la jeringa de 10 ml equipada con una aguja roma de calibre 16 para tomar los pedazos de hígado y medios de comunicación. A continuación, traslado a un tubo cónico de 50 ml.
- Resuspender suavemente la suspensión de los medios de comunicación y el tejido y expulsar 5-7 veces más para homogeneizar el tejido por completo.
- Preparar 10 ml de medio IMDM suplementado con enzimas: 500 U / ml de colagenasa, 2400 U / ml hialuronidasa, y 300 U / ml de DNasa, así como 450 mg / ml de piperacilina / tazobactam y anfotericina B. Filtrar los medios de comunicación a través de un filtro de 0,22 micras y luego agregar los medios de comunicación a la suspensión de hígado.
- Se tapa el tubo cónico de 50 ml que contiene la suspensión hígado y sellar herméticamente con una película autosellante como Parafilm to evitar fugas. Girar en un rotador de tubos en la incubadora a 37 ° C durante 90 minutos.
- Se filtra la suspensión celular digerida a través de un filtro de células de 100 micras en un tubo fresco 50 ml.
NOTA: Añadir PBS a la suspensión para llevar el volumen total hasta 50 ml. Dividir esta en dos tubos de tubos de 50 ml, conteniendo cada uno 25 ml de suspensión celular. - Lenta y suavemente subyacer las células en cada tubo con 10 ml de medio de densidad de centrifugación (por ejemplo, Ficoll). Girar a 1.200 xg durante 20 min sin freno. Nota: Todas las centrifugación mencionado en este protocolo se realiza a temperatura ambiente (25 ºC).
- Retire cuidadosamente la interfaz (es decir., La capa leucocitaria) de cada tubo y transferencia a dos tubos de 50 ml separados. Llevar el volumen de cada tubo de interfaz de hasta 50 ml con PBS. Girar a 300 xg durante 7 - 10 minutos a. Aspirar el sobrenadante con cuidado.
- Combinar los dos gránulos. Lavar tres veces más con 50 ml de PBS que contenía 2% de FBS. Centrifugado a 300 xg durante 7 a 10 men cada tiempo mientras se aspira cuidadosamente el sobrenadante.
- Resuspender el precipitado en 50 ml de medio RPMI + 10% de FBS. Recuento de células utilizando un hemocitómetro en este momento antes de proceder a la clasificación de células.
- Ordenar CD34 + células por medio de la clasificación de inmediato CD34 Kit (por ejemplo., CD34 micro perlas), de acuerdo con el protocolo del fabricante.
NOTA: Como alternativa, las células pueden ser cultivadas en medio RPMI + 10% de FBS en millón / ml durante la noche. - Ahorrar CD34 + y CD34- fracción.
NOTA: En este paso, las células CD34 + y CD34 se pueden congelar usando Bambanker medios de congelación u otros medios de congelación. Congelación de 1 ml de 4 - 6 x 10 células CD34 + 6 por tubo y congelar 1 ml de 40 - 60 x 10 6 células CD34 por tubo.
- Procesamiento timo
- Transducción de células CD34 +
- Calcular el número de pozos de transducción requeridos de una placa de 6 pocillos de cultivo de tejidos. 1 bien se puede usar para transducir hasta 8 x 10 6 células. porcada ratón BLT, 0,5 x 10 6 células CD34 + se implanta junto con las células CD34- y timo debajo de la cápsula renal y las células de 0,5 x 10 6 CD34 + se inyectará por vía intravenosa. El número de células CD34 + a utilizar se determina por el número de ratones (1 millón de células por ratón).
- Coat el número necesario de pocillos de una cultura no tejido tratado placa de 6 pocillos con 1,25 ml de la solución de fibronectina humana recombinante (por ejemplo., RetroNectin) (20 g / ml en PBS) en cada pocillo. Cubrir la placa y dejar reposar durante 2 horas a temperatura ambiente en una cabina de bioseguridad limpia.
- solución de fibronectina Aspirar de los pocillos y añadir 1,25 ml de tampón FACS (PBS con 4% de FBS) a cada pocillo para bloquear. Deje que la placa reposar a temperatura ambiente (25 ° C) durante 30 minutos.
- Aspirar tampón FACS y pozos de lavado una vez con PBS.
- Mantenga PBS en los pocillos recubiertos hasta que la placa está lista para su uso. Guarde la placa a 4 ° C durante la noche si no se utiliza inmediatamente.
- Células de la placa CD34 + en la infección por Medio (2% albúmina de suero humano en libre de suero de células T de Yssel Medium) en pocillos recubiertos de fibronectina de solución-(~ 2 x 10 6 células / ml) e incubar a 37 ºC durante 1 hora.
- Usar una pipeta para añadir vector lentiviral a los pocillos a una multiplicidad de infección (MOI) entre 2 - 10. suavemente la mezcla y se incuba durante la noche a 37 ºC.
NOTA: El título del vector lentiviral utilizada debe ser determinado de antemano. - Recoger las células a la mañana siguiente, raspando suavemente en el fondo de los pocillos con un rascador de células. Recoger las células y contar con hemocitómetro en este momento.
- Para preparar las células para implante, se combinan 0,5 x 10 6 células CD34 + transducidas con 4,5 x 10 6 células CD34 por ratón, alícuota en tubos estériles con tapón de rosca de 1,5 ml. Girar las células hacia abajo a 300 xg para sedimentar ellos, se aspira el sobrenadante. Girar de nuevo a 300 xg y aspirar cualquier resto de sobrenadante con una pipeta P10 y aspirando muy carefully. Mantener los gránulos secos en hielo durante todo el estudio. Nota: Para asegurarse de que las células son viables, utilizar las células sedimentadas y realizar la cirugía dentro de las 2-3 horas.
- Para preparar las células para inyección, con buenos efectos de 0.5 x 10 6 células CD34 + transducidas por ratón para sedimentar ellos, se aspira el sobrenadante. Resuspender las células en 100 l de RPMI medios por ratón y mantener en hielo.
- Para comprobar la eficacia de transducción, alícuota ~ 1 x 10 5 no transducidas y transducido células CD34 + a partir de cada condición y la cultura en 200 medio de citoquinas l (medio RPMI con 10% de FBS, complementado con 100 ng / ml de IL-3 humana, IL-6 , SCF) en placas de 96 pocillos durante 5 - 7 días a 37 ºC.
NOTA: Las células utilizadas en este paso no se utiliza para la cirugía, pero para asegurarse de que la transducción tiene éxito y el vector no es tóxico para la supervivencia de células madre y la renovación. La eficacia de transducción se puede comprobar mediante la búsqueda de la expresión génica del vector (por ejemplo., GFP y CD4) y analizar por citometría de flujo.
- Los trasplantes de tejidos para la construcción de ratones genéticamente modificados
- En el mismo día antes de la cirugía realizar irradiación corporal total de los ratones inmunocomprometidos NOD.Cg- Prkdc scid IL2RG t m1Wjl / SZJ (NSG) con un irradiador de cesio-137 y una dosis de 2,7 Gy (270Rad).
NOTA: Los ratones GSN son severamente inmunocomprometidos. Por tanto, su vivienda y el mantenimiento deben ajustarse a la norma de salud más alto y manipulados por personal altamente capacitado. - Verter piezas del timo y el medio del matraz en una placa de 60 mm. Verter PBS en otro 60 mm plato, que se utiliza para limpiar el trocar y mantener el riñón húmedo.
- Chill puntas de pipeta de desplazamiento positivo, colocándolos en tubos de 1,5 ml con tapón de rosca estériles abiertos en el hielo. Mantener en hielo con los sedimentos celulares secos y mezcla de proteína gelatinosa, como Matrigel.
NOTA: Es importante mantener la mezcla de proteína gelatinosa y cualquier tubo o consejos quetocará el frío en todo momento hasta que se cargue la aguja de implante. - Anestesiar a los ratones: Pesar los ratones individualmente y pesos de registro; oreja perforar los ratones contar. Inyectar ellas por vía intraperitoneal con 15 l de ketamina (2,6 mg / ml en solución salina) / xilazina (100 mg / ml en solución salina) por gramo de peso corporal). Ponga los ratones nuevo en la jaula y esperar a que sea totalmente anestesiado.
NOTA: Compruebe el nivel de anestesia del ratón apretando una pata. Si el ratón se estremece por reflejo, administrar 25-50% de la cantidad original de ketamina / xilazina para anestesiar el ratón más lejos. Espere hasta que no se inmutó por reflejo para realizar la cirugía. - El uso de la maquinilla Oster (máquina de afeitar), afeitarse el lado izquierdo de cada ratón desde la cadera hasta el hombro entre el centro de la espalda y el estómago. Por vía subcutánea inyectar 0,3 ml de la carprofeno diluido (6 mg / kg) en el hombro del animal o triángulo inguinal (pit pierna). El uso de un hisopo de algodón, poner una pequeña gota de lágrimas artificialesen cada ojo y poner el ratón en su lado de nuevo en la jaula.
NOTA: Límite de la cirugía de preparación de una jaula (aproximadamente 4-5 ratones) a la vez. - Enjuague la cánula de la aguja de implante cáncer de calibre 16 (trocar) con PBS. Con un par de pinzas curvas contundentes, coloque un pedazo de timo de la placa de 60 mm en la abertura de la cánula con el trocar dentro de la abertura, a continuación, tire hacia atrás del trocar para aspirar el tejido en la cánula.
- Usar una pipeta de desplazamiento positivo y una punta fría para poner 5 l de mezcla de proteína gelatinosa frío en el tubo con un sedimento de células se secaron (mezcla de CD34 + y CD34- para células implantadas) y suavemente se agita para generar suspensión celular. No pipetear arriba y abajo. Pipetear la suspensión mezcla / célula proteína gelatinosa en la abertura de la cánula y lentamente tire hacia atrás del trocar para cargar la aguja.
NOTA: Se recomienda tener un ayudante para cargar la pipeta mientras que uno manipula la aguja de implante. - hisopo de la zona afeitada del ratón con povidona yodada y, posteriormente, frote el área con un paño con alcohol tres veces. Determinar el punto más oscuro debajo de la piel. Esto indica la ubicación del bazo. El riñón es de aproximadamente 5 mm dorsal al bazo. Levante la piel con pinzas curvas y hacer una incisión larga de 15 mm con tijeras quirúrgicas en la piel paralelo al bazo. A continuación, hacer un corte similar en el peritoneo capa de abajo. En los hombres, el riñón debe ser fácilmente visible, y puede ser extruida simplemente pulsando sobre el abdomen. Usted puede apoyar el riñón con una pinza hemostática o un par de pinzas romas curvos. En las mujeres, los ovarios tienden a obstruir el riñón de fácil extracción. Usando una pinza hemostática, recoger cuidadosamente el ovario y exponer el riñón.
- Utilice las pinzas de punta de aguja para arrancar un pequeño agujero en el extremo posterior de la cápsula renal.
NOTA: No utilice estas pinzas de punta de aguja para manejar materiales biológicos peligrosos. - Deslice el implanteaguja en este agujero y a lo largo del riñón hasta que la abertura de la cánula está completamente cubierta por la cápsula renal.
- extrudir suavemente el tejido bajo la cápsula renal, y tire de la aguja de vuelta. Las piezas de timo pueden ser pegajosas a fin de utilizar unas pinzas curvas para asegurarse de que la pieza de timo no sale con la aguja.
- Alza el peritoneo con las pinzas y utilizar con cuidado la pinza hemostática para empujar el riñón nuevo en su lugar. Ate una puntada de doble nudo en el peritoneo usando Vicryl 4-0 suturas absorbibles. Use dos Autoclips clips de la herida para cerrar la piel.
- Mezclar las células CD34 + transducidas que se reservan para la inyección y la absorción 100 l (0,5x10 6 células) en una jeringa de insulina. Inyectar estas células en el ratón a través de inyección en la vena retroorbital o otras vías de inyección intravenosa. El uso de un hisopo de algodón, poner una pequeña gota de lágrimas artificiales en cada ojo y poner el ratón en su parte posterior en una jaula.
- Una vez que todos los ratones han been implanta, confirman que los animales están recuperando la conciencia y deambular normalmente antes de salir de ellos.
- El cuidado post-operativa: El día después de la cirugía, por vía subcutánea inyectar 0,3 ml de carprofeno diluida (6 mg / kg) y 1,2 ml de solución salina estéril en cada ratón. 2 y 3 días después de la cirugía, por vía subcutánea inyectar 1,5 ml de solución salina estéril en cada ratón. Monitorear los ratones y las incisiones de 10-14 días después de la cirugía. Retire el Autoclips y pesar los ratones después de 10-14 días. NOTA: Los ratones son lentas después de la radiación y la inyección de solución salina impide que los animales que se deshidrate.
- Después de 8 - 10 semanas, comprobar el injerto por sangrado los ratones y la realización de análisis FACS en la sangre periférica, la tinción de marcadores tales como CD45, CD3, CD4, CD8, y cualquier genes del vector debe expresar.
- En el mismo día antes de la cirugía realizar irradiación corporal total de los ratones inmunocomprometidos NOD.Cg- Prkdc scid IL2RG t m1Wjl / SZJ (NSG) con un irradiador de cesio-137 y una dosis de 2,7 Gy (270Rad).
2. Caracterización de la diferenciación y desarrollo de las células gen modificado
- Caracterización deGen modificado Las células de la sangre periférica
- 8 - 10 semanas después del trasplante, obtener 50 - 100 l de sangre de ratón a partir de sangrado retro-orbital. Colocar en tubos de microcentrífuga que contiene 10 l de EDTA. centrifugar las células a 350 xg durante 3 min. Recoger plasma. Congelar a -80ºC para el análisis ELISA o ensayo de carga viral en plasma si el ratón está infectado por el VIH.
- Añadir 2 ml de solución de NH4Cl (83%) para lisar las células rojas de la sangre. Se incuba durante 5 minutos a temperatura ambiente (25 ºC). Después de la incubación, añadir 10 ml de RPMI 10% FBS para llenar el tubo. Girar a 300 xg durante 5 min. Aspirar el sobrenadante con cuidado. Las células están listas para inmuno-tinción y citometría de flujo análisis y otros ensayos.
NOTA: Los marcadores de varios linajes de células hematopoyéticas, la activación y marcadores fenotípicos de células de los animales o de la memoria se puede medir cada 2 semanas antes y después de la infección por VIH mediante citometría de flujo. Gates, son creados por tinción de las células con controles de isotipo. Se recomienda para teñir del healtPBMCs humanos hy y el uso que como control positivo. Alternativamente, el ratón puede ser sacrificado y hasta 1 ml de sangre periférica se puede obtener de punción cardiaca que proporcionará suficientes células para múltiples paneles de análisis de flujo 17.
- Caracterización del gen modificado Las células de bazo, el timo y la médula ósea
- Cosecha bazo, el timo y la médula ósea de los ratones humanizado BLT
- La eutanasia a los ratones mediante sobredosis de isoflurano. Confirmar la eutanasia con dislocación cervical secundaria. Pulverizar la superficie de la canal con 70% de etanol para mantener la piel se adhiera a los tejidos. Precisar las extremidades en una bandeja de cera de disección.
- Con unas tijeras quirúrgicas, cortar y abrir la piel, y luego se corta a través de la capa peritoneal para exponer la cavidad del cuerpo.
- Extirpar el bazo utilizando pinzas. Retirar el implante del timo en el riñón usando pinzas y tijeras. Poner el implante del timo y el bazo en la etiqueta conta tuboscaniza 5 ml de PBS.
- Desde mitad del abdomen cortar y quitar la piel de la parte distal del ratón que cubre las extremidades inferiores.
- Cortar los músculos de las extremidades inferiores con unas tijeras y dislocar cuidadosamente el acetábulo de la articulación de la cadera. Retire el fémur y la tibia y colocarlos en un tubo que contiene 5 ml de PBS.
- Aislamiento de esplenocitos
- Colocar un filtro de células 100μm en un tubo cónico de 50 ml. Mojar el filtro con 3 ml de medio RPMI suplementado con FBS al 10% y penicilina / estreptomicina (medio RPMI completo).
- Coloque el bazo en el filtro de células. Uso del émbolo de goma de una jeringa de 10 ml, triturar el bazo para disociar a través del filtro en el tubo de 50 ml.
- Enjuague el filtro de células con 5 ml de medio completo RPMI 4 a 5 veces.
- Girar las células a 300 xg durante 10 min.
- Aspirar el sobrenadante y pellet se resuspende en 5 ml de tampón de lisis de glóbulos rojos. Se incuba a tempera ambientetura durante 10 minutos. Añadir 20 ml de RPMI medio completo y centrifugado a 300 xg durante 7 minutos.
- Aspirar el sobrenadante y pellet se resuspende en 10 ml de medio completo RPMI y filtrar de nuevo a través de un filtro de 100 micras de células. Recuento de células usando un hemocitómetro.
NOTA: Las células se pueden utilizar para ensayos ex vivo, análisis de flujo y se pueden congelar de manera viable para su uso posterior. Antes de recuento de células, Trypan azul se puede utilizar para determinar el número de células viables.
- Aislamiento de los timocitos humanos de implante
- Coloque el timo en 5 ml de PBS en un pocillo de una placa de 6 pocillos. Utilizando unas pinzas y tijeras de punta roma limpias cortan el timo en trozos pequeños.
- Colocar un cuadrado de malla de acero inoxidable esterilizado en el pozo. Uso del émbolo de goma de una jeringa de 10 ml, triturar las piezas del timo en la malla de acero inoxidable para romper el timo.
- Resuspender las células bien y filtrar a través de un tamiz de 100 micras de células. Girar las células a 300 xg durante 10 min.Suspender las células en 10 ml de RPMI medio completo. Si matas son visibles, pasar las células resuspendidas a través de un filtro de células de nuevo.
- Recuento de células usando un hemocitómetro.
Nota: Las celdas se pueden utilizar para el análisis de flujo y de manera viable congelados para su uso posterior.
- Aislamiento de células de la médula ósea
- Limpiar y esterilizar el mortero y mortero con 70% de etanol. Coloque el fémur y la tibia en el mortero. Añadir 5 ml de PBS frío. Utilizar mano de mortero para machacar los huesos hasta que el PBS se vuelve de color rosa claro y despejado.
- Pipetear arriba el líquido del mortero y del filtro a través de un filtro de células de 50 M colocado en un tubo cónico de 50 ml. Lavar mortero con 5 ml de PBS y repetir cinco veces hasta que se convierte en PBS clara.
- Girar las células hacia abajo a 300 x g durante 7 min. Aspirar el sobrenadante y resuspender en 10 ml de RPMI medio completo.
- Recuento de células usando un hemocitómetro.
NOTA: Las células pueden usarse para ensayos ex vivo, análisis de flujo y puede ser viable f congeladao después de usar.
- Cosecha bazo, el timo y la médula ósea de los ratones humanizado BLT
3. Caracterización funcional de las células gen modificado
- Infección por VIH y Supervisión de la replicación viral a través del tiempo
- Después de la confirmación de la reconstitución del sistema inmunológico humano, inyecte la cantidad deseada del virus del VIH a través de inyección en la vena retro-orbital usando una jeringa de insulina. Después de la infección por VIH, recolectar 100 l de sangre periférica mediante sangrado retroorbital cada 2 semanas.
- Cosecha de plasma siguiendo los pasos en la parte 2.1.1 - 2.1.2. Para el ensayo de carga viral de VIH, extraer el ARN viral usando el kit de extracción de ARN de acuerdo con las instrucciones del fabricante y medir la carga viral por el tiempo real de RT-PCR con los conjuntos de cebador y sonda adecuadas para el virus VIH utilizado 4,8,18,19.
- Para medir la célula asociada ARN del VIH e identificar células que están infectadas activamente por el VIH, realizar primero la lisis RBC siguientes pasos 2.1.2
- suspensión de células resuspender en 1; Ml de PBS, se divide uniformemente en dos tubos. Girar a 300 xg durante 5 min. Aspirar el sobrenadante.
- Para medir la célula RNA asociado, extracto de ARN utilizando el kit de extracción de ARN de acuerdo con las instrucciones del fabricante y realizar en tiempo real RT-PCR utilizando conjuntos de cebadores y sondas apropiados.
NOTA: Es importante que el cebador / sonda no reconoce el lentivirus utilizado para las células madre modificadas - Para medir el VIH células infectadas por flujo, volver a suspender las células en el otro tubo en 50 l de tampón FACS y realizan manchas superficiales con el anticuerpo deseado, tal como anti-CD45, anti-CD4 y anti-CD3. Después de manchas superficiales, fijar y permeabilizar las células y tinción intracelular para la expresión de la mordaza utilizando anticuerpos anti-Gag (clon KC57). Realizar citometría de flujo.
- Ex Vivo de citoquinas Ensayo de el gen modificado Las células de esplenocitos
- esplenocitos de ratones de cosecha, como se describe en el apartado 2.2.2.
- Preparar las células diana. Para probar la funcionalidaddad de las células T modificadas del receptor de antígeno quimérico CD4, utilizar las células infectadas por el VIH T1 como células diana. Infectar las células T1 con VIH 3 días antes del ensayo de citoquinas, confirmar la infección por VIH mediante la tinción de las células intracelularmente con anti VIH-anticuerpo gag (clon KC57). Utilice células T1 no infectadas como células diana control.
- Co-incubar esplenocitos con células diana o de control en relación 1: 1 durante la noche. Para el mejor resultado, llevar a cabo una valoración (1: 1, 1: 3, 1: 9) de efector (esplenocitos) frente a células diana (T1 infectados). Por ejemplo, resuspender 0,9 millones de esplenocitos en 0,25 ml de medio RPMI completo, añadir 0,9, 0,3 o 0,1 millones de infectados o no infectados T1 T1 resuspendieron en 0,25 ml de medio RPMI completo.
- A la mañana siguiente, añadir inhibidor del transporte de la proteína durante 6 horas para inhibir el transporte de proteínas y realizar la tinción de marcadores extracelulares y la expresión intracelular de citoquinas tal como se describe anteriormente en 8.
Resultados
La Figura 1 muestra un esquema de la construcción de ratones humanizados BLT con células madre modificada. 10 semanas después de la cirugía de implante, se sacrificaron los ratones para evaluar la diferenciación y el desarrollo de células modificadas de genes. Como se muestra en la Figura 2, múltiples tejidos linfoides (sangre, bazo, timo y médula ósea) se recogieron de un ratón que se ha modificado con CD4ζCAR. El CD4ζCAR utilizado en este protocolo contiene CD4 receptor de antígeno quimérico y GFP que puede ser detectada por el anticuerpo anti-CD4 y la expresión de GFP 8. Se aislaron las células y se tiñeron con anticuerpos contra CD45 humano, así como de anticuerpos anti-CD4 y se analizaron por citometría de flujo. se detectaron GFP y células positivas dobles CD4, lo que indica la presencia de células CD4CAR + en múltiples tejidos linfoides.
Para investigar la diferenciación de las células modificadas de genes, los esplenocitos se tiñeron con anticuerpos contra CD45 humano (linfocitos), CD3 (células T), CD19 (células B), CD14 (monocitos y macrófagos) y CD337 (células NK). Como se muestra en la Figura 3, las células madre hematopoyéticas CD4ζCAR diferenciarse en múltiples linajes.
Para investigar si las células CD4CAR modificados son funcionales, que coincubated esplenocitos con células diana que las células CD4CAR reconocerían (T1 células infectadas por el VIH o las células no infectadas T1 como control). Las células se co-incubaron durante la noche y se añadió el inhibidor del transporte de la proteína durante 6 horas adicionales. Después, las células se fijaron y se permeabilizaron para la tinción para la expresión intracelular de citoquinas tales como IFN y TNF. Como se muestra en la Figura 4, las células que expresan CAR producen mayor cantidad de IFN y TNF con células T1 infectados.
carga / 54048 / 54048fig1.jpg "/>
Figura 1: Esquema de construcción de los ratones humanizados BLT con células madre modificadas FT:. Timo fetal. FL:. Hígado fetal Haga clic aquí para ver una versión más grande de esta figura.

Figura 2:. Células modificadas CD4 receptor de antígeno quimérico se pueden detectar en varios tejidos linfoides de ratón con HSCs modificado CD4CAR se sacrificaron 10 semanas después de la cirugía y múltiples tejidos linfoides fueron cosechadas y las células se tiñeron con anticuerpos CD4 CD45 anti-humano y anti-humanos y se analizaron mediante citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
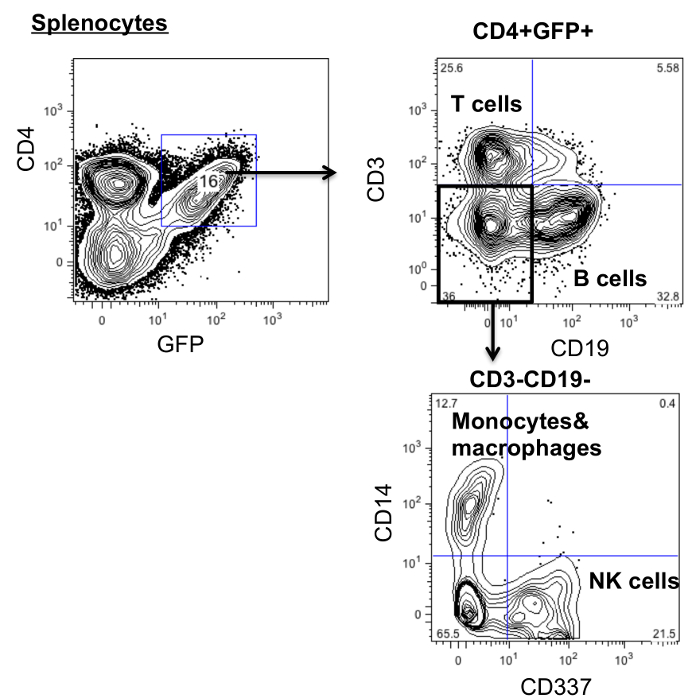
Figura 3:.. Células modificadas CD4 de los receptores de antígeno quimérico pueden diferenciarse en múltiples linajes esplenocitos de ratones modificados CD4CAR se cosecharon y se tiñeron con anticuerpos contra CD45 humano, CD3, CD19, CD14 y CD337 y se analizó mediante citometría de flujo favor, haga clic aquí para ver una mayor versión de esta figura.
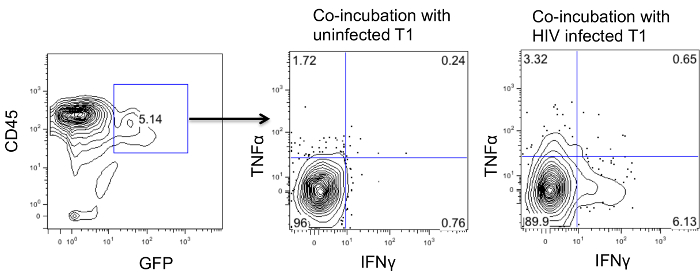
Figura 4: Ej. Ensayo de citoquinas in vivo de las células CD4 + T CAR esplenocitos de los ratones infectados con el VIH CD4CAR se estimularon con células T1 infectado o no infectado por el VIH y su producción intracelular de citoquinas se muestra. Por favor, haga clic aquí para competirwa versión más grande de esta figura.
Discusión
Con CAR y ganando impulso inmunidad ingeniería basada en HSC hacia los estudios clínicos, es importante tener un modelo animal adecuado para examinar de cerca la diferenciación y función de estas células modificadas. En este protocolo se describen los métodos para la construcción y prueba de ratones humanizados con células madre modificadas genéticamente manipulados contra el VIH. Es importante tener la transducción eficiente de células madre antes del trasplante. Sin embargo, debido a la capacidad de las células T para proliferar a partir del reconocimiento de las células diana, los bajos niveles de modificación de células madre eran suficientes para generar una respuesta sólida contra la replicación del VIH 8.
No obstante, para lograr un alto nivel de modificación de células madre, se recomienda utilizar células CD34 + transducidas células en la mezcla de proteína gelatinosa con timo autólogo en lugar de trozos de hígado y timo para la cirugía de ratones que habían sido descritos en otras partes 13-15. mezcla de proteína gelatinosa es un solubilized tejido membrana basal rica en proteínas de la matriz extracelular. En condiciones fisiológicas normales, la mezcla de proteína gelatinosa polimeriza para producir una matriz reconstituida, biológicamente activa y estable que permitir la unión y la diferenciación efectiva de la célula madre 20. la reconstitución de células humanas se puede comprobar mediante sangrado retro-orbital y citometría de flujo 6 - 8 semanas después de la cirugía. Para asegurar que el vector no es tóxico para la supervivencia de células madre y la renovación, se recomienda para titular el vector en las células CD34 + antes del experimento como se describe en 1.2.6.
La capacidad del modelo de ratón NSG-BLT para apoyar la infección de la mucosa, viremia consistente y respuestas inmunes celulares hace que sea un modelo muy útil para estudiar la patología inmune VIH y terapias basadas en células para el tratamiento de la infección por VIH 1. Lo más importante, las células T generadas a partir de los ratones NSG-BLT se seleccionan en el tejido tímico autólogo, permitiendo que el investigador para estudiar el destinode modificación de genes de células madre después de la selección tímica 8,21. Con el método descrito, hemos sido capaces de conseguir un 40% -90% de la reconstitución de las células inmunes humanas constantemente. Los bajos niveles de reconstitución de células humanas pueden resultar de múltiples factores, incluyendo las capacidades de la persona que realiza la cirugía y la calidad de los tejidos para el trasplante. Para lograr un alto nivel de reconstitución de células humanas, es importante para asegurar que los trasplantes se colocan de forma segura debajo de la cápsula renal. Además, es muy recomendable para examinar cada implante del timo preparada para la cirugía bajo microscopio de luz y desechar piezas cuestionables.
Aunque el modelo de BLT ratón humanizado es una herramienta prometedora para el estudio de la inmunidad contra el VIH ingeniería (revisado en 1,15,22), tiene sus propias limitaciones. A saber, este modelo no imita perfectamente un sistema inmune periférica humana. Los estudios han demostrado el desarrollo de problemas de hiper-mutado, Antibo IgG cambio de clasedy 1,23. Además, el uso de ratones inmunodeficientes es un desafío técnico y el mantenimiento de estos ratones sanos requiere considerables recursos y formación. infecciones oportunistas sutiles diferencias pueden manifestarse como significativas entre las muestras y potencialmente tener consecuencias negativas en la experimentación. Por lo tanto, es importante contar con instalaciones bien preparados y personal debidamente capacitado para mantener la integridad de la futura 1,24 datos. Con estas limitaciones en mente, el modelo de ratón humanizado GSN-BLT todavía proporciona una herramienta importante para el estudio de la inmunidad de ingeniería basada en células madre, como lo demuestran estos ejemplos 4,8.
Con la tendencia de desarrollar receptores de antígenos quiméricos basado en una amplia VIH anticuerpos neutralizantes 10 y modificación del dominio de señalización para CAR más eficiente 25, este modelo y el protocolo se pueden utilizar para caracterizar e investigar la funcionalidad del gen modificado cells con una nueva generación de automóviles. Además, este modelo puede potencialmente dar cabida a los estudios sobre la terapia basada inmune (tales como el bloqueo del receptor inhibidor) en conjunción con la inmunidad de ingeniería.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We would like to thank Ms. Jessica Selander in providing artistic assistant in making our figures. This work was funded by grants from the NIAID/NIH, grant no. RO1AI078806, the UCLA Center for AIDS Research (CFAR), grant no. P30AI28697, the California Institute for Regenerative Medicine, grant no. TR4-06845, the American Federation for AIDS Research (amfAR), grant no. #108929-54-RGRL, and the UC Multi-campus Research Program and Initiatives, California Center for Antiviral Drug discovery (CCADD)
Materiales
| Name | Company | Catalog Number | Comments |
| CD34 microbead kit | Miltenyi | 130-046-702 | For sorting human CD34+ progenitor cells |
| Bambanker | Wako | 302-14681 | For freezing cells |
| QIAamp Viral RNA kit | Qiagen | 52904 | For measuring viral load in the serum |
| MACSQuant Flow Cytometer | Miltenyi | For flow analysis | |
| BD LSRFortessa™ | BD biosciences | For flow analysis | |
| Hyaluronidase | Sigma | H6254-500MG | For tissue digestion |
| Deoxyribonuclease I | Worthington | LS002006 | for tissue digestion |
| Collagenase | Life technology | 17104-019 | for tissue digestion |
| CFX Real time PCR detection system | Biorad | For measuring viral load and gene expression | |
| Mice, strain NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ | The Jackson Laboratory | 5557 | For constructing the humanized mice |
| Penicillin Streptomycin (Pen Strep) | Thermo Fisher Scientific | 10378016 | For culturing cells |
| Piperacillin/tazobactam | Pfizer | Zosyn | Anti-fungal |
| Amphotericin B (Fungizone antimycotic) | Thermo Fisher Scientific | 15290-018 | Anti-fungal |
| Autoclip Wound Clips, 9 mm - 1,000 units | Becton Dickinson | 427631 | For surgery |
| Sterile Poly-Reinforced Aurora Surgical Gowns, 30 per case | Medline | DYNJP2707 | For surgery |
| Sutures, 4-0, vicryl | Owens and Minor | 23000J304H | For surgery |
| Alcohol prep pads | Owens and Minor | 3583006818 | For surgery |
| Gloves, surgical, 6 1/2 | Owens and Minor | 4075711102 | For surgery |
| Yssel’s Serum-Free T-Cell Medium | Gemini Bio-products | 400-102 | For CD34+ cell transduction |
| Human Serum Albumin | Sigma-Aldrich | A9511 | For CD34+ cell transduction |
Referencias
- Karpel, M. E., Boutwell, C. L., Allen, T. M. BLT humanized mice as a small animal model of HIV infection. Current opinion in virology. 13, 75-80 (2015).
- Zhen, A., Kitchen, S. Stem-cell-based gene therapy for HIV infection. Viruses. 6 (1), 1-12 (2014).
- Goulder, P. J. R., Watkins, D. I. HIV and SIV CTL escape: implications for vaccine design. Nature Reviews: Immunology. 4 (8), 630-640 (2004).
- Kitchen, S. G., Bennett, M., et al. Engineering Antigen-Specific T Cells from Genetically Modified Human Hematopoietic Stem Cells in Immunodeficient Mice. PloS one. 4 (12), e8208(2009).
- Goulder, P. J. R., Watkins, D. I. HIV and SIV CTL escape: implications for vaccine design. Nature Reviews: Immunology. 4 (8), 630-640 (2004).
- Kitchen, S. G. S., Levin, B. R. B., et al. In vivo suppression of HIV by antigen specific T cells derived from engineered hematopoietic stem cells. PLoS Pathogens. 8 (4), e1002649(2012).
- Yang, O. O., Tran, A. C., Kalams, S. A., Johnson, R. P., Roberts, M. R., Walker, B. D. Lysis of HIV-1-infected cells and inhibition of viral replication by universal receptor T cells. PNAS. 94 (21), 11478-11483 (1997).
- Zhen, A., Kamata, M., et al. HIV-specific Immunity Derived From Chimeric Antigen Receptor-engineered Stem Cells. Molecular Therapy. 23 (8), 1358-1367 (2015).
- Barrett, D. M., Singh, N., Porter, D. L., Grupp, S. A., June, C. H. Chimeric Antigen Receptor Therapy for Cancer. Annual Review of Medicine. 65 (1), 333-347 (2014).
- Pejchal, R., Doores, K. J., et al. A Potent and Broad Neutralizing Antibody Recognizes and Penetrates the HIV Glycan Shield. Science. 334 (6059), 1097-1103 (2011).
- Caskey, M., Klein, F., et al. Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature. 522 (7557), 487-491 (2015).
- West, A. P., Scharf, L., Scheid, J. F., Klein, F., Bjorkman, P. J., Nussenzweig, M. C. Structural insights on the role of antibodies in HIV-1 vaccine and therapy. Cell. 156 (4), 633-648 (2014).
- Lan, P., Tonomura, N., Shimizu, A., Wang, S., Yang, Y. -G. Reconstitution of a functional human immune system in immunodeficient mice through combined human fetal thymus/liver and CD34+ cell transplantation. Blood. 108 (2), 487-492 (2006).
- Melkus, M. W., Estes, J. D., et al. Humanized mice mount specific adaptive and innate immune responses to EBV and TSST-1. Nature medicine. 12 (11), 1316-1322 (2006).
- Shultz, L. D., Brehm, M. A., Garcia-Martinez, J. V., Greiner, D. L. Humanized mice for immune system investigation: progress, promise and challenges. Nature Reviews: Immunology. 12 (11), 786-798 (2012).
- Vatakis, D. N., Bristol, G. C., et al. Using the BLT humanized mouse as a stem cell based gene therapy tumor model. Journal of visualized experiments : JoVE. (70), e4181(2012).
- De Rosa, S. C., Brenchley, J. M., Roederer, M. Beyond six colors: a new era in flow cytometry. Nature medicine. 9 (1), 112-117 (2003).
- Shimizu, S., Hong, P., et al. A highly efficient short hairpin RNA potently down-regulates CCR5 expression in systemic lymphoid organs in the hu-BLT mouse model. Blood. 115 (8), 1534-1544 (2010).
- Denton, P. W., Olesen, R., et al. Generation of HIV latency in humanized BLT mice. Journal of virology. 86 (1), 630-634 (2012).
- Zhou, J., Zhang, Y., et al. Embryoid bodies formation and differentiation from mouse embryonic stem cells in collagen/Matrigel scaffolds. Journal of Genetics and Genomics. 37 (7), 451-460 (2010).
- Vatakis, D. N., Arumugam, B., Kim, S. G., Bristol, G., Yang, O., Zack, J. A. Introduction of Exogenous T-cell Receptors Into Human Hematopoietic Progenitors Results in Exclusion of Endogenous T-cell Receptor Expression. Molecular Therapy. 21 (5), 1055-1063 (2013).
- Ito, R., Takahashi, T., Katano, I., Ito, M. Current advances in humanized mouse models. Cellular & Molecular Immunology. 9 (3), 208-214 (2012).
- Martinez-Torres, F., Nochi, T., Wahl, A., Garcia, J. V., Denton, P. W. Hypogammaglobulinemia in BLT humanized mice--an animal model of primary antibody deficiency. PloS one. 9 (10), e108663(2014).
- McCune, J. M. Development and applications of the SCID-hu mouse model. Seminars in Immunology. 8 (4), 187-196 (1996).
- Srivastava, S., Riddell, S. R. Engineering CAR-T Cells: Design Concepts. Trends in immunology. 36 (8), (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados