Method Article
Т-клеток Захват бактерий Transinfection от дендритных клеток
В этой статье
Резюме
Вот протокол представлен для измерения бактериальной захвата CD4 + Т-клеток, которые произошли во время презентации антигена через transinfection из предварительно зараженных дендритных клеток (ДК). Мы покажем, как выполнить необходимые шаги: изоляция первичных клеток, инфекции формирования сопряженной клеток DC, DC / T, и измерения бактериальной трансфекции Т-клеток.
Аннотация
Recently, we have shown, contrary to what is described, that CD4+ T cells, the paradigm of adaptive immune cells, capture bacteria from infected dendritic cells (DCs) by a process called transinfection. Here, we describe the analysis of the transinfection process, which occurs during the course of antigen presentation. This process was unveiled by using CD4+ T cells from transgenic OTII mice, which bear a T cell receptor (TCR) specific for a peptide of ovoalbumin (OVAp), which therefore can form stable immune complexes with infected dendritic cells loaded with this specific OVAp. The dynamics of green fluorescent protein (GFP)-expressing bacteria during DC-T cell transmission can be monitored by live-cell imaging and the quantification of bacterial transinfection can be performed by flow cytometry. In addition, transinfection can be quantified by a more sensitive method based in the use of gentamicin, a non-permeable aminoglycoside antibiotic killing extracellular bacteria but not intracellular ones. This classical method has been used previously in microbiology to study the efficiency of bacterial infections. We hereby explain the protocol of the complete process, from the isolation of the primary cells to the quantification of transinfection.
Введение
Если патоген поражает своего хозяина, обычно активация врожденных и адаптивных реакций иммунной, необходимых для бактериальной очистки. Врожденный иммунитет является первой линией обороны, что не позволяет большинству инфекций. Врожденный иммунитет отличать через точный способ элементов, которые сохраняются среди широких групп микроорганизмов (патоген-ассоциированных молекулярных моделей, PAMPs) 1. Механизмы врожденного иммунитета включают в себя физические барьеры, такие как кожа, химикаты барьеры (антимикробные пептиды, лизоцим) и врожденные лейкоциты, которые включают фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, эозинофилы, базофилы и естественных клеток-киллеров 2. Эти клетки выявить и устранить болезнетворные микроорганизмы, либо, нападая на них при контакте или через фагоцитоза, который включает в себя возбудитель охватившим и убийство. Эта система не позволяет на протяжении всей жизни оборону, в отличие от адаптивного иммунитета, которые придают иммунологическую память против рathogens. Адаптивная иммунная система является второй линией обороны и способна распознавать и реагировать на специфические антигены множественной микробной и не микробные-веществ 3. Основными компонентами адаптивной иммунной системы являются лимфоциты, которые включают В- и Т-клеток. В-клетки участвуют в гуморального ответа, секретирующие антитела против патогенов или экзогенных белков. Однако Т-клетки представляют собой клеточный иммунитет, модуляции иммунного ответа цитокинами секреции или убивают патогенов клеток, инфицированных 4.
Антиген-представляющих клеток (БТР), включая дендритные клетки или макрофаги, составляющих иммунной системы, могут признать фагоцитировать патогенов и процесса бактериальных компонентов в антигенов, которые представлены на поверхности клеток в главный комплекс гистосовместимости (МНС). 5-7 После БТР уже фагоцитируются патогенов, они, как правило мигрируют в лимфатические узлы слива, где они взаимодействуют с Тклеток. Т-лимфоциты могут распознавать специфические комплексы пептид-МНС их Т-клеточных рецепторов. Иммунная синапса (ИС) имеет место на границе раздела между антиген-АПК и загружен лимфоцита в течение презентации антигена 8,9. Некоторые бактерии могут выжить фагоцитоз и распространять систематически в течение БТР. С этой точки зрения, зараженные БТР служить бактериальных водоемов или "троянских коней", которые облегчают распространение бактерий 10. Интимная контакт между БТР-лимфоцитов и, которые имеют место в ходе формирования также функционировать в качестве платформы для обмена части мембраны, генетический материал и экзосом и может быть угнан для некоторых вирусов заражают Т-клеток; Этот процесс называется transinfection 11-13.
Некоторые патогенные бактерии (Listeria моноцитогенес, сальмонеллы enterica и шигеллы Флекснера) могут вторгнуться в Т-лимфоциты в естественных условиях и изменить свое поведение 14-16. У нас естьНедавно описано, что Т-лимфоциты также могут захватывать бактерии от transinfection от ранее инфицированных дендритных клеток (DC) в течение 16 презентации антигена. Т-клеток бактериальной захват transinfection чрезвычайно более эффективной (1,000-4,000x), чем прямые инфекций. Т клетки патогена захват и непатогену бактерии с указанием, чем transinfection является процесс, движимый Т-клеток. Поразительно, transinfected Т (Тит) клетки быстро убили захваченных бактерий и сделал так более эффективно, чем профессиональных фагоцитов 16. Эти результаты, которые нарушают догмы иммунологии, показывают, что клетки адаптивного иммунитета может выполнять функции, которые были якобы эксклюзивные из врожденного иммунитета. Кроме того, мы показали, что Тит клетки секретируют большое количество провоспалительных цитокинов и защищают от бактериальных инфекций в естественных условиях.
Здесь мы представляем различные протоколы, используемые для изучения процесса бактериальной transinfection вмодель мыши. Эта модель основана на использовании CD4 + Т-клеток из трансгенных мышей OTII, которые несут специфического TCR для пептида 323-339 яйцеклеток (OVAp) в контексте I-Ab 17, которые взаимодействуют с бактериальной специально-инфицированной кости marrow- полученные ДК (BMDCs) 18,19 загруженные OVAp, образуя устойчивые иммунные синапсов.
Т-клеток transinfection могут быть визуализированы и отслеживаются с помощью флуоресцентной микроскопии. Кроме того, проточной цитометрии могут быть использованы для обнаружения инфицированных клеток воспользовавшись флуоресценции, испускаемой бактерий, экспрессирующих зеленый флуоресцентный белок (GFP) 16,20. Кроме того, Т-клетки transinfection можно количественно определить более чувствительной подхода, гентамицина анализа выживаемости, который позволяет измерять большое количество событий. Гентамицин вл етс антибиотиком, который не может проникнуть эукариотических клеток. Таким образом, с помощью этого антибиотика позволяет дифференцировать внутриклеточных бактерий, который пережил антибиотиками сложение FROM внеклеточные те, которые были убиты 21.
протокол
Примечание: Экспериментальные процедуры были одобрены Комитетом по исследованию этики Автономного университета Мадрида и провел под руководством Автономного университета Мадрида руководителя благосостояния и здоровья животных в соответствии с испанскими и европейскими рекомендациями. Мыши были выведены в специфических патогенов (SPF) жилья, и они были умерщвлены квалифицированным персоналом с использованием диоксида углерода (СО 2) методом ингаляции.
1. костного мозга мыши, полученные ДК Дифференциация и Инфекция
Примечание: На рисунке 1 представлены этот первый шаг. Все процедуры должны проводиться в капюшоне с этого момента, используя только стерильные медиа, инструменты, наконечники пипеток и культуры блюда.
- Костного мозга мыши, полученные ДК Дифференциация
- Рассеките большеберцовые кости и бедра от одного С57 / BL6 мыши 22 и передачи в пластиковую чашку с 10 мл RPMI среде.
- Разрежьте каждый эпифиз с, стерильными ножницами и выставить костный мозг, который имеет характерный ярко-красный цвет.
- Наполните внутреннюю часть кости с 10 мл фосфатно-солевом буфере (PBS), содержащим 0,5% бычьего сывороточного альбумина (BSA) и 5 ммоль этилендиаминтетрауксусной кислоты (ЭДТА) (PBS / БСА / ЭДТА буфере) с использованием стерильного шприца на стерильную чашку блюдо.
- Сбор клеточной суспензии и центрифуги в трубке при 600 х г в охлаждаемой центрифуге (4 ° C).
- Ресуспендируют клеток в 1 мл аммония-хлоридно-Калий (ACK) лизирующего буфера (0,15 М NH 4 Cl, 10 мМ КНСО 3 и 0,1 мМ ЭДТА) и инкубируют в течение 30 сек при комнатной температуре, чтобы исключить эритроциты.
- Добавьте 10 мл RPMI 1640 с 10% фетальной бычьей сыворотки (FBS) и фильтруют через клеточный фильтр (70 мкм), чтобы удалить фрагменты костей и скопления клеток перед центрифугированием при той же скорости (600 XG) из-за скопления были устранены путем фильтрации.
- Граф клетокд регулировки 5 × 10 5 клеток / мл RPMI с 10% FBS (содержащей 50 мкМ меркаптоэтанола B-1 мМ пирувата натрия) и добавить 20 нг / мл рекомбинантный мышиный гранулоцитов-макрофагов колонии-стимулирующий фактор (RM-GM-CSF) в конечной концентрации.
- Добавить это суспензии в стерильном микробиологического качества, 15 см чашки Петри, и культуры в СО 2 инкубатор (37 ° С, 5% СО 2).
- Каждые три дня, как спин вниз неадгезированных клеток и отдельные клетки с 5 мМ EDTA в PBS и ресуспендируют в 5 × 10 5 клеток / мл клеточной плотности, свежей средой, содержащей 20 нг / мл RM-GM-CSF.
- Созревание ДК и антиген Загрузка
- В 9-й день, ресуспендирования клеток в 5 × 10 5 клеток / мл плотности в среде, содержащей 20 нг / мл RM-GM-CSF. Затем добавить 20 нг / мл липополисахарида (ЛПС), чтобы позволить экспрессию МНС высокую-II на клетки и инкубируют в не-культуры ткани, обработанных стерильную чашку Петри 15 см в течение 24 часов.
- После одногодень LPS-стимуляции, окрасить некоторые клетки DC с антителами против мыши CD11c, MHCII и GR-1, чтобы проверить DCS дифференциации с помощью проточной цитометрии. Пример проточной цитометрии ДК показано на фиг 3А и 3В.
- Инкубируйте ДК (5 х 10 5 клеток / образец) с моноклональными антителами против мышиного CD16-/ CD32 на 2,5 мкг / мл конечной концентрации в 50 мкл PBS / BSA / EDTA буфера на образце. Затем добавляют 50 мкл антител против MHCII (IA / IE), CD11c и Gr-1, конъюгированного с различными флюорохромами 1: 100, 1: 200 и 1: 500 в PBS / BSA / EDTA буфера соответственно.
- Наконец, мыть ДК с PBS / BSA / EDTA буфера и анализировать с помощью проточной цитометрии в соответствии с протоколом производителя.
Примечание: Если клетки хорошо дифференцируются, клетки готовы к антигену нагрузки.
- Промыть ДК с RPMI 10% FBS (без антибиотиков) и инкубируют их 10 мкг / мл OTII OVAp (OVA 323-339; ISQAVHAAHAEINEAGR) на пластмассовой трубки в 1 мл RMPI 10% FBS среды в 5 х 10 6 ДК для минимального 1 часа при 37 ° С. В качестве отрицательного контроля, оставить без РС инкубации с OVAp.
- Заражение домена
- Infect ДК при множественности инфекции (MOI) 10 бактерий (10 бактерий на DC) в течение 1 часа в СО2-инкубаторе (37 ° С, 5% СО 2).
- Промыть клетки DC 3x в PBS и 1х в RMPI 10% FBS и центрифуги при 450 мкг для промывки наиболее внеклеточных бактерий. Наконец, ресуспендирования клеток в RMPI 10% FBS средой (без антибиотиков) в 20 х 10 6 клеток / мл.
2. Выделение CD4 + Т-лимфоцитов из OTII трансгенных мышей
Примечание: На рисунке 1 представлены этот второй шаг. Лимфатические узлы должны быть использованы вместо селезенки для выделения CD4 + Т-клеток, поскольку доля CD4 + лимфоцитов в лимфатическом узлес (~ 50%) больше, чем в селезенке (~ 25%) и, следовательно, очищение будет более эффективным.
- Сделать одноклеточные подвеска лимфатических узлов
- Удалить паховые, подмышечные, плечевой шейки матки и брыжеечных лимфатических узлов 23 от OTII трансгенных мышей и передачи в пластиковую чашку с 10 мл RPMI 10% FBS среде.
- Измельчить лимфатические узлы под капотом стерильной, используя два матовых микроскопа. Поместите лимфатические узлы на стороне матового одного слайда микроскопа, и протрите с матовым стороне второго слайда до органы не были земля.
- Промыть суспензии отдельных клеток в PBS / BSA / EDTA буфера.
- Фильтр клетки, хотя клетка фильтр (70 мкм) для удаления соединительной ткани и промывают PBS / BSA / EDTA буфера.
- Ресуспендируют клеток в 1 мл буфера для лизиса АСК и инкубируют в течение 1 мин при комнатной температуре, чтобы исключить эритроциты.
- Выделение CD4 + Т-клеток
- Вымойте снова, как в шаге 2.1.3 и подсчетаКлетки ресуспендируют в 100 их × 10 6 клеток / мл в PBS / BSA / EDTA буфера. Добавить биотинилированных антител против CD8, IgM, B220, CD19, MHC класса II (I-Ab), CD11b, CD11c и DX5 1: 250 в течение 30 мин на льду для последующего отрицательного отбора CD4 + Т-клеток.
- Промыть клетки в PBS / BSA / EDTA буфера и инкубируют клетки (100 × 10 6 клеток / мл) стрептавидином микросфер в концентрации, рекомендованной в протоколом производителя в течение 15 мин на льду.
- Вымойте клеток в PBS / BSA / EDTA буфера и фильтровать их, хотя клеточной фильтр (30 мкм) до выделения CD4 + Т-клеток.
- Изолировать CD4 + Т-клеток с помощью отрицательной селекции с использованием магнитной сепарации клеток машину в соответствии с протоколом производителя.
- Граф клеток и регулировать 4 х 10 6 клеток / мл RPMI 10% FBS среде (без антибиотиков).
- Fix и держать на льду, изолированных CD4 + Т-клеток (3 х 10 5 клеток), чтобы проверить чистоту потокомцитометра как описано 24. Пример CD4 + Т-клеток очистки показано на фиг.3С.
3. Т-клеток Transinfection Измерение анализе гентамицин защиты
Примечание: На рисунке 2 представлены этот третий шаг протокола.
- Т-клеток Transinfection
- Инкубируйте изолированные CD4 + Т-клеток с зараженными DC клеток (1: 1) (ДК инфицировали в течение 1 ч и промывают, чтобы исключить свободные бактерии) в течение 30 мин, чтобы позволить образование иммунного синапса в СО 2 инкубатор (37 ° C, 5% СО 2).
- Добавить 0,5 мл изолированных CD4 + Т-клеток (2 х 10 6 клеток) и 0,1 мл инфицированных ДК (2 х 10 6 клеток) на культуральную чашку 24-луночного. В качестве отрицательного контроля, заражают непосредственно 0,5 мл CD4 + Т-клеток в МВД 10 бактерий в течение 30 мин.
- Включить дополнительные элементы управления, разделяющие зараженных ДК от Т-клеток с помощьюполикарбонат Transwell барьер (с 3 мкм с размером пор), препятствуя DC-T физический контакт. Добавить 0,1 мл ДК внутри Transwell и 0,5 мл CD4 + Т-клеток в нижнем отделении скважины (24-луночный планшет).
- Наконец, в комплекте с RMPI среде, пока не будет 0,6 мл в каждую лунку, чтобы сделать равные объемы во всех образцах.
- Через 30 мин формирования иммунной синапсов, добавить 100 мкг / мл гентамицина и инкубируют в течение 1 часа перед сбором клеток в СО 2 инкубатор (37 ° С, 5% СО 2).
- Re-изоляции CD4 + Т-клеток
- Сбор неприкрепленных клеток и ресуспендируют в PBS, их / БСА / ЭДТА буфере. Большинство РС остаются прикрепленными к пластиковой пластины культуры. Вихревые трубки мягко, чтобы обеспечить клеток разбивку. Держите 500 мкл клеточного супернатанта в качестве контроля, чтобы показать, что гентамицин работал хорошо.
- Re-изолировать CD4 + Т-клеток из образцов, которые содержат контроллеры домена и Т-клетки вместе, как в шаге 2.2, Хотя большая часть домена должен крепится на пластине. Держите контрольные образцы на льду. Примите во внимание только эксперименты с менее чем 2% загрязнения. Пример CD4 + Т-клеток после очистки transinfection показано на рисунке 3D.
- Lyse Т-клеток и семя их от бактерий среднего агар пластин.
- Промыть CD4 + Т-клетки дважды PBS.
- Граф клеток и ресуспендируют их в 2 х 10 6 клеток / мл в PBS.
- Добавить 500 мкл 0,1% Тритона Х-100 в 500 мкл Т-клеток лизировать их на 1 × 10 6 клеток / мл, освобождая внутриклеточные бактерии из Т-клеток.
- Сделать 3 последовательных десятичных разведений лизированных клеток и семян 50 мкл каждого разбавления на бактерии средних чашках с агаром. Разделить пластины на 4 части и семян различных разведений лизированных клеток в каждой части. Типичные результаты показаны на рисунке 4.
- В качестве контроля, а также табличкахранятся клеточного супернатанта из конъюгатов на агаре, чтобы гарантировать, что гентамицин хорошо работал. Также пластины зараженные ДК в качестве дополнительного контроля. В случае низкого загрязнения ДК происходит (<2%), вычесть колониеобразующих единиц (КОЕ), соответствующие низким уровнем загрязнения постоянного тока.
4. Количественное определение Т-клеток Transinfection с помощью проточной цитометрии
Примечание: На рисунке 2 представлены этот шаг.
- Т-клеток Transinfection
- Инфекция BMDCs как в шаге 1.3, но использовать GFP выражения бактерий в этом случае.
- Пятно CD4 + Т-клетки (выделенные из лимфатических узлов в шаге 2.2) с сотового трекер хлорметилового аминокумарин (CMAC) в течение 30 мин при 37 ºC в соответствии с протоколом производителя.
- Промыть меченых CD4 + Т-клетки дважды RMPI 10% FBS (без антибиотиков).
- Выдержите зараженные ДК (после 1 ч инкубации с бактериями) с меченым CD4 +Т-клетки в течение 30 мин, чтобы позволить формирование иммунной синапса на 37 ºC, включая все управления, объясняющих в шаге 3.1.1.
- Окрашивание инфицированных CD4 + Т-клеток
- Через 30 мин DC-T формирования иммунной синапсов, собрать клетки и мыть их в PBS / BSA / EDTA.
- После двух промывок PBS / БСА / ЭДТА, отдельные агрегированные клетки осторожно вортексе трубки.
- Исправление образцов в 0,2 мл / пробирку PBS, содержащем 3% PFA в течение 15 мин при комнатной температуре. Затем промыть их в PBS.
- Инкубируйте с анти-CD16 мыши / CD32 моноклонального антитела (2,5 мкг / мл) в 50 мкл / образец PBS / BSA / EDTA в течение 15 мин на льду, чтобы блокировать Fc рецепторы дендритных клеток.
- Добавить кролика против бактерии антитела (10 мкг / мл в конечной концентрации) в 50 мкл / образец PBS / BSA / EDTA в течение 30 мин на льду, чтобы окрасить внеклеточные бактерии.
- Вымойте клеток с PBS / BSA / EDTA и инкубировать с антителом против мышиного CD11c сопряженной с фикоэритрином (PE) и а себеcondary антитело к кролику, конъюгированного с другим флуорохромом как Alexa Fluor 647-1: 200 в 100 мкл / образец PBS / BSA / EDTA в течение 30 мин на льду.
- Промыть клетки и анализа проб с помощью проточной цитометрии. Не забудьте включить образец transinfected Т-клеток с использованием не-люминесцентные бактерии в качестве отрицательного контроля и образцов с надписью только с одной из каждой флуорохромом используемой в эксперименте, чтобы компенсировать образцы и регулировать поток цитометрии настроек 25. Представитель анализ показано на фиг.5.
Примечание: Если бактерии не экспрессируют GFP, чтобы отличить внутриклеточной и внеклеточной бактерии, этикетка внеклеточные бактерии, исправить, и проницаемыми образцы с Тритон Х-100 в концентрации 0,5% в PBS в течение 5 мин. Впоследствии пятно всего бактерии (внутриклеточные + внеклеточные) с различной флуорохромом.
Результаты
В этом мы описали, как выполнить Т-клеток мышей бактерий transinfection от зараженного костного мозга производного ДК и как измерить бактериальную transinfection помощью двух различных подходов: проточной цитометрии и гентамицин выживание анализ Рисунок 1 суммирует процедуру получения клеток.. ДК генерируются путем инкубации клеток костного мозга с GM-CSF в течение 9 дней. Затем, ДК созрела ЛПС увеличить MHCII на его мембране, чтобы загрузить их позже с определенного пептида OVA (OVAp). В качестве контроля, некоторые ДК не загружен OVAp. Оба ДК (OVAp загруженные и ненагруженных) заражены при множественности инфекции (МВД) 10 бактерий. С другой стороны, CD4 + Т-клетки выделяют из лимфатических узлов OTII трансгенных мышей, которые распознают специфическую OVAp. 2 изображает процедуру для выполнения и количественно Т-клеток transinfection включая соответствующие отрицательные контроли. Как descriкровать прежде, некоторые контроллеры домена не загружается с OVAp. В этом случае происходит взаимодействие между контроллерами домена и Т-клеток, но не формирования иммунной синапсов из-за отсутствия OVAp. Дополнительный контроль включен, отделяя ДК и Т-клеток с поликарбоната Transwell барьера (с 3 мкм размер пор), что препятствует DC-T физический контакт. ДК включены внутри Transwell; в результате они не в состоянии пройти через этот размер пор. Другой отрицательный контроль также включены, прямой T инфекции клеток, путем инкубации Т-клетки непосредственно в МВД 10 бактерий. Т-клеток transinfection можно количественно двух подходов: проточной цитометрии или гентамицин анализ выживаемости. Для измерения с помощью проточной цитометрии, ДК должны были инфицированы ранее с бактериями-GFP и CD4 + Т-клеток окрашиваются мобильный трекер (Т-клетки-синие). После формирования конъюгата, клетки должны быть окрашивались антителами к РС (CD11c-PE). Внеклеточные бактерии также должны быть окрашены, чтобы quantifу процент инфицированных CD4 + Т-клеток с помощью проточной цитометрии позже. Для измерения transinfection по гентамицина анализа выживаемости клетки инкубируют с гентамицином в течение 1 часа, чтобы убить бактерии внеклеточные, то Т-клетки повторно выделен семян на чашку с агаром. Десятичный серийные разведения сделаны, чтобы отобрать 50 мкл каждого разбавления в чашки с агаром и облегчить подсчет КОЕ.
Как показано на рисунке 3, дифференцировка постоянного тока должна быть проверена с помощью проточной цитометрии (рис 3а и 3b). ДК должен выразить CD11c и MHCII (фиг.3А), а не GR-1, который является маркером нейтрофилов. Как представлено на рисунке 3В, некоторые нейтрофилы (3.27% от Gr-1 +, MHC -) были представлены в культуре, но культура ДК с более чем 5% загрязнения нейтрофилов не должны использоваться. CD4 + Т-клетки чистота должны быть проверены после выделения из LYмиль в час (узлы Рисунок 3C) и после отделения от ДК сопрягает образование (рис. 3d) Примите во внимание эксперименты с менее чем 2% загрязняющих веществ после образования конъюгатов.
4 показан пример Т transinfection эксперименте с использованием Salmonella. Как показано на фиг.4А, пластины разделены на четыре порции, чтобы отобрать те серийных разведений в каждой части. Salmonella выросли на LB чашках с агаром и колониеобразующих единиц можно пересчитать. Как показано на фиг.4А, Salmonella был захвачен Т-клеток, инфицированных от домена, и этот процесс был четко повышена с признанием OVAp (пластин на левой фиг.4А и фиг.4В). Тем не менее, когда был физический барьер препятствует контакту между ДК и Т-клеток, не было практически ни transinfection, как и в случае ведения прямой T инфекции клеток (плиты на право фиг.4А и фиг.4В).
Как показано на рисунке 5, Т-клеток transinfection может быть определена количественно с помощью проточной цитометрии с использованием бактерий, экспрессирующих GFP светлое. ДК и Т-клетки могут быть дифференцированы по размеру и сложности в прямом и боковое рассеивание участка, но разные маркеры могут быть использованы для хорошо различать их. CD4 + Т-клетки метили с сотовым слежения (КЦР) и ДК с антителами против CD11c. Внеклеточные бактерии окрашивали антителами кролика против сальмонеллы и вторичным антителом против кролика, конъюгированным с Alexa Fluor 647. Поэтому процент инфицированных CD4 + Т-клеток может быть определена количественно, так как они помечены КЦР (не с CD11c-PE) и выражали GFP (бактерии-GFP), но они не были окрашены антителом против внеклеточного бактерий (Alexa Fluor 647).
ntent "FO: держать-together.within-страница =" 1 ">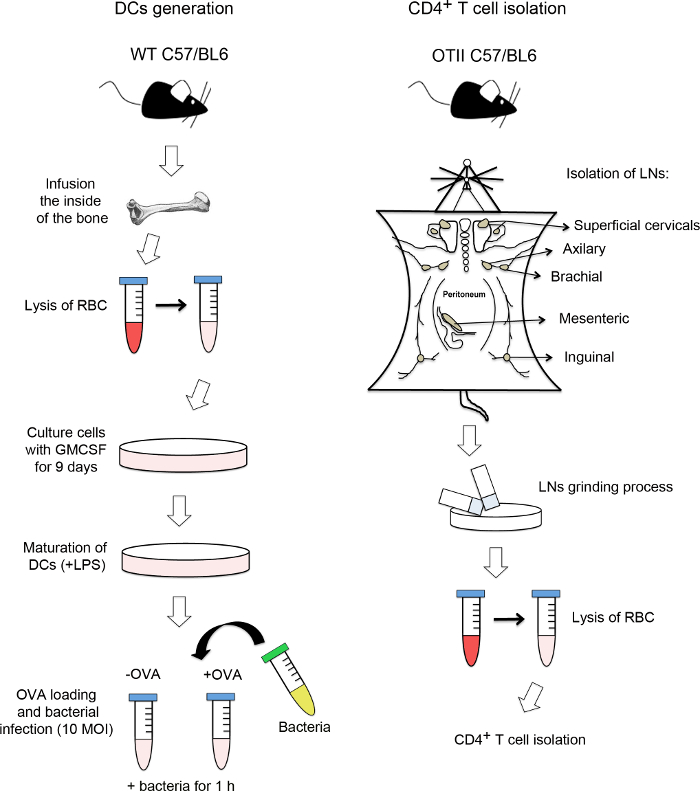
Рисунок 1. Блок-схема генерации постоянного тока и CD4 + Т-клеток изоляции. На левой стороне фигуры, процесс дифференцировать дендритные клетки (DC) из клеток костного мозга подробно. После рассечения бедра и большеберцовые кости, клетки костного мозга извлекаются из недр костей. После этого эритроциты (RBC) лизировали и клетки костного мозга культивировали с рекомбинантный мышиный гранулоцитов-макрофагов колонии-стимулирующий фактор (GM-CSF) в течение 9 дней. После того, как они хорошо дифференцированы, ДК инкубировали с липополисахаридом (LPS) для увеличения главного комплекса гистосовместимости II (MHCII) выражение. Затем ДК загружаются с конкретным ovoalbumin пептида (OVAp) и инфицировали с множественностью заражения (MOI) 10 бактерий. Некоторые из них не загружен OVAp в качестве контроля. На правой стороне рисунка, какизолировать CD4 + Т-клеток от мышей OTII трансгенной представлена. Лимфатические узлы (LNS) удаляются и земля, получение одного-клеточной суспензии. Наконец, CD4 + Т-клетки выделяют негативной селекции с использованием магнитной сепарации клеток машину. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2. Блок-схема процедуры Т клеток transinfection. Infected (бактерии изображены зеленым цветом) и OVAp загружен-РС (красные клетки) инкубируют с CD4 + Т-клеток (синие клетки), чтобы образование синапсов иммунную. Зараженные ДК (но не загружается с OVAp) также инкубировали с Т-клеток, что позволяет взаимодействие между двумя клетками, но без образования синапсов иммунной. Дополнительный контроль включен, отделяя CD4 + Т-клетки и ДК с поликарбоната Transwell барьер (+ TW), что препятствует DC-Т-клеток в контакт. Прямая Т-инфекции клеток, также включена в качестве отрицательного контроля. Наконец, Т-клеток transinfection может быть количественно двумя способами, с помощью проточной цитометрии (левая часть рисунка), что указывает на количество Т-клеток захвата бактерий и по гентамицин анализа выживаемости (правая сторона рисунка) очень чувствительный метод ( одним заражения бактерия может быть обнаружено) с указанием бактериальной инфекции скорость. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
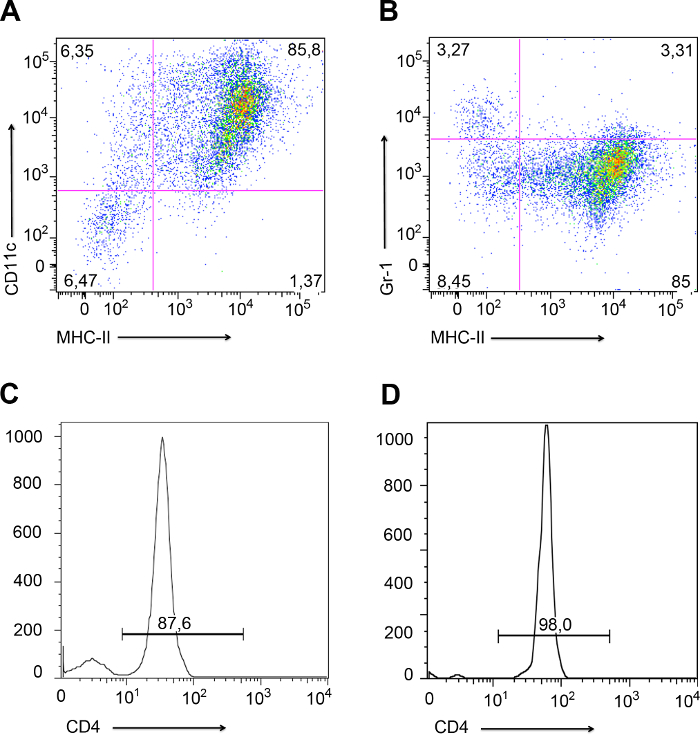
Рисунок 3. Поток цитометр анализа костного мозга, полученного-ДК и изолированные CD4 + Т-клетки. Характерные точечные участки костного мозга, полученных ДК-проанализированныепроточной цитометрии. (А) РС выразил MHCII и CD11c (85,8%; верхний правый квадрант) (B) РС выразил MHCII, но не Gr-1 (85%; нижний правый квадрант). Тем не менее, было 3,27% клеток, которые выразили GR-1, но не MHCII клетки (верхний левый квадрант). Эти клетки были небольшие загрязненные нейтрофилы. (С и D), представляющие Гистограммы чистоту CD4 + Т-клеток, выделенных из лимфатических узлов (C), и после формирования конъюгата с дендритных клеток (D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
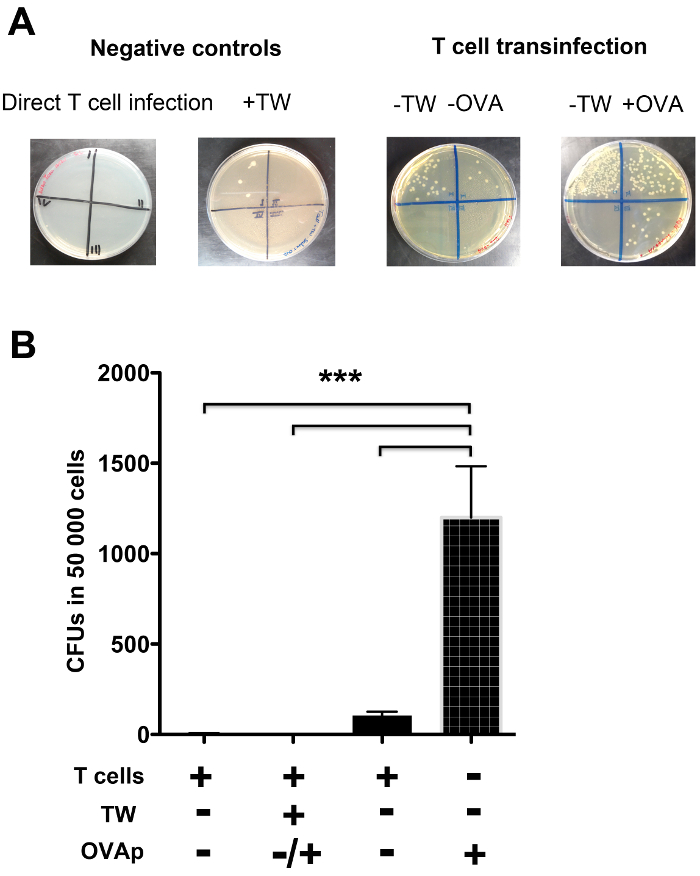
Рисунок 4. Т transinfection клеток количественно гентамицин анализе выживаемости. LB агаром были разделены на 4 участках, соответствующих DECIMAл серийные разведения лизированных CD4 + Т-клеток. (А) колониеобразующих единиц Salmonella enterica росли на LB чашках с агаром, соответствующий Т-клеток transinfection в присутствии (+) или отсутствию (-) из OVAp на поверхности инфицированной DC, и в условиях, позволяющих DC / Т-клеток в контакт (- TW) или в присутствии физического барьера, препятствующего таких контактов (+ Tw). Пустой пластина, соответствующей прямой инфекции Т-клеток (отрицательный контроль) также показана. Был почти нет transinfection, когда DC / Т-клеток контакт был затруднен (+ TW). (В) Количественное определение колониеобразующих единиц (КОЕ) от нескольких экспериментов, показывающих скорость бактериальной захваченного Т-клеток, инфицированных от DC. Прямая инфекция Т-клеток, а также условия, препятствующие DC / Т-клеток контакты производить практически нет уровней Т инфекции клеток. При DC / Т-клеточные контакты были разрешены, было Т-клеток transinfection, и это было увеличено распознавание антигена (+ OVAp). Бары столбцов представляют собой среднее из 3 Independent эксперименты. Стрелки ошибок указывают на СД. Значительные различия представлены ***, соответствующее р <0,0001. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5. Т transinfection клеток количественно проточной цитометрии. Представитель точка график, показывающий ДК и Т-клеточные конъюгатов после процесса transinfection. CD4 + Т-клетки малы и круглые, как вперед и боковое рассеивание (ФТС - SSC) дот-блот показывает, и для того, чтобы быть хорошо дифференцированная, их окрашивали с сотовым слежения (КЦР). ДК выражающие CD11c не помечены CMAC и больше, чем Т CD4 + Т-клеток с неправильной формы. Зараженные CD4 + Т-клетки, содержащие внутриклеточный бактерий-GFP, но отрицательный для extracellular бактерии (6.19%) показаны в правом нижнем квадранте. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Т-клетки или Т-лимфоциты типа лейкоцитов, которые играют центральную роль в клеточного иммунитета и принадлежащих адаптивного иммунного ответа 26. Т-клетки являются невосприимчивыми к заражения в пробирке, но некоторые отчеты показывают, что они могут быть заражены в естественных условиях 14,15. Интимные контакты APC и Т-клеток иммунной во время синапса служить в качестве платформы для обмена биологический материал, в том числе 13 некоторых вирусов, таких как ВИЧ 11. Недавно было показано, что в отличие от догмата, Т-клеток, парадигма клеток адаптивного иммунитета, также могут эффективно захватить бактерии от transinfection от инфицированных ДК 11,16. В этом мы показываем он подробно протоколы количественного Т-клеток бактерий transinfection в пробирке из инфицированных BMDCs.
Т-клеток бактериальной transinfection была увеличена распознавания антигена 16. Мы показали, что при использовании CD4 + Т-клеток, выделенных изOTII трансгенных мышей, признающие определенный OVAp, BMDCs загружен OVAp и мышей, инфицированных различными бактериями (здесь данные, представленные от Salmonella enterica). CD4 + Т-клеток, выделенный из мышей OTII инкубируют с инфицированными домена в течение 30 мин, чтобы позволить образование иммунного синапса. Представленные здесь данные соответствуют бактерий, Т-клетки могут захватить от ДК в этом короткий период времени. Мы знаем, что более воздействия Т-клеток в инфицированных домена привело к увеличению бактериальных захватов (не показано), но, как Т-клетки также уничтожить uptaken бактерии очень быстро, количественное бактериальной transinfection происходящих во время длительных DC / T время сотовый контактов оказалось трудно , Гентамицин анализ выживаемости очень чувствительный метод для количественного Т-клеток transinfection, потому что это в состоянии обнаружить одну бактерию, заражающих 21. После инкубации с гентамицином, которые убивают бактерии только внеклеточные, Т-клетки выделяют и лизируют, чтобы отобрать на бактерии среднего агар плАтеш. Изоляция Т-клеток после образования конъюгатов с ДК является важным шагом в протоколе. Только эксперименты с менее чем 2% от загрязнений должны быть приняты во внимание. Загрязнение постоянного тока может быть измерена с помощью проточной цитометрии и КОЕ соответствующие низкой загрязнения DC следует вычесть. В качестве альтернативы, CD4 + Т-клетки чистоты может быть улучшено с помощью сортировки клеток.
Другой подход к количественной Т-клеток transinfection это с помощью проточной цитометрии, используя GFP выражения бактерии и маркировка внеклеточные бактерии с совместимым флюорофора. Одно ограничение этого подхода состоит в том, что бактерии имеют выразить GFP, который является достаточно ярким для обнаружения инфицированных клеток против автофлуоресцентной фоне. Кроме того, бактерии могут быть окрашены до заражения РС с сотового трекера. Другой подход окрашивания внеклеточные бактерии, permeabilizing Т-клеток, то маркировка всех бактерий (внутриклеточный + Внеклеточный)с другой флуорохромом.
Что касается будущих направлений этого протокола, мы пытаемся создать протокол для количественной оценки количества Т-клеток, которые захватили бактерии после длительного экспозиции для инфицированных домена, с помощью бактерий, оформленные с магнитными частицами. Т-клетки, захватив бактерии сохранит магнитных частиц и, следовательно, он должен быть легким, чтобы изолировать их с помощью магнитов.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by grants BFU2011-29450, BFU2008-04342/BMC from the Spanish Ministry of Science and Innovation and PIES201020I046 from Consejo Superior de Investigaciones Cientìficas (CSIC).
Материалы
| Name | Company | Catalog Number | Comments |
| RPMI | Fisher Scientific | SH3025501 | |
| r-GMCSF | Peprotech | 315-03 | |
| LPS | SIGMA | L2630-10mg | |
| Na Pyruvate | Thermo Scientific | SH3023901 | |
| 2-ME | Gibco | 31350-010 | |
| OVAp OTII (323–339) | GenScript | --- | |
| Cell Strainer 70uM | BD | 352350 | |
| 30uM Syringe Filcons Sterile | BD | 340598 | |
| AutoMacs Classic | Miltenyi Biotec | 130-088-887 | |
| Gentamicin | Normon | 624601.6 | |
| Transwell | Costar | 3415 | |
| LB | Pronadisa | 1231 | |
| Agar | Pronadisa | 1800 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Triton X-100 | |||
| CD8 biot | BD Biosciences | 553029 | |
| IgM Biot | ImmunoStep | Clone RMM-1 | |
| B220 Biot | BD Biosciences | 553086 | |
| CD19 biot | BD Biosciences | 553784 | |
| MHC-II Biot (I-A/I-E) | BD Biosciences | 553622 | |
| CD11b biot | Immunostep | 11BB-01mg | |
| CD11c biot | Immunostep | 11CB3-01mg | |
| DX5 biot | BD Biosciences | 553856 | |
| Gr-1 biot | BD Biosciences | 553125 | |
| CD16/CD32 | ImmunoStep | M16PU-05MG | |
| anti Salmonella | ABD Serotec | 8209-4006 | |
| CD11cPE | BD Biosciences | 553802 | |
| CD4-APC | Tonbo Biosciences | 20-0041-U100 | |
| Gr-1 APC | BD Biosciences | 553129 | |
| MHC-II (I-A/I-E) FITC | BD Biosciences | 553623 | |
| Alexa-Fluor 647 Goat Anti-Rabbit IgG (H+L) Antibody, highly cross-adsorbed | Invitrogen | A-21245 | |
| CMAC (7-amino-4-chloromethylcoumarin) | Life technologies | C2110 | |
| BSA | SIGMA | A7030-100G | |
| Streptavidin MicroBeads | Miltenyi Biotec | 130-048-101 | |
| BD FACSCanto II | BD Biosciences | --- |
Ссылки
- Medzhitov, R. Recognition of microorganisms and activation of the immune response. Nature. 449 (7164), 819-826 (2007).
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (1989).
- Pancer, Z., Cooper, M. D. The evolution of adaptive immunity. Annual Review of Immunology. 24, 497-518 (2006).
- Rhoades, R. A., Bell, D. R. . Medical Phisiology. , (2012).
- Cossart, P. Bacterial Invasion: The Paradigms of Enteroinvasive Pathogens. Science. 304 (5668), 242-248 (2004).
- Kaufmann, S. H., Schaible, U. E. Antigen presentation and recognition in bacterial infections. Current Opinion in Immunology. 17 (1), 79-87 (2005).
- Pizarro-Cerdá, J., Cossart, P. Bacterial Adhesion and Entry into Host Cells. Cell. 124 (4), 715-727 (2006).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221, 77-89 (2008).
- Calabia-Linares, C., Robles-Valero, J., et al. Endosomal clathrin drives actin accumulation at the immunological synapse. Journal of Cell Science. 124 (5), 820-830 (2011).
- Westcott, M. M., Henry, C. J., Cook, A. S., Grant, K. W., Hiltbold, E. M. Differential susceptibility of bone marrow-derived dendritic cells and macrophages to productive infection with Listeria monocytogenes. Cellular Microbiology. 9 (6), 1397-1411 (2007).
- Geijtenbeek, T. B., Kwon, D. S., et al. DC-SIGN, a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells. Cell. 100 (5), 587-597 (2000).
- Izquierdo-Useros, N., Naranjo-Gòmez, M., et al. HIV and mature dendritic cells: Trojan exosomes riding the Trojan horse. PLoS Pathogens. 6 (3), e1000740 (2010).
- Mittelbrunn, M., Sanchez-Madrid, F. Intercellular communication: diverse structures for exchange of genetic information. Nature Reviews. Molecular cell biology. 13 (5), 328-335 (2012).
- McElroy, D. S., Ashley, T. J., D'Orazio, S. E. Lymphocytes serve as a reservoir for Listeria monocytogenes growth during infection of mice. Microbial Pathogenesis. 46 (4), 214-221 (2009).
- Salgado-Pabon, W., Celli, S., et al. Shigella impairs T lymphocyte dynamics in vivo. Proceedings of the National Academy of Sciences. 110 (12), 4458-4463 (2013).
- Cruz Adalia, A., Ramirez-Santiago, G., et al. T cells kill bacteria captured by transinfection from dendritic cells and confer protection in mice. Cell Host and Microbe. 15 (5), 611-622 (2014).
- Barnden, M. J., Allison, J., Heath, W. R., Carbone, F. R. Defective TCR expression in transgenic mice constructed using cDNA-based alpha- and beta-chain genes under the control of heterologous regulatory elements. Immunology and Cell Biology. 76 (1), 34-40 (1998).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. Journal of Visualized Experiments: JoVE. (17), (2008).
- Inaba, K., Inaba, M., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. Journal of Experimental Medicine. 176 (6), 1693-1702 (1992).
- Thöne, F., Schwanhäusser, B., Becker, D., Ballmaier, M., Bumann, D. FACS-isolation of Salmonella-infected cells with defined bacterial load from mouse spleen. Journal of Microbiological Methods. 71 (3), 220-224 (2007).
- Vaudaux, P., Waldvogel, F. A. Gentamicin antibacterial activity in the presence of human polymorphonuclear leukocytes. Antimicrobial Agents and Chemotherapy. 16 (6), 743-749 (1979).
- Zhang, X., Goncalves, R., Mosser, D. M., Coligan, J. E. Chapter 14, The isolation and characterization of murine macrophages. Current protocols in immunology. , Unit 14.1 (2008).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments: JoVE. (79), e50765 (2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). Journal of Visualized Experiments: JoVE. (41), (2010).
- Foucar, K., Chen, I. M., Crago, S. Organization and operation of a flow cytometric immunophenotyping laboratory. Seminars in diagnostic pathology. 6 (1), 13-36 (1989).
- Itano, A. A., Jenkins, M. K. Antigen presentation to naive CD4 T cells in the lymph node. Nature Immunology. 4 (8), 733-739 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены