Method Article
T 세포는 수지상 세포에서 Transinfection에 의해 박테리아를 캡처
요약
여기 프로토콜은 사전에 감염된 수지상 세포 (DC)에서 transinfection 통해 항원 제시 동안 발생하는 CD4 + T 세포에 의해 세균 캡처를 측정하기 위해 제공됩니다. 일차 전지, DC, DC / T 세포 복합체 형성의 감염, 박테리아 T 세포 형질의 측정의 분리 : 우리는 필요한 단계를 수행하는 방법을 보여줍니다.
초록
Recently, we have shown, contrary to what is described, that CD4+ T cells, the paradigm of adaptive immune cells, capture bacteria from infected dendritic cells (DCs) by a process called transinfection. Here, we describe the analysis of the transinfection process, which occurs during the course of antigen presentation. This process was unveiled by using CD4+ T cells from transgenic OTII mice, which bear a T cell receptor (TCR) specific for a peptide of ovoalbumin (OVAp), which therefore can form stable immune complexes with infected dendritic cells loaded with this specific OVAp. The dynamics of green fluorescent protein (GFP)-expressing bacteria during DC-T cell transmission can be monitored by live-cell imaging and the quantification of bacterial transinfection can be performed by flow cytometry. In addition, transinfection can be quantified by a more sensitive method based in the use of gentamicin, a non-permeable aminoglycoside antibiotic killing extracellular bacteria but not intracellular ones. This classical method has been used previously in microbiology to study the efficiency of bacterial infections. We hereby explain the protocol of the complete process, from the isolation of the primary cells to the quantification of transinfection.
서문
병원균은 숙주를 감염 할 때, 일반적으로 세균 통관에 필요한 타고난 및 적응 면역 반응의 활성화가있다. 선천성 면역은 대부분의 감염을 방지 방어의 첫 번째 줄입니다. 선천성 면역은 미생물의 다양한 그룹들 사이에서 보존되는 정확한 방법 요소 (병원체 관련 분자 패턴, PAMPS) 1 구분합니다. 선천성 면역 메카니즘 식세포 (대 식세포, 호중구 및 수지상 세포), 비만 세포, 호산구, 호염기구, 및 천연 킬러 세포를 포함 실제 피부와 같은 장벽 화학 장벽 (항균 펩티드 리소자임) 및 선천적 백혈구를 포함 2. 이 세포는 접촉을 통해 또는 병원체 덮어 및 살해를 포함 식균 작용을 통해 그들을 공격하여 하나 확인하고 병원균을 제거한다. 이 시스템은 P에 대한 면역 학적 기억을 부여 적응 면역, 대조적으로, 평생 방어를 허용하지 않습니다athogens. 적응 면역 시스템은 방어의 두 번째 라인 및 인식하고 여러 미생물 및 비 미생물 물질 3의 특정 항원에 반응 할 수있다. 적응 면역 시스템의 주요 구성 요소는 B 및 T 세포 림프구를 포함이다. B 세포는 병원체 또는 외래 단백질에 대한 항체를 분비, 체액 성 반응에 관여한다. 그러나, T 세포의 사이토 카인 분비 또는 죽이는 병원체에 감염된 세포를 4 면역 반응을 조절, 세포 성 면역을 나타낸다.
주요 조직 적합성 복합체 (MHC) 5-7에 의해 세포 표면에 제시되는 항원에 탐식 병원균 세균성 및 공정 요소를 인식 할 수있는 수상 세포 또는 대 식세포, 선천 면역의 성분을 포함하여 항원 제시 세포 (APC를). 장갑차가 병원균을 phagocytized 한 후, 그들은 일반적으로 그들이 T와 상호 작용 배수 림프절로 이동세포. T 림프구는 T 세포 수용체에 의해 특정 MHC 펩티드 복합체를 인식 할 수있다. 면역 시냅스 (IS) 항원 제시 8,9 동안 항원 - 로딩 APC 및 림프구 사이의 인터페이스에서 발생한다. 일부 박테리아는 식균 작용을 생존과 장갑차 내에서 체계적으로 보급 할 수 있습니다. 이보기에서 감염된 장갑차는 세균 저수지 또는 세균 확산 (10)를 용이하게 "트로이 목마"의 역할을한다. 장갑차 및 IS 형성 도중에 일어난다 림프구 사이의 긴밀한 접촉은 또한 막, 유전 물질 및 엑소 좀의 일부의 교환을위한 플랫폼으로 기능과 T 세포를 감염시킬 수있는 어떤 바이러스 탈취 할 수있다; 이 과정은 transinfection 11 ~ 13이라고합니다.
일부 병원성 세균 (리스테리아, 살모넬라 엔테과 시겔의 flexneri)은 생체 내에서 T 림프구를 침공과 행동 14-16을 수정할 수 있습니다. 우리는 가지고있다최근 T 림프구는 항원 제시 16의 과정 이전에 감염된 수지상 세포로부터 transinfection 의해 박테리아를 캡처 할 수있는 것을 설명했다. T 세포의 직접 감염보다 (1,000-4,000x) 대단히 더 효과적 transinfection에 의해 세균 캡처. 보다 transinfection 나타내는 T 세포 캡처 병원체 및 비 병원균 박테리아는 T 세포에 의해 구동되는 프로세스이다. 놀랍게도, 세포는 빠르게 캡처 박테리아를 죽이고 전문 식세포 (16)보다 그렇게 더 효율적으로 한 T (가슴) transinfected. 면역학 도그마 휴식이 결과, 적응 면역 세포는 선천성 면역의 가정 배타적이었다 기능을 수행 할 수 있음을 보여준다. 또, 유방 세포 염증성 사이토 카인의 다량 분비 및 생체 내에서 세균 감염으로부터 보호하는 것으로 나타났다.
여기에서 우리는에 세균 transinfection 과정을 연구하는 데 사용되는 다른 프로토콜을 제시마우스 모델. 이 모델은 박테리아에 감염된 뼈 구체적 I-Ab의 상호 작용 (17)의 맥락에서 OVA (OVAp)의 펩티드 3백23부터 3백39까지 대한 TCR의 특정 베어 OTII 트랜스 제닉 마우스에서 CD4 + T 세포의 사용에 기초한다 marrow- 안정적인 면역 시냅스를 형성 OVAp로드 유래 수지상 세포 (BMDCs) 18, 19,.
T 세포 transinfection 시각화 및 형광 현미경을 사용하여 추적 될 수있다. 또한, 유동 세포 계측법, 녹색 형광 단백질 (GFP)을 발현하는 박테리아 16, 20에 의해 방출 된 형광을 이용하여 감염된 세포를 검출하기 위해 사용될 수있다. 또한, T 세포는 transinfection 더 민감한 방법, 이벤트의 다수의 측정이 가능 젠타 생존 분석으로 정량 할 수있다. 겐타 마이신은 진핵 세포에 침투 할 수 없습니다 항생제이다. 따라서,이 항생제를 사용하는 것은 항생제 첨가 FR 살아남은 세포 내 박테리아의 분화를 허용(21) 사망했다 톰 외 것.
프로토콜
참고 : 실험 절차는 대학교 Autònoma 마드리드의 연구 윤리위원회의 승인을 스페인과 유럽 지침에 따라 동물 복지 및 보건 대학교 Autònoma 마드리드 헤드의 감독하에 실시 하였다. 마우스는 특정 병원체 무료 (SPF) 하우징에 자란하고 이산화탄소를 사용하여 훈련과 자격을 갖춘 사람 (CO 2) 흡입 방법으로 안락사시켰다.
1. 마우스 뼈 수지상 세포의 분화 및 감염 골수 유래
참고 : 그림 1은 첫 번째 단계를 요약 한 것입니다. 모든 절차 만 멸균 미디어, 악기, 피펫 팁 및 배양 접시를 사용하여,이 시점에서 후드에서 수행되어야한다.
- 마우스 골수 유래 수지상 차별화
- 하나 C57 / BL6 마우스 (22)에서 경골과 대퇴골을 해부하고 RPMI 배지 10 ml의 플라스틱 접시에 전송합니다.
- 멸균 가위, 각 골단을 잘라 특성 밝은 붉은 색이 골수를 노출.
- 멸균 페트리에 멸균 주사기를 사용하여 0.5 % 소 혈청 알부민을 함유하는 인산염 완충 식염수 10 ㎖ (PBS) (BSA), 5 mM의 에틸렌 디아민 테트라 아세트산 (EDTA) (PBS / BSA / EDTA 완충액)로 뼈의 내부 달이다 요리.
- 냉장 원심 분리기 (4 ° C)에서 600 XG에 튜브에 세포 현탁액을 원심 분리기를 수집합니다.
- 암모늄 염화 칼륨 (ACK) 용균 완충액 (0.15 M NH4Cl 등, 10mM의 KHCO 3, 0.1 mM의 EDTA) 1 ㎖로 세포를 재현 탁하고, 적혈구를 제거하기 위해 RT에서 30 초 동안 배양한다.
- 덩어리는 여과에 의해 제거 되었기 때문에 동일한 속도 (600 XG)에서 원심 분리하기 전에 뼈 조각 세포 덩어리를 제거하기 위해 셀 스트레이너 (70 μm의)을 통하여, 10 % 소 태아 혈청 (FBS)과 RPMI 1640 배지 10 ㎖를 첨가하고 필터.
- 셀 개수D RPMI, 10 % FBS (함유 50 μM의 B 머 캅토 에탄올, 1 mM 나트륨 피루 베이트)를 5 × 105 세포 / ml로 조정하고 20 NG / ml의 재조합 쥣과 과립구 대 식세포 콜로니 자극 인자 (RM-GM-CSF)를 추가 최종 농도.
- CO 2 배양기에서 멸균, 미생물 학적 품질, 15cm 페트리 접시, 문화에 현탁액을 추가 (37 ℃, 5 % CO 2).
- 3 일마다 20 NG / ㎖ RM-GM-CSF를 함유하는 신선한 배지로 세포 밀도 5 × 105 세포 / ml에서 비 - 부착 세포 및 PBS에 5mM의 EDTA와 분리 된 세포와 재현 탁을 모두 스핀 다운.
- DC의 항원로드의 성숙
- 9 일에, 20 NG / ㎖ RM-GM-CSF를 함유하는 배지에서의 밀도 5 × 105 세포 / ㎖로 세포를 재현 탁. 그런 다음 세포에 높은 MHC-II의 발현을 허용하고 24 시간 동안이 아닌 조직 배양 처리 된 멸균 15cm 페트리 접시에서 배양 20 NG / 리포 폴리 사카 라이드 (LPS)의 ㎖에 추가 할 수 있습니다.
- 한 후LPS 자극의 날, 유동 세포 계측법에 의해 수지상 세포의 분화를 확인하기 위해 마우스의 CD11c, MHCII 및 GR-1에 대한 항체와 일부 DC 세포를 얼룩. 수지상 세포의 유세포 분석의 예는도 3a 및도 3b에 도시된다.
- 샘플 당 50 μl의 PBS / BSA / EDTA 버퍼에 최종 농도 2.5 ㎍ / ㎖의에서 항 - 마우스-CD16 / CD32 단클론 항체와 DC가 (5 × 10 5 세포 / 샘플)을 품어. 그 후, MHCII (IA / IE)에 대한 항체의 50 μl를 추가하는 CD11c 1에서 서로 다른 형광 색소와 결합 GR-1 : 100, 1 : 200, 1 : 각각 PBS / BSA / EDTA 버퍼 (500).
- 마지막으로, PBS / BSA / EDTA 버퍼와 DC가 씻어 제조 업체의 프로토콜에 따라 유동 세포 계측법에 의해 분석한다.
참고 : 세포가 잘 분화 된 경우, 세포는 항원 로딩을위한 준비가되어 있습니다.
- 워시 RPMI와 DC가 10 % (항생제없이) FBS, 10 μg의 / ㎖ OTII OVAp (OVA 323-339으로 그들을 품어; ISQA37 ºC에서 최소 1 시간 동안 5 × 106 수지상 RMPI 당 10 % FBS 배지 1 ㎖에 플라스틱 튜브 VHAAHAEINEAGR). 음성 대조군으로, OVAp으로 배양하지 않고 DC가 둡니다.
- 수지상 세포의 감염
- CO 2 인큐베이터에서 1 시간 동안 10 세균 (박테리아 DC 당 10)의 감염 다중도 (MOI)에서 DC의 감염 (37 ° C, 5 % CO 2).
- 워시 DC 세포는 세포 외 박테리아의 대부분을 세척하기 위해 RMPI 10 % FBS 450 XG에 원심 분리기에 PBS와 1 배에서 3 배. 마지막으로, 20 × 106 세포 / ml에서 (항생 물질없이) RMPI 10 % FBS 배지에서 세포를 재현 탁.
OTII 형질 전환 마우스에서 CD4 + T 림프구의 2. 분리
참고 : 그림 1은이 두 번째 단계를 요약 한 것입니다. 림프절은 대신 CD4 + T 세포를 분리하는 비장의 표기 림프절에서의 CD4 + 림프구 비율 때문에S (~ 50 %), 비장 (~ 25 %) 때문에, 정제가 더 효과적 일 것보다 크다.
- 림프절의 단일 세포 현탁액을 확인
- OTII 형질 전환 마우스에서 23 노드 사타구니, 겨드랑이, 상완, 자궁 경부 및 장간막 림프절을 제거하고 RPMI 10 % FBS 배지 10 ml의 플라스틱 접시에 전송합니다.
- 두 프로스트 현미경 슬라이드를 사용하여 멸균 후드 아래 갈기 림프절. 한 현미경 슬라이드의 프로스트 측에 림프절을 배치하고 장기 지상 될 때까지 두 번째 슬라이드의 프로스트면 문질러.
- PBS / BSA / EDTA 버퍼에 단일 세포 현탁액을 씻으십시오.
- 셀 스트레이너 (70 μm의)가 결합 조직을 제거하고 PBS / BSA / EDTA 버퍼로 씻어 불구하고 세포를 필터링합니다.
- ACK 용해 완충액 1 ml의 세포를 재현 탁하고, 적혈구를 제거하기 위해 RT에서 1 분 동안 배양한다.
- CD4 + T 세포의 분리
- 단계 2.1.3 카운트로 다시 세척세포를 PBS / BSA / EDTA 완충액에서 100 × 106 세포 / ml로 재현 탁 그들을한다. 1 CD8, IgM의, B220, CD19, MHC 클래스 II (I-AB), CD11b를, 중 CD11c 및 DX5에 비오틴 항체를 추가 : (250)을 30 분 동안 얼음에 CD4 + T 세포의 이상 음의 선택에.
- PBS / BSA / EDTA 버퍼에 세포를 씻고 얼음에 15 분 동안 제조 업체의 프로토콜에서 권장하는 농도에서 스트렙 타비 딘 마이크로 비드와 세포 (100 × 10 6 세포 / ml)을 품어.
- PBS / BSA / EDTA 버퍼에 세포를 씻으와 CD4 + T 세포 분리하기 전에 셀 스트레이너 (30 μm의) 비록을 필터링 할 수 있습니다.
- 제조사의 프로토콜에 따라, 자기 세포 분리 장치를 사용하여 음성 선별하여 CD4 + T 세포를 분리.
- 세포를 세어 (항생 물질없이), 10 % FBS RPMI 배지 4 × 106 세포 / ml로 조정한다.
- 수정 및 유동에 의해 순도를 확인하는 얼음 절연 CD4 + T 세포 (3 × 105 세포)에 유지같은 사이토 (24)을 설명했다. CD4 + T 세포를 정제의 예는도 3C에 도시되어있다.
3. T 세포 Transinfection 측정 겐타 마이신 보호 분석에 의한
참고 : 그림 2는 프로토콜의 세 번째 단계를 요약 한 것입니다.
- T 세포 Transinfection
- 감염된 DC 세포 (1 : 1)과 함께 격리 CD4 + T 세포를 부화 CO2 인큐베이터 (37 ° C에서 면역 시냅스 형성을 허용하도록 30 분 동안 (DC에서 1 시간 동안 감염 제거하기 위해 세척 한 후 무료 박테리아), 5 % CO 2).
- 추가 절연 CD4 + T 세포 (2 × 106 세포) 및 24 웰 배양 접시에 감염된 수지상 세포 (2 × 106 세포)를 0.1 mL의 0.5 mL의. 음성 대조군으로서, 30 분 동안 10 박테리아의 MOI에서 직접 0.5ml를 CD4 + T 세포를 감염.
- 사용하여 T 세포에서 감염 DC가 분리 추가 컨트롤을 포함DC-T 물리적 접촉을 방해 (공경이 3 μm)와 폴리 카보네이트 트랜스 웰 배리어. 잘 (24 웰 플레이트)의 하부 구획으로 0.1 트랜스 웰 내부의 DC ㎖의 CD4 + T 세포의 0.5 ML을 추가합니다.
- 마지막으로, RMPI 매체를 갖춘 모든 샘플에서 동일한 볼륨을 만들기 위해 각 웰에 0.6 ml의가있을 때까지.
- 면역 시냅스 형성의 30 분 후, 겐타 마이신 100 ㎍ / ㎖의 추가 및 CO 2 인큐베이터에서 세포를 수집하기 전에 1 시간 동안 배양 (37 ℃, 5 % CO 2).
- 다시 격리 CD4 + T 세포의
- 비 부착 세포를 수집하고 PBS / BSA / EDTA 버퍼를 재현 탁. DC가 대부분의 플라스틱 배양 접시에 부착 된 상태로 유지. 소용돌이 튜브는 부드럽게 세포 세분화을 보장합니다. 겐타 마이신이 잘 작동 것을 보여 제어와 같은 세포 상층 액 500 μl를 유지합니다.
- 단계 2.2에서와 같이 수지상 세포 및 T 세포를 포함하는 샘플로부터 CD4 + T 세포를 다시 분리, DC가 있지만 대부분은 접시에 부착해야합니다. 얼음에 제어 샘플을 보관하십시오. 계정에 2 % 미만 오염 만 실험을 가져 가라. transinfection 후 CD4 + T 세포를 정제의 예는도 3D에 도시된다.
- 를 Lyse T 세포와 박테리아 중간 한천 플레이트에 그들을 씨앗.
- PBS로 두 번 CD4 + T 세포를 씻으십시오.
- 세포를 세어 PBS에서 2 × 106 세포 / ml로 재현 탁 그들을.
- T 세포의 세포 밖으로 방출 박테리아, 1 × 106 세포 / ml에서 그들을 용해시키기 위해 T 세포를 500 ㎕의 0.1 % 트리톤 X-100 500 ㎕를 추가하기.
- 용해 세포의 3 연속 진수 희석을 확인하고 박테리아 매체 한천 플레이트에 각 희석의 50 μl를 시드. 4 부분으로 판을 나누고 각 부분에 용해 세포의 다른 희석 씨앗. 대표적인 결과를도 4에 나타낸다.
- 대조군으로서, 또한 판형그 겐타 마이신을 보장하기 위해 한천의 접합체의 저장 세포 상층 액을 잘 근무하고있다. 또한 추가 제어로 감염된 DC의 플레이트. 경우 낮은 DC가 오염 (<2 %), 낮은 DC 오염에 대응하는 콜로니 형성 단위 (CFUs)를 빼기 발생합니다.
4. 정량 유동 세포 계측법에 의한 T 세포 Transinfection의
참고 : 그림 2는이 단계를 요약 한 것입니다.
- T 세포 Transinfection
- 단계 1.3에서와 같이 BMDCs 감염,하지만이 경우 GFP 표현 박테리아를 사용합니다.
- 제조 업체의 프로토콜에 따라 37에서 30 분 동안 세포 추적기 클로로 aminocoumarin (CMAC)와 (단계 2.2에서 림프절에서 격리) 얼룩 CD4 + T 세포 ºC.
- 두 번 (항생제없이) RMPI 10 % FBS으로 표시 CD4 + T 세포를 씻으십시오.
- 감염된 수지상 세포를 품어 표시 CD4 +와 (박테리아와 1 시간 배양 후)30 분 동안 T 세포 단계 3.1.1에서 설명하는 모든 컨트롤을 포함하여 37 ºC에서 면역 시냅스 형성을 허용합니다.
- 감염된 CD4 + T 세포의 염색
- DC-T 면역 시냅스 형성의 30 분 후, 세포를 수집하고 PBS / BSA / EDTA에 씻어.
- PBS / BSA / EDTA 버퍼, 부드럽게 튜브를 텍싱하여 별도의 집계 세포와 두 세척 후.
- 0.2 ㎖ / PBS 실온에서 15 분 동안 3 % 함유의 PFA 튜브에 샘플을 고정한다. 그런 다음 PBS로 씻어.
- 수지상 세포 된 Fc 수용체를 차단하는 얼음에 15 분 동안 PBS / BSA / EDTA 50 μL / 샘플에서 항 - 마우스 CD16 / CD32 모노클로 날 항체 (2.5 μg의 / ml)로 배양한다.
- 세포 외 박테리아를 얼룩 얼음에 30 분 동안 50 μL / PBS / BSA / EDTA의 샘플에서 항균 항체 (최종 농도 10 μg의 / ㎖) 토끼를 추가합니다.
- PBS / BSA는 / EDTA로 세포를 씻으 및 피코 에리 트린 (PE)가 결합 마우스의 CD11c에 대한 항체 및 그 자체로 품어토끼에 대한 condary 항체는 1 알렉사 - 형석 647과 같은 다른 형광 색소가 결합 : 얼음에 30 분 동안 PBS / BSA / EDTA의 200 μL 100 / 샘플.
- 세포를 세척하고 유동 세포 계측법에 의해 샘플을 분석 할 수 있습니다. 비 - 형광성 박테리아에게 샘플들을 보상 및 설정 (25) 유동 세포 계측법을 조정 실험에 사용 된 각각의 형광 색소로 표지 한 음성 대조군 샘플을 사용 transinfected T 세포의 시료를 포함하는 것을 잊지 마십시오. 대표 분석은 그림 5에 표시됩니다.
참고 : 박테리아가 GFP를 표현하지 않는 경우, 5 분 동안 PBS에 0.5 %에서 트리톤 X-100 샘플을, 세포 내와 세포 외 박테리아, 라벨 외 박테리아를 구별 수정 및 Permeabilize 하시려면 할 수 있습니다. 그 후 다른 형광 색소와 총 박테리아 (세포 + 세포)를 얼룩.
결과
유동 세포 계측법 및 겐타 마이신 생존 분석 그림 1은 세포를 획득하는 절차를 요약 한 것입니다. 여기에서 우리는 감염된 골수 유래-DC가 어떻게 두 개의 서로 다른 접근 방식을 통해 박테리아 transinfection을 측정하는 방법에서 쥐의 T 세포 박테리아 transinfection을 수행하는 방법을 설명했다. 수지상 9 일간 GM-CSF와 골수 세포를 배양하여 생성된다. 그리고 DCS는 OVA (OVAp)의 특정 펩타이드 나중에 그들을로드의 막에 MHCII을 증가 LPS와 숙성된다. 대조군으로, 어떤 DC가이 OVAp으로로드되지 않습니다. (OVAp -로드 및 비 로딩)는 모두 DC의 감염 다중도 (10)의 박테리아 (MOI)로 감염된다. 한편, CD4 + T 세포는 특정 OVAp 인식 OTII 트랜스 제닉 마우스의 림프절로부터 분리된다. (2)가 수행하고 적절한 음성 대조군을 포함하여 T 세포 transinfection를 정량화하는 절차를 도시 한 도표. descri으로침대 전에, 어떤 DC가이 OVAp으로로드되지 않습니다. 이 경우, 인해 OVAp의 부재로 수지상 세포 및 T 아니지만 면역 시냅스 형성 사이의 상호 작용이있다. 추가 제어는 DC-T 물리적 접촉을 방해 (공경이 3 μm)와 폴리 카보네이트 트랜스 웰 배리어로 수지상과 T 세포를 분리하여 포함된다. 수지상 세포는 트랜스 웰 내부에 포함되어 있습니다; 결과적으로 그들은이 기공 크기를 통과 할 수 없다. 다른 대조군은 10 박테리아의 MOI에서 직접 T 세포를 배양함으로써, 직접 T 세포 감염을 포함된다. T 세포 transinfection은 두 가지 방법에 의해 정량화 될 수있다 : 유세포 또는 겐타 마이신 생존 분석. 유동 세포 계측법에 의해 측정하기 위해 DC가 박테리아 GFP와 CD4 + T 세포와 이전에 감염되어 있어야 세포 추적기와 얼룩 (T 세포 블루). 결합체 형성 후, 수지상 세포 (의 CD11c-PE)에 대한 항체로 염색한다. 세포 외 박테리아는 quantif하기 위해 염색한다Y 나중에 유동 세포 계측법에 감염된 CD4 + T 세포의 백분율. 겐타 마이신 생존 분석에 의해 transinfection을 측정하기 위해, 세포는 세포 외 박테리아를 죽일 1 시간 동안 겐타 마이신과 함께 배양 한 후 T 세포는 한천 플레이트에 시드 다시 격리됩니다. 소수 직렬 희석는 한천 플레이트에 각 희석의 50 μl를 씨와 CFUs의 계산을 용이하게하기 위해 만들어집니다.
도 3에 도시 된 바와 같이, DC 분화는 유동 세포 계측법 (도 3a 및 3b)에 의해 확인되어야한다. DC가이 중 CD11c 및 MHCII (그림 3A)이 아닌 GR-1, 호중구 마커 표현한다. 도 3b에 제시된 바와 같이, 약간의 호중구 (GR-1 +, MHC의 3.27 %는 -) 배양에서 제시되었지만 호중구 오염의 5 % 이상으로 수지상 세포의 배양이 사용되어서는 안된다. CD4 + T 세포의 순도는 LY에서 분리 한 후 확인해야시속 노드 (그림 3C) 및 수지상에서 분리 한 후 형성 (그림 3D)를 공액. 접합체 형성 후의 오염물이 2 % 미만으로 고려 실험 걸릴.
도 4는 살모넬라 균을 이용하여 T transinfection의 실험 예를 나타낸다. 도 4a에 도시 된 바와 같이, 플레이트 카운트 수 LB 아가 플레이트 및 콜로니 형성 단위를 성장하는 각 부품. 살모넬라의 연속 희석을 시드하는 네 개의 부분으로 분할된다. 도 4a에 도시 된 바와 같이, 살모넬라 감염의 DC로부터 T 세포에 의해 캡처하고,이 프로세스는 명확 OVAp 인식 (도 4a 및도 4b의 좌측 판) 향상되었다. 수지상 세포와 T 세포 사이의 접촉을 방해하는 물리적 장벽이있을 때 그러나, 사실상 transinfection는 직접적인 T를 수행하는 경우와 같이, 없었다 세포 감염 (그림 4a 및도 4b의 오른쪽에 판).
도 5에 도시 된 바와 같이, T 세포는 밝은 transinfection GFP를 발현하는 박테리아를 이용한 유동 세포 계측법에 의해 정량화 될 수있다. 수지상 세포 및 T 세포를 전방 및 측면 산란 플롯의 크기 및 복잡성에 의해 구별 될 수 있지만, 다른 마커는 잘 구별 할 수있다. CD4 + T 세포 중 CD11c 대한 항체와 세포 추적기 (CMAC) 및 수지상 세포로 표지 하였다. 이들은 CMAC 표지 (하지의 CD11c-PE 포함) 및 표현되기 때문에 세포 외 박테리아 정량화 할 수있다 따라서 알렉사 형석 647, 감염된 CD4 + T 세포의 백분율 공액 살모넬라 및 이차 항체 항 - 토끼 대해 토끼 항체로 염색 하였다 GFP (박테리아-GFP), 그러나 그들은 세포 외 박테리아 (알렉사 플 루어 647)에 대한 항체로 염색되지 않았다.
ntent "FO : 유지 - together.within 페이지 ="1 ">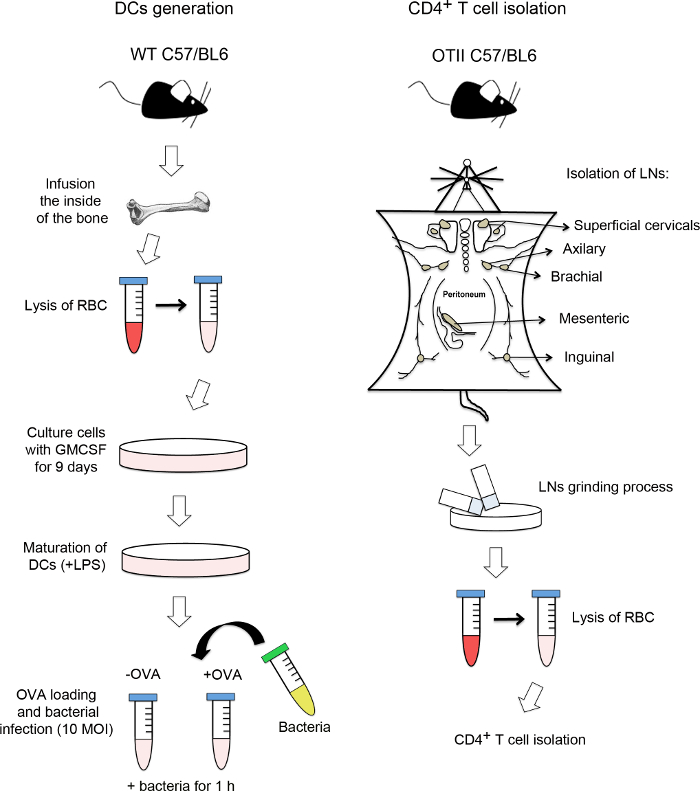
DC 생성 및 CD4 + T 세포의 분리도 1 흐름도. 도면의 왼쪽에, 처리는 골수 세포로부터 수상 세포 (DCS)를 구별하기 상세이다. 대퇴골과 경골을 절개 한 후에, 골수 세포는 뼈의 내부로부터 추출된다. 이후, 적혈구 (RBC)를 용균 및 골수 세포 9 일간 뮤린 재조합 과립구 대 식세포 콜로니 자극 인자 (GM-CSF)와 함께 배양했다. 그들이 잘 차별화 일단, 수지상는 주요 조직 적합성 복합체 II (MHCII) 발현을 증가하는 리포 폴리 사카 라이드 (LPS)와 함께 배양한다. 그 다음, 수지상 세포는 특정 ovoalbumin 펩티드 (OVAp) 로케이션 및 감염의 다중성 (10)의 박테리아 (MOI)로 감염된다. 그들 중 일부는 대조군으로 OVAp으로로드되지 않습니다. 도면의 오른쪽에, 방법OTII 트랜스 제닉 마우스가 표현에서 CD4 + T 세포를 분리. 림프절 (림프절)은 단일 세포 현탁액을 얻는 제거 및 접지이다. 마지막으로, CD4 + T 세포가 자기 세포 분리 기계를 사용하여 음의 선택에 의해 격리됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2 T 세포 transinfection 절차의 흐름도. (박테리아가 녹색으로 도시되어있다) 및 OVAp로드 - 수지상 세포 (적혈구) 감염은 면역 시냅스 형성을 허용하는 CD4 + T 세포 (청색 세포)와 함께 배양된다. 감염된 수지상 (그러나 OVAp로드하지 않음) 또한 두 셀들 사이의 상호 작용하지만 면역 시냅스 형성없이 허용 T 세포와 함께 배양된다. 추가 제어가 CD4 +를 분리 포함 DC-T 세포의 접촉을 방해 폴리 카보네이트 트랜스 웰 장벽 (+ TW)와 T 세포와 수지상. 직접 T 세포 감염은 음성 대조군으로서 포함된다. 마지막으로, T 세포 transinfection은 겐타 마이신 생존율 분석법 (도면의 우측)에 매우 민감 방법 (박테리아 캡처 T 세포의 수를 나타내며, 의한 유동 세포 계측법 (도면의 좌측)에 의해, 두 방법에 의해 정량화 될 수있다 한 감염 세균은 세균 감염의 속도를 나타내는)를 검출 할 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
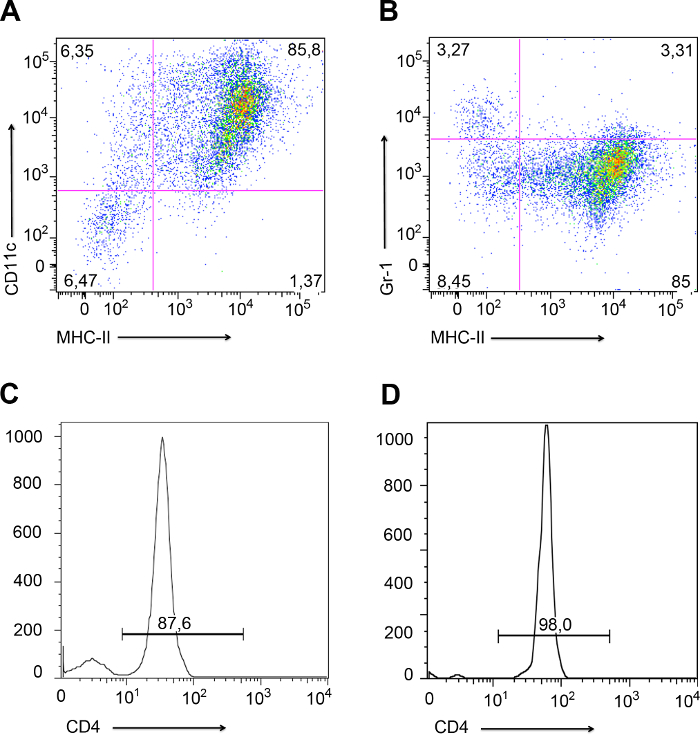
고립 된 CD4 + T 세포 - 유래 수지상 골수의 분석 사이토 그림 3. 흐름. 분석 골수 유래-DC를 대표 도트 플롯유동 세포 계측법. (; 오른쪽 상단 사분면 85.8 %) (B) DC가 MHCII하지만 GR-1 (; 오른쪽 아래 사분면 85 %)을 표현 (A)의 DC는 MHCII와의 CD11c 표현. 그러나, GR-1이 아닌 MHCII 세포 (왼쪽 사분면)을 표현 세포의 3.27 %가 있었다. 이 세포들은 경미한 오염 호중구 있었다. (C와 D) 림프절 (C)에서 분리 된 CD4 + T 세포의 순도를 나타내는 히스토그램, 그리고 수지상 세포 (D)와 복합체를 형성 한 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
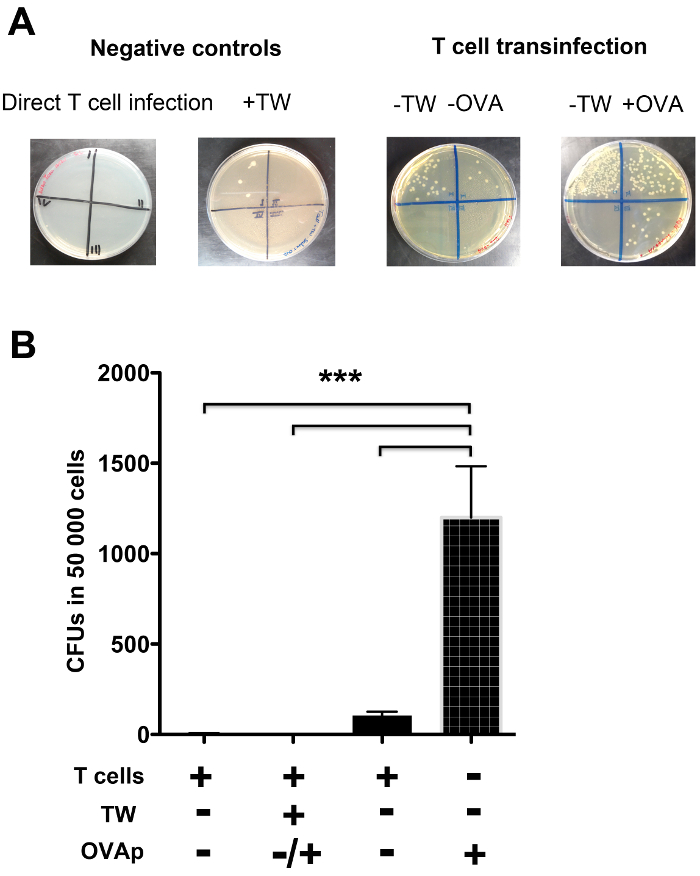
겐타 마이신 생존 분석으로 정량도 4 T 세포 transinfection. LB 아가 플레이트는 시마 대응 4 부분으로 나누어분해 된 CD4 + T 세포의 L 연속 희석. (-) (A) 콜로니는 살모넬라 엔테 단위가 존재 (+) 또는 부재하에 T 세포 transinfection에 대응하는 LB 아가 플레이트상에서 성장 형성 감염 DC의 표면에 OVAp, 그리고 (DC / T 세포 접촉을 허용하는 조건 - TW) 또는 접점 (+ TW)을 방해하는 물리적 장벽의 존재. 직접 T 세포 감염 (음성 대조군)에 대응하는 빈 접시 또한 도시된다. DC / T 세포 접촉 (+ TW)을 방해 한 거의 transinfection이 있었다. DC의 감염에서 T 세포에 의해 캡처 된 박테리아의 속도를 보여주는 몇 가지의 실험에서 콜로니 형성 단위 (CFUs)의 (B) 부량. 직접 T 세포 감염 및 DC / T 세포 접촉을 방해하는 조건은 T 세포 감염의 수준으로 거의 생산. DC / T 세포 접촉이 허가되었을 때,이 T 세포 transinfection이었고, 이는 항원 인식 (+ OVAp)에 의해 강화되었다. 열 바는 3 I의 평균을 나타냅니다ndependent 실험. 오차 막대는 SD를 나타냅니다. 유의 한 차이가 P <0.0001에 해당 ***로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5 T 세포는 유동 세포 계측법 transinfection 의해 정량화. 주제 도트 플롯 transinfection 공정 후 수지상 세포 및 T 결합체를 도시. CD4 + T 세포와 같은 작은 둥근 전방 및 측면 스 캐터있다 (FCS - SSC) 도트 블롯 쇼, 잘 분화되기 위해, 이들은 셀 트랙커 (CMAC)으로 염색 하였다. 중 CD11c을 표현 수지상는 CMAC으로 표시하고 불규칙한 모양 T CD4 + T 세포보다 더 큰되지 않습니다. extracel에 대한 세포 내 세균-GFP하지만 부정적인를 포함 감염된 CD4 + T 세포오른쪽 아래 사분면에 표시됩니다적인 다공질 박테리아 (6.19 %). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
T 세포 또는 T 림프구는 적응성 면역 반응 (26)에 세포 성 면역에 중요한 역할을 담당하고 속하는 백혈구 유형이다. T 세포는 시험 관내에서 감염에 반응하지만 일부 리포트들은 생체 14,15에 감염 될 수 있다는 것을 나타낸다. 면역 시냅스 동안 APC와 T 세포의 친밀한 접촉은 HIV (11)와 같은 일부 바이러스를 포함하는 생체 재료 (13)를 교환하기위한 플랫폼 역할을합니다. 그것은 최근에 교리, T 세포에 그 반대를 줬습니다 적응 면역 세포의 패러다임은, 또한 효율적으로 감염된 수지상 11,16에서 transinfection에 의해 박테리아를 캡처 할 수 있습니다. 여기에서 우리는 그가 감염 BMDCs에서 체외에서 T 세포 박테리아 transinfection을 정량화하는 프로토콜을 자세히 보여줍니다.
T 세포는 박테리아 transinfection 항원 인식 (16)에 의해 강화되었다. 우리는 CD4 + T 세포를 이용하여 분리되었습니다특정 OVAp을 인식 OTII 형질 전환 마우스는 BMDCs는 OVAp하고 (여기에 데이터가 살모넬라 엔테에서 제시) 다른 박테리아에 감염된 쥐와 함께로드. OTII 생쥐로부터 단리 CD4 + T 세포는 면역 시냅스 형성을 허용하도록 30 분 동안 감염된 수지상 세포와 함께 배양된다. 여기에 제시된 데이터는 T 세포가이 짧은 시간에 수지상에서 캡처 박테리아에 대응한다. 우리는 감염된 수지상에 T 세포의 긴 노출 큰 박테리아 캡처 (도시 생략)의 결과 알지만, T 세포는 또한 매우 신속 uptaken 박테리아를 파괴로 긴 DC / T 세포 시간 콘택트 중에 발생하는 세균 transinfection 정량화는 어려웠다 . 겐타 마이신 생존 분석은 하나의 세균 감염 (21)를 검출 할 수 있기 때문에 T 세포 transinfection를 정량화하는 매우 민감한 방법이다. 겐타 마이신과 부화 후 T 세포가 분리되어 박테리아 매체 한천 (PL)에 씨앗에 용해, 단지 외 박테리아를 죽이고 그ATES. 수지상과 복합체를 형성 한 후 T 세포의 분리는 프로토콜 내에서 중요한 단계이다. 오염 물질이 2 % 미만으로 만 실험은 고려되어야한다. DC 오염은 유동 세포 계측법 및 낮은 DC 오염에 대응 CFUs 감산되어야 의해 측정 할 수있다. 대안 적으로, CD4 + T 세포의 순도는 세포 분류를 사용함으로써 개선 될 수있다.
또 다른 방법은 T 세포 transinfection는 GFP가 세균을 표현과 호환되는 형광 물질로 세포 외 세균에 레이블을 사용하여, 유동 세포 계측법입니다 정량화합니다. 이 방법의 한 가지 제한은 박테리아가 자기 형광 배경에 감염된 세포를 검출 충분히 밝은 GFP를 표현해야한다는 것입니다. 또한, 박테리아 세포 추적기와 DC가 감염되기 전에 염색 할 수있다. 또 다른 방법은, 세포 외 박테리아 오염 T 세포 permeabilizing, 모든 세균 (세포 + 세포)를 라벨링 될다른 형광 색소와.
이 프로토콜의 미래 방향에 대해 우리는 자성 입자로 장식 된 박테리아를 사용하여 수지상 세포로 감염 후에 박테리아 이상 설명 캡처 T 세포 수를 정량화하는 프로토콜을 설정하기 위해 시도하고있다. 박테리아를 캡처 T 세포는 자성 입자를 보유 것이고 그러므로 자석을 사용하여 그것들을 분리하기 쉽게한다.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by grants BFU2011-29450, BFU2008-04342/BMC from the Spanish Ministry of Science and Innovation and PIES201020I046 from Consejo Superior de Investigaciones Cientìficas (CSIC).
자료
| Name | Company | Catalog Number | Comments |
| RPMI | Fisher Scientific | SH3025501 | |
| r-GMCSF | Peprotech | 315-03 | |
| LPS | SIGMA | L2630-10mg | |
| Na Pyruvate | Thermo Scientific | SH3023901 | |
| 2-ME | Gibco | 31350-010 | |
| OVAp OTII (323–339) | GenScript | --- | |
| Cell Strainer 70uM | BD | 352350 | |
| 30uM Syringe Filcons Sterile | BD | 340598 | |
| AutoMacs Classic | Miltenyi Biotec | 130-088-887 | |
| Gentamicin | Normon | 624601.6 | |
| Transwell | Costar | 3415 | |
| LB | Pronadisa | 1231 | |
| Agar | Pronadisa | 1800 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Triton X-100 | |||
| CD8 biot | BD Biosciences | 553029 | |
| IgM Biot | ImmunoStep | Clone RMM-1 | |
| B220 Biot | BD Biosciences | 553086 | |
| CD19 biot | BD Biosciences | 553784 | |
| MHC-II Biot (I-A/I-E) | BD Biosciences | 553622 | |
| CD11b biot | Immunostep | 11BB-01mg | |
| CD11c biot | Immunostep | 11CB3-01mg | |
| DX5 biot | BD Biosciences | 553856 | |
| Gr-1 biot | BD Biosciences | 553125 | |
| CD16/CD32 | ImmunoStep | M16PU-05MG | |
| anti Salmonella | ABD Serotec | 8209-4006 | |
| CD11cPE | BD Biosciences | 553802 | |
| CD4-APC | Tonbo Biosciences | 20-0041-U100 | |
| Gr-1 APC | BD Biosciences | 553129 | |
| MHC-II (I-A/I-E) FITC | BD Biosciences | 553623 | |
| Alexa-Fluor 647 Goat Anti-Rabbit IgG (H+L) Antibody, highly cross-adsorbed | Invitrogen | A-21245 | |
| CMAC (7-amino-4-chloromethylcoumarin) | Life technologies | C2110 | |
| BSA | SIGMA | A7030-100G | |
| Streptavidin MicroBeads | Miltenyi Biotec | 130-048-101 | |
| BD FACSCanto II | BD Biosciences | --- |
참고문헌
- Medzhitov, R. Recognition of microorganisms and activation of the immune response. Nature. 449 (7164), 819-826 (2007).
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (1989).
- Pancer, Z., Cooper, M. D. The evolution of adaptive immunity. Annual Review of Immunology. 24, 497-518 (2006).
- Rhoades, R. A., Bell, D. R. . Medical Phisiology. , (2012).
- Cossart, P. Bacterial Invasion: The Paradigms of Enteroinvasive Pathogens. Science. 304 (5668), 242-248 (2004).
- Kaufmann, S. H., Schaible, U. E. Antigen presentation and recognition in bacterial infections. Current Opinion in Immunology. 17 (1), 79-87 (2005).
- Pizarro-Cerdá, J., Cossart, P. Bacterial Adhesion and Entry into Host Cells. Cell. 124 (4), 715-727 (2006).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221, 77-89 (2008).
- Calabia-Linares, C., Robles-Valero, J., et al. Endosomal clathrin drives actin accumulation at the immunological synapse. Journal of Cell Science. 124 (5), 820-830 (2011).
- Westcott, M. M., Henry, C. J., Cook, A. S., Grant, K. W., Hiltbold, E. M. Differential susceptibility of bone marrow-derived dendritic cells and macrophages to productive infection with Listeria monocytogenes. Cellular Microbiology. 9 (6), 1397-1411 (2007).
- Geijtenbeek, T. B., Kwon, D. S., et al. DC-SIGN, a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells. Cell. 100 (5), 587-597 (2000).
- Izquierdo-Useros, N., Naranjo-Gòmez, M., et al. HIV and mature dendritic cells: Trojan exosomes riding the Trojan horse. PLoS Pathogens. 6 (3), e1000740 (2010).
- Mittelbrunn, M., Sanchez-Madrid, F. Intercellular communication: diverse structures for exchange of genetic information. Nature Reviews. Molecular cell biology. 13 (5), 328-335 (2012).
- McElroy, D. S., Ashley, T. J., D'Orazio, S. E. Lymphocytes serve as a reservoir for Listeria monocytogenes growth during infection of mice. Microbial Pathogenesis. 46 (4), 214-221 (2009).
- Salgado-Pabon, W., Celli, S., et al. Shigella impairs T lymphocyte dynamics in vivo. Proceedings of the National Academy of Sciences. 110 (12), 4458-4463 (2013).
- Cruz Adalia, A., Ramirez-Santiago, G., et al. T cells kill bacteria captured by transinfection from dendritic cells and confer protection in mice. Cell Host and Microbe. 15 (5), 611-622 (2014).
- Barnden, M. J., Allison, J., Heath, W. R., Carbone, F. R. Defective TCR expression in transgenic mice constructed using cDNA-based alpha- and beta-chain genes under the control of heterologous regulatory elements. Immunology and Cell Biology. 76 (1), 34-40 (1998).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. Journal of Visualized Experiments: JoVE. (17), (2008).
- Inaba, K., Inaba, M., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. Journal of Experimental Medicine. 176 (6), 1693-1702 (1992).
- Thöne, F., Schwanhäusser, B., Becker, D., Ballmaier, M., Bumann, D. FACS-isolation of Salmonella-infected cells with defined bacterial load from mouse spleen. Journal of Microbiological Methods. 71 (3), 220-224 (2007).
- Vaudaux, P., Waldvogel, F. A. Gentamicin antibacterial activity in the presence of human polymorphonuclear leukocytes. Antimicrobial Agents and Chemotherapy. 16 (6), 743-749 (1979).
- Zhang, X., Goncalves, R., Mosser, D. M., Coligan, J. E. Chapter 14, The isolation and characterization of murine macrophages. Current protocols in immunology. , Unit 14.1 (2008).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments: JoVE. (79), e50765 (2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). Journal of Visualized Experiments: JoVE. (41), (2010).
- Foucar, K., Chen, I. M., Crago, S. Organization and operation of a flow cytometric immunophenotyping laboratory. Seminars in diagnostic pathology. 6 (1), 13-36 (1989).
- Itano, A. A., Jenkins, M. K. Antigen presentation to naive CD4 T cells in the lymph node. Nature Immunology. 4 (8), 733-739 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유