Method Article
T細胞は、樹状細胞からTransinfectionによって細菌をキャプチャ
要約
ここで、プロトコルは、事前に感染した樹状細胞(DC)からtransinfection介して抗原提示の間に発生するCD4 + T細胞による細菌の取り込みを測定するために提示されています。初代細胞、DC、DC / T細胞複合体の形成の感染、および細菌のT細胞トランスフェクションの測定の分離:私たちは、必要なステップを実行する方法を示しています。
要約
Recently, we have shown, contrary to what is described, that CD4+ T cells, the paradigm of adaptive immune cells, capture bacteria from infected dendritic cells (DCs) by a process called transinfection. Here, we describe the analysis of the transinfection process, which occurs during the course of antigen presentation. This process was unveiled by using CD4+ T cells from transgenic OTII mice, which bear a T cell receptor (TCR) specific for a peptide of ovoalbumin (OVAp), which therefore can form stable immune complexes with infected dendritic cells loaded with this specific OVAp. The dynamics of green fluorescent protein (GFP)-expressing bacteria during DC-T cell transmission can be monitored by live-cell imaging and the quantification of bacterial transinfection can be performed by flow cytometry. In addition, transinfection can be quantified by a more sensitive method based in the use of gentamicin, a non-permeable aminoglycoside antibiotic killing extracellular bacteria but not intracellular ones. This classical method has been used previously in microbiology to study the efficiency of bacterial infections. We hereby explain the protocol of the complete process, from the isolation of the primary cells to the quantification of transinfection.
概要
病原体は、ホストに感染すると、細菌排除のために必要な自然免疫と適応免疫応答の活性化は、通常はあります。自然免疫は、ほとんどの感染を防ぐ防御の最前線です。自然免疫は、微生物の広範なグループの間で保存されている正確な方法要素(病原体関連分子パターン、PAMPS)1に区別します。先天性免疫機構は、食細胞(マクロファージ、好中球、および樹状細胞)、マスト細胞、好酸球、好塩基球、およびナチュラルキラー細胞を含む皮膚、化学障壁(抗菌ペプチド、リゾチーム)と先天的白血球、などの物理的障壁を含みます2。これらの細胞は、コンタクトを介して、または病原体巻き込むと殺害を含んで食作用を介してそれらを攻撃することによってのいずれか、特定して病原体を排除します。このシステムは、pに対する免疫記憶を与える適応免疫とは対照的に、生涯の防衛を許可していませんathogens。適応免疫系は、防衛の2行目で、認識し、複数の微生物および非微生物物質3の特定の抗原に反応することができます。適応免疫系の主要な構成要素は、BおよびT細胞を含むリンパ球です。 B細胞は、病原体または外来性タンパク質に対する抗体を分泌する、体液性応答に関与しています。しかし、T細胞は、サイトカイン分泌または殺す病原体に感染した細胞を4との免疫応答を調節する、細胞性免疫を表します。
主要組織適合複合体(MHC)5-7によって細胞表面に提示される抗原に貪食病原体及びプロセス細菌成分を認識することができ、樹状細胞またはマクロファージ、先天性免疫系の構成成分を含む、抗原提示細胞(APC)。 APCが病原体を貪食した後、彼らは通常、彼らはTと対話流入領域リンパ節への移行します細胞。 Tリンパ球は、そのT細胞レセプターによって特異的ペプチド-MHC複合体を認識することができます。免疫シナプス(IS)は、抗原提示8,9の間に抗原負荷APCとリンパ球との界面に発生します。いくつかの細菌は、食作用を生き残るためには、APCの内部に体系的に普及させることができます。このビューでは、感染したAPCは、細菌の貯水池や細菌の拡散10を容易に 「トロイの木馬」としての役割を果たす。 IS形成の過程で起こりAPCおよびリンパ球の間の密接な接触はまた、膜の一部の交換、遺伝物質およびエキソソームのためのプラットフォームとして機能し、T細胞を感染させるためにいくつかのウイルスのハイジャックすることができます。このプロセスはtransinfection 11-13と呼ばれています。
いくつかの病原性細菌( リステリア菌 、 サルモネラ菌や赤痢菌)は 、in vivoでのTリンパ球に侵入し、その挙動14-16を変更することができます。我々は持っています最近、Tリンパ球は、抗原提示16の過程で以前に感染した樹状細胞(DC)からtransinfectionによって細菌を捕捉することができることを説明しました。 T細胞の直接感染より(1,000-4,000x)極めてより効果transinfectionによる細菌捕獲。 T細胞はtransinfectionはT細胞によって駆動されるプロセスよりも示す病原体及び非病原体細菌を捕捉します。驚くべきことに、細胞が急速に捕捉された細菌を殺し、プロの食細胞16よりもので、より効率的にやったT(東工大)transinfected。免疫学の定説を破るこれらの結果は、適応免疫の細胞は、先天性免疫のおそらく排他的であった機能を実行することができることを示しています。加えて、我々は、TIT細胞が前炎症性サイトカインを大量に分泌し、 インビボでの細菌感染から保護することが示されました。
ここでは、細菌transinfectionプロセスを研究するために使用される様々なプロトコルを提示マウスモデル。このモデルは、細菌に感染した骨と特異的に相互作用するI-AB 17の文脈においてOVA(OVAp)ペプチド323-339に特異的なTCRを負担OTIIトランスジェニックマウスからのCD4 + T細胞の使用に基づきますmarrow-安定した免疫シナプスを形成OVApでロード由来DC(BMDCを)18,19、。
T細胞transinfectionを可視化し、蛍光顕微鏡を使用して追跡することができます。さらに、フローサイトメトリー、緑色蛍光タンパク質(GFP)16,20を発現する細菌によって放出される蛍光を利用して、感染した細胞を検出するために使用することができます。さらに、T細胞transinfectionより敏感なアプローチ、多数のイベントの測定を可能にゲンタマイシン生存アッセイにより定量することができます。ゲンタマイシンは、真核細胞に浸透することができない抗生物質です。したがって、この抗生物質を使用して、抗生物質添加FRを生き残った細胞内細菌の分化を可能にします21を殺されたオム外のもの。
プロトコル
注意:実験手順は、大学自治・デ・マドリッドの研究倫理委員会によって承認され、スペイン語、欧州のガイドラインに従って動物福祉と健康の大学自治・デ・マドリードヘッドの監督の下で行われました。マウスは、特定病原体不在(SPF)は、ハウジングで飼育され、それらは、二酸化炭素(CO 2)吸入法を用いて、訓練を受けた有資格者により安楽死させました。
1.マウスの骨髄由来DC分化および感染
注: 図1は、この最初のステップをまとめたものです。すべての手順は、メディア、楽器、ピペットチップ及び培養皿だけ滅菌を使用して、この時点からフード内で行われるべきです。
- マウス骨髄由来DCの分化
- 1 C57 / BL6 マウス 22から脛骨と大腿骨を解剖し、RPMI培地10mlでプラスチックの皿に移します。
- 滅菌はさみで、各骨端をカットし、特徴的な赤の鮮やかな色をしている骨髄を、公開しています。
- 滅菌ペトリに無菌注射器を用いて0.5%ウシ血清アルブミン(BSA)および5mMエチレンジアミン四酢酸(EDTA)(PBS / BSA / EDTA緩衝液)を含有するリン酸緩衝生理食塩水(PBS)10mlで骨の内部に吹き込みます皿。
- 冷却遠心機(4℃)で600×gでチューブ中の細胞懸濁液と遠心分離機を収集します。
- 塩化アンモニウム-カリウム(ACK)溶解緩衝液(0.15 M NH 4 Clを 、10mMのKHCO 3および0.1mM EDTA)を1mlで細胞を再懸濁し、赤血球を除去するために室温で30秒間インキュベートします。
- 塊は、濾過により除去されたので、同じ速度(600×gで)で遠心分離する前に、骨片および細胞塊を除去するために、セルストレーナー(70ミクロン)を介して、10%ウシ胎児血清(FBS)を含むRPMI 1640培地10mlを加え、濾過します。
- 細胞をカウントし、AND RPMI 10%FBS(50μMのβ-メルカプトエタノールを含有し、1mMピルビン酸ナトリウム)、5×10 5細胞/ mlに調整し、20 ngの/ mlの組換えマウス顆粒球-マクロファージコロニー刺激因子(RM-GM-CSF)を追加最終濃度として。
- CO 2インキュベーター中で、滅菌、微生物学的品質、15 cmでペトリ皿、培養にこの懸濁液を加える(37℃、5%CO 2)。
- 3日ごとに、20 ng / mlでRM-GM-CSFを含有する新鮮な培地で、細胞密度を5×10 5細胞/ mlで、非接着細胞およびPBS中の5mM EDTAで剥離した細胞を再懸濁両方をスピンダウン。
- DCおよび抗原負荷の成熟
- 9日目に、20 ngの/ mlのRM-GM-CSFを含有する培地中濃度の5×10 5細胞/ mlで細胞を再懸濁。その後、細胞に高MHC-IIの発現を可能にし、24時間非組織培養処理滅菌15センチメートルペトリ皿にインキュベートすることを20ng /リポポリサッカライド(LPS)のミリリットルを追加します。
- 1の後LPS刺激の日は、フローサイトメトリーによってDCの分化を確認するために、マウスのCD11c、MHCIIおよびGR-1に対する抗体で、いくつかのDC細胞を染色します。 DCのフローサイトメトリー分析の例を図3A及び 3Bに示されています。
- サンプルあたり50μlのPBS / BSA / EDTA緩衝液中の最終濃度2.5μgの/ mlの抗マウスCD16 / CD32モノクローナル抗体を用いたDC(5×10 5細胞 /サンプル)をインキュベートします。それぞれPBS / BSA / EDTA緩衝液で500:100:1:200および1その後、1で異なる蛍光色素とコンジュゲートMHCII(IA / IE)、のCD11cおよびGR-1に対する抗体の50μlを添加します。
- 最後に、PBS / BSA / EDTAバッファーでDCを洗浄し、製造業者のプロトコールに従って、フローサイトメトリーによって分析します。
注:細胞が十分に分化している場合は、細胞が抗原負荷の準備ができています。
- ウォッシュ(抗生物質を含まない)RPMI、10%FBSを含む樹状細胞および10μg/ mlのOTII OVAp(OVA 323-339でそれらをインキュベート; ISQA37ºCで最小1時間、5×10 6のDCあたりRMPI 10%FBS培地1ml中のプラスチックチューブにVHAAHAEINEAGR)。陰性対照として、OVApとインキュベートすることなく、DCを残します。
- DCの感染
- CO 2インキュベーター(37℃、5%CO 2)で1時間10細菌(DCあたり10細菌)の感染多重度(MOI)での樹状細胞に感染します。
- ウォッシュDC細胞は、細胞外細菌の大部分を洗浄するためにRMPI、10%FBSおよび450×gで遠心分離にPBSおよび1倍で3倍。最後に、20×10 6細胞/ mlで(抗生物質を含まない)RMPI 10%FBS培地中で細胞を再懸濁し。
OTIIトランスジェニックマウスからのCD4 + Tリンパ球の2の単離
注: 図1は、この第二段階をまとめたものです。リンパ節は、リンパ節におけるCD4 +リンパ球の割合ので、CD4 + T細胞を単離する代わりに脾臓を使用すべきですS(〜50%)、脾臓(〜25%)よりも大きいので、精製はより有効であろう。
- リンパ節の単一細胞懸濁液を作製
- OTIIトランスジェニックマウスから23ノード鼠径部、腋窩、上腕、子宮頸部および腸間膜リンパを削除し、RPMI、10%FBS培地10mlでプラスチックの皿に移します。
- 2つや消し顕微鏡スライドを使用して無菌フード下のリンパ節を挽きます。 1顕微鏡スライドのつや消し側のリンパ節を置き、臓器がグラウンドされるまで、第2のスライドのつや消し側でこすります。
- PBS / BSA / EDTA緩衝液中の単一細胞懸濁液を洗ってください。
- セルストレーナー(70μm)は、結合組織を除去し、PBS / BSA / EDTA緩衝液で洗浄するためにかかわらず、細胞をフィルタリングします。
- ACK溶解緩衝液1ml中に細胞を再懸濁し、赤血球を除去するために室温で1分間インキュベートします。
- CD4 + T細胞の単離
- ステップ2.1.3カウントのように再び洗浄し細胞を、PBS / BSA / EDTA緩衝液中の100×10 6細胞/ mlで再懸濁します。 CD4 + T細胞の後の負の選択のために氷上で30分間、250:CD8、IgM抗体、B220、CD19、MHCクラスII(I-AB)、のCD11b、CD11cの1でDX5に対するビオチン化抗体を追加します。
- PBS / BSA / EDTA緩衝液中で細胞を洗浄し、氷上で15分間、製造業者のプロトコールで推奨濃度でストレプトアビジンマイクロビーズを用いた細胞(100×10 6細胞/ ml)をインキュベートします。
- PBS / BSA / EDTA緩衝液中で細胞を洗浄し、CD4 + T細胞の単離の前に細胞ストレーナー(30ミクロン)かかわらず、それらをフィルタリングします。
- 製造業者のプロトコルに従って、磁気細胞分離機を用いて陰性選択によってCD4 + T細胞を単離します。
- 細胞をカウントし、(抗生物質を含まない)RPMI、10%FBS培地に4×10 6細胞/ mlに調整します。
- 流れにより純度を確認して修正し、氷単離したCD4 + T細胞 (3×10 5細胞 )を続けますサイトメーター24を説明します。 CD4 + T細胞の精製の 一例は、図3Cに示されています。
ゲンタマイシン保護アッセイ3. T細胞Transinfection測定
注: 図2は、プロトコルのこの第三の工程をまとめたものです。
- T細胞Transinfection
- CO 2インキュベーター(37℃、5%における免疫シナプス形成を可能にするために30分間(DCを1時間感染させ、自由な細菌を除去するために洗浄した)感染したDC細胞(1)を有する単離されたCD4 + T細胞をインキュベートCO 2)。
- 追加単離されたCD4 + T細胞(2×10 6細胞)を、24ウェル培養プレートに感染したDC(2×10 6細胞 )を0.1mlの0.5 mlです。陰性対照として、30分間、10細菌のMOIで直接0.5 mlのCD4 + T細胞に感染します。
- 使用したT細胞から感染したDCを分離する追加のコントロールを含めますDC-Tの物理的接触を妨げる(孔径3ミクロンを有する)ポリカーボネートトランスウェル障壁。ウェル(24ウェルプレート)の下の区画に0.1トランスウェル内部のDC mlのCD4 + T細胞の0.5ミリリットルを追加します。
- 最後に、RMPI培地で完全に全てのサンプルにおいて同等のボリュームを作成する各ウェルの0.6ミリリットルがあるまで。
- 免疫シナプス形成の30分後、ゲンタマイシン100μg/ mlを添加し、CO 2インキュベーター中で細胞を収集する前に1時間インキュベート(37℃、5%CO 2)。
- 再分離CD4 + T細胞の
- 非接着細胞を収集し、PBS / BSA / EDTA緩衝液で再懸濁します。 DCの大部分は、プラスチック培養皿に付着したままです。ボルテックスチューブを静かに細胞分解を確実にします。ゲンタマイシンがうまく働いていることを示すためのコントロールとして細胞上清500μlのを保管してください。
- ステップ2.2と一緒にDCおよびT細胞を含む試料からCD4 + T細胞を再単離します、が、DCのほとんどがプレートに付着している必要があります。氷の上にコントロールサンプルを保管してください。アカウントに2%未満の汚染との唯一の実験を行ってください。 transinfection後のCD4 + T細胞の精製の 一例が図3Dに示されています。
- 溶解性T細胞および細菌中寒天プレート上でそれらをシード。
- PBSで2回洗浄CD4 + T細胞。
- 細胞をカウントし、PBS中で2×10 6細胞/ mlで再懸濁。
- T細胞からの細胞内細菌を放出する、1×10 6細胞/ mlで、それらを溶解するT細胞を500μlの0.1%トリトンX-100の500μLを加えます。
- 溶解した細胞の3連続小数の希釈を行い、細菌培地寒天プレート上で各希釈液50μlをシード。 4の部分に板を分割し、各部分に溶解した細胞の異なる希釈をシード。代表的な結果を図4に示します 。
- 対照として、またプレートゲンタマイシンがうまく働いていることを確認するために、寒天のコンジュゲートの細胞上清を保管していました。また、追加の対照として、感染したDCをプレート。ケースでは、低DCの汚染は(<2%)、低直流汚染に対応するコロニー形成単位(CFUの)を引く起こります。
フローサイトメトリーによるT細胞Transinfection 4.定量
注: 図2は、この手順をまとめたものです。
- T細胞Transinfection
- ステップ1.3のようにのBMDCに感染するが、この場合には、GFP発現する細菌を使用しています。
- 製造業者のプロトコルに従って、37℃で30分間、細胞トラッカークロロメチルアミノクマリン(CMAC)と(ステップ2.2でリンパ節から単離された)ステインCD4 + T細胞ºC。
- 二回(抗生物質を含まない)RMPI 10%のFBSで標識されたCD4 + T細胞を洗浄します。
- 感染した樹状細胞をインキュベートし、標識CD4 +と(細菌と1時間のインキュベーション後)30分間のT細胞は、ステップ3.1.1で説明するすべてのコントロールを含む37ºCで免疫シナプスの形成を可能にします。
- 感染CD4 + T細胞の染色
- DC-T免疫シナプス形成の30分後、細胞を回収し、PBS / BSA / EDTAでそれらを洗浄。
- PBS / BSA / EDTA緩衝液、静かにチューブをボルテックスすることにより独立した凝集細胞で2回洗浄した後。
- 室温で15分間、3%PFAを含むPBSを0.2ml /チューブでサンプルを修正しました。その後、PBSでそれらを洗ってください。
- 樹状細胞のFc受容体をブロックするために、氷上で15分間、PBS / BSA / EDTAを50μl/サンプル中の抗マウスCD16 / CD32モノクローナル抗体(2.5μgの/ ml)でインキュベートします。
- 細胞外細菌を染色し、氷上で30分間50μL/ PBS / BSA / EDTAのサンプル中の抗細菌抗体(最終濃度として10 / mlの)ウサギを追加します。
- PBS / BSAは/ EDTAで細胞を洗浄し、フィコエリトリン(PE)とコンジュゲートしたマウスのCD11cに対する抗体およびSEでインキュベート氷上で30分間、PBS / BSA / EDTAを100μl/サンプル中の200:1でアレクサフルーア647のような他の蛍光色素と結合したウサギに対するcondary抗体。
- 細胞を洗浄し、フローサイトメトリーによってサンプルを分析。ただ一つのサンプルを補償し、設定25フローサイトメトリーを調整するために実験で使用した各蛍光色素で標識の非蛍光細菌などネガティブコントロールとサンプルを使用してtransinfected T細胞のサンプルを含めることを忘れないでください。代表的な分析は、 図5に示されています。
注:細菌は、GFPを発現しない細胞内および細胞外細菌を区別するために、細胞外細菌をラベル、修正し、5分間PBS中の0.5%トリトンX-100を含む試料を透過した場合。その後、異なる蛍光色素で総細菌(細胞内+外)を染色します。
結果
ここで、我々は派生-DCを感染した骨髄からマウスT細胞細菌transinfectionを実行する方法を説明し、どのように2つの異なるアプローチを介した細菌transinfectionを測定する:フローサイトメトリーおよびゲンタマイシン生存アッセイ図1は、細胞を得るための手順をまとめたものです。 DCは、9日間のGM-CSFとの骨髄細胞をインキュベートすることによって生成されます。その後、DCはOVA(OVAp)の特定のペプチドで、後にそれらをロードするために、その膜上MHCIIを高めるために、LPSで成熟しています。対照として、いくつかのDCをOVApがロードされていません。両方のDC(OVAp、ロードされ、無負荷)が10細菌の感染多重度(MOI)で感染させます。一方、CD4 + T細胞は、特定のOVApを認識OTIIトランスジェニックマウスのリンパ節から単離されている。 図2は、適切な陰性対照を含むT細胞transinfectionを実行し、定量化するための手順を示しています。 descriとしてベッドの前に、いくつかのDCをOVApがロードされていません。この場合には、原因の欠如OVApにDCとT細胞との相互作用ではなく、免疫シナプスの形成があります。付加的な制御は、DC-Tの物理的接触を妨げる、(孔径3ミクロンを有する)ポリカーボネートトランスウェル障壁とDCおよびT細胞を分離し、含まれています。 DCは、トランスウェルの内側に含まれています。結果として、彼らはこの細孔径を通過することができません。別のネガティブコントロールは、10の細菌のMOIで直接T細胞をインキュベートすることによって、直接T細胞の感染を組み込まれています。フローサイトメトリーまたはゲンタマイシン生存アッセイ:T細胞transinfectionは、二つの方法によって定量することができます。フローサイトメトリーで測定するために、DCは、細胞が細胞トラッカー(T細胞-青)で染色細菌-GFP および CD4 + Tで以前に感染している必要があります。共役形成した後、細胞は、DC(CD11cの-PE)に対する抗体で染色されるべきです。細胞外細菌もquantifするために染色されるべきですY後にフローサイトメトリーによる感染CD4 + T細胞のパーセンテージ。ゲンタマイシン生存アッセイによってtransinfectionを測定するために、細胞を、細胞外細菌を死滅させるために1時間ゲンタマイシンと共にインキュベートされ、その後T細胞を、寒天プレート上に播種するために再分離されています。小数点連続希釈液を寒天プレート上に各希釈液50μlをシードとのCFUの計数を容易にするために作られています。
図3に示すように 、DCの分化は、フローサイトメトリー(図3Aおよび3B)によって確認されなければなりません。 DCはCD11cのとMHCII(図3A)とないGR-1、好中球のマーカーで表現する必要があります。 図3Bに示されるように、いくつかの好中球(GR-1 +、MHCの3.27パーセント- )は文化の中で提示されたが、好中球の汚染の5%以上としたDCの文化は使用すべきではありません。 CD4 + T細胞の純度は、LYから分離した後にチェックする必要がありますMPHノード(図3C)および DCの複合体形成 ( 図3D)から分離した後。複合体形成後の汚染物の2%未満での実験を考慮してください。
図4は、 サルモネラ菌を使用してのT transinfection実験の一例を示しています。 図4(a)に示すように 、プレートは、各部分の連続希釈物を播種するために4つの部分に分割される。 サルモネラ菌は、LB寒天プレートおよびコロニー形成単位で成長しているカウントすることができます。 図4Aに示されるように、 サルモネラに感染したDCからT細胞によって捕捉され、この方法は明らかにOVAp認識( 図4Aおよび 図4Bの左側のプレート)で増強されました。 DCとT細胞との間の接触を妨げる物理的障壁があったときしかし、何transinfectionは、直接Tを行う場合のように、事実上ありませんでした細胞感染( 図4Aおよび 図4Bの右側のプレート)。
図5に示すように、T細胞transinfection明るいGFPを発現する細菌を用いたフローサイトメトリーにより定量することができます。 DCおよびT細胞は前方および側方散乱プロットにサイズおよび複雑さによって区別することができるが、別のマーカーはよく区別するために使用することができます。 CD4 + T細胞は、のCD11cに対する抗体を用いて細胞トラッカー(CMAC)とDCで標識しました。それらはCMACで標識(ないのCD11c-PEを含む)と表現されるので、細胞外細菌を定量することができるのでアレクサフルオロ647、感染したCD4 + T細胞のパーセンテージと共役サルモネラ及び二次抗体抗ウサギに対するウサギ抗体で染色しましたGFP(細菌-GFP)が、それらは、細胞外細菌(アレクサフルオロ647)に対する抗体で染色されませんでした。
ntent「FO:キープtogether.withinページ= "1">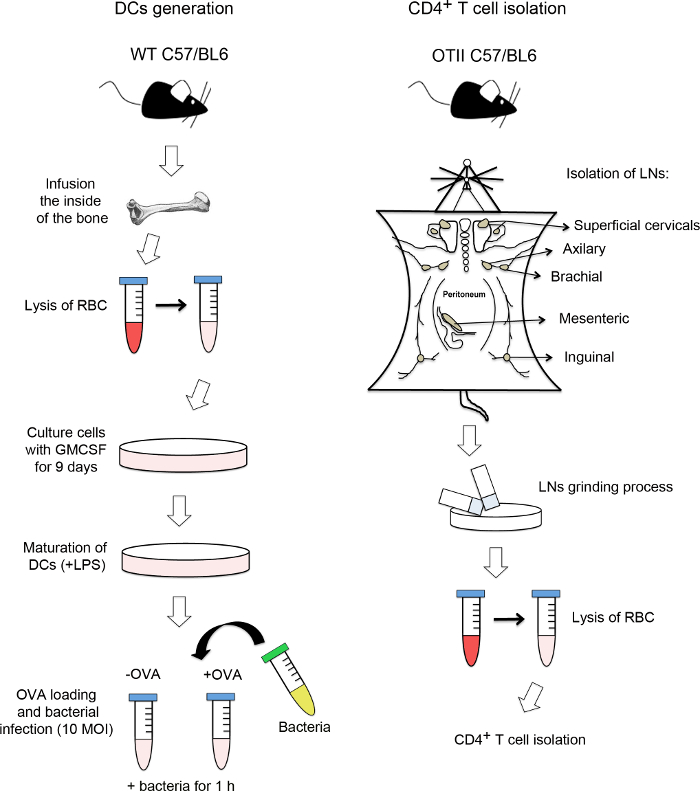
DC生成およびCD4 + T細胞単離 の図1のフロー図 。図の左側には、骨髄細胞から樹状細胞(DC)を区別するためのプロセスは、詳細です。大腿骨と脛骨を切開した後、骨髄細胞は、骨の内部から抽出されます。その後、赤血球(RBC)を溶解し、骨髄細胞を9日間組換えマウス顆粒球マクロファージコロニー刺激因子(GM-CSF)と共に培養します。それらは十分に分化した後、DCは、主要組織適合遺伝子複合体II(MHCII)の発現を増加させるためにリポ多糖(LPS)とともにインキュベートします。その後、DCは、特定のオボアルブミンペプチド(OVAp)でロードされ、10細菌の感染多重度(MOI)で感染させます。それらのいくつかは、対照としてOVApがロードされていません。図の右側には、どのようにOTIIトランスジェニックマウス表現されるからCD4 + T細胞を単離します。リンパ節(LNS)は、単一細胞懸濁液を得、除去し、粉砕します。最後に、CD4 + T細胞を磁気細胞分離機を用いて陰性選択によって単離する。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:T細胞transinfection手順を示すフローチャート。(細菌は緑色で示されている)とOVApをロード-DCS(赤血球)の感染は、免疫シナプス形成を可能にするために、CD4 + T細胞(青色細胞)と共にインキュベートします。感染したDC(ただしOVApにロードされていない)もまた、相互作用の両方のセルの間ではなく、免疫シナプスを形成することなく可能にするT細胞とインキュベートします。追加のコントロールは、CD4 +を分離し 、含まれています DC-T細胞接触を阻害ポリカーボネートトランスウェル障壁(+ TW)とT細胞とDC。直接T細胞の感染はまた、ネガティブコントロールとして組み込まれています。最後に、T細胞transinfectionは、細菌を捕捉するT細胞の数を示すフローサイトメトリー(図の左側)による、およびゲンタマイシン生存アッセイ(図の右側)は、非常に感度の高い方法(により、2つの方法によって定量することができます1感染細菌は、細菌の感染率を示す)を検出することができる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
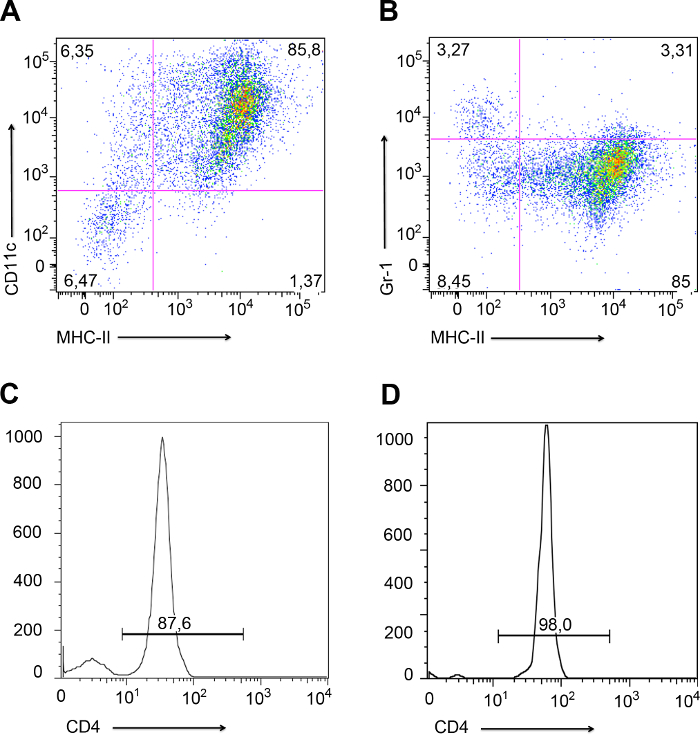
および単離されたCD4 + T細胞 、樹状細胞を骨髄由来の分析サイトメーター図3 フローにより分析骨髄由来-DCの代表的なドットプロットフローサイトメトリー。 (A)DCがMHCIIおよびCD11c(85.8パーセント、右上の象限)を発現した(B)DCは(85%;右下の象限)GR-1 MHCIIを発現するがありません。しかし、GR-1ではなくMHCII細胞(左上の象限)を発現した細胞の3.27パーセントがありました。これらの細胞はわずかに汚染された好中球でした。 (CとD)リンパ節(C) から単離したCD4 + T細胞の純度を表すヒストグラムを、樹状細胞(D)と共役を形成した後。 この図の拡大版をご覧になるにはこちらをクリックしてください。
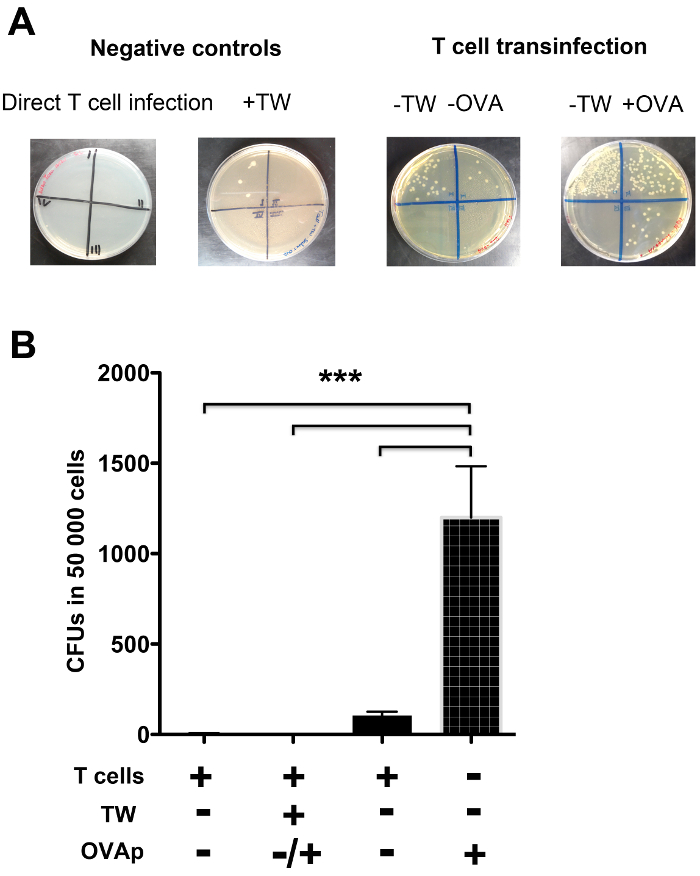
ゲンタマイシン生存アッセイにより定量化し、図4のT細胞transinfection。 LB寒天プレートはデシマに対応する4つの部分に分割しました溶解されたCD4 + T細胞のL連続希釈。 ( - )(A)コロニーは、 サルモネラ・ エンテリカの単位は存在(+)または非存在下でT細胞transinfectionに対応するLB寒天プレート上で増殖した形成感染DCの表面上OVApの、及び(DC / T細胞の接触を可能にする条件下で- TW)または、連絡先(+ TW)を妨げる物理的障壁の存在下で実施されます。直接T細胞の感染(陰性対照)に対応する空のプレートにも示されています。 DC / T細胞の接触が妨げられたほとんどtransinfection(+ TW)がありました。感染したDCからT細胞によって取り込まれた細菌の割合を示すいくつかの実験からのコロニー形成単位(CFUの)の(B)の定量。直接T細胞の感染、およびDC / T細胞の接触を妨げる条件は、T細胞の感染のレベルに少し作り出します。 DC / T細胞に接触が許可されたとき、そこにT細胞transinfectionであり、それは抗原認識(+ OVAp)によって増強されました。列バーは3、iの平均値を表しますndependent実験。エラーバーはSDを示します。有意差は、p <0.0001に対応した、***で表現される。 この図の拡大版をご覧になるにはこちらをクリックしてください。

フローサイトメトリーによって定量化し 、図5 のT細胞transinfection。transinfection処理後のDCおよびT細胞の複合体を示す代表的なドットプロット。 CD4 + T細胞が小さく、前方円形および側方散乱である(FCS - SSC)ドットブロットを示し、そして十分に分化であるために、それらは、細胞トラッカー(CMAC)で染色しました。 CD11cを発現するDCは、CMACで標識し、不規則な形状のT CD4 + T細胞よりも大きいされていません。 extracelのための細胞内細菌-GFPが、負数を含む感染CD4 + T細胞lular菌(6.19パーセント)は、右下の象限に示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
T細胞またはTリンパ球は細胞性免疫において中心的な役割を果たし、適応免疫応答26に属している白血球の一種です。 T細胞は 、インビトロで感染されるのに不応性であるが、いくつかの報告は、それらがインビボ14,15 に感染させることができることを示しています。免疫シナプス中のAPCとT細胞の緊密な連絡先は、HIV 11のようないくつかのウイルスを含む生物学的材料13を 、交換するためのプラットフォームとして機能します。最近、教義に反して、T細胞、適応免疫の細胞のパラダイムは、さらに効率的に感染したDC 11,16からtransinfectionによって細菌を捕捉することができることが示されました。ここで我々は彼が感染したBMDCから、in vitroでのT細胞の細菌transinfectionを定量化するためのプロトコルを詳述示します。
T細胞の細菌transinfectionは、抗原認識16によって増強されました。我々は、CD4 + T細胞を使用してから単離されたことが示されました特定OVAp、BMDCを認識OTIIトランスジェニックマウスは、様々な細菌に感染OVApとマウス(ここではデータはサルモネラ菌から提示されている)を搭載しました。 OTIIマウスから単離したCD4 + T細胞は、免疫シナプス形成を可能にするために30分間、感染したDCと共にインキュベートします。ここに示されたデータは、T細胞がこの時間の短い期間でのDCからキャプチャすることができます細菌に対応しています。我々は、感染したDCのT細胞のより長い曝露が大きい細菌捕捉(図示せず)をもたらしたことを知っているが、T細胞は、非常に迅速に取り込ま細菌を破壊するように、長いDC / T細胞時間コンタクトの間に発生する細菌transinfectionの定量化が困難であることが証明され。ゲンタマイシン生存アッセイには、単一の感染細菌21を検出することができるため、T細胞transinfectionを定量するための非常に敏感な方法です。ゲンタマイシンとのインキュベーション後に、T細胞が分離され、細菌寒天培地PLに播種するために溶解し、ちょうど細胞外細菌を殺すことATE。 DCと複合体を形成した後のT細胞の単離は、プロトコル内の重要なステップです。汚染物の2%未満を有する唯一の実験では考慮されるべきです。 DC汚染は、フローサイトメトリーにより測定することができ、低DC汚染に対応するのCFUを減算しなければなりません。代替的に、CD4 + T細胞の純度は、細胞選別を使用することによって改善することができます。
T細胞transinfectionを定量化するための別のアプローチは、細菌が発現すると互換性のあるフルオロフォアで細胞外細菌を標識GFPを用いて、フローサイトメトリーです。このアプローチの1つの制限は、細菌が自己蛍光背景に感染した細胞を検出するための十分に明るいGFPを発現させるために持っていることです。また、細菌が細胞トラッカーでDCを感染前に染色することができました。別のアプローチは、細胞外の細菌を染色するT細胞を透過性にし、全ての細菌(細胞内+外)で標識されます異なる蛍光色素で。
このプロトコルの将来の方向性につきましては、磁性粒子で飾られた細菌を使用することにより、感染したDCに長い博覧会の後に細菌を捕獲したT細胞の数を定量化するためのプロトコルを設定しようとしています。細菌を捕捉するT細胞は、磁性粒子を保持することになるので、それは、磁石を使用してそれらを分離することが容易であるべきです。
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by grants BFU2011-29450, BFU2008-04342/BMC from the Spanish Ministry of Science and Innovation and PIES201020I046 from Consejo Superior de Investigaciones Cientìficas (CSIC).
資料
| Name | Company | Catalog Number | Comments |
| RPMI | Fisher Scientific | SH3025501 | |
| r-GMCSF | Peprotech | 315-03 | |
| LPS | SIGMA | L2630-10mg | |
| Na Pyruvate | Thermo Scientific | SH3023901 | |
| 2-ME | Gibco | 31350-010 | |
| OVAp OTII (323–339) | GenScript | ||
| Cell Strainer 70uM | BD | 352350 | |
| 30 uM Syringe Filcons Sterile | BD | 340598 | |
| AutoMacs Classic | Miltenyi Biotec | 130-088-887 | |
| Gentamicin | Normon | 624601.6 | |
| Transwell | Costar | 3415 | |
| LB | Pronadisa | 1231 | |
| Agar | Pronadisa | 1800 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Triton X-100 | |||
| CD8 biot | BD Biosciences | 553029 | |
| IgM Biot | ImmunoStep | Clone RMM-1 | |
| B220 Biot | BD Biosciences | 553086 | |
| CD19 biot | BD Biosciences | 553784 | |
| MHC-II Biot (I-A/I-E) | BD Biosciences | 553622 | |
| CD11b biot | Immunostep | 11BB-01mg | |
| CD11c biot | Immunostep | 11CB3-01mg | |
| DX5 biot | BD Biosciences | 553856 | |
| Gr-1 biot | BD Biosciences | 553125 | |
| CD16/CD32 | ImmunoStep | M16PU-05MG | |
| anti Salmonella | ABD Serotec | 8209-4006 | |
| CD11cPE | BD Biosciences | 553802 | |
| CD4-APC | Tonbo Biosciences | 20-0041-U100 | |
| Gr-1 APC | BD Biosciences | 553129 | |
| MHC-II (I-A/I-E) FITC | BD Biosciences | 553623 | |
| Alexa-Fluor 647 Goat Anti-Rabbit IgG (H+L) Antibody, highly cross-adsorbed | Invitrogen | A-21245 | |
| CMAC (7-amino-4-chloromethylcoumarin) | Life technologies | C2110 | |
| BSA | SIGMA | A7030-100G | |
| Streptavidin MicroBeads | Miltenyi Biotec | 130-048-101 | |
| BD FACSCanto II | BD Biosciences |
参考文献
- Medzhitov, R. Recognition of microorganisms and activation of the immune response. Nature. 449 (7164), 819-826 (2007).
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. Molecular biology of the cell. , Garland Science. New York. (1989).
- Pancer, Z., Cooper, M. D. The evolution of adaptive immunity. Annual Review of Immunology. 24, 497-518 (2006).
- Rhoades, R. A., Bell, D. R. Medical Phisiology. , Lippincott Williams & Wilkins. (2012).
- Cossart, P. Bacterial Invasion: The Paradigms of Enteroinvasive Pathogens. Science. 304 (5668), 242-248 (2004).
- Kaufmann, S. H., Schaible, U. E. Antigen presentation and recognition in bacterial infections. Current Opinion in Immunology. 17 (1), 79-87 (2005).
- Pizarro-Cerdá, J., Cossart, P. Bacterial Adhesion and Entry into Host Cells. Cell. 124 (4), 715-727 (2006).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221, 77-89 (2008).
- Calabia-Linares, C., Robles-Valero, J., et al. Endosomal clathrin drives actin accumulation at the immunological synapse. Journal of Cell Science. 124 (5), 820-830 (2011).
- Westcott, M. M., Henry, C. J., Cook, A. S., Grant, K. W., Hiltbold, E. M. Differential susceptibility of bone marrow-derived dendritic cells and macrophages to productive infection with Listeria monocytogenes. Cellular Microbiology. 9 (6), 1397-1411 (2007).
- Geijtenbeek, T. B., Kwon, D. S., et al. DC-SIGN, a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells. Cell. 100 (5), 587-597 (2000).
- Izquierdo-Useros, N., Naranjo-Gòmez, M., et al. HIV and mature dendritic cells: Trojan exosomes riding the Trojan horse. PLoS Pathogens. 6 (3), e1000740(2010).
- Mittelbrunn, M., Sanchez-Madrid, F. Intercellular communication: diverse structures for exchange of genetic information. Nature Reviews. Molecular cell biology. 13 (5), 328-335 (2012).
- McElroy, D. S., Ashley, T. J., D'Orazio, S. E. Lymphocytes serve as a reservoir for Listeria monocytogenes growth during infection of mice. Microbial Pathogenesis. 46 (4), 214-221 (2009).
- Salgado-Pabon, W., Celli, S., et al. Shigella impairs T lymphocyte dynamics in vivo. Proceedings of the National Academy of Sciences. 110 (12), 4458-4463 (2013).
- Cruz Adalia, A., Ramirez-Santiago, G., et al. T cells kill bacteria captured by transinfection from dendritic cells and confer protection in mice. Cell Host and Microbe. 15 (5), 611-622 (2014).
- Barnden, M. J., Allison, J., Heath, W. R., Carbone, F. R. Defective TCR expression in transgenic mice constructed using cDNA-based alpha- and beta-chain genes under the control of heterologous regulatory elements. Immunology and Cell Biology. 76 (1), 34-40 (1998).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. Journal of Visualized Experiments: JoVE. (17), (2008).
- Inaba, K., Inaba, M., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. Journal of Experimental Medicine. 176 (6), 1693-1702 (1992).
- Thöne, F., Schwanhäusser, B., Becker, D., Ballmaier, M., Bumann, D. FACS-isolation of Salmonella-infected cells with defined bacterial load from mouse spleen. Journal of Microbiological Methods. 71 (3), 220-224 (2007).
- Vaudaux, P., Waldvogel, F. A. Gentamicin antibacterial activity in the presence of human polymorphonuclear leukocytes. Antimicrobial Agents and Chemotherapy. 16 (6), 743-749 (1979).
- Zhang, X., Goncalves, R., Mosser, D. M., et al. Chapter 14, The isolation and characterization of murine macrophages. Current protocols in immunology. Coligan, J. E., et al. , Unit 14.1(2008).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments: JoVE. (79), e50765(2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). Journal of Visualized Experiments: JoVE. (41), (2010).
- Foucar, K., Chen, I. M., Crago, S. Organization and operation of a flow cytometric immunophenotyping laboratory. Seminars in diagnostic pathology. 6 (1), 13-36 (1989).
- Itano, A. A., Jenkins, M. K. Antigen presentation to naive CD4 T cells in the lymph node. Nature Immunology. 4 (8), 733-739 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved