Method Article
Исследование тучных клеток секреторных гранул; от биосинтеза к экзоцитозу
В этой статье
Резюме
Целью настоящего протокола заключается в разработке способа, который позволит функциональные геномные анализы секреции тучных клеток. Протокол основан на количественной оценке высвобождения флуоресцентного гена-репортера cotrasfected с интересующего гена и реального времени анализа морфологии секреторной гранулы в.
Аннотация
Тучных клеток (MC) являются секреторные клетки иммунной системы, которые выполняют свои физиологические и патологические функции, выпуская предварительно сформированных и вновь синтезированных аллергических, воспалительных и иммунорегуляторных медиаторов. Посредники MCS "влияют несколько тканей и органов кульминацией аллергических и иммунных реакций. Синтез, хранение и выпуск медиаторов MC высоко регулируется. Предварительно формируется посредники упаковываются в цитоплазматические секреторных гранул (SG), что сливаются с плазматической мембраной и высвобождают их содержимое, регулируемой экзоцитоза. Мы представляем протокол, основанный на совместной экспрессии интересующего гена с геном-репортером, которая предназначена для ИК и выпущен в регулируемом образом наряду с эндогенными посредниками SG. Протокол позволяет с высоким разрешением четырехмерный конфокальной анализы MC ПГ и контроля за их сроки от биогенеза, чтобы срабатывает экзоцитоза. Таким образом, используя этот протокол для скрининга генов ИнтерТекущая за их фенотипического и функционального воздействия позволяет расшифровать молекулярные механизмы, которые регулируют биогенез и экзоцитоз МК ПГ и выявление регуляторов, участвующих. Таким образом, должна быть обеспечена более полное представление о клеточных механизмах, которые составляют функции MCS в норме и патологии.
Введение
Тучные клетки (ТК) являются иммунные клетки, которые лучше всего известны за их участие в аллергических и воспалительных реакций, таких как артрит, астма, эозинофильный эзофагит, хронический дерматит и анафилактический шок 1,2, а также других патологий, включая болезнь коронарных артерий 3,5 и Рак 3,4. Кроме того, МС играют важную роль в врожденного и адаптивного иммунитета, как в иммунной защиты против бактерий и паразитов и подавления иммунного ответа, например, индуцирующего аллотрансплантата толерантности 5,6.
МС происходят из костного мозга, развивается от CD34 + / CD117 + плюрипотентные клетки-предшественники 7. Совершенные костного мозга MC предшественники попадают в кровь и мигрируют в периферические ткани локализовать преимущественно в соединительной ткани и эпителиальные поверхности 8. Созревание и терминальная дифференцировка, в конечном итоге достигается под влиянием OF цитокины в пределах окружающей среде 8,9.
МС может быть активирован аллергена (антигена, Ag), чья встреча привела к образованию иммуноглобулина Е (IgE) тип антител. Связывание такой IgE к FcεRI рецепторов МК, за ними следуют сшивания клеток, связанного IgE при повторном воздействии того же Ag, приводит к FcεRI агрегации и начала сигнального каскада, который завершается в дегрануляции ячейки [рассмотрены в 10,11] , МС также активируются, независимо от IgE, по нейропептидов 5,12, токсины 13, бактериальных и вирусных антигенов 14,15, количество положительно заряженных пептидов совместно именуемые основных секреции, иммунных клеток и цитокинов 5,13,12,16 17. МС также активируется многие из их собственных выпущенных медиаторов, которые дополнительно усиливают воспалительную реакцию.
МС упакованы с секреторных гранул (SGS), которые содержат иммунорегулирующих посредники, в том числе вазоактивных аминов, таких как гистамин и серотонин (у грызунов), протеогликанов, протеаз, таких как химазы и триптазы, фактора роста эндотелия сосудов и нескольких цитокинов и хемокинов 8,9. Эти посредники "готов пойти" и один раз МС активируются соответствующего стимула, эти посредники освобождаются из клеток регулируется экзоцитоза (дегрануляции) в течение нескольких секунд до минут 18,19. Это исходное событие следует путем синтеза De Novo и выделением большого массива биологически сильнодействующих веществ, в том числе метаболитов арахидоновой кислоты, несколько цитокинов и хемокинов 20,21,22. Выпуск новых синтезированных продуктов происходит независимо от выпуска SG. В совокупности эти посредники инициировать ранние и поздние фазы воспалительных и аллергических реакций. Таким образом, понимание механизмов, учитывающие MC активации и дегрануляции оба из теоретической и клинической импortance.
Трудность генетически манипулировать первичных и культурные МС препятствует попыткам выяснения механизмов, лежащих в основе MC дегрануляцию, которые были плохо решены. Чтобы преодолеть эту проблему, мы разработали на основе анализа репортерного СО-трансфекции линии тучных клеток слизистой оболочки, крысы базофильной лейкемии (RBL) -2H3 (отнесено здесь к RBL) или костного мозга, полученные МС (ВММС) 30 с интересующего гена и нейропептида Y (NPY), слитый с мономерной RFP (MRFP), как SG репортера.
NPY Ранее было показано, воспроизводят поведение эндогенных маркеров SG в других системах. Кроме того, из-за флюоресценции MRFP является нечувствительным рН, выражение NPY-MRFP позволяет визуализировать кислотных ИК, а также количественную оценку с помощью экзоцитоза 96-луночные планшеты и устройства чтения флуоресценции пластины. Мы показали, что NPY-MRFP доставляется в кислых ИК в RBL-клеток и ВММС и высвобождается из клетокна регулируемом моды наряду с эндогенным SG груза (например, β-гексозаминидазы и серотонина) 30, 32. Этот протокол обеспечивает изображения на основе методологии высокого разрешения, что позволяет скрининга генов, представляющих интерес для их фенотипических и функциональных влияния на характеристики SG и дегрануляции в RBL клеток 32. В частности, этот протокол позволяет в режиме реального времени отслеживать MC ПГ и количественную оценку их области или размера тома, их номера, кинетики сборки, их движения по мобильному цитоскелета и их конечной слияния с плазматической мембраной при различных условиях. Например, сенсибилизации клеток с DNP-специфического IgE и запуск клетки с поливалентной Ag (DNP конъюгированный сывороточный альбумин) при различных возмущений (то есть, нокдаун генов, представляющих интерес, более экспрессии мас или мутантных генов, или фармакологических манипуляций) и по сравнению с контрольными клетками.
протокол
1. Подготовка RBL среды для культивирования клеток
- Смешайте 500 мл среды с низким глюкозы Игла в модификации Игла (DMEM) с 56 мл фетальной бычьей сыворотки (это составляет 10% FBS), а затем добавить 5,5 мл пенициллина стрептомицин (это делает ~ 1% PEST).
- Фильтр носитель при помощи 500-1000 мл флакон-Топ вакуум-фильтры с размером пор 0,22 мкм размер пор и хранить при температуре 4 ° С.
2. Культура RBL клеток
- Выращивают клетки RBL в увлажненной атмосфере 5% CO 2 при 37 ° С либо в пластинах или колбы. RBL клетки, которые растут в 10 см пластинах должны быть дополнены 10 мл среды и образуют сливающийся монослой ~ 10 7 клеток / пластину.
- Когда слой клеток приближается слияния, replate культуру при более низкой плотности.
- Удалить культуральной среды от пластины / колбу с помощью стерильной пастеровской пипетки, подключенный к вакууме.
- Промойте клеточный монослой с подогретую (37° С) 0,25% трипсина / EDTA, который охватывает весь монослой (объем зависит от размера пластины культуры / колбу, 2 мл на 10 см пластины). Это открепления клеток.
- В качестве альтернативы, промыть монослой клеток фосфатно-солевым буфером (PBS), удалить PBS и добавить предварительно нагретой (37 ° С) трипсин / ЭДТА. Этот шаг отделяет клетки быстрее.
- Поместите пластину / колбу в термостат при 37 ° С (не более 10 мин).
- Проверьте клеток под оптическим микроскопом, чтобы проверить, если они были отключены. Если клетки не отсоединить через 10 мин, осторожно нажмите на пластине / колбу.
- Добавить носитель в культуральный планшет / колбу приостановить клеток (объем среды должна быть по крайней мере в 2 раза больше, чем объем раствора трипсина).
- Гранул клетки центрифугированием в течение 3 мин при 200 г при 25 ° С.
- Ресуспендируют клеток в среде. Развести клетки, 1:10 и семян в новой культуре блюдо. Инкубируйте клетки в течение 48-72 ч, пока они не пастьч приблизительно 90% слияния.
- Повторите ту же процедуру (раздел 2.2.1-2.2.8) до 3 месяцев (30 проходов).
3. Подготовка трансфекции Media.
- Подготовьте 100 мМ раствора K-Трубы рН 7, 1 мМ раствора Ca 2+ ацетата и 100 мМ раствора Mg 2+ ацетата.
- Развести 100 мМ раствора K труб рН 7 в 20 мм с использованием DMEM носитель, добавьте 1 мМ раствора ацетата Ca 2+ до конечной концентрации 10 мкМ и 100 мМ раствора Mg 2+ ацетата до конечной концентрации 2 мм.
- Взвешивание калия глутамата и добавить к раствору до конечной концентрации 128 мМ, хорошо перемешать и не хранить при температуре 4 ° С до использования. Держите оставшиеся решения (т.е.., К-трубы, Ca 2+ ацетат, Mg 2+ ацетат) при температуре -20 ° C.
4. Трансфекция RBL клеток
- Удалить культуральной среды из пластины / колбу с использованиемстерильной пастеровской пипетки подключен к вакууме.
- Промыть клеточный монослой с предварительно нагретой (37 ° С) трипсин / ЭДТА, которые должны охватывать весь монослой. Поместите пластину / колбу в термостат при 37 ° С (не более 10 мин). Проверьте, если клетки были отключены с помощью оптического микроскопа.
- Добавить среды в культуре пластины / колбу приостановить клетки (объем средств массовой информации должна быть не менее 2-более крупной, чем объем раствора трипсина).
- Подсчитайте количество клеток с использованием гемоцитометра.
- Гранул 1,5 × 10 7 клеток центрифугированием в течение 3 мин при 200 х г при 25 ° С. Откажитесь от супернатантов и добавить 280 мкл трансфекции среды. Передача реакционной смеси в 4 мм кювете.
- Добавить 20 мкг NPY-MRFP плазмиды и либо 30 мкг управления пустой плазмидой или с плазмидой тестируемого. Конечный объем реакционной смеси должен быть 300 мкл.
- Сразу же место на льду в течение 10 мин. Протрите кювету из остаточной воды и рroceed электропорации при 300 V в течение 9 мс.
- Для измерения экзоцитоза, replate клетки сразу в 24-луночные культуры ткани, содержащие 300 мкл среды. Добавить 8 мкл реакционной смеси (4 × 10 5 клеток) в каждую лунку. Добавить 4 × 10 5, не являющимся трансфекции клеток в дополнительных скважин для контроля. Подготовка достаточно скважин для иметь по крайней мере дублировать скважин для каждой обработки для каждого трансфекции.
- Для промежуток времени микроскопии, replate клетки сразу в камеру боросиликатного системы покровного стекла 8-а, содержащего 80 мкл среды. Добавить 1,5 мкл реакционной смеси (7,5 × 10 4 клеток) в каждой камере. (Попытка избежать с помощью камеры на краю покровного стекла, камеры в центре покровного стекла легче изображения).
ПРИМЕЧАНИЕ: Важно отметить, что не все клетки ответ на триггер, а иногда и покадровой микроскопии отменены из-за потери внимания и дрейфа 8-а камеры borosiсиликатное покровного стекла система. Таким образом, подготовка по меньшей мере, 8 камер для каждой обработки для каждой трансфекции. - Для сенсибилизации клеток к FcεRI опосредованной активации, добавить 1 мкг / мл мыши DNP IgE специфических моноклональных в средствах массовой информации (Инкубируйте клетки с IgE, по крайней мере, 2 ч).
- После 18-24 часов использования флуоресцентного микроскопа, чтобы подтвердить, что клетки экспрессируют плазмиды. Возбуждения и излучения длины волны флуоресценции MRFP являются: ех 584, λEm 607 нм. NPY-MRFP должен появиться в везикулярного структур, которые соответствуют ПГ. Если второй интерес ген слит с флуоресцентной меткой использовать флуоресцентного микроскопа, чтобы подтвердить совместной экспрессии обоих плазмид при тех же клетках. Например, если тестируемый ген, слитый с GFP, возбуждения и излучения длин волн флуоресценции GFP являются: ех 488, λEm 507 нм. GFP помечены белок должен появиться в одних и тех же клеток, которые экспрессируют NPY-MRFP.
- Для измерения экзоцитоза приступить тО шагом 5 и промежуток времени микроскопии, перейдите к шагу 6.
5. Измерение NPY-MRFP Экзоцитоз
- Подготовка Тироде буфера:
- Приготовьте раствор 54 мМ KCl, 20 мМ MgCl 2, 2,74 М NaCl и 8 мм NaH 2 PO 4 в DDW. Хорошо перемешать и хранить при 4 ° С. Этот шаг для подготовки 20x Тироде буфера.
- Приготовьте раствор 20 мМ Hepes рН 7, 1,8 мМ CaCl 2, 1 мг / мл BSA, 5,6 мМ глюкозы и 1 к 20 разбавление Тироде 20x в DDW и хорошо перемешать. Этот шаг для подготовки 1x Тироде буфера.
- Алиготе буфера 1x Тироде и хранить при температуре -20 ° C. Избегайте повторного замораживания и оттаивания.
- Удалить культуральной среды из 24-луночного планшета и промыть 3 раза буфером Tyrode. Подготовка нестимулированных клеток путем добавления 200 мкл буфера Тироде с контрольными лунками.
- Подготовка 10 мкл / лунку 20X концентрировали активирующего реагента (например, [1000 нг / мл DNP-BSA или DNP-HSA (Ag), 200 мкМ Са 2+ ионофор (например, А23187), и комбинация 20 мкМ Ca 2+ ионофора и 1000 нМ 12-O- тетрадеканоилфорбол-13-ацетата (TPA)]. Если реагенты хранятся в ДМСО, разбавляют реагенты в 20x концентрации в Тироде буфера, содержащего 1% ДМСО. Инкубируют при 37 ° С в течение 30 мин.
- Удалить супернатантах каждую лунку тщательно, чтобы 96-луночного планшета, поместить на лед и избежать от света. (Надосадочные содержать химерный пептид NPY-MRFP, который был выпущен из клетки).
- Добавить 200 мкл буфера, содержащего Тироде 0,5% Triton X-100 в каждую лунку и инкубируют при 37 ° С в течение 10 мин. (Этот шаг является важным для подготовки клеточных лизатов, которые содержат оставшегося NPY-MRFP, что не был выпущен из клетки). Сбор клеточных лизатов и передать 96-луночного планшета, поместить на лед и избежать от света.
- Измерить флуоресценцию клеточных супернатантах и клеточных лизатов с использованием fluorescENCE ридер, используя 590-, 20 нм полосы пропускания возбуждения фильтр и 635-, 35 нм фильтр излучения полосы пропускания.
- Рассчитать процент NPY-MRFP выхода:
ПРИМЕЧАНИЕ: Флюориметры мера произвольные единицы флуоресценции (AFU). Значения AFU зависит от машины и ее чувствительности и эффективности трансфекции.- Установите аутофлюоресценции nontransfected RBL клеток как пустые. Разделите ВСУ каждого супернатанта к общей флуоресценции (AFU супернатантов + AFU соответствующего лизата) и умножить на 100.
6. Покадровый Микроскопия Экзоцитоз
- Семенной 7,5 × 10 4 трансфецированных клеток / камере в 8-а системы покровного стекла камеры из боросиликатного. После 18-24 часов, удалите культуральную среду из камер и промойте 3 раза Тироде буфера
- Добавить 72 мкл буфера Tyrode в каждую камеру. Развести активирующие реагенты в Тироде буфера 10x концентрации.
- Используйте конфокальной флуоресцентной микроскопии, оснащенный нагретой камере (37 ° C) и CO 2 контроллера (4,8%) и в 40 раз или 63x цели. Включите систем микроскопов: ртутная лампа, компьютер и лазеры. Убедитесь, что нагревается камера при правильной температуре до начала эксперимента.
- Поместите камеру в нагретой камере и убедитесь, что камера правильно и стабильно установлен.
- Включите света флуоресценции в соответствии с соответствующим флуорофора и визуализировать трансфекции клеток. Выключение флуоресценции когда клетка представляет интерес в области, чтобы минимизировать обесцвечивания и цитотоксичность. Важно, что в этом поле будет содержать около 2-3 трансфицированных клеток. В трансфицированные клетки должны быть хорошо нанесен, но не соприкасаются друг с другом.
- Регулировка мощности лазера (в зависимости от микроскопа), чтобы минимизировать шум и перенасыщение, а также токсичности, и установки усиления и смещения для изменения отношения сигнал-шум. Сканирование быстро илидер чтобы свести к минимуму продолжительность лазерного экспозиции (в среднем 2).
- Регулировка микроотверстий размер не более, это позволяет уменьшения мощности лазера и поддерживать изображения, направленные в течение длительного периода времени. При желании, установить параметры для Z стек, чтобы восстановить изображение в трехмерном, регулировать обскуры размер до 1 воздушный единицу (а.е.), что дает лучшее отношение сигнала к шуму и приобрести последовательного сканирования двумерных конфокальной оптической срезов в Z -axes с оптическими ломтиками ≤0.7 мкм.
- Задайте временной интервал между каждым приобретения до 15-30 сек и продолжительности общего приобретения до 15 мин и начать получения изображений. После 5 мин приобретения приостановить временной ряд. Добавить 8 мкл 10-кратного триггера и сразу же продолжить приобретение.
- Сохранить фотографии, выполните деконволюции с помощью программного обеспечения деконволюции и реконструировать стеки трехмерных изображений и в кино, используя программное обеспечение Imaris.
7. Анализ изображения
- Импорт данных из разрешенный изображений временных рядов, которые были получены с помощью конфокальной флуоресцентной микроскопии к программному обеспечению Imaris. Это программное обеспечение считывает более 40 микроскопии файлов. Если программное обеспечение не может читать файлы; конвертировать файлы в TIF файлов и импорта.
- Чтобы добавить моменты времени до конца открытого множества данных нажмите Правка -> Добавить моменты времени и импортировать новый набор данных.
- Создание поверхности канала MRFP с использованием опции мастера поверхность. Выберите алгоритм по умолчанию. Выберите канал NPY-MRFP. Отметьте данную опцию сглаживания для снижения шума. Чтобы избежать потери мелких деталей снизить уровень до 0,05 мкм области сведений.
- Установите порог интенсивности. Новый серая поверхность будет отображаться. Перейдите в раздел "Настройки" и включить стиль от "центральной точке" в "Surface".
- Перейдите на вкладку статистики в свойствах выбранного объекта, выберите подробную вкладку и конкретное значение SUCч как интенсивность флуоресценции, объем и т.д.
- Просмотрите данные и убедитесь, что значения совместимы с изображениями. Например, два или более соседних гранул может быть измерена как один большего гранулы. Для количественной оценки средний размер гранул разделить размер присоединяемых гранул до фактического количества гранул.
- Экспортируйте нужные наборы данных в файлы Excel и анализировать данные.
Результаты
Из-за низкой эффективности трансфекции ТК, генетические манипуляции вряд ли оставят влияние на показаниями среднего секреции, измеренных эндогенных медиаторов SGS. Тем не менее, путем создания полного со-экспрессии репортерного гена NPY-MRFP и ко-трансфицировали плазмидой в одних и тех же клеток, контроль результатов NPY-MRFP в мониторинге исключительно клеточную популяцию, которая экспрессирует интересующий ген. Таким образом, преимущество данного метода по сравнению с традиционными методами является возможность выборочного контроля генетически модифицированных клеток (рисунок 1).
Действительно, используя эту анализ мы экранированный гены, которые регулируют везикулярного транспорта, включая растворимого NSF белок привязанность рецепторов (SNARE) белков [чувствительны слияние N-этилмалеимид] и 44 членов семьи Раб ГТФ. Мы определили гены, которые регулируют SGsize, количество, состав грузов и экзоцитоз 23.
Wе определены 30 БОА, что изменили (то есть, ингибировать или стимулировать) экзоцитоз в RBL клеток, стимулированных либо Ag или комбинации Ca 2+ ионофора и форболового эфира ТФК (Ион / TPA) 23. Конфокальной изображения показали ловушки и Rabs, что повлекли за собой тяжелые фенотипы изменения морфологии клеток или ПГ 30,32. Конфокальной визуализации этих белков показали 8 ловушек и Rabs, что повлекли за собой тяжелые фенотипы на клетки или SG морфологии 30,32. Используя этот протокол, мы смогли отслеживать отдельные ГХ и выполнять измерения их размеров, интенсивности флуоресценции, их движения и экзоцитоза. Например, мы определили Rab5 в качестве регулятора SG биогенеза 30. Rab5 был определен в качестве главного регулятора эндоцитоза и эндосомный слияния 24. Мы показали, что совместное выражение конструктивно негативных (CN) ВВП автоподстройки мутантов эндогенно выраженных изоформ Rab5 (Rab5A, Rab5B и Rab5C), или по электроннойXpression из Rab5A / B / C таргетирования shRNAs, значительно снижается размер ЕСГ »с сопутствующим увеличением их числа 30. С другой стороны, выражение GTP выхода к морю, конструктивно-активного (Калифорния) Rab5A мутанта (Rab5A Q79L, здесь: "CA Rab5A"), который, как известно, чтобы облегчить гомотипическую слияние ранних эндосом (ЕЭС) 24, привело к образованию гигантских Rab5A оформлены пузырьки, которые мы выделили в качестве ИК на основе их содержания секреторная грузов NPY-MRFP и серотонина, и их способности exocytose на регулируемом моды 30.
Рисунок 2 демонстрирует морфометрических анализ на NPY-MRFP содержащего ПГ. Средний объем SGs в ЦА Rab5A-экспрессирующих клеток достигла значения 44 мкм 3, который был> 20 раз больше, чем средний объем ПГ в контроле GFP-экспрессирующих клеток, а их количество уменьшилось на 20 раза (рис 2А). Обратная связьмежду количеством и размером SGS (фиг.2А) предположил, что Rab5-опосредованной расширение ИК включает их гомотипическую синтеза. Гигант NPY-MRFP, содержащий ГХ, образованные CA Rab5A позволяет конфокальной микроскопии изображений живых клеток в высоком разрешении, что позволяет контролировать ЕСГ в деталях, которые не могли быть возможно в противном случае. Например, мы обнаружили Rab5A в фьюзинг ГХ наряду мелких структур, разбросанных среди гигантских SGS, скорее всего, соответствующая эндосомах (рис 2b). Кроме того, мы показали, что Rab5 временно и, предпочтительно, ассоциируется с вновь образованными ПГ, предполагая, что селективный и переходные ассоциация Rab5A с вновь образованной ПГ совместим с фузогенные устройства, в котором только вновь созданные гранулы имеют способность сливаться с другими ПГ 30.
Рисунок 3 показывает типичные покадровой образы MC гигантского ПГ, которые сформировались в результате экспрессии CARab5A и кинетика экзоцитоза в разрешении одного SG после стимуляции. Во время MC экзоцитоза, что ИК двигаться в направлении и сливаются с плазматической мембраной. Как следствие секреторной груз высвобождается из клеток во внеклеточное пространство. В этой экспериментальной системе, NPY-MRFP высвобождается из клеток, и нашли в клетках супернатантов. Флуоресценция NPY-MRFP в клеточных супернатантах могут быть измерены с помощью считывания флуоресценции. Тем не менее, из-за NPY-MRFP разбавляют в супернатантах его флуоресценции сигнал не может быть обнаружен или визуализированы с помощью флуоресцентной микроскопии. Высвобождение NPY-MRFP из гранул во результатов экзоцитоза в быстром и значительному снижению NPY-MRFP интенсивности флуоресценции и усадки NPY-MRFP содержащего ИК и их disappearance.Therefore, живой клетки визуализации стимулированных клеток и измерений NPY -mRFP интенсивность флуоресценции или NPY-MRFP размер, содержащий SG обеспечить точные оценки кинетики экзоцитозаотдельные гранулы. 3В показывает интенсивность флуоресценции СЖС после стимуляции клеток с Ca 2+ ионофором. В ИК пройти экзоцитоз в различные моменты времени (например, 2, 3, 6 и 11 мин после стимуляции), в то время как интенсивность флуоресценции одной SG, которые не сливаются с плазматической мембраной остался неизменным.

Фигура 1:. Иллюстрация из основных этапов протокола RBL трансфицировали клетки с NPY-MRFP и второй интересующего гена или соответствующей контрольной плазмиды и немедленно высевают на покровные, камеры боросиликатного системы покровного стекла 8-а или 96-луночных планшетах. На следующий день, Изображения NPY-MRFP содержащего ИК в состоянии покоя и вызвал клетки приобрели с помощью конфокальной микроскопии (A). Кроме того, экзоцитоз restinг и срабатывает cellsis количественно, измеряя высвобождение NPY-MRFP в 96-луночный планшет флюоресцентный детектор (B).
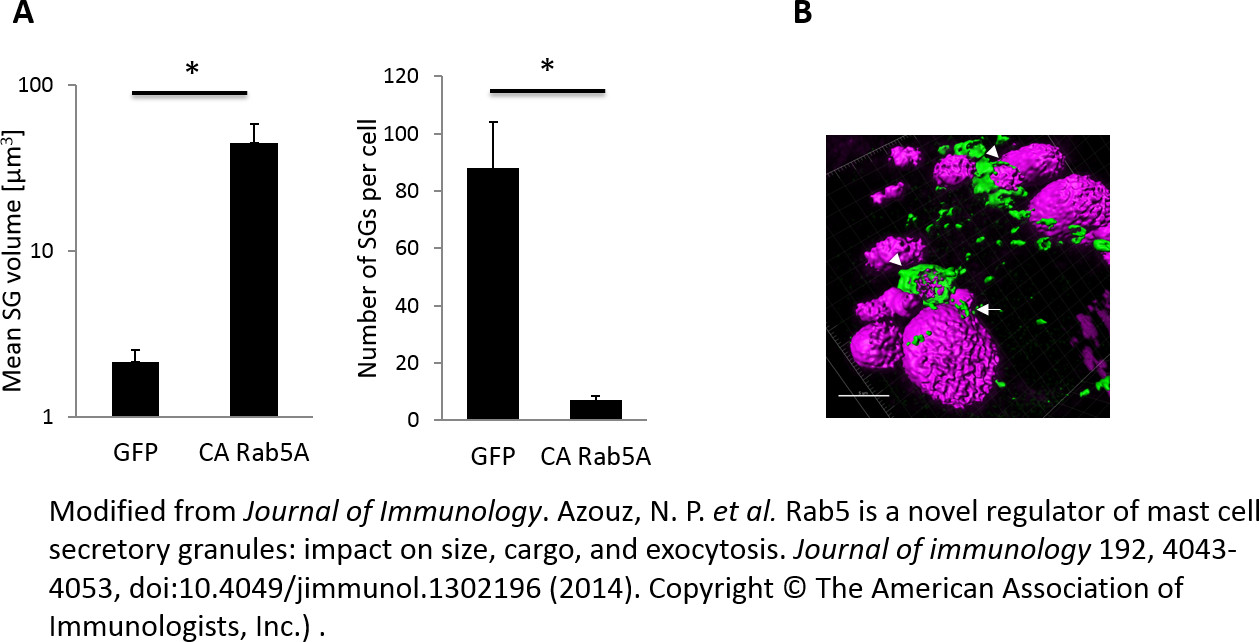
Рисунок 2:. Количественная оценка размера SGS "RBL клетки котрансфицировали NPY-MRFP и либо GFP или GFP-CA Rab5A и высевают в системе покровного стекла 8-а камера боросиликатного. 24 ч позже, камера 8-и помещали в лазерного конфокального микроскопа оборудованной нагретую камеру (37 ° C). Изображения Z-стека последовательных изображений с оптическими ломтиками 0,7 мкм получены с помощью 63X масла / 1,4 численное цели апертуры. Изображения деконволюции и трехмерная изображения были построены с помощью программного обеспечения Imaris. Объем ИК и их количества были рассчитаны с использованием программного обеспечения Imaris (A). Часть NPY-MRFP содержащего Грануле-видимому, быть встроены в Rab5A (стрелки). Другие голые или мостиком с Rab5A (стрелки). Масштабная линейка = 5 мкм (B). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
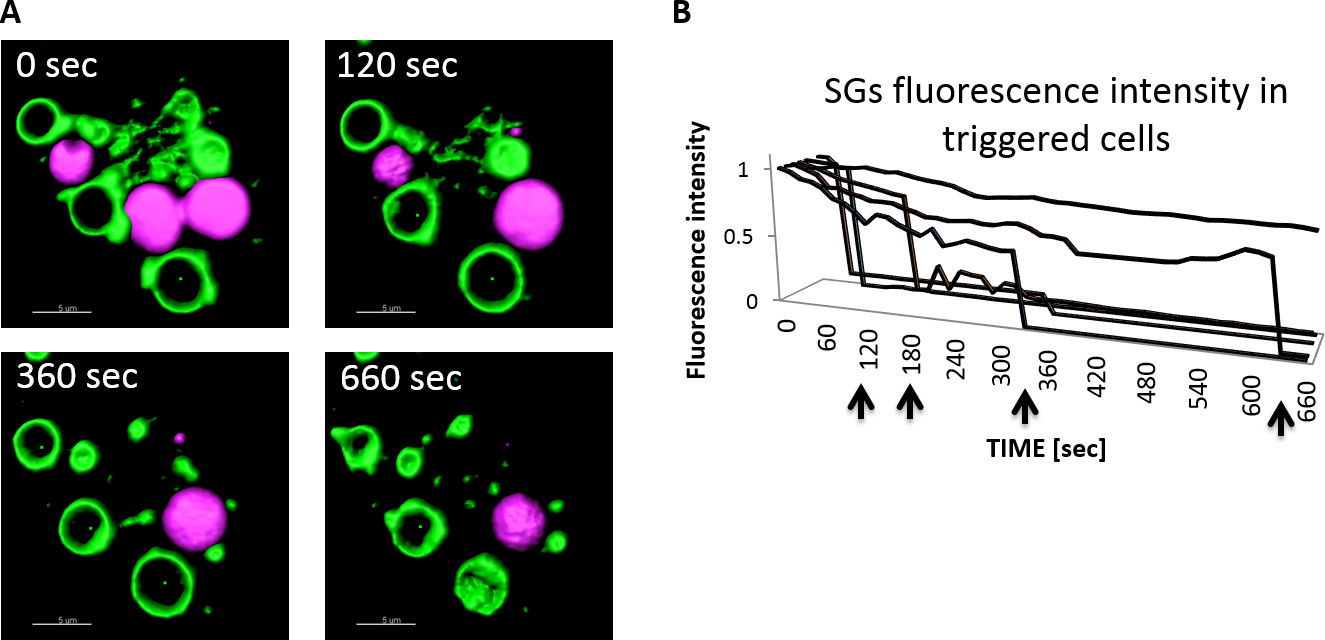
Рисунок 3:. Измерение степени и кинетики экзоцитоза в разрешении одного SG в activatedRBL клеток RBL клетки котрансфицировали NPY-MRFP и GFP-CA Rab5A и высевают In8-а камера боросиликатного системы покровного стекла. 24 ч позже in8-а камера была помещена в лазерного конфокального микроскопа, оснащенного нагретой камере (37 ° C), и клетки были вызваны с 10 мкМ Са2 + ионофором. Изображения были получены в 15 сек, используя 63X масла / 1,4 численное цели апертуры. Изображенийбыли деконволюции, а затем обрабатываются с помощью программного обеспечения Imaris. Шкала бар = 5 мкм (А). Интенсивность флуоресценции среднее NPY-MRFP содержащих гранул определяли с помощью программного обеспечения Imaris и данные были нормализованы в зависимости от времени 0 (время добавления Ca2 + ионофором). Стрелки представляют временные точки, в которых выпуск SGcargo wasnoted (б). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Обсуждение
Мы описываем инновационной стратегии, которая сочетает в себе количественную МКС экзоцитоза и четыре (X, Y, Z, т) Размер количественными по времени истек трехмерной визуализации ИК в живых клетках с использованием ген-репортер для экзоцитоза. Этот метод позволяет просмотр семейств белков для их влияния на функции MC, таких как ИК мониторинга, начиная уже их выхода из аппарата Гольджи через их созревания, приобретение экзоцитоза компетенции и дегрануляции. Сочетание измерений экзоцитоза вместе с морфометрических и кинетических характеристик в ИК дает представление о механизмах, с помощью которых исследуемые белки опосредуют функции MC. Таким образом, с помощью этой методики, генетические манипуляции целевых генов может раскрыть новые молекулярные механизмы, посредством которых магазин MC ИК и выпустить свой груз. Примечательно, что NPY может служить в качестве репортера для экзоцитоза в других секреторных клеток, таких как MCF-7 клеток, клеточной линии, полученной FRом человеком молочной железы аденокарциномы 31, Хромаффинные клетки 34 и поджелудочной железы β-клетки 35.
Генетические манипуляции являются наиболее мощными инструментами имеющиеся в настоящее время для исследования функциональных сетей. Генетические манипуляции позволяют выявлять основных белков в каждой сети, которой удаление будет применять крах системы, в отличие от других белков, исключение которой будет применять перекрестные помехи между параллельными сетях или не имеют никакого эффекта, за счет избыточности. Тем не менее, из-за низкой эффективности трансфекции ТК, при измерении экзоцитоз эндогенных медиаторов только небольшая часть клеток, экспрессирующих «манипулирующую" тест ДНК. Следовательно, при измерении экзоцитоз эндогенных медиаторов, вклад трансфицированных клеток к общему считывания является незначительным. Поэтому, пытаясь принять такой подход, чтобы исследовать сложные сети, связанные с регулируемым экзоцитоза в МР было ха-mpered. Этот метод преодолевает препятствие низкой эффективности трансфекции и обеспечивает простой способ наблюдать фенотипические чередование MC ПГ, вызванные по экспрессии, нокдаун и мутагенеза генов, представляющих интерес.
Этот метод может быть продлен для исследования иерархии и режим взаимодействия функциональных сетей, использующих переходные тройной трансфекции. Результаты будут проанализированы, чтобы определить, какой ген может спасти определенный фенотип; вызвать более резкое фенотип или не имеют никакого эффекта. На основании таких комбинаторных трансфекции, экзоцитоза сети могут быть построены. Например, с помощью тройной трансфекции мы смогли определить SNARE белка VAMP8 как нижестоящий посредника в процессе Rab5 зависит от SG слияния 25.
Этот метод позволяет визуализировать и количественно оценить экзоцитоза в разрешении отдельных ПГ. Действительно, мы смогли показать, что SGS дифференциальные дисплей ответы на стимУли. Причина, почему некоторые ИК сливаются с плазматической мембраной, тогда как другие не сделали или причина для дифференциальных кинетики MC SG слияния еще предстоит определить. Будущие исследования, использующие этот экспериментальный подход имеет потенциал, чтобы ответить на эти вопросы. Например, количественная оценка различных SNAREs или Rabs по индивидуальному ПГ и корреляции с экзоцитоза компетенции и кинетики экзоцитоза в разрешении одного SG должен открыть новые регуляторы экзоцитоза.
Основным ограничением этого метода является генетическая манипуляция, потому что избыточная экспрессия белка может влиять на функцию клеток или морфологию. Таким образом, важно, чтобы проверить результаты с дополнительных подходов. Например, когда сверхэкспрессия конститутивно активного мутанта ингибирует экзоцитоз, эффект конститутивного отрицательного мутанта или сбить гена должны быть проверены, а также.
Используя эту технику, мы IDENTIFСВУ новые регуляторы функций MC, которые влияют на MC экзоцитоз или изменить морфологию SG. Сочетание измерений экзоцитоза вместе с ИК морфометрического характеристики обеспечивает более глубокое понимание функции и механизмы действия испытуемых белков.
Раскрытие информации
The authors have no financial conflicts of interest.
Благодарности
Мы благодарим доктора У. поташа за дар NPY-MRFP кДНК. Мы благодарим доктора. MJ Kofron, Л. Mittleman, М. Shaharbani, Е. Зильберштейн за неоценимую помощь в микроскопии и анализ изображения. Мы также благодарим д-р Джозеф Орли за критическое прочтение рукописи. Эта работа была поддержана грантом Научного фонда Израиля, основанной Израиля академии наук (1139/12 к RS-Е.).
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma-Aldrich | D6046-500ML | Warm in 37 °C water bath before use |
| Fetal Bovine Serum | GE health care Life sciences | SH30071.01 | |
| Penicillin-Streptomycin | Life technologies | ||
| Cellulose acetate membrane, pore size 0.22 μm | Sigma-Aldrich | CLS430769-1EA | |
| Corning tissue-culture treated culture dishes | Sigma-Aldrich | CLS430167 | |
| Trypsin/EDTA Solution (TE) | Life technologies | R001100 | Warm in 37 °C water bath before use |
| PIPES dipotassium salt | Sigma-Aldrich | 108321-27-3 | |
| Calcium acetate hydrate | Sigma-Aldrich | 114460-21-8 | |
| Magnesium acetate tetrahydrate | Sigma-Aldrich | M5661 | |
| L-Glutamic acid potassium salt monohydrate (Potassium glutamate) | Sigma-Aldrich | G1501 | |
| 4 mm electroporation cuvettes | cell projects | EP-104 | |
| GENE PULSER WITH PULSE CONTROLLER & CAPACITANCE | Bio rad | ||
| Chambered coverglass | Thermo scientific | 155411 | |
| 24 well, flat bottom | Sigma-Aldrich | CLS3524 | |
| Corning 96 well plates | Sigma-Aldrich | CLS3367 or CLS390 | |
| 96 well plate fluorescence reader- Infinite 200 | Tecan | ||
| Calcium ionophore A23187 | Sigma-Aldrich | C7522 | Avoid from direct light exposure |
| 12-O-tetradecanoyl-13-acetate (TPA) | Calbiochem | P3766 | |
| anti-DNP monoclonal IgE | Sigma-Aldrich | D8406 | |
| DNP-BSA/ DNP-HAS | Sigma-Aldrich | A6661 | Avoid from direct light exposure |
| Triton-x-100 | Sigma-Aldrich | T8787 | |
| Confocal fluorescent microscope: | |||
| Zeiss LSM 510 | |||
| Leica | SP5 | ||
| Nikon A1 inverted | |||
| Imaris software | BITLANE | ||
| Microsoft exel or Prism or other analyses software | |||
| Other reagent: | |||
| Magnesium Chloride | MERK | 5833 | |
| Sodium chloride | MERK | 6404 | |
| Calcium chloride | MERK | 2382 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Glucose | BDH Laboratories | 284515V | |
| Monosodium phosphate | MERK | 5345 | |
| Sterile water |
Ссылки
- Abonia, J. P., et al. Involvement of mast cells in eosinophilic esophagitis. J Allergy Clin Immunol. 126 (1), 140-149 (2010).
- Galli, S. J., Tsai, M. Mast cells in allergy and infection: versatile effector and regulatory cells in innate and adaptive immunity. Eur J Immunol. 40 (7), 1843-1851 (2010).
- Ribatti, D., Crivellato, E. The controversial role of mast cells in tumor growth. International Review of Cell and Molecular Biology. 275, 89-131 (2009).
- Ribatti, D., Crivellato, E. Mast cells, angiogenesis and cancer. Adv Exp Med Biol. 716, 270-288 (2011).
- Tsai, M., Grimbaldeston, M., Galli, S. J. Mast cells and immunoregulation/immunomodulation. Adv Exp Med Biol. 716, 186-211 (2011).
- Vries, V. C., Noelle, R. J. Mast cell mediators in tolerance. Curr Opin Immunol. 22 (5), 643-648 (2010).
- Kirshenbaum, A. S., et al. Demonstration that human mast cells arise from a progenitor cell population that is CD34(+), c-kit(+), and expresses aminopeptidase N (CD13). Blood. 94 (7), 2333-2342 (1999).
- Metcalfe, D. D., Baram, D., Mekori, Y. A. Mast cells. Physiol Rev. 77 (4), 1033-1079 (1997).
- Gilfillan, A. M., Austin, S. J., Metcalfe, D. D. Mast cell biology: introduction and overview. Adv Exp Med Biol. 716, 2-12 (2011).
- Rivera, J., Gilfillan, A. M. Molecular regulation of mast cell activation. J Allergy Clin Immunol. 117 (6), 1214-1225 (2006).
- Rivera, J., Gilfillan, A. M. Molecular regulation of mast cell activation. Journal of Allergy and Clinical Immunology. 117 (6), 1214 (2006).
- Lagunoff, D., Martin, T. W., Read, G. Agents that release histamine from mast cells. Annu Rev Pharmacol Toxicol. 23, 331-351 (1983).
- Depinay, N., Hacini, F., Beghdadi, W., Peronet, R., Mecheri, S. Mast cell-dependent down-regulation of antigen-specific immune responses by mosquito bites. J Immunol. 176 (7), 4141-4146 (2006).
- Abel, J., et al. Staphylococcus aureus evades the extracellular antimicrobial activity of mast cells by promoting its own uptake. J Innate Immun. 3 (5), 495-507 (2011).
- Avila, M., Gonzalez-Espinosa, C. Signaling through Toll-like receptor 4 and mast cell-dependent innate immunity responses. IUBMB Life. 63 (10), 873-880 (2011).
- Novak, N., Bieber, T., Peng, W. M. The immunoglobulin E-Toll-like receptor network. Int Arch Allergy Immunol. 151 (1), 1-7 (2010).
- Rudich, N., Ravid, K., Sagi-Eisenberg, R. Mast cell adenosine receptors function: a focus on the a3 adenosine receptor and inflammation. Front Immunol. 3, 134 (2012).
- Theoharides, T. C., Kempuraj, D., Tagen, M., Conti, P., Kalogeromitros, D. Differential release of mast cell mediators and the pathogenesis of inflammation. Immunol Rev. 217, 65-78 (2007).
- Caughey, G. H. Mast cell proteases as protective and inflammatory mediators. Adv Exp Med Biol. 716, 212-234 (2011).
- Lundequist, A., Pejler, G. Biological implications of preformed mast cell mediators. Cell Mol Life Sci. 68 (6), 965-975 (2011).
- Metz, M., Maurer, M. Mast cells--key effector cells in immune responses. Trends Immunol. 28 (5), 234-241 (2007).
- Gordon, J. R., Burd, P. R., Galli, S. J. Mast cells as a source of multifunctional cytokines. Immunol Today. 11 (12), 458-464 (1990).
- Azouz, N. P., Matsui, T., Fukuda, M., Sagi-Eisenberg, R. Decoding the regulation of mast cell exocytosis by networks of Rab GTPases. J Immunol. 189 (5), 2169-2180 (2012).
- Stenmark, H., et al. Inhibition of rab5 GTPase activity stimulates membrane fusion in endocytosis. EMBO J. 13 (6), 1287-1296 (1994).
- Azouz, N. P., et al. Rab5 is a novel regulator of mast cell secretory granules: impact on size, cargo, and exocytosis. J Immunol. 192 (9), 4043-4053 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены