Method Article
Investigando mastocitos secretora gránulos; de Biosíntesis de la exocitosis
En este artículo
Resumen
El objetivo de este protocolo era desarrollar un método que permita a los análisis de genómica funcional de la secreción de mastocitos. El protocolo se basa en la evaluación cuantitativa de la liberación de un gen indicador fluorescente cotrasfected con el gen de interés y análisis en tiempo real de la morfología de los gránulos de secreción.
Resumen
Los mastocitos (MC) son células secretoras del sistema inmune que logran sus funciones fisiológicas y patológicas mediante la liberación de mediadores alérgicos, inflamatorios e inmunorreguladores preformados y recién sintetizados. Mediadores MCs 'afectan a múltiples tejidos y órganos que culminaron en las respuestas alérgicas e inmunológicas. La síntesis, el almacenamiento y la liberación de los mediadores MC están muy regulados. Los mediadores preformados se embalan en gránulos secretores citoplásmicos (SG) que se fusionan con la membrana plasmática y liberan su contenido por exocitosis regulada. Se presenta un protocolo, basado en la co-expresión de un gen de interés con un gen reportero que se dirige a la SGS y se libera de una manera regulada junto a los mediadores endógenos SG. El protocolo permite una alta resolución de cuatro dimensiones confocal análisis de la MC SGS y el seguimiento de su línea de tiempo de la biogénesis de exocitosis disparado. Por lo tanto, el uso de este protocolo para la detección de genes de interest por su impacto fenotípica y funcional permite descifrar los mecanismos moleculares que gobiernan la biogénesis y exocitosis de la MC SGS y la identificación de los reguladores implicados. Por ello, deben proporcionar más conocimientos sobre los mecanismos celulares que dan cuenta de la función MCs en la salud y la enfermedad.
Introducción
Mastocitos (MC) son células inmunes que son mejor conocidos por su participación en las reacciones alérgicas e inflamatorias tales como la artritis, el asma, la esofagitis eosinofílica, dermatitis crónica y shock anafiláctico 1,2, así como otras patologías como la enfermedad de las arterias coronarias y 3,5 cáncer de 3,4. Además, MCs juegan un papel importante en la inmunidad innata y adaptativa, tanto en la defensa del huésped contra las bacterias y los parásitos y por la supresión de las respuestas inmunes, por ejemplo la inducción de tolerancia aloinjerto 5,6.
MCs se originan en la médula ósea, el desarrollo de CD34 + / CD117 + células progenitoras pluripotentes 7. La médula ósea comprometida progenitores MC se liberan en el torrente sanguíneo y migran hacia los tejidos periféricos de localización predominantemente dentro de los tejidos conectivos y las superficies epiteliales 8. La maduración y la diferenciación terminal se consiguen finalmente bajo la influencia of citoquinas en el 8,9 entorno circundante.
MCs pueden ser activados por un alergeno (antígeno, Ag), cuyo encuentro dado lugar a la generación de inmunoglobulina E (IgE) de tipo anticuerpos. La unión de tales IgE a los receptores Fc RI de la MC, seguido de la reticulación de IgE unido a las células en la re-exposición al mismo Ag, resulta en la agregación de Fc RI y la iniciación de una cascada de señalización que culmina en la desgranulación de células [revisado en 10,11] . MCs también se activan, de forma independiente de IgE, por neuropéptidos 5,12, 13 toxinas, bacterias y antígenos virales 14,15, un número de péptidos cargados positivamente que se hace referencia colectivamente como secretagogos básicas, las células inmunes y citoquinas 5,13,12,16 , 17. MCs también se activan por muchos de sus propios mediadores liberados, que amplifican aún más la respuesta inflamatoria.
MCs están llenas de gránulos de secreción (SGS) que contienen inmunomediadores reguladoras, incluyendo aminas vasoactivas, tales como la histamina y la serotonina (en roedores), proteoglicanos, proteasas, tales como la quimasa y triptasa, factor de crecimiento endotelial vascular y varias citocinas y quimiocinas 8,9. Estos mediadores son "listo para funcionar" y una vez MCs son activados por un estímulo apropiado, estos mediadores se liberan de las células mediante exocitosis regulada (degranulación) en cuestión de segundos a minutos 18,19. Este evento inicial es seguido por la síntesis de novo y la liberación de una gran variedad de sustancias biológicamente potentes, incluyendo metabolitos del ácido araquidónico, múltiples citocinas y quimiocinas 20,21,22. La liberación de productos de nueva síntesis se produce independientemente de la liberación de SG. Colectivamente, estos mediadores inician temprana y de fase tardía respuestas inflamatorias y alérgicas. Por lo tanto, la comprensión de los mecanismos de contabilidad para la activación y degranulación MC son tanto de imp teórica y clínicaortance.
La dificultad para manipular genéticamente MCs primarias y cultivadas ha obstaculizado los intentos de dilucidar los mecanismos subyacentes MC degranulación, que quedó mal resueltos. Para superar este problema hemos desarrollado un ensayo basado reportero cotransfectando la línea de mastocitos de la mucosa, rata leucemia basófila (RBL) -2H3 (en adelante denominado como RBL) o derivadas de médula ósea MCs (BMMCs) 30 con un gen de interés y El neuropéptido Y (NPY) fusionado con RFP monomérica (mRFP), como reportero SG.
NPY fue demostrado previamente para recapitular el comportamiento de los marcadores SG endógenos en otros sistemas. Además, debido a mRFP fluorescencia es insensible al pH, la expresión de NPY-mRFP permite la visualización de los SGs ácidas así como la evaluación cuantitativa de la exocitosis mediante el uso de placas de 96 pocillos y un lector de placas de fluorescencia. Hemos demostrado que el NPY-mRFP se entrega a las Comisiones de ácidos de las células RBL y BMMCs y se libera de las célulasde una manera regulada junto con la carga SG endógena (es decir, β-hexosaminidasa y serotonina) 30, 32. Este protocolo proporciona una metodología basada en la proyección de imagen de alta resolución que permite que los genes de detección de interés para su fenotípica y el impacto funcional de las características de la SG y la degranulación de células RBL 32. Específicamente, este protocolo permite el seguimiento en tiempo real de MC SGS y la cuantificación de su área o tamaño del volumen, su número, la cinética de montaje, su movimiento a lo largo del citoesqueleto de la célula y su fusión definitiva con la membrana plasmática en condiciones diferentes. Por ejemplo, la sensibilización de las células con DNP-específico IgE y la activación de las células con un Ag multivalente (DNP conjugado de albúmina de suero) bajo diferentes perturbaciones (es decir, desmontables de genes de interés, sobre la expresión de genes WT o mutantes, o las manipulaciones farmacológicas) y en comparación con las células control.
Protocolo
1. Preparación de RBL Cell Culture Media
- Mezclar 500 ml de medio de Eagle modificado bajo nivel de glucosa de Dulbecco (DMEM) con 56 ml de suero fetal bovino (esto hace que el 10% de FBS), y luego añadir 5,5 ml de penicilina estreptomicina (esto hace ~ 1% de plagas).
- Filtra los medios de comunicación mediante el uso de 500-1.000 ml Botella-Top Filtros de Vacío con 0,22 m de tamaño de poro y se almacena a 4 ° C.
2. Cultura de células RBL
- Se cultivan las células RBL en una atmósfera humidificada de 5% de CO2 a 37 ° C, ya sea en placas o frascos. Células RBL que crecen en placas de 10 cm deben ser complementados con 10 ml de medio y forman monocapa confluente de ~ 10 7 células / placa.
- Cuando la capa de células se está acercando a la confluencia, replate el cultivo a una densidad más baja.
- Retire el medio de cultivo de la placa / matraz utilizando una pipeta pasteur estéril conectado al vacío.
- Enjuague la monocapa celular con precalentado (37° C) 0,25% de tripsina / EDTA que cubre toda la monocapa (el volumen depende del tamaño de la placa de cultivo / matraz; 2 ml para 10 cm de placa). Esto separar las células.
- Alternativamente, enjuague la monocapa celular con tampón fosfato salino (PBS), eliminar el PBS y añadir precalentado (37 ° C) de tripsina / EDTA. Este paso se separa de las células más rápido.
- Colocar la placa / matraz en una incubadora a 37 ° C (no más de 10 min).
- Inspeccione las células bajo el microscopio óptico para comprobar si se han desprendido. Si las células no se separan después de 10 minutos, toque suavemente sobre la placa / matraz.
- Añadir medio a la placa de cultivo / matraz para suspender las células (el volumen del medio debe ser al menos 2 veces mayor que el volumen de la solución de tripsina).
- Sedimentar las células por centrifugación durante 3 min a 200 g a 25 ° C.
- Resuspender las células en medio. Diluir las células por 1:10 y sembrar en una nueva placa de cultivo. Se incuban las células durante 48 a 72 horas, hasta que REACh aproximadamente 90% de confluencia.
- Repita el mismo procedimiento (sección 2.2.1-2.2.8) durante un máximo de 3 meses (30 pases).
3. Preparación de transfección de medios.
- Preparar una solución de K-Pipes pH 7, solución 1 mM de Ca 2+ de etilo y solución de Mg 2 + acetato de 100 mM 100 mM.
- Diluir la solución 100 mM de K-Pipes pH 7 en 20 mM utilizando medios DMEM, añadir la solución de 1 mM de Ca 2+ de etilo a una concentración final de 10 mM y la solución de Mg 2+ acetato 100 mM a una concentración final de 2 mM.
- Pesar glutamato de potasio y añadir a la solución a una concentración final de 128 mM, mezclar bien y mantener a 4 ° C hasta su uso. Mantenga las soluciones restantes (es decir., K-Tubos, Ca 2+ acetato, Mg 2 + acetato) a -20 ° C.
4. La transfección de células RBL
- Retire el medio de cultivo de la placa / matraz utilizando unapipeta Pasteur estéril conectado al vacío.
- Enjuague la monocapa de células con precalentado (37 ° C) de tripsina / EDTA que debe cubrir toda la monocapa. Colocar la placa / matraz en una incubadora a 37 ° C (no más de 10 min). Compruebe si las células se han separado utilizando el microscopio óptico.
- Añadir medio a la placa de cultivo / matraz para suspender las células (el volumen de los medios debe ser de al menos 2 más grande más que el volumen de la solución de tripsina).
- Contar el número de células usando un hemocitómetro.
- Pellet 1,5 × 10 7 células por centrifugación durante 3 min a 200 xg a 25 ° C. Descartar el sobrenadante y añadir 280 l de medio de transfección. Transfiera la mezcla de reacción a 4 mm cubeta.
- Añadir 20 g de plásmido NPY-mRFP y, o bien 30 g de control de plásmido vacío o un plásmido probado. El volumen final de la mezcla de reacción debe ser de 300 l.
- Colocar inmediatamente en hielo durante 10 min. Limpiar la cubeta del agua residual y proceed a electroporación a 300 V durante 9 mseg.
- Para las mediciones de la exocitosis, replate las células inmediatamente en 24 platos de cultivo de tejidos que contienen 300 l de medio. Añadir 8 l de la mezcla de reacción (4 × 10 5 células) a cada pocillo. Añadir células 4 × 10 5 no transfectadas para pozos adicionales para el control. Prepare suficientes pocillos para tener al menos pocillos duplicados para cada tratamiento para cada transfección.
- Para microscopía lapso de tiempo, replate las células inmediatamente en un sistema cubreobjetos borosilicato cámara de 8 pocillos que contiene 80 l medio. Añadir 1,5 l de la mezcla de reacción (7,5 × 10 4 células) a cada cámara. (Trate de evitar el uso de las cámaras en el borde del cubreobjetos, las cámaras en el centro del cubreobjetos son más fáciles de imagen).
NOTA: Es importante destacar que no todas las células de respuesta a un factor desencadenante y de vez en cuando la microscopía de lapso de tiempo se suprime debido a la pérdida de foco y de la deriva de la Borosi cámara de 8 pocillossistema cubreobjetos licate. Por lo tanto, preparar al menos 8 cámaras para cada tratamiento para cada transfección. - Para sensibilizar a las células para la activación mediada por Fc RI, añadir 1 g / ml de DNP ratón monoclonal IgE específica frente a los medios de comunicación (incubar las células con IgE durante al menos 2 h).
- Después de 18-24 hr utilizar un microscopio de fluorescencia para confirmar que las células expresan los plásmidos. Las longitudes de onda de excitación y emisión de fluorescencia mRFP son:? Ex 584, λEm 607 nm. NPY-mRFP debe aparecer en estructuras vesiculares que corresponden a los SGS. Si el segundo gen de interés se fusiona con una etiqueta fluorescente utilizar un microscopio de fluorescencia para confirmar la co-expresión de ambos plásmidos en las mismas células. Por ejemplo, si el gen probado está fusionado a GFP, Las longitudes de onda de excitación y emisión de fluorescencia de GFP son:? Ex 488, λEm 507 nm. La proteína GFP etiquetado deberá figurar en las mismas células que expresan NPY-mRFP.
- Para las mediciones de exocitosis proceder to el paso 5 y para microscopía lapso de tiempo, vaya al paso 6.
5. Medición de NPY-mRFP exocitosis
- Preparación de tampón Tyrode:
- Preparar una solución de 54 mM KCl, 20 mM MgCl 2, NaCl 2,74 y 8 mM NaH 2 PO 4 en DDW. Mezclar bien y almacenar a 4 ° C. Este paso es para la preparación de 20x tampón Tyrode.
- Preparar una solución de Hepes 20 mM pH 7, 1,8 mM CaCl 2, 1 mg / ml de BSA, glucosa 5,6 mM y 1 a 20 dilución de Tyrode 20x en DDW y mezclar bien. Este paso es para la preparación de tampón 1x Tyrode.
- Alícuota de la memoria intermedia 1x Tyrode y se almacena a -20 ° C. Evite los ciclos de congelación y descongelación.
- Retire el medio de cultivo de la placa de 24 pocillos y lavar 3 veces con tampón de Tyrode. Preparar las células no estimuladas mediante la adición de tampón de Tyrode 200 l a los pocillos de control.
- Preparar 10 l / pocillo de 20X concentró reactivo activador [(por ejemplo, 1.000 ng / ml de DNP-BSA o DNP-HSA (Ag), 200 mM Ca 2 + ionóforo (por ejemplo, A23187), y una combinación de 20 mM Ca 2 + ionóforo y 1000 nM 12-O- tetradecanoilforbol-13-acetato (TPA)]. Si los reactivos se almacenan en DMSO, diluir los reactivos en la concentración 20x en tampón de Tyrode que contiene 1% de DMSO. Incubar a 37 ° C durante 30 min.
- Retire los sobrenadantes de cada pocillo con cuidado a una placa de 96 pocillos, colocar en hielo y evitar la luz. (Los sobrenadantes contienen el péptido quimérico NPY-mRFP que se libera de las células).
- Añadir 200 l de tampón de Tyrode que contenía 0,5% de Triton X-100 a cada pocillo e incubar a 37 ° C durante 10 min. (Este paso es importante para la preparación de los lisados celulares que contienen el restante de NPY-mRFP que no se libera de las células). Recoge los lisados celulares y transferir a una placa de 96 pocillos, colocar en hielo y evitar la luz.
- Medir la fluorescencia de los sobrenadantes de las células y lisados de células utilizando un FLUORESCcia lector de placas, utilizando un 590-, 20 nm de ancho de banda de excitación filtro y 635-, 35 nm filtro de emisión de ancho de banda.
- Calcular el porcentaje de NPY-mRFP lanzado:
NOTA: La medida lector de fluorescencia unidades arbitrarias de fluorescencia (AFU). AFU valores dependen de la máquina y su sensibilidad y la eficiencia de transfección.- Establezca la autofluorescencia de las células RBL no transfectadas como en blanco. Divida la AFU de cada sobrenadante a la fluorescencia total (AFU de los sobrenadantes + AFU del lisado correspondiente) y se multiplica por 100.
6. Time-lapse microscopía de exocitosis
- Semillas 7,5 × 10 4 de la células / cámara transfectadas en un sistema de cubreobjetos de borosilicato cámara de 8 pocillos. Después de 18 a 24 horas, retire el medio de cultivo de las cámaras y lavar 3 veces con tampón de Tyrode
- Añadir 72 l de tampón de Tyrode a cada cámara. Diluir los reactivos activantes en tampón de Tyrode a 10 veces la concentración.
- usar un microscopio de fluorescencia confocal equipado con una cámara calentada (37 ° C) y CO 2 controlador (4,8%) y un objetivo de 40X o 63X. Encienda los sistemas de microscopio: lámpara de mercurio, el ordenador y los láseres. Asegúrese de que la cámara climatizada está a la temperatura adecuada antes de iniciar el experimento.
- Coloque la cámara en la cámara climatizada y asegúrese de que la cámara esté correctamente instalado y estable.
- Encienda la luz de fluorescencia de acuerdo con el fluoróforo relevante y visualizar las células transfectadas. Apague la fluorescencia una vez una célula de interés está en el campo con el fin de minimizar la decoloración y la citotoxicidad. Es importante que este campo contendrá alrededor de 2-3 células transfectadas. Las células transfectadas deben estar bien distribuidas, pero no se toquen entre sí.
- Ajustar la potencia del láser (dependiendo del microscopio) para minimizar el ruido y la sobresaturación, así como la toxicidad, y ajustar la ganancia y el desplazamiento para modificar la relación de señal a ruido. Escaneado rápido en oder reducir al mínimo la duración de la exposición láser (promedio 2).
- Ajuste el tamaño del agujero de alfiler a un máximo, esto permite la disminución de la potencia del láser y de mantener las imágenes enfocadas por un largo período de tiempo. Si lo desea, establezca los parámetros para la pila de Z a reconstruir la imagen en tres dimensiones, ajustar el tamaño del agujero de alfiler a 1 unidad aireado (UA) que le da la mejor relación señal-ruido y adquirir sucesiva exploración de rebanadas óptica confocal de dos dimensiones en el -axes z con rodajas ópticos ≤0.7 micras.
- Ajuste el intervalo de tiempo entre cada adquisición de 15 a 30 segundos y la duración de la adquisición de un total de 15 minutos y comenzar a adquirir las imágenes. Después de 5 minutos de la adquisición de una pausa en la serie de tiempo. Añadir 8 l de 10x el gatillo y continuar la adquisición de inmediato.
- Guardar las imágenes, realizar deconvolución utilizando un software de deconvolución y reconstruir las pilas a imágenes en tres dimensiones y con una película utilizando el software Imaris.
7. Los análisis de imagen
- Importar los datos de las imágenes de series de tiempo deconvoluted que se obtuvieron por el microscopio de fluorescencia confocal de software Imaris. Este software lee más de 40 archivos de microscopía. Si el software no puede leer los archivos; convertir los archivos en archivos tif y de importación.
- Para agregar puntos de tiempo hasta el final de un conjunto de datos abierto pulse editar -> Añadir puntos de tiempo e importar el nuevo conjunto de datos.
- Crear superficie del canal mRFP usando opción del asistente superficie. Elija el algoritmo predeterminado. Elija el canal de NPY-mRFP. Marque la opción de suavizado para reducir el ruido. Para evitar la pérdida de pequeños detalles reducen el nivel de detalle área de 0,05 m.
- Ajuste el umbral de intensidad. Se mostrará Nueva superficie gris. Ir a "Configuración" y cambiar el estilo de "punto central" de "Surface".
- Ir a la ficha estadística en las propiedades del objeto seleccionado, seleccione la ficha detallada y la suc valor específicoh como la intensidad de fluorescencia, volumen, etc.
- Revise los datos y confirme que los valores son compatibles con las imágenes. Por ejemplo, dos o más gránulos adyacentes pueden ser medidos como un gránulo más grande. Para cuantificar el tamaño medio de gránulo dividir el tamaño de los gránulos fusionados al número real de gránulos.
- Exportar los conjuntos de datos que desee en los archivos de Excel y analizar los datos.
Resultados
Debido a la baja eficiencia de transfección de MCs, las manipulaciones genéticas son poco probable que deje un impacto en las lecturas de la secreción de promedio medidos por los mediadores endógenos SGs. Sin embargo, mediante el establecimiento de completa co-expresión del gen reportero NPY-mRFP y el plásmido co-transfectadas en las mismas células, el seguimiento de los resultados de NPY-mRFP exclusivamente en el seguimiento de la población de células que expresa el gen de interés. Por lo tanto, la ventaja de este ensayo en comparación con los métodos convencionales es la capacidad de controlar selectivamente las células manipuladas genéticamente (Figura 1).
De hecho, el uso de este ensayo hemos analizado los genes que regulan el tráfico vesicular incluyendo NSF soluble del receptor de proteína de fijación (SNARE) proteínas [fusión sensible N-etilmaleimida] y 44 miembros de la familia Rab GTPasas. Se identificaron los genes que regulan SGsize, número, composición de la carga y la exocitosis 23.
We identificó 30 Rabs que alterado (es decir, inhibir o estimular) la exocitosis en las células RBL estimuladas por cualquiera de Ag o por la combinación de un ionóforo de Ca 2+ y el éster de forbol TPA (Ion / TPA) 23. Imagen confocal reveló lazos y Rabs que causaron fenotipos dramáticos que alteran la morfología de las células o las Comisiones de 30,32. Confocal de imágenes de estas proteínas reveló 8 trampas y Rabs que causaron fenotipos dramáticos en las células o la morfología SG 30,32. El uso de este protocolo hemos sido capaces de realizar un seguimiento de los SG individuales y realizar mediciones de su tamaño, la intensidad de fluorescencia, su movimiento y exocitosis. Por ejemplo, identificamos Rab5 como regulador de la biogénesis SG 30. Rab5 ha sido identificado como un regulador maestro de endocitosis y endosomal fusión 24. Hemos demostrado que la co-expresión de (CN) mutantes constitutivamente negativos del PIB salida al mar de las isoformas expresadas endógenamente de Rab5 (Rab5a, Rab5B y Rab5C), o correoxpression de Rab5a / B / focalización shRNAs C, reduce significativamente el tamaño de las Comisiones de Estudio 'con el consiguiente aumento de su número 30. Por el contrario, la expresión de un GTP-bloqueado, constitutivamente activo (CA) mutante Rab5a (Rab5a Q79L, en el presente documento: "CA Rab5a"), que es conocido para facilitar la fusión homotipica de los endosomas tempranos (EEs) 24, resultó en la formación de gigante vesículas Rab5a-decorado, que hemos identificado como SG en función de su contenido de la carga secretora NPY-mRFP y la serotonina, y su capacidad de exocitosis de una manera regulada 30.
La figura 2 muestra los análisis morfométricos de las Comisiones de NPY-mRFP contienen. El volumen medio SGs en las células que expresan Rab5a CA alcanzó el valor de 44 m 3, que era> 20 veces más grande que el volumen medio de la SGs en el control GFP-células que expresan mientras que su número se redujo en 20 veces (Figura 2A). La relación inversaentre el número y el tamaño de SGs (Figura 2A) sugirió que la ampliación Rab5 mediada de la SGs implica su fusión homotípica. El gigante de NPY-mRFP contiene SG formados por CA Rab5a permite obtener imágenes de microscopía confocal de células vivas en una alta resolución que permite el seguimiento de las Comisiones de Estudio en detalles que no serían posibles de otra manera. Por ejemplo, detectamos Rab5a fusionar SG junto a estructuras más pequeñas dispersas entre el gigante de los SG, lo más probable correspondiente a los endosomas (Figura 2B). Además, hemos demostrado que Rab5 asociados transitoriamente y preferiblemente con SGS recién formadas que sugieren que la asociación selectiva y transitoria de Rab5a con recién formado SGS es compatible con un aparato de fusogénica en el que sólo gránulos recién generados tienen la capacidad de fusionarse con otra SGs 30.
Figura 3 muestra imágenes en tiempo lapso representativas de MC gigante SG que se formaron por la expresión de CARab5a y la cinética de la exocitosis en la resolución de un solo SG después de la estimulación. Durante MC exocitosis, los SGs se mueven hacia y se fusionan con la membrana plasmática. Como consecuencia, la carga secretora se libera de las células en el espacio extracelular. En este sistema experimental, NPY-mRFP se libera de las células y se encontró en los sobrenadantes de células. La fluorescencia de NPY-mRFP en los sobrenadantes de las células puede ser medido por un lector de fluorescencia. Sin embargo, debido NPY-mRFP se diluye en los sobrenadantes de su señal de fluorescencia puede no ser detectado o visualizado por microscopía de fluorescencia. La liberación de NPY-mRFP de los gránulos durante resultados exocitosis en un descenso rápido y dramático en la intensidad de fluorescencia NPY-mRFP y la contracción del NPY-mRFP contienen SGS y su disappearance.Therefore, imágenes de células vivas de células estimuladas y mediciones de NPY intensidad de fluorescencia -mRFP o NPY-mRFP tamaño que contiene SG proporcionan evaluaciones precisas de la cinética de la exocitosis degránulos individuales. La Figura 3b muestra las intensidades de fluorescencia de SGs después de la estimulación de las células con un ionóforo de Ca 2+. Los SGs se someten a la exocitosis en diferentes puntos de tiempo (es decir, 2, 3, 6, y 11 min de estimulación posterior), mientras que la intensidad de fluorescencia de una sola SG que no se fusionan con la membrana plasmática se mantuvo constante.

Figura 1:. Ilustración de las principales etapas del protocolo RBL células se cotransfectaron con NPY-mRFP y un segundo gen de interés o plásmido de control correspondiente e inmediatamente se sembraron en cubreobjetos, de 8 pocillos sistema de cámara de borosilicato cubreobjetos o placas de 96 pocillos. Al día siguiente, Imágenes de las Comisiones de NPY-mRFP contienen en reposo y células activadas se adquieren mediante microscopía confocal (A). Además, exocitosis de resting y provocó cellsis cuantificó midiendo la liberación de NPY-mRFP en un lector de fluorescencia de placa de 96 pocillos (B).
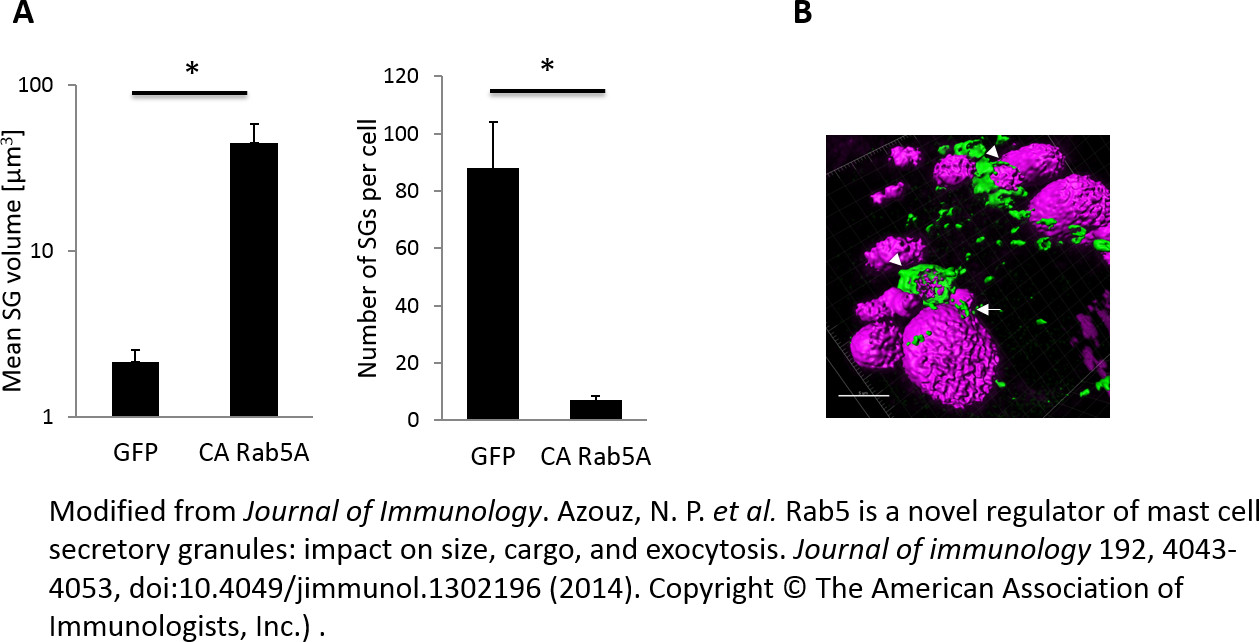
Figura 2:. Cuantificación de tamaño las Comisiones de Estudio 'RBL células se cotransfectaron con NPY-mRFP y, o bien GFP o GFP-CA Rab5a y se sembraron en el sistema cubre objetos borosilicato cámara de 8 pocillos. 24 horas más tarde, la cámara de 8 pocillos se coloca en el microscopio confocal láser equipada cámara calentada (37 ° C). Imágenes Z-stack de imágenes sucesivas con rodajas ópticos 0.7 micras fueron capturados utilizando un / 1.4 objetivo apertura numérica 63X petróleo. Las imágenes fueron deconvoluted y tres imágenes de dimensión se construyeron mediante el software Imaris. El volumen de la SGS y su número se calcularon utilizando el software Imaris (A). Parte de la granu NPY-mRFP que contienenles parece estar incrustado dentro de Rab5a (puntas de flecha). Otros están desnudas o en puente con Rab5a (flechas). La barra de escala = 5 mm (B). Haga clic aquí para ver una versión más grande de esta figura.
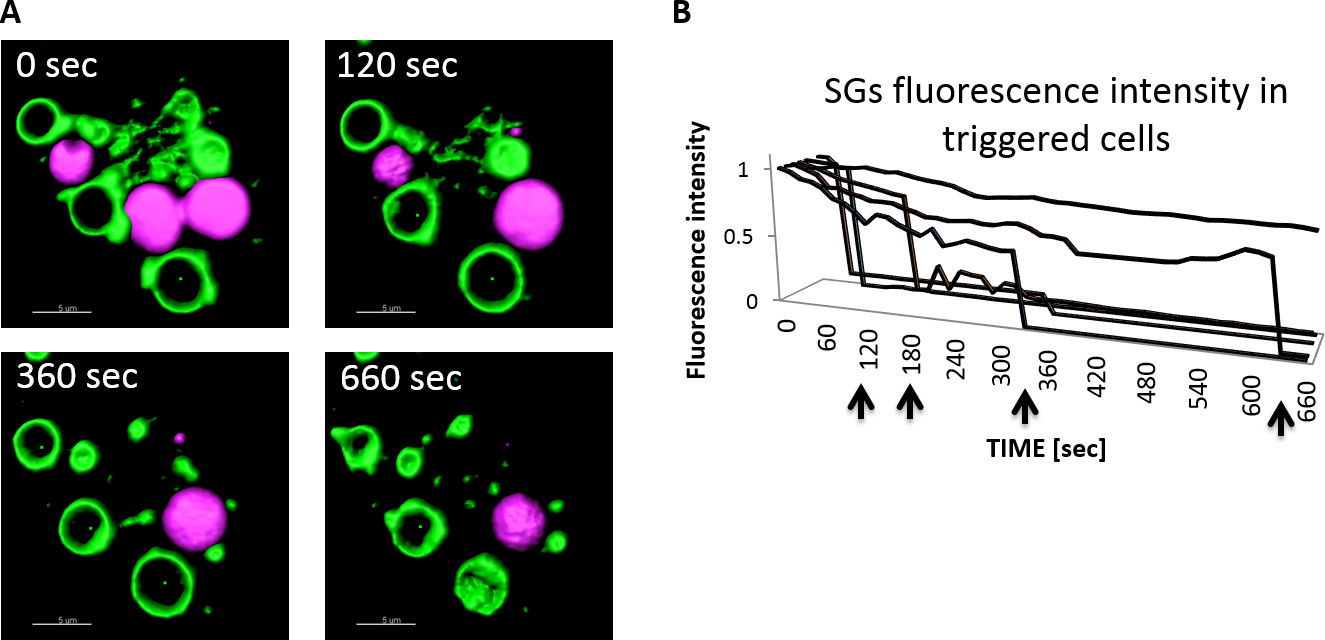
Figura 3:. Medición de la extensión y la cinética de la exocitosis en la resolución de un solo SG en células RBL activatedRBL células se cotransfectaron con NPY-mRFP y GFP-CA Rab5a y sistema de cubreobjetos de borosilicato cámara de in8 bien sembrado. 24 horas más tarde cámara de in8 así se colocó en un microscopio láser confocal equipado con una cámara calentada (37 ° C) y las células se desencadenó con 10 mM Ca2 + ionóforo. Las imágenes fueron adquiridas cada 15 seg usando un / 1.4 objetivo apertura numérica 63X aceite. Imágeneseran deconvoluted y luego procesados por el software Imaris. La barra de escala = 5 m (A). La intensidad de fluorescencia media de las mRFP-NPY que contienen gránulos se determinó por el software Imaris y los datos se normalizaron de acuerdo al tiempo 0 (tiempo de adición del ionóforo de Ca2 +). Las flechas representan los puntos de tiempo en el que la liberación de SGcargo wasnoted (B). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se describe una estrategia innovadora que combina la cuantificación de MCs exocitosis y cuatro (x, y, z, t) cuantificaciones dimensión por imágenes en tres dimensiones de tiempo transcurrido de las Comisiones de Estudio en las células vivas utilizando un gen reportero de exocitosis. Esta técnica permite la detección de las familias de proteínas por su impacto en la función MC como SG de monitoreo a partir tan pronto como su salida del Golgi a través de su maduración, la adquisición de competencias exocitosis y degranulación. La combinación de mediciones de exocitosis junto con caracterizaciones morfométricos y cinéticos de las Comisiones de Estudio ofrece una visión de los mecanismos por los que las proteínas de la prueba median funciones MC. Por lo tanto, el uso de esta metodología, la manipulación genética de determinados genes puede revelar nuevos mecanismos moleculares por los cuales la tienda MC SGS y liberan su carga. Cabe destacar que el NPY puede servir como reportero para la exocitosis en otras células secretoras, como las células MCF-7, una línea celular derivada de from un adenocarcinoma de glándula mamaria humana 31, las células cromafines 34 y β-células pancreáticas 35.
Las manipulaciones genéticas son las herramientas más potentes actualmente disponibles para la investigación de redes funcionales. Manipulaciones genéticas permiten la identificación de proteínas esenciales en cada red, cuya deleción hará cumplir colapso del sistema, a diferencia de otras proteínas, cuya deleción hará cumplir diafonía entre redes paralelas o no tener ningún efecto debido a la redundancia. Sin embargo, debido a la baja eficiencia de transfección de MCs, al medir la exocitosis de mediadores endógenos sólo una pequeña fracción de células que expresan el ADN se prueba 'manipular'. Por lo tanto, al medir la exocitosis de mediadores endógenos, la contribución de las células transfectadas para la lectura total es menor. Por lo tanto, tratando de adoptar este enfoque para explorar las redes complejas asociadas con la exocitosis regulada en MCs era jampered. Esta técnica supera el obstáculo de la baja eficiencia de transfección y proporciona una forma sencilla para observar alteraciones fenotípicas de MC SGs causadas por más de expresión, desmontables y mutagénesis de los genes de interés.
Esta técnica se puede ampliar para la investigación de la jerarquía y el modo de interacción de redes funcionales utilizando transitoria triple transfección. Los resultados se analizaron para determinar qué gen puede rescatar un cierto fenotipo; causar un fenotipo más dramática o no tienen ningún efecto. Sobre la base de tales transfecciones combinatorias, las redes de exocitosis se pueden construir. Por ejemplo, usando triple transfección hemos sido capaces de identificar la proteína SNARE VAMP8 como mediador aguas abajo en el proceso de fusión Rab5 SG-25 dependiente.
Este método permite la visualización y cuantificación de la exocitosis en la resolución de SGs individuales. De hecho hemos sido capaces de demostrar que la SGS respuestas pantalla diferenciales para STIMuli. La razón de por qué ciertos SG fusionados con la membrana plasmática, mientras que otros no lo hicieron o la razón de la cinética diferenciales de MC SG fusión no se habían determinado. Futuros estudios que utilizan este enfoque experimental tienen el potencial para responder a estas preguntas. Por ejemplo, la cuantificación de diferentes trampas o Rabs sobre individuo SGS y correlación con competencia exocitosis y la cinética de la exocitosis en la resolución de un solo SG debe revelar nuevos reguladores de exocitosis.
La principal limitación de esta técnica es la manipulación genética debido a la sobreexpresión de una proteína puede afectar a la función celular o la morfología. Por lo tanto, es esencial para validar los resultados con enfoques complementarios. Por ejemplo, cuando la sobreexpresión de un mutante constitutivamente activa inhibe la exocitosis, el efecto de un mutante negativo constitutiva o derribar del gen deben ser probados.
Usando esta técnica, que IDENTIFnuevos reguladores del IED de funciones MC, que afectan MC exocitosis o alteran la morfología SG. La combinación de mediciones exocitosis junto con la caracterización morfométrica SG ofrece una visión más profunda sobre la función y los mecanismos de acción de las proteínas de la prueba.
Divulgaciones
The authors have no financial conflicts of interest.
Agradecimientos
Agradecemos al Dr. U. Ashery por el don de cDNA NPY-mRFP. Agradecemos a los Dres. MJ Kofron, L. Mittleman, M. Shaharbani y Y. Zilberstein por su valiosa asistencia con microscopía y análisis de imagen. También agradecemos al Dr. Joseph Orly para la lectura crítica de este manuscrito. Este trabajo fue apoyado por una beca de la Fundación de Ciencias de Israel, fundado por la Academia Israelí de Ciencias (1139-1112 a RS-E.).
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma-Aldrich | D6046-500ML | Warm in 37 °C water bath before use |
| Fetal Bovine Serum | GE health care Life sciences | SH30071.01 | |
| Penicillin-Streptomycin | Life technologies | ||
| Cellulose acetate membrane, pore size 0.22 μm | Sigma-Aldrich | CLS430769-1EA | |
| Corning tissue-culture treated culture dishes | Sigma-Aldrich | CLS430167 | |
| Trypsin/EDTA Solution (TE) | Life technologies | R001100 | Warm in 37 °C water bath before use |
| PIPES dipotassium salt | Sigma-Aldrich | 108321-27-3 | |
| Calcium acetate hydrate | Sigma-Aldrich | 114460-21-8 | |
| Magnesium acetate tetrahydrate | Sigma-Aldrich | M5661 | |
| L-Glutamic acid potassium salt monohydrate (Potassium glutamate) | Sigma-Aldrich | G1501 | |
| 4 mm electroporation cuvettes | cell projects | EP-104 | |
| GENE PULSER WITH PULSE CONTROLLER & CAPACITANCE | Bio rad | ||
| Chambered coverglass | Thermo scientific | 155411 | |
| 24 well, flat bottom | Sigma-Aldrich | CLS3524 | |
| Corning 96 well plates | Sigma-Aldrich | CLS3367 or CLS390 | |
| 96 well plate fluorescence reader- Infinite 200 | Tecan | ||
| Calcium ionophore A23187 | Sigma-Aldrich | C7522 | Avoid from direct light exposure |
| 12-O-tetradecanoyl-13-acetate (TPA) | Calbiochem | P3766 | |
| anti-DNP monoclonal IgE | Sigma-Aldrich | D8406 | |
| DNP-BSA/ DNP-HAS | Sigma-Aldrich | A6661 | Avoid from direct light exposure |
| Triton-x-100 | Sigma-Aldrich | T8787 | |
| Confocal fluorescent microscope: | |||
| Zeiss LSM 510 | |||
| Leica | SP5 | ||
| Nikon A1 inverted | |||
| Imaris software | BITLANE | ||
| Microsoft exel or Prism or other analyses software | |||
| Other reagent: | |||
| Magnesium Chloride | MERK | 5833 | |
| Sodium chloride | MERK | 6404 | |
| Calcium chloride | MERK | 2382 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Glucose | BDH Laboratories | 284515V | |
| Monosodium phosphate | MERK | 5345 | |
| Sterile water |
Referencias
- Abonia, J. P., et al. Involvement of mast cells in eosinophilic esophagitis. J Allergy Clin Immunol. 126 (1), 140-149 (2010).
- Galli, S. J., Tsai, M. Mast cells in allergy and infection: versatile effector and regulatory cells in innate and adaptive immunity. Eur J Immunol. 40 (7), 1843-1851 (2010).
- Ribatti, D., Crivellato, E. The controversial role of mast cells in tumor growth. International Review of Cell and Molecular Biology. 275, 89-131 (2009).
- Ribatti, D., Crivellato, E. Mast cells, angiogenesis and cancer. Adv Exp Med Biol. 716, 270-288 (2011).
- Tsai, M., Grimbaldeston, M., Galli, S. J. Mast cells and immunoregulation/immunomodulation. Adv Exp Med Biol. 716, 186-211 (2011).
- Vries, V. C., Noelle, R. J. Mast cell mediators in tolerance. Curr Opin Immunol. 22 (5), 643-648 (2010).
- Kirshenbaum, A. S., et al. Demonstration that human mast cells arise from a progenitor cell population that is CD34(+), c-kit(+), and expresses aminopeptidase N (CD13). Blood. 94 (7), 2333-2342 (1999).
- Metcalfe, D. D., Baram, D., Mekori, Y. A. Mast cells. Physiol Rev. 77 (4), 1033-1079 (1997).
- Gilfillan, A. M., Austin, S. J., Metcalfe, D. D. Mast cell biology: introduction and overview. Adv Exp Med Biol. 716, 2-12 (2011).
- Rivera, J., Gilfillan, A. M. Molecular regulation of mast cell activation. J Allergy Clin Immunol. 117 (6), 1214-1225 (2006).
- Rivera, J., Gilfillan, A. M. Molecular regulation of mast cell activation. Journal of Allergy and Clinical Immunology. 117 (6), 1214 (2006).
- Lagunoff, D., Martin, T. W., Read, G. Agents that release histamine from mast cells. Annu Rev Pharmacol Toxicol. 23, 331-351 (1983).
- Depinay, N., Hacini, F., Beghdadi, W., Peronet, R., Mecheri, S. Mast cell-dependent down-regulation of antigen-specific immune responses by mosquito bites. J Immunol. 176 (7), 4141-4146 (2006).
- Abel, J., et al. Staphylococcus aureus evades the extracellular antimicrobial activity of mast cells by promoting its own uptake. J Innate Immun. 3 (5), 495-507 (2011).
- Avila, M., Gonzalez-Espinosa, C. Signaling through Toll-like receptor 4 and mast cell-dependent innate immunity responses. IUBMB Life. 63 (10), 873-880 (2011).
- Novak, N., Bieber, T., Peng, W. M. The immunoglobulin E-Toll-like receptor network. Int Arch Allergy Immunol. 151 (1), 1-7 (2010).
- Rudich, N., Ravid, K., Sagi-Eisenberg, R. Mast cell adenosine receptors function: a focus on the a3 adenosine receptor and inflammation. Front Immunol. 3, 134 (2012).
- Theoharides, T. C., Kempuraj, D., Tagen, M., Conti, P., Kalogeromitros, D. Differential release of mast cell mediators and the pathogenesis of inflammation. Immunol Rev. 217, 65-78 (2007).
- Caughey, G. H. Mast cell proteases as protective and inflammatory mediators. Adv Exp Med Biol. 716, 212-234 (2011).
- Lundequist, A., Pejler, G. Biological implications of preformed mast cell mediators. Cell Mol Life Sci. 68 (6), 965-975 (2011).
- Metz, M., Maurer, M. Mast cells--key effector cells in immune responses. Trends Immunol. 28 (5), 234-241 (2007).
- Gordon, J. R., Burd, P. R., Galli, S. J. Mast cells as a source of multifunctional cytokines. Immunol Today. 11 (12), 458-464 (1990).
- Azouz, N. P., Matsui, T., Fukuda, M., Sagi-Eisenberg, R. Decoding the regulation of mast cell exocytosis by networks of Rab GTPases. J Immunol. 189 (5), 2169-2180 (2012).
- Stenmark, H., et al. Inhibition of rab5 GTPase activity stimulates membrane fusion in endocytosis. EMBO J. 13 (6), 1287-1296 (1994).
- Azouz, N. P., et al. Rab5 is a novel regulator of mast cell secretory granules: impact on size, cargo, and exocytosis. J Immunol. 192 (9), 4043-4053 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados