Method Article
Быстрое Фракционирование и выделение целых компонентов крови в образцах, полученных из Окружение сообщества, основанного
В этой статье
Резюме
We outline a methodology for the processing of whole blood to obtain a variety of components for further analysis. We have optimized a streamlined protocol that enables rapid, high-throughput simultaneous processing of whole blood samples in a non-clinical setting.
Аннотация
Сбор и обработка образцов цельной крови в не-клинической предлагает уникальную возможность оценить общинных жилых лиц, так и без существовавшие ранее условиях. Быстрая обработка этих образцов необходимо избежать деградации ключевых клеточных компонентов. Сюда относятся методы для одновременного периферической крови мононуклеаров клетки (РВМС), ДНК, РНК и изоляция сыворотки от одного взятия крови выполняется в домах по обоюдному согласию участников по столичной области, с обработкой начато в течение 2 ч сбора. Мы использовали эти методы, чтобы обработать более 1600 образцов крови уступая последовательным, высокое качество материалов, которые впоследствии были использованы в успешной метилирования ДНК, генотипирование, экспрессия генов и проточной цитометрии анализа. Некоторые из методов, используемых стандартные; Однако при сочетании описанным способом, они позволяют эффективную обработку образцов из участников общей направленности и / или от сообществаИсследования, проведенные в которые обычно не быть оценены в клинических условиях. Таким образом, этот протокол имеет потенциал, чтобы получить образцы (и впоследствии данных), которые более представительным населения в целом.
Введение
Многочисленные исследования характеризуется различия в экспрессии генов, метилирование ДНК и клеточного подмножества в крови среди лиц с и без умственной (или другой) болезни 1-4. Эти исследования, однако, были получены из клинических условий, в которых различия связанных с заболеванием может быть увеличено за счет общем более тяжелым характером заболеваний, для которых пациенты, нуждающихся в лечении. Благодаря достижениям в области "omics" подходов, в последнее десятилетие наблюдается взрыв интереса в получении биологических образцов из сообщества и / или эпидемиологических параметров 5-7, для того, чтобы обеспечить население на основе оценки распространенности заболевания и широкую картину из экологические детерминанты этих психических и / или соматических заболеваний.
Основной проблемой в этой связи является требование для быстрой обработки собранных образцов. Деградация мононуклеарных клеток, ключевых компонентов иммунной системы, которые frequentlу используется для оценки здоровья индивида, начинается сразу же после взятия крови со значительным снижением в восстановлении после 2 часов сбора 8-10. Для решения этой проблемы, мы представляем оптимизированный протокол, в котором несколько компонентов цельной крови человека одновременно изолирован от образцов, полученных в домах субъектов, живущих в большом столичном районе. Протокол основан на нашей компиляции и модификации современных методов, в том числе хранения всех «лишних» фракций в случае будущих методы позволяют для дальнейшей изоляции / анализов. В то время как альтернативные методы или комплекты могут быть использованы вместо отдельных методов, описанных здесь, которые изложены оказались надежным и эффективным средством для обработки образцов в высокой пропускной образом. Высококачественные фракции (МНПК, ДНК, сыворотки, и РНК) свежей крови может быть произведено в течение 2 ч сбора и анализа всех готовых образцов могут быть доступны в течение 2 дней (рис 1).
Этот протокол был разработан для того, чтобы эффективно обрабатывать образцов, взятых из сообщества-жилище, взрослых жителей города Детройта для тестирования в Детройте соседства изучения здравоохранения (DNHS; DA022720, RC1MH088283, DA022720-05-S1), А на основе популяционных Изучение социальных и биологических детерминант посттравматического стрессового расстройства (ПТСР) и других психических заболеваний. Распространенность ПТСР в Детройте более чем в два раза в среднем по стране 11,12. Определение биологических детерминант ПТСР в этой группе населения может помочь разработать соответствующие фармакологические и / или когнитивно-поведенческие вмешательства, чтобы помочь тем, кто страдает от расстройства, как в этом городское население, и в других популяциях высокого риска (например, возвращение военных ветеранов). Наша лаборатория, ранее расположенный в Wayne State University в Детройте, штат Мичиган, был выбран для обработки на основе нашего опыта в работе с образцами тканей, полученных свежие из различныхисточников, необходимость начать обработку образцов в 2 ч сбора, и наша близость к местам сбора. С этой уникальной возможностью в стороны, наша цель в том, чтобы оптимизировать обработку для наибольшей урожайности ДНК, РНК, сыворотки и мононуклеарных клеток периферической крови (МНПК) из каждого образца (в общей сложности N = 1639 образцов в течение 5 волн сбора образца). Процедуры, описанные здесь, могут быть выполнены одновременно в не-клинической, таким образом производя исходного материала (см таблицу 1 для средней урожайности) для множества последующих применений, включая микрочипов, эпигенетические, в режиме реального времени RT-PCR, и проточной цитометрии анализа.
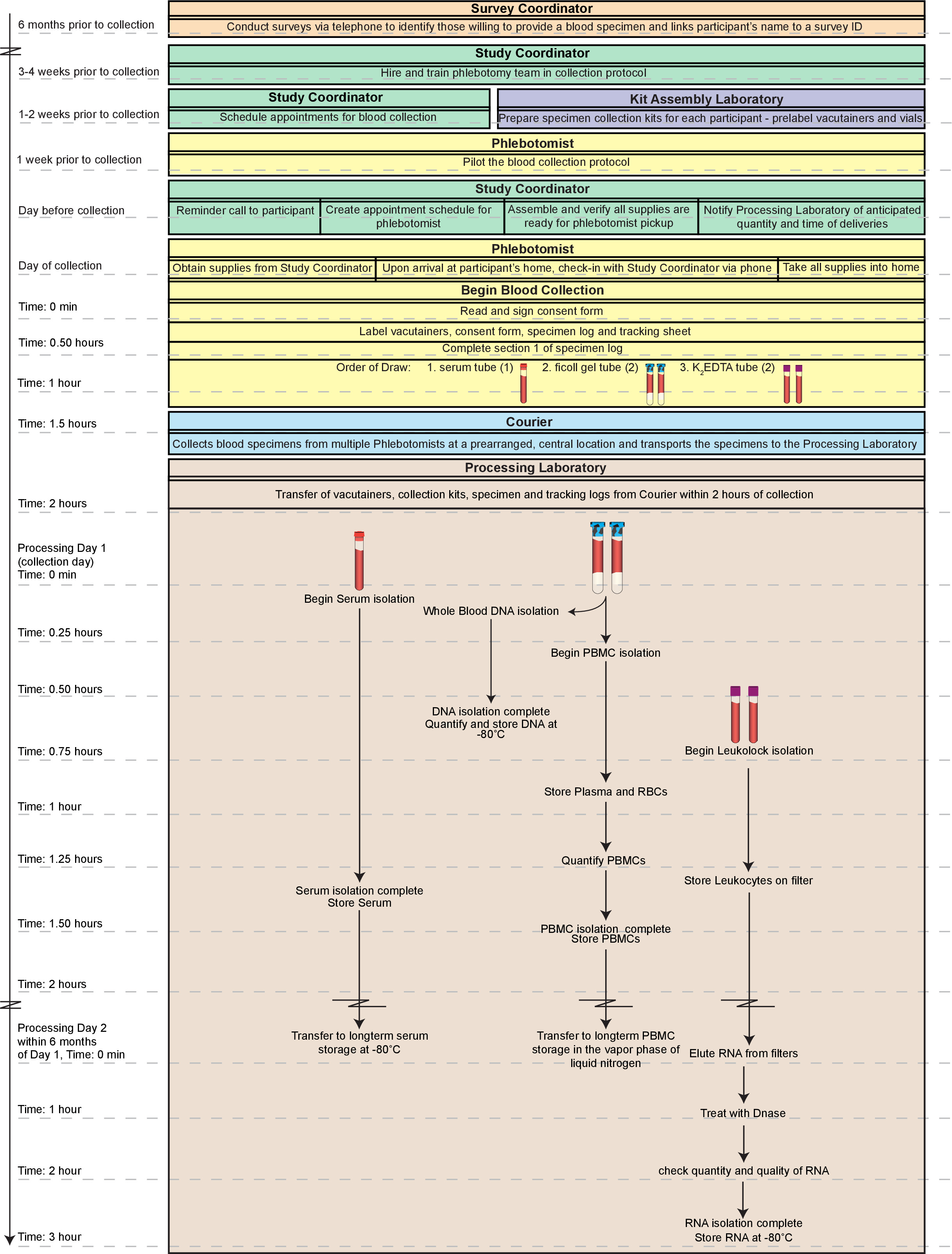
Рисунок 1. Общая поток работы. В целом, процесс изображен здесь включает в себя логистику получения образцов крови от идентификации попустительство учаipants в крови обратить себя. Высокое качество, фракции (одноядерные клетки периферической крови; МНПК, ДНК, сыворотки, и РНК) свежего цельной крови может быть произведено в течение 2 ч сбора и анализа всех готовых образцов могут быть доступны в течение 2 дней. Кроме того, фракции, полученные с помощью этого метода пригодны для длительного хранения, если образцы не должны быть проверены немедленно. Вся шкала изложил здесь может быть завершена в течение одного дня (~ 5 ч) общего. Тем не менее, в такой день было бы крайне трудоемким, особенно для одного специалиста с большим опытом с методами. Таким образом, мы рекомендуем деления процедуры на 1 день по меньшей мере между двумя техниками и завершения обработки РНК в День 2. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
Здоровье Исследование Детройт Район был рассмотрен и утвержден в университете Institutional Review Board Мичигана. Все участники представили информированное согласие до их участия в исследовании.
1. Обзор
- Правильно документировать все этапы от набора с помощью анализа данных конечной точки. Выполните протоколы на 1 день одновременно, переключение ступеней и перекрытия, как позволит время. Последовательность этапов написано для оптимизации эффективности работы. Рисунок 1 дает обзор всего процесса.
Примечание: Термин "участник" используется на протяжении, чтобы показать образец крови де-определены обращается с них согласия человека. Время в скобках ниже, показывают, руки-на время. Примеры отслеживания листа и журнал образца можно найти в дополнительных таблицах S1 и S2 соответственно. Образцы собирают в домах Phlebotomistsлиц, определенных в качестве согласию участников координатором исследования и транспортируется в лабораторию курьером (см дополнительную информацию (SI) 1 для более подробной информации предварительной обработки).
2. День 1 Настройка
- Подготовьте 1x фосфатно-солевом буфере (PBS).
- Разогреть нагревательный блок до 56 ° C.
- Подготовка протеазы (см SI 2) аликвоты по 20 мкл в соответствующее число микропробирок для поставок этого дня (2 на каждого участника).
- Убедитесь, буферы AW1 и AW2 (буферы мыть, предусмотренные в комплекте изоляции ДНК, которые увеличивают чистоту ДНК) готовы к использованию, добавив 100% этанола, как указано на этикетке, если это необходимо.
- Охладить охлаждаемой центрифуге до 4 ° С.
- Заменить крышку на бутылке 1x PBS с указанной каучуковой перегородкой крышкой и проколет резиновую перегородку с передачей шипа, сохраняя винтовую крышку на верхней части передачи SPIке, чтобы предотвратить испарение. Повторите с бутылкой решения стабилизации РНК.
- После подготовки буферов, центрифуги и тепловой блок, документировать время доставки Vacutainer на отслеживая образец листа (см таблицу SI).
3. День 1: Обработка образца цельной крови для ДНК, МНПК и лейкоцитов РНК (2 ч)
- Обзор
- Выделит достаточное время, чтобы свести к минимуму задержку между ничьей крови и начала обработки времени. Начало обработку Ficoll содержащих vacutainers течение 2 ч розыгрыша крови, чтобы избежать увеличения загрязнения эритроцитов и уменьшение мононуклеарных клеток восстановления.
- Предположим, коллекцию 2 vacutainers, содержащих гель градиента Ficoll, 2 К 2 этилендиаминтетрауксусной кислоты (ЭДТА) vacutainers, и 1 в сыворотке крови Vacutainer на взрослого участника. При сдаче vacutainers в лабораторию, есть техник подписать отслеживания лист означающий принятие образцов. Очень прошув обработке сразу с временем начала документально на основе на Vacutainer на журнал образца.
- Сыворотка Выделение Стадия 1 (1 мин)
- Документ время начала на журнал образца (см таблицу SI 2). Центрифуга (с тормозом и ускорения OFF) 7,0 мл сыворотки (красный) Vacutainer (1 на каждого участника), используя ротор Бакет с аэрозольными колпачками (уровень биобезопасности 2; BSL2 сертифицированной) в течение 20 мин, 1300 XG, 4 ºC.
- Выделение ДНК Стадия 1 (15 мин)
Примечание: Для получения дополнительной информации об этой процедуре изоляции, см протокол производителя 13.- Документ время начала. В капотом BSL2 клеточной культуре, инвертировать vacutainers содержащего гель Ficoll 5 раз затем добавить 200 мкл цельной крови из верхней части одной из vacutainers в каждую из двух 20 мкл аликвоты протеазы (400 мкл общего объема каждого участника). Оставив протеазы + микроцентрифужных трубки крови в капюшоне, по-прежнему в Centrifugation из фиколлом содержащей vacutainers в шаге 3.4.1.
Примечание: Используйте Vacutainer с наибольшим объемом сбора, имея в виду необходимость балансирования центрифуги (т.е., это может быть необходимо, чтобы удалить 200 мкл каждой из двух vacutainers), когда спиннинг vacutainers в шаге 3.4.1. Кроме того, чтобы обеспечить надлежащее разделение в процессе обработки голубых vacutainers, уровень крови, оставшейся в Vacutainer не должно быть меньше, чем 2,5 дюйма над слоем Ficoll.
- Документ время начала. В капотом BSL2 клеточной культуре, инвертировать vacutainers содержащего гель Ficoll 5 раз затем добавить 200 мкл цельной крови из верхней части одной из vacutainers в каждую из двух 20 мкл аликвоты протеазы (400 мкл общего объема каждого участника). Оставив протеазы + микроцентрифужных трубки крови в капюшоне, по-прежнему в Centrifugation из фиколлом содержащей vacutainers в шаге 3.4.1.
- РВМС изоляции Стадия 1 (1 мин)
- Документ время начала (должен быть в пределах 2 ч розыгрыша крови, чтобы избежать увеличения загрязнения эритроцитов в крови и снижение в мононуклеарных клеток) восстановления .Invert в фиколлом содержащий vacutainers 8-10 раз. Центрифуга (с тормозом и ускорения Выкл) vacutainers (2 на каждого участника), используя ротор Бакет с аэрозольными колпачками (BSL2 сертифицирована) в течение 30 мин, 1600 мкг, 22 ° C.
Изоляция ДНК Этап 2 (20 мин) - Возврат к капоту и добавить 200 мкл буфера AL каждому из протеазы + в крови микропробирок (этап 3.3.1). Крышка, удалить из капотом, вихревой 15 сек и флэш-спин.
- Выдержите 56 ºC в тепловой блок, 10 мин.
- Удалить труб от теплового блока. Вспышка спин. Вернуться к BSL2 капотом. Добавить 200 мкл 100% этанола. Крышка, удалить из капотом, вихревой 15 сек и флэш-спин. Остальные шаги могут быть завершены за пределами капотом.
- Применение лизата (в течение 30 мин на этапе 3.5.3) с меченым ротационную колонку (в 2 мл пробирку). Закройте крышку, чтобы избежать перекрестного загрязнения с помощью аэрозолей. Центрифуга 6000 мкг, 1 мин.
- Откажитесь от сбора трубки, содержащей фильтрата и поставить колонки отжима в новом 2 мл пробирку.
- Добавить 500 мкл буфера AW1 к колонке без увлажнения обод, закройте крышку, и центрифуга 6000 мкг, 1 мин.
- Откажитесь от сбора пробирку Filtraте и поместите колонку отжима в новом 2 мл пробирку.
- Добавить 500 мкл буфера AW2 к колонке без увлажнения обод, закройте крышку, и центрифуга 20000 мкг, 3 мин.
- Откажитесь от сбора трубки, содержащей фильтрата и поставить колонки отжима в новом 1,5 мл пробирку (не входит в комплект), и центрифуга 20000 мкг, 1 мин.
- Откажитесь от сбора трубки, содержащей фильтрата и поставить колонки отжима в новом 1,5 мл пробирку (не входит в комплект).
- Добавить 200 мкл буфера AE или воды к каждому столбцу и инкубируют при комнатной температуре в течение 5 мин. Центрифуга 6000 мкг, 1 мин.
- Повторите шаг 3.5.11 элюирование в то же пробирку.
- Бассейн элюированную ДНК из 2 столбцов каждого участника. Общий выход ~ 800 мкл каждого участника.
- Количественно образцы с помощью спектрофотометра, когда время позволяет.
- Алиготе ДНК по желанию в 2 мл криопробирки, документирование концентрацию каждого на specimeп журнала. Передача криопробирки к cryobox и место в -80 ° С в течение длительного хранения. Документ время начала морозильник.
- Выделение РНК лейкоцитов Этап 1 (30 мин)
Примечание: Выполните в Уровень биобезопасности 2 сертифицированных капот культуре клеток. Для получения более подробной информации по этому изоляции смотрите инструкции производителя 15.- Пирс резиновую перегородку ЭДТА Vacutainer К 2 с передачи шип. Сохраните оболочку и винтовой крышкой для использования на стадии 3.6.11. После стандартной практикой BSL2, заботиться, чтобы избежать контакта с кровью патогенных микроорганизмов.
- Подключите разъем белого скольжения в верхней части передачи шип.
- Этикетка фильтр с соответствующей участника ID затем подключите вход (вспыхнул конец) фильтра к разъему белого скольжения.
- Приложите оболочкой 25⅝ G иглу в выходной (коническим концом) фильтра. Подготовка фильтрующий узел перед поставкой ускоряет процесс и, следовательно, значительно,есть белый скольжения разъем для передачи всплеска, добавив фильтр, затем ножны иглу и не устанавливая сборку в стойке пробирку до использования, рекомендуется.
- После сборки системы труб К 2 ЭДТА, безопасно обнажить иглы (используйте конец металлического шпателя). Stab иглу в пустую 10 мл пробирку эвакуированы крови (приемник трубки в сыворотке) и инвертировать сборку труб K 2 ЭДТА Vacutainer / фильтр / приемник. После стандартной практикой BSL2, заботиться, чтобы избежать контакта с кровью патогенных микроорганизмов.
- Дайте крови через фильтр до тех пор, клиновидные участки фильтра не очищены от крови. Фильтрация занимает около 2 мин и может быть размещен в стойке пробирки в процессе фильтрации.
- Удалить фильтр из сборки. Оставьте иглу в пробирку, содержащую фильтрат и отбросить всю сборку в контейнер с острыми инструментами в.
- Прикрепите 5 мл шприц с передачей шип на бутылке 1x PBS, вVert бутылку, и вывести 3 мл.
- Приложить шприц с PBS с впускным отверстием фильтра и очистить фильтр (3-5 капли в секунду). Сбор проточные в контейнере биологических отходов. Снять шприц с фильтром без втягивания поршень.
- После фильтрации и промывки PBS, отозвать 3 мл стабилизации РНК агента с использованием нового шприца 5 мл и метода, описанного в пункте 3.6.8. Промойте фильтр, как в шаге 3.6.9. Стабилизация агент РНК должна оставаться на фильтре. Снять шприц с фильтром без втягивания поршень.
- Печать входного фильтра и выход с оболочкой и винтовой крышкой сохраняется от передачи шип, оставляя фильтр, насыщенный стабилизации РНК агента. Фильтр может храниться в этой точке. Храните фильтр при -80 ° С до разрешений время (~ 2 ч), чтобы завершить шаги 5,3 до 5.4.7.
Примечание: Фильтры, хранящиеся при температуре -80 ° С в течение одного года после сбора были обработаны без decreaSE качества РНК.
- РВМС изоляции Стадия 2 (30 мин)
- Снимите фиколл содержащие vacutainers из центрифуги (шаг 3.4.1) и продолжают в BSL2 капотом. Vacutainers должен отображать разделение как показано на рисунке 2. Если нет, см таблицу 2.
- После того, как Vacutainer возвращается к BSL2 капотом, снимите пробку и снять 1,5 мл верхней, желтоватый, плазменного слоя (рис 2), используя серологические пипетки с без приближается к одноядерных (прозрачный / белый) слоя. Перевести плазму 5 мл криопробирку - (бассейн с 2 vacutainers - 1 участника). Войти объем собранной. См шаг 3.7.6 Инструкции хранения.
Примечание: лучшее разделение и большие урожаи РВМС приходят из участников, кто постился, по крайней мере 12 ч до сбора крови. - Перенести оставшиеся плазмы и беловатый, мононуклеарную слой (все, что выше слоя геля - Рисунок 2) ипеть серологическое пипетки на 15 мл коническую трубку, объединения мононуклеарной слой от каждого из двух фиколлом содержащей vacutainers за участника в один конической трубе.
- Добавить 1X PBS, чтобы довести общий объем в конической трубе 15 мл. Крышка трубки и инвертировать в 5 раз. Центрифуга (с тормозом и ускорения OFF) 15 мин, 300 XG, 22 ° C.
- Вернуться к фиколл содержащих vacutainers в капюшоне и собирать красные кровяные клетки (эритроциты) с помощью 5¾ "Пастера пипетки вертеться вокруг и ослабить снаружи слоя геля фиколла и удалить его, если это возможно. Использование серологических пипетки для сбора и передачи БС (~ 4,5 мл) до 5 мл криопробирку. Войти объем собранной.
- Перевести оба 5 мл криопробирки (плазму в шаге 3.7.2 и БС в шаге 3.7.5) для регулируемой скоростью замораживания контейнер и поставить в -80 ° С в течение не менее 24 часов, после чего они могут быть переданы в cryobox и вернулся в -80 ° С для длительного хранения.
- Вернуться СОское трубки капотом, когда центрифугирования в шаге 3.7.4 является полной и аспирации все, но ~ 500 мкл PBS, не нарушая гранул. Выход РВМС больше, если ~ 200 мкл PBS остается выше гранул на данном этапе.
- Добавить свежие 1x PBS, чтобы довести объем до 10 мл. Ресуспендируют осадок осторожно. Крышка трубки и инвертировать в 5 раз. Центрифуга (с тормозом и ускорения OFF) 10 мин, 300 XG, 22 ° C.
- Сыворотка Выделение Стадия 2 (10 мин)
Примечание: Выполните в BSL2 капотом.- Алиготе верхний слой сыворотки из сыворотки Vacutainer, после центрифугирования (этап 3.2.1), в 2 мл криопробирки по желанию. Типичный выход 2,5 мл (таблица 1). Войти громкости. Например, можно использовать 4 криопробирки аликвоты 200 мкл в криопробирку 1, 1000 мкл в криопробирку 2, а затем разделить оставшийся в криопробирки 3 и 4.
- Передача криопробирки в в cryobox и место при температуре -80 ° С для длительного хранения. Документ о начале морозильниквремя.
- РВМС изоляции Этап 3 (15 мин)
- Вернуться к капоту, после центрифугирования (этап 3.7.8), и аспирата как много надосадочной / PBS, как это возможно, не нарушая гранул. Ресуспендируют осадок с помощью пипетки в 2,5 мл РВМС Замораживание среда 1 (см SI 2).
- Добавить 2,5 мл РВМС Замораживание среда 2 (см Si 2) в клеточной / среднего раствора на стадии 3.9.1. Вихревой нежно.
- Аликвоты 10 мкл раствора клетки в 0,65 мл микроцентрифужных трубки (дальнейшего разбавления может быть необходимо). Добавьте 10 мкл 0,4% трипанового синевы в 0,65 мл трубки микроцентрифужных и перемешать с помощью пипетки несколько раз. Для более подробной информации см руководство изготовителя 16.
- Пипеткой 10 мкл смеси в камеру счетной камере слайд и место скольжение в клеточную счетчика в течение 3 мин перемешивания. Увеличение и сосредоточиться клетки. Нажимать кнопку "Граф клеток", чтобы получить рассчитывать РВМС.
- Аликвоты, если жизнеспособностьКоличество РВМС выше 3 млн клеток на миллилитр (MC / мл), по желанию в криопробирки и перейти к шагу 3.9.9. Храните МНПК в срок до 5 криопробирки в концентрации не менее 3 тс / мл каждого.
- Если количество жизнеспособных РВМС ниже 3 MC / мл, рассчитать общее количество клеток путем умножения жизнеспособным MC / мл по 5 мл. Разделите это число на 4, 3, 2 или 1 мл, так что будет по крайней мере одна трубка с 3 тс / мл.
- Центрифуга коническую трубку, содержащую клетки / замерзания среды раствор в течение 5 мин при 300 х г (тормоза и ускорение OFF). После центрифугирования аспирата соответствующий объем морозильной среды (супернатанта), оставляя объем, рассчитанный выше (4, 3, 2 или 1 мл).
- Ресуспендируют осадок в оставшейся надосадочной жидкости и аликвоту по крайней мере, 3 MC / мл в соответствующее число криопробирки (1-4) со скоростью 1 мл / криопробирку. Заключительный замораживания среднего 10% диметилсульфоксида (ДМСО) / 20% фетальной бычьей сыворотки (FBS) / 70% Roswell Park Memorial институт (RPMI) 1 640.
- DocumЛОР число клеток на криопробирку. Передача криопробирки с контролируемой скоростью замораживания контейнер и поместить при -80 ° С в течение не менее 24 ч, после чего в криопробирки может быть передано cryobox и поставить в жидкостном резервуаре азота (парофазного) для длительного хранения. Морозильник Документ время начала.
4. День 2 Настройка
- Тепло аликвоту (220 мкл на фильтре) нуклеазы свободной 0,1 мМ ЭДТА в нуклеазы без трубки до 80 ° С в нагревательный блок.
- Приготовьтесь промывные растворы 1 и 2 (см SI 2).
5. День 2: Долговременное хранение образцов и лейкоцитов Фильтр обработка (3 ч)
- Обзор.
- Выполните эту процедуру в течение 6 месяцев применения лейкоцитов в фильтре.
Примечание: В целом, день 2 обработки занимает около 3 ч и в то время он помечен "День 2", ключевым требованием является то, что часть обработки фильтра должна быть выполнена в день, когданет день 1 обработки происходит в лаборатории.
- Выполните эту процедуру в течение 6 месяцев применения лейкоцитов в фильтре.
- Длительное хранение образца (15 мин)
- Выполните эту процедуру каждый день, до поставки новых vacutainers в лабораторию для обработки 1 день. Передача криопробирки, которые были сохранены O / N в контролируемых контейнеров ставка замораживания на 1 день в надлежащим образом маркированных cryoboxes и вернуть их в -80 ° С или жидким азотом (паровой фазы) для длительного хранения. Организуйте криопробирки в зависимости от типа образца (например, ДНК, эритроцитов, РВМС и т.д.), чтобы ускорить образец расположение слежения за конечных анализов.
- Лейкоцитов РНК Фильтры Обработка (45 мин).
Примечание: Для получения дополнительной информации по данной процедуре смотрите инструкцию 17 производителя.- Принесите фильтр для РТ (оттаивания около 5 мин).
- Снимите оболочку и винтовой крышкой из фильтра. Уберите поршень 5 мл шприц и подключите его к входу (вспыхнул конец) фильтра, нажмите на поршеньвысылать стабилизации РНК агента из фильтра портов в контейнер биологических отходов.
- Загружает новый шприц 5 мл с 4 мл фенола и гуанидинизотиоцианата раствора для выделения РНК и прикрепить ее к входу фильтра, нажмите на поршень, чтобы смыть раствор через фильтр, собирая лизата в меченого 15 мл коническую пробирку (2 на каждого участника).
- Отключите шприц из фильтра, убрать поршень, повторно прикрепить его к фильтру, и нажмите на поршень, чтобы изгнать остаточного образца попадает в фильтр диска в те же 15 мл коническую трубку. Откажитесь фильтр и шприц.
- Добавить 800 мкл BCP в конической трубе, закрыть трубу плотно и интенсивно встряхнуть преп течение 30 сек.
- Инкубируют при комнатной температуре в течение 5 мин. Центрифуга в течение 10 мин при 2000 х г в.
- Передача водный (вверху) фазы в свеже меченого 15 мл коническую пробирку (~ 2,5 мл).
- Добавить 0,5 раза объем водной фазы нуклеазы свободной воды апD хорошо перемешать. Затем добавить 1.25 водной объема 100% этанола, и снова перемешать.
Примечание: Для 2,5 мл водного объема, добавить 1,25 мл нуклеазы свободной воды, перемешать, а затем добавить 4,7 мл 100% этанола (2,5 мл х 0,5 = 1,25 мл нуклеазы свободной воды ТОГДА 2,5 мл + 1,25 мл = 3,75 мл новый водный объем ТОГДА 3,75 мл х 1,25 = 4,7 мл 100% этанола). Этот шаг позволяет изолировать общей РНК, который включает небольшое РНК фракции. Метод, чтобы опустить малые РНК из изоляции можно найти в руководстве 17. - Снимите поршень от 5 мл шприц и вставить картридж в спин на месте. Прикрепите картриджа / шприца с вакуумным коллектором. Для более безопасного подключения к вакуумным коллектором, поместите картридж / шприца внутри 1,5 мл микроцентрифужных трубка с нижней отрезать.
- Нанесите образец с шага 5.3.8 к спиновой картриджа медленно с вакуумом, внимательно добавляя больше образца, как это тянут через картридж.
Примечание: Если вакуум не являетсяНастоящий см методом центрифугирования на http://www.ambion.com/techlib/misc/leuko_iso.pdf. - Перенести спин-картридж на 1,5 мл микроцентрифужных пробирку и добавляют 750 мкл промывочного 1. Центрифуга спин картридж / сборки трубка 5 - 10 сек при 12000 х г.
- Отменить фильтрата из трубки и возврата спин картридж с аналогичным микроцентрифужных трубки.
- Добавить 750 мкл промывочного 2 и центрифугой спин картриджа / трубки для 5 - 10 сек при 12000 х г. Откажитесь фильтрата, как в шаге 5.3.12. Вернуться спин картридж в той же трубки микроцентрифужных.
- Повторите с другой 750 мкл промывочного 2 и центрифугирования, как в шаге 5.3.13. Отменить фильтрат. Вернуться спин картридж в той же трубки микроцентрифужных. Центрифуга спин картриджа / трубки на максимальной скорости в течение 1 мин, чтобы высушить фильтр.
- Перенести спин картридж свежий, помечены 1,5 мкл микроцентрифужную трубку.
- Добавить 200 мкл нуклеазы 0,1 мМ ЭДТА (предварительно нагретый до 80 & #176; С) до центра фильтра спин картриджа (2 на каждого участника). Выдержите при комнатной температуре в течение 1 мин.
- Центрифуга в течение 1 мин при 12000 х г, чтобы элюировать РНК. Сохраните фильтрат. Откажитесь отжима картриджа.
- Сплит каждый 200 мкл фильтрата на два, 100 мкл аликвоты в 1,5 мл свежей микропробирок, этикетки и держать на льду. В этот момент, начиная с 2 фильтрами каждого участника будет давать четыре 100 мкл аликвоты РНК одного участника.
- ДНКазы лечение (1 час)
Примечание: Для получения более подробно о данном лечении см протокол производителя 18.- Создать мастер микс, комбинируя 10 мкл ДНКазы I буфера и 2 мкл rDNase я за аликвоты + 1 (для учета пипетки ошибку).
Примечание: Для четырех образцов, 100 мкл аликвоты использовать 50 мкл ДНКазы I буфера + 10 мкл rDNase I. - Алиготе 12 мкл мастер смеси на стадии 5.4.1 в каждом из РНК аликвот от стадии 5.3.18 и аккуратно перемешать. Выдержите в 37° C в течение 30 мин в нагревательный блок.
- Vortex ДНКазы Инактивация реагент и добавить 11,2 мкл в каждую аликвоту, хорошо перемешать. Инкубируют при комнатной температуре в течение 2 мин вортексе 2-3 раза во время инкубации.
- Центрифуга при 10000 мкг в течение 1,5 мин.
- Передача супернатант (РНК) в чистую пробирку 1,5 мл. Помещенные в одного участника может быть объединены здесь.
- Запуск каждого образца на спектрофотометре, чтобы получить концентрацию. Качество анализ РНК рекомендуется пользоваться Bioanalyzer (см шаг 5,5).
- Алиготе РНК в криопробирки по желанию. Если анализ Bioanalyzer не будет выполнено немедленно, аликвоту 1,5 мкл образца в пробирку микроцентрифужных для последующего анализа. Документ концентрации и время начала морозильник. Храните образцы при -80 ° C.
- Создать мастер микс, комбинируя 10 мкл ДНКазы I буфера и 2 мкл rDNase я за аликвоты + 1 (для учета пипетки ошибку).
- Bioanalyzer анализ (1 час)
- Следуйте протокол производителя 19. Когда пробег завершена, данные автоматически сохраняются, но сохранить его еще раз шIth меньшие, более узнаваемым именем файла. Ожидаемые результаты (рисунок 3): лестница должна иметь 6 пики, образцы должны иметь 3 пики (2 рибосомных пики при 44 сек и 50 сек, соответственно и 1 в начале пика маркера на 25 сек).
Результаты
Важно, чтобы общая процедура получения высококачественного материала для анализа в разнообразных последующих применений, включая генной экспрессии через микрочипов и анализа RT-PCR, определение эпигенетических модификаций и вариаций клеток подмножества. Таблица 1 показывает средний выход и качество материалов от каждого из процессов. Рисунок 3 представляет собой пример качества продукции из изоляции лейкоцитов РНК и фильтров методов обработки. Изображение на верхнем левом рисунке 3 это образ гель в результате капиллярного электрофореза. Каждая дорожка должна производить два разных полос с минимальным слежки, которая будет указывать деградации. Хроматограммы ниже геля обеспечивают дополнительный смотреть на уровень и тип деградации, который может быть определен на основе местоположения и размера пиков. РНК Целостность номер (РИН) является еще одним показателем качества, который колеблется от 1 (низкая; деградирует), чтобы10 (высокая; чистый, хорошее качество РНК).
Такая методология высокую пропускную способность поддается случайной ошибки, но есть несколько контрольно-пропускных пунктов на различных этапах обработки для обеспечения контроля качества. Рисунок 2 отображает надлежащее разделение следующее центрифугирования, содержащего Vacutainer фиколла. Есть несколько причин, Vacutainer могут не отображать это разделение в том числе ошибки в скорости центрифугирования, низкий объем сбора, или отсутствие участника натощак, как указано в таблице 2.
Подмножества (п = 100) образцов, выделенных с помощью этой процедуры были проанализированы с успехом HumanMethylation27 (HM27) анализ ДНК BeadChips в том числе проверки этих результатов по пиросеквенирования 11. Генотипирование, целевые бисульфит Пиросеквенирование, и в режиме реального времени RT-PCR была успешно выполнена в Wildman и Уддин лаборатории 20,21,22,23. Сыворотка, изолированных в парАллель с выделением ДНК, как Beadchip и генотипирования анализирует, успешно проанализированы на IL-6 и С-реактивного белка 24 деятельности. Т-клеточные подмножества из изолированных МКПК были успешно проанализированы с помощью проточной цитометрии 25-28. Кроме того, РНК из модифицированной методике лейкоцитов был подвергнут геном Wide экспрессию генов профилирования 29.
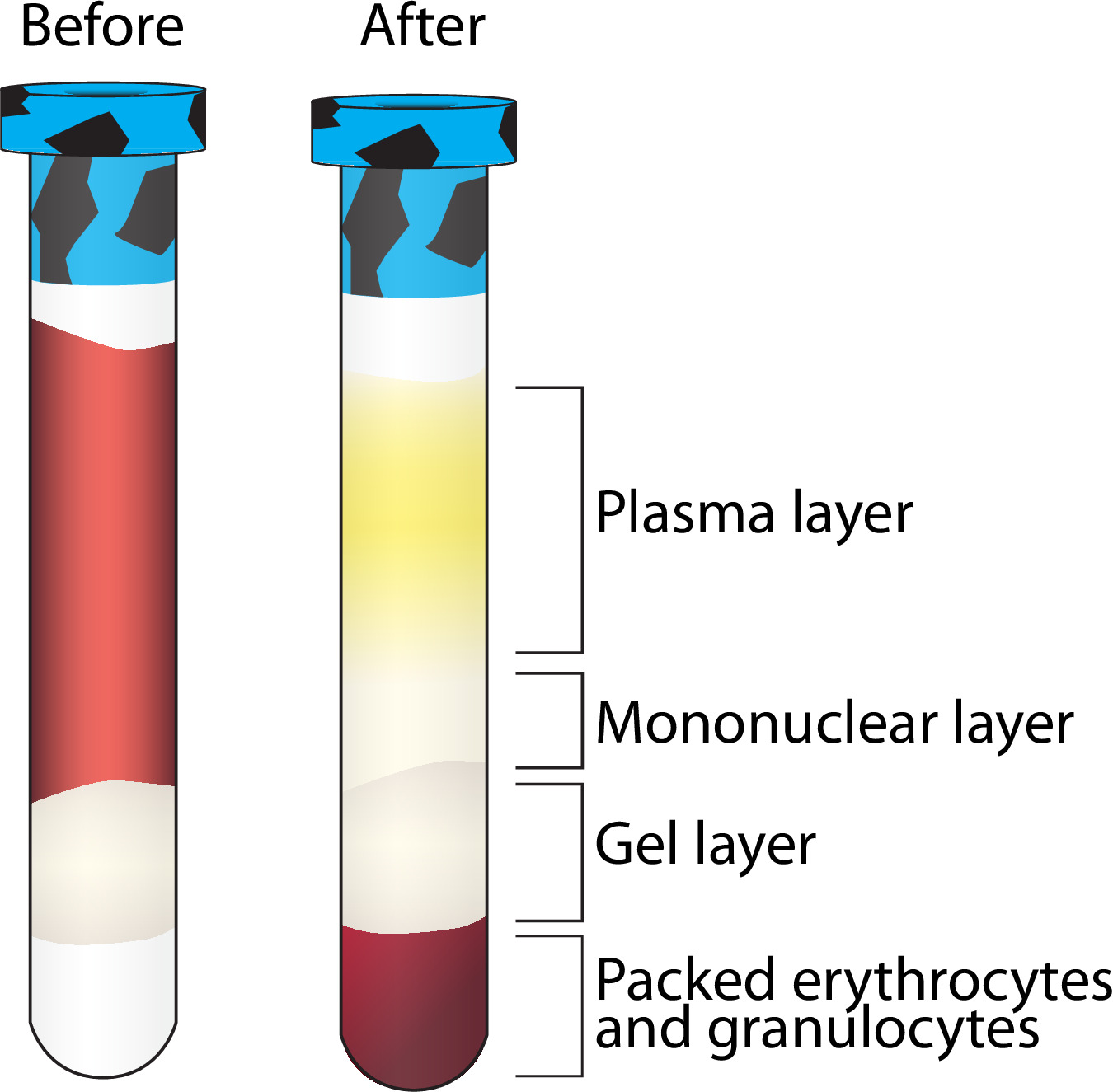
Рисунок 2. Разделительный слой после центрифугирования, содержащего фиколла Vacutainer. Визуализация разделения нескольких компонентов крови после центрифугирования. Мононуклеарных слой дополнительно очищают в то время как другие слои сохраняются при -80 ° С. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3. Ожидаемые результаты от обработки лейкоцитов РНК. Результаты Bioanalyzer отображение двух различных диапазонов, представляющих 18S рибосомальной 28S и РНК с номерами целостности РНК (Rins) выше 8 изолированных с методами для выделения РНК описано лейкоцитов и фильтр обработки (см протокол 3.6 и 5.3). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Всего средняя урожайность (N≈500) | Среднее качество | |
| Сыворотка | 2.30 мл | N / A |
| ДНК из цельной крови | 39.97 мкг | Поглощение при 260/280 = 1,74 |
| РВМС | 22.25 млн жизнеспособных клеток | Не менее 95% общей жизнеспособности изоляции |
| РНК из лейкоцитов | 44.09 мкг | Поглощение при 260/280 = 2.01 РНК Целостность номер (РИН) = 6,48 |
Таблица 1. Ожидаемая доходность. Среднее количество и качество образцов обрабатываются с помощью описанных методов.
| Проблема | Потенциальное решение |
| Нет разделения после фиколла содержащей Vacutainer центрифугирования | Vacutainer не заполнен до отказа - минимальный объем коллекция для адекватного обработки 6 мл. |
| Проверьте настройки центрифуг, убедитесь, что скорость в G-Force. Если неправильно, установите г-силы и Respin. | |
| Низкий РВМС соЕНТ | Объем крови обратить слишком низко. |
| Придыханием слишком близко к осадку в шаге 3.7.8 | |
| Номера пост участником. | |
| Нет разделения сыворотки после центрифугирования Vacutainer | Проверьте настройки центрифуг, убедитесь, что скорость в G-Force. Если неправильно, установите г-силы и Respin. |
| Неожиданный концентрация помощью NanoDrop 1000 | Убедитесь, что измерения для соответствующего типа образца (например, ДНК или РНК). |
Таблица 2. Устранение неполадок. Общие проблемы, связанные с описанных способов и возможных решений.

Дополнительное Таблица 1. Отслеживание лист. Пример отслеживания vacutainers сюдам сбор крови лабораторных доставки. Пожалуйста, нажмите здесь, чтобы посмотреть эту таблицу.
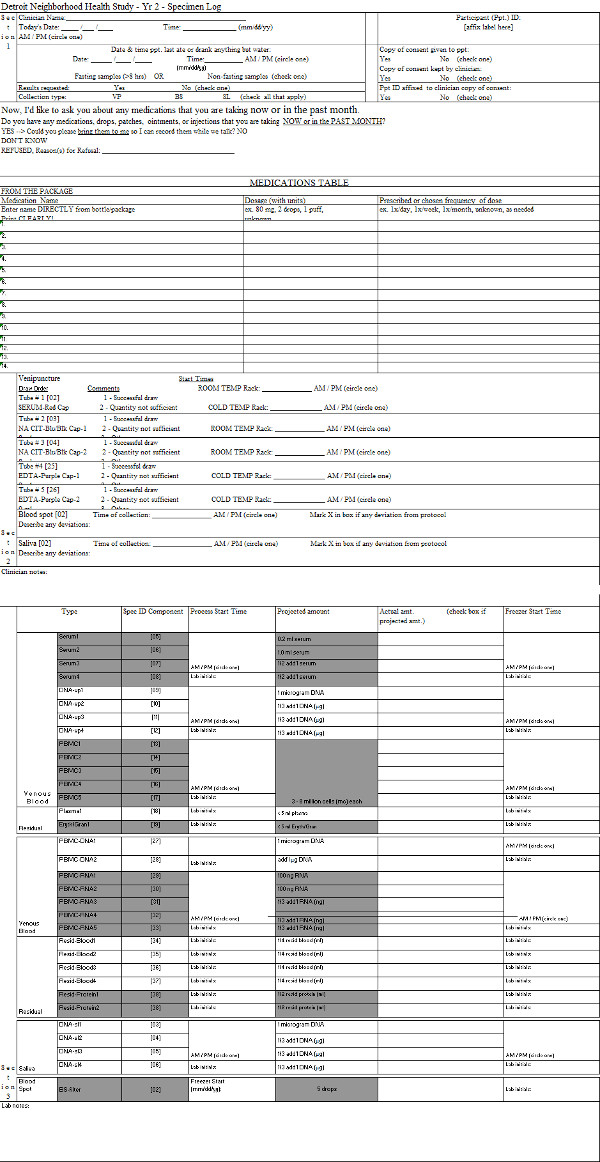
Дополнительное Таблица 2. Образец журнала. Пример документа, используемого для документирования обработку vacutainers после доставки в лабораторию. Пожалуйста, нажмите здесь, чтобы посмотреть эту таблицу.

Дополнительное Таблица 3. криопробирку система нумерации. Пример системы нумерации, используемой для каждого участника. Пожалуйста, нажмите здесь, чтобы посмотреть эту таблицу.
Дополнительная информация 1. Предварительная обработка детали. Детали обязанности Координатора Исследовательской, Courier и Phlebotomist. Пожалуйста, нажмите здесь, чтобы посмотреть дополнительную информацию 1.

Дополнительная информация 2. Рецепты. Список рецептов для необходимых реагентов. Пожалуйста, нажмите здесь, чтобы посмотреть дополнительную информацию 2.
Обсуждение
Мы описали обтекаемый протокол, который был успешно применен для обработки более 1600 образцов цельной крови в Health Study Детройт соседства. Хотя многие из этих методов имеются в существующей литературе, наш шаг за шагом компиляции, в том числе именно приуроченных изменений между каждым шагом, отражает оптимизированная эффективный протокол, успешно производит различные биологические образцы с широким диапазоном вниз по течению приложений, в том числе метилирования ДНК, мРНК и выражения иммунологической анализа. Эти образцы уже были испытаны в различных экспериментах, результаты которых были опубликованы в рецензируемых изданиях и / или представленных на национальных собраниях 11,20,21,23,24,29. Этот протокол должен, таким образом, представляет интерес для исследователей, стремящихся других, чтобы собрать биологических образцов популяционных исследованиях, подобных DNHS.
При обработке проб таким высоким throughpут образом, это имеет первостепенное значение для поддержания точных записей на всех этапах. Мы рекомендуем разработке базы данных для хранения всех криопробирку информации с самого начала. Эта база данных должна включать в себя все аспекты образца в каждой криопробирку в том числе объем, концентрация, качество, штрих-код, и место хранения (хранение ящик номер и расположение в коробке). Мы рекомендуем подготовке предварительного меченные криопробирки и ящики для хранения, которые содержат штрих-код. Кроме того, мы обнаружили, что удобно иметь "мастер" документ, содержащий штрих-кодов для каждой трубки, специфические для каждого участника (табл S3). Это позволяет быстро вводить в криопробирку данных в базу данных без чрезмерного обработки образцов, представляя ненужные циклы замораживания / оттаивания образцов, чтобы и исключает возможность ошибки человека в выходе в штрих-кодов вручную. Важно также, что этикетки придерживаться в крайности (например, в паровой фазе жидкого азота -178 до -150° C) температуры. В документации может быть трудоемким и с необходимостью эффективной обработки при доставке, мы обнаружили, что по меньшей мере с двумя техники разделить процессы производит наибольшую эффективность.
Ограничением этого способа является близость лаборатории до места сбора. Для выделения МКПК, в частности, образцы должны быть обработаны в течение 2 ч сбора, чтобы избежать значительного увеличения загрязнения эритроцитов и уменьшается в жизнеспособных мононуклеарных клеток. Таким образом, лаборатория должна быть не более 30 мин от места сбора к ответственности за любые движения, связанные с вопросами, которые могут возникнуть. Кроме того, в любой лаборатории предлагают провести протокол, описанной здесь потребуется два технических под рукой, чтобы обеспечить оптимальную обработку образца. Кроме того, каждая лаборатория должна иметь доступ к необходимым оборудованием для каждого шага, описанной выше. Таким образом, лаборатории с меньшим количеством персонала и / или ограниченного оборудования жульд вероятно, будет не в состоянии провести этот протокол.
Преимущество этого протокола является возможность отбирать пробы непосредственно в домах отдельных лиц согласию. Это позволяет изучать, чтобы достичь лиц по вопросам психического здоровья или другие, которые, как правило, не обращаются за медицинской помощью, возможно, из-за отсутствия страхования или транспортировки. Это также позволяет сравнение пострадавших и не пострадавших людей, живущих в той же общины, которые испытали подобные триггеры, но отличаются с точки зрения их симптомов психического здоровья. Получение образцов таким образом, требует точного времени и координации Phlebotomists в области. Потому что наша лаборатория находится в рамках сообщества мы изучали, А Phlebotomist может, как правило, собирают образцы из двух-трех домов, и доставить образцы в лабораторию в окне 2 ч первой коллекции. Эффективность является ключом к нашей обработки образца, и, таким образом, у нас было несколько Phlebotomists вПоле, увеличивает потребность в точном координации. Лаборатория получила несколько поставок крови до восьми участников в поставке расстоянии 2 ч друг от друга. В Phlebotomists встретились в назначенном месте и в сочетании их коллекции только с одним Phlebotomist доставки образцов в лабораторию в одном пакете. Способы, описанные здесь, могут быть легко адаптированы для изучения многих других фенотипов и биологических образцов, собранных может быть использован во множестве последующих анализов.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие интересы.
Благодарности
We would like to thank Henriette Mair-Meijers for invaluable attention to detail and hours devoted to processing the blood collections. We are grateful for the graphic design expertise of Natalie Jameson Kiesling. We also appreciate the approval of the manufacturers (Qiagen (Valencia, CA), BD Biosciences (San Jose, CA), Life Technologies (Grand Island, NY)) mentioned herein to publish the use of their products as described. Funding for this work was generously provided by the National Institutes of Health award numbers DA022720, RC1MH088283, and DA022720-05-S1.
Материалы
| Name | Company | Catalog Number | Comments |
| QIAamp DNA Blood Mini Kit | Qiagen | 51104 | Day 1: DNA isolation |
| Phosphate-buffered saline (PBS) | Sigma | P5493-1L | Day 1: PBMC isolation |
| 5 ¾” Pasteur pipets | Fisher | 13-678-6A | Day 1: PBMC isolation |
| Fetal Bovine Serum (FBS), heat inactivated | Life Technologies | 10082147 | Day 1: PBMC isolation |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418-500ml | Day 1: PBMC isolation |
| RPMI Medium 1640, liquid | Invitrogen | 11875119 | Day 1: PBMC isolation |
| 0.4% trypan blue stain | Invitrogen | T10282 | Day 1: PBMC isolation |
| Countess Cell Counting Chamber | Invitrogen | C10283 | Day 1: PBMC isolation |
| Countess Automated Cell Counter or cell counting device such as a microscope and hemocytometer | Invitrogen | C10281 | Day 1: PBMC isolation |
| LeukoLOCK Fractionation & Stabilization Kit | Ambion | 1933 | Day 1: Leukocyte RNA isolation |
| 25 G x 5/8 in. needles | Becton Dickinson | 305122 | Day 1: Leukocyte RNA isolation |
| Syringes (5 ml) | Becton Dickinson | 309646 | Days 1 and 2: Leukocyte RNA isolation |
| Denaturing Lysis Solution | Ambion | 8540G | Day 2: Leukocyte RNA isolation |
| 5 M NaCl | Life Technologies | 24740011 | Day 2: Leukocyte RNA isolation |
| TRI Reagent | Ambion | 9738 | Day 2: Leukocyte RNA isolation |
| Bromo-3-chloro-propane (BCP) | Sigma | B-9673 | Day 2: Leukocyte RNA isolation |
| spin cartridges | Ambion | 10051G | Day 2: Leukocyte RNA isolation |
| 0.1 mM EDTA | Ambion | 9912 | Day 2: Leukocyte RNA isolation |
| DNA-free Kit | Ambion | AM1960 | Day 2: DNase treament |
| RNA 6000 Ladder | Agilent | 5067-1529 | Day 2: Bioanalyzer analysis |
| RNA 6000 Nano Series II Kit | Agilent | 5067-1511 | Day 2: Bioanalyzer analysis |
| RNaseZAP | Ambion | AM8782 | Day 2: Bioanalyzer analysis |
| Ethanol >99% | Sigma | E7023-500ml | |
| Isopropanol >99% | Sigma | I9516-500ml | |
| Nuclease-free ultra pure water | Invitrogen | 9938 | |
| Pipette tips (nuclease-free) | Eppendorf | 22491253 | |
| Pipetter (serological) | Eppendorf | 2223020-4 | |
| Pipetters (for volumes under 1 ml) | Eppendorf | 3120000-054 | |
| Pipettes (serological) | Fisher | 13-678-27E | |
| Controlled rate freezing containers | Nalgene | 5100-0001 | |
| Cryoboxes (to hold 2 ml and 5 ml cryovials and 1.5 ml microcentrifuge tubes) | Fisher | 03-395-464 | |
| Test tube rack | Thermo Scientific | 14-804-134 | |
| 15 ml polypropylene tubes | Fisher | 14-959-49D | |
| 1.5 ml and 0.65 microcentrifuge tubes | Fisher | 07-200-534 and 07-200-185 | |
| 2 ml and 5 ml cryovials | Fisher | 10-500-26 and 10-269-88F | |
| 8 ml CPT vacutainer | BD Biosciences | 362761 | 2 tubes |
| 6 ml K2 EDTA vacutainer | BD Biosciences | 367863 | 2 tubes |
| 8.5 ml SST vacutainer | BD Biosciences | 367988 | 1 tube |
| Vortexer | Fisher | 2215365 | |
| Dry bath incubator with heating block for microcentrifuge tubes | Fisher | 11-715-1250 | |
| Filtration/vacuum system for use within the cell culture hood | Fisher | 01-257-87 | |
| Fixed-angle rotor for microcentrifuge tubes with aerosol-tight lid | Eppendorf | 22637002 | |
| Refrigerated centrifuge with a swing-bucket rotor and aerosol-tight caps for 16 x 125 mm vacutainers and 15 ml polypropylene tubes | Eppendorf | 22628157 | 2, one does not need to be refrigerated |
| Nanodrop 2000 (recommended for accuracy of small volumes) or other spectrophotometric device | Fisher | 13-400-411 | |
| Agilent Bioanalyzer | Agilent Technologies | G2940CA | |
| Liquid nitrogen tank | Thermo Scientific | 11-676-56 | |
| Sharps container | Fisher | 22-037-970 | |
| Biological waste container | Thermo Scientific | 1223P52 | |
| Biosafety Level 2 certified cell culture hood | Thermo Scientific | 13-261-315 |
Ссылки
- Hernandez, M. E., Martinez-Fong, D., Perez-Tapia, M., Estrada-Garcia, I., Estrada-Parra, S., Pavon, L. Evaluation of the effect of selective serotonin-reuptake inhibitors on lymphocyte subsets in patients with a major depressive disorder. Eur Neuropsychopharmacol. 20, 88-95 (2010).
- Weigelt, K., et al. TREM-1 and DAP12 expression in monocytes of patients with severe psychiatric disorders EGR3, ATF3 and PU.1 as important transcription factors. Brain Behav Immun. 25, 1162-1169 (2011).
- Robertson, M. J., et al. Lymphocyte subset differences in patients with chronic fatigue syndrome, multiple sclerosis and major depression. Clin Exp Immunol. 141, 326-332 (2005).
- Rotter, A., Asemann, R., Decker, A., Kornhuber, J., Biermann, T. Orexin expression and promoter-methylation in peripheral blood of patients suffering from major depressive disorder. J Affect Disord. 131, 186-192 (2011).
- Klengel, T., et al. Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nat Neurosci. 16, 33-41 (2013).
- Segman, R. H., Shefi, N., Goltser-Dubner, T., Friedman, N., Kaminski, N., Shalev, A. Y. Peripheral blood mononuclear cell gene expression profiles identify emergent post-traumatic stress disorder among trauma survivors. Mol Psychiatry. 10, 500-513 (2005).
- Smith, B. H., et al. Cohort Profile: Generation Scotland: Scottish Family Health Study (GS:SFHS). The study, its participants and their potential for genetic research on health and illness. Int J Epidemiol. 42, 689-700 (2013).
- Mallone, R., et al. Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive T cell responses: position statement of the T-Cell Workshop Committee of the Immunology of Diabetes Society. Clin Exp Immunol. 163, 33-49 (2011).
- Duvigneau, J. C., Hartl, R. T., Teinfalt, M., Gemeiner, M. Delay in processing porcine whole blood affects cytokine expression. J Immunol Methods. 272, 11-21 (2003).
- Debey, S., et al. Comparison of different isolation techniques prior gene expression profiling of blood derived cells: impact on physiological responses, on overall expression and the role of different cell types. Pharmacogenomics J. 4, 193-207 (2004).
- Uddin, M., et al. Epigenetic and immune function profiles associated with posttraumatic stress disorder. Proc Natl Acad Sci U S A. 107, 9470-9475 (2010).
- Kessler, R. C., Wang, P. S. The descriptive epidemiology of commonly occurring mental disorders in the United States. Annu Rev Public Health. 29, 115-129 (2008).
- . QIAamp® DNA Mini and Blood Mini Handbook Available from: https://www.qiagen.com/us/resources/resourcedetail?id=67893a91-946f-49b5-8033-394fa5d752ea (2010)
- Koenen, K. C., et al. SLC6A4 methylation modifies the effect of the number of traumatic events on risk for posttraumatic stress disorder. Depress Anxiety. 28, 639-647 (2011).
- Walsh, K., Uddin, M., Soliven, R., Wildman, D. E., Bradley, B. Associations between the SS variant of 5-HTTLPR and PTSD among adults with histories of childhood emotional abuse: Results from two African American independent samples. J Affect Disord. 161, 91-96 (2014).
- Bustamante, A. C., et al. Childhood maltreatment is associated with epigenetic differences in hypothalamic-pituitary-adrenal (HPA) axis genes in the Detroit Neighborhood Health Study. , (2013).
- Sipahi, L., et al. Longitudinal epigenetic variation of DNA methyltransferase genes is associated with vulnerability to post-traumatic stress disorder. Psychol Med. 44, 3165-3179 (2014).
- Uddin, M., Koenen, K. C., Aiello, A. E., Wildman, D., de los Santos, R., Galea, S. Epigenetic and inflammatory marker profiles associated with depression in a community-based epidemiologic sample. Psychol Med. 41, 997-1007 (2011).
- Uddin, M., et al. Post-traumatic stress disorder is associated with immunosenescent T cell phenotypes in the Detroit Neighborhood Health Study. , (2011).
- Uddin, M., et al. Post-traumatic stress disorder is associated with immunosenescent T cell phenotypes in the Detroit Neighborhood Health Study. , (2011).
- Uddin, M. Biological signatures of post-traumatic stress disorder in the Detroit Neighborhood Health Study. , (2010).
- Aiello, A. E. Cytomegalovirus antibodies as a marker of immunosenescence in the Detroit Neighborhood Health Study. , (2010).
- Bustamante, A. C., et al. . Distinct gene expression profiles characterize lifetime PTSD and childhood maltreatment in the Detroit Neighborhood Health Study. , (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены