Method Article
迅速な分別とコミュニティベースの設定から得られた試料中の全血液成分の単離
要約
We outline a methodology for the processing of whole blood to obtain a variety of components for further analysis. We have optimized a streamlined protocol that enables rapid, high-throughput simultaneous processing of whole blood samples in a non-clinical setting.
要約
非臨床現場で収集し、全血サンプルの処理が持つと既存の条件なしの両方の地域在住の個人を評価するユニークな機会を提供しています。これらの試料の迅速な処理は、重要な細胞成分の分解を回避することが不可欠です。同時に末梢血単核細胞(PBMC)、DNAのための方法がここに含まれるものは、RNAおよび処理と首都圏全体での参加を同意の家で行われ、単一の採血から血清分離は、コレクションの2時間以内に開始しました。我々は、その後、成功したDNAのメチル化に使用されている一貫した、高品質の材料、遺伝子型決定、遺伝子発現をもたらす1,600血液検体を処理し、フローサイトメトリー分析を流れるようにこれらの技術を使用しています。採用される方法のいくつかは、標準的なものです。以下のように組み合わされたときしかし、それらは母集団および/または地域社会の参加者からのサンプルの効率的な処理を可能にします通常、臨床現場で評価されないベースの研究。したがって、このプロトコルは、一般集団のより代表的なものである(その後、データ)サンプルを得る可能性を秘めています。
概要
複数の研究が持つと精神(または他の)1-4病気ない個体間の血液中の遺伝子発現、DNAメチル化及び細胞サブセットの違いを特徴としています。これらの研究は、しかしながら、疾患関連の差異が原因で患者が治療を求めている病気の一般的に、より深刻に拡大することができる、臨床現場から得られました。 「オミクス」のアプローチの進歩に、過去十年間は、疾患の有病率の集団ベースの推定値を提供するために、コミュニティおよび/ または疫学的設定5-7からの生物学的サンプルを得ることに興味の爆発とのより広範な絵を見ていますこれらの精神的および/または物理的な病気の環境的決定要因。
この点で重要な課題は、収集した検体の迅速な処理のための必要条件です。単核細胞、frequentlあるキー免疫系の成分の分解yは、個人の健康状態を評価するために使用、コレクション8-10の2時間後の回復の有意な減少と血液採取直後に開始されます。この課題に対処するために、我々は、ヒト全血の複数のコンポーネントを同時に大都市圏に住んでいる被験者の家庭で得られた試料から分離されている最適化されたプロトコルを提示します。プロトコルは、将来の技術をさらに分離/分析を可能とするイベント内のすべての "余分な"画分のストレージを含む現在の技術、当社の編集や変更に基づいています。代替方法またはキットは、ここで説明する個々のメソッドの代わりに使用することができるが、概説したものは、ハイスループット様式で処理試料の信頼性が高く効率的な手段であることが証明されています。新鮮な血液の高品質の分画(PBMCを、DNA、血清、およびRNA)は、コレクションの2時間以内に製造することができ、すべての分析に対応した標本は2日以内に利用可能である( 図1)。
、集団ベース;このプロトコルは、デトロイト近所健康調査(DA022720、RC1MH088283、DA022720-05-S1 DNHS)にテストのためにデトロイトの街の地域在住、大人の住民から採取したサンプルの効率的な処理を可能にするために開発されました心的外傷後ストレス障害(PTSD)の社会的および生物学的決定要因やその他の精神疾患の研究。デトロイトのPTSDの有病率は倍以上の全国平均11,12です。この集団では、PTSDの生物学的決定因子を同定することは、この都市人口で、その他の高リスク集団(例えば、退役軍人を返す)の両方で、障害で苦しむ人々を支援するための適切な薬理学的および/ または認知行動的介入を開発するのを助けることができます。以前にデトロイト、ミシガン州のウェイン州立大学にある研究室では、様々な由来の新鮮な組織サンプルを取り扱うのノウハウに基づいて、処理のために選択されましたソースの、必要性は、コレクションの2時間以内にサンプルを処理を開始し、回収サイトへの私たちの近接。手元にこのユニークな機会を、我々の目標は、各試料からのDNA、RNA、血清および末梢血単核細胞(PBMC)の最大収率(試料採取の5波以上N = 1639サンプルの合計)のための処理を最適化することでした。ここで説明した手順は、このように、マイクロアレイなどの下流のアプリケーションの多数の出発材料(平均収率は 、表1を参照)、エピジェネティックな、リアルタイムRT-PCRを製造する、非臨床環境で同時に実行され、フローサイトメトリー分析を流すことができます。
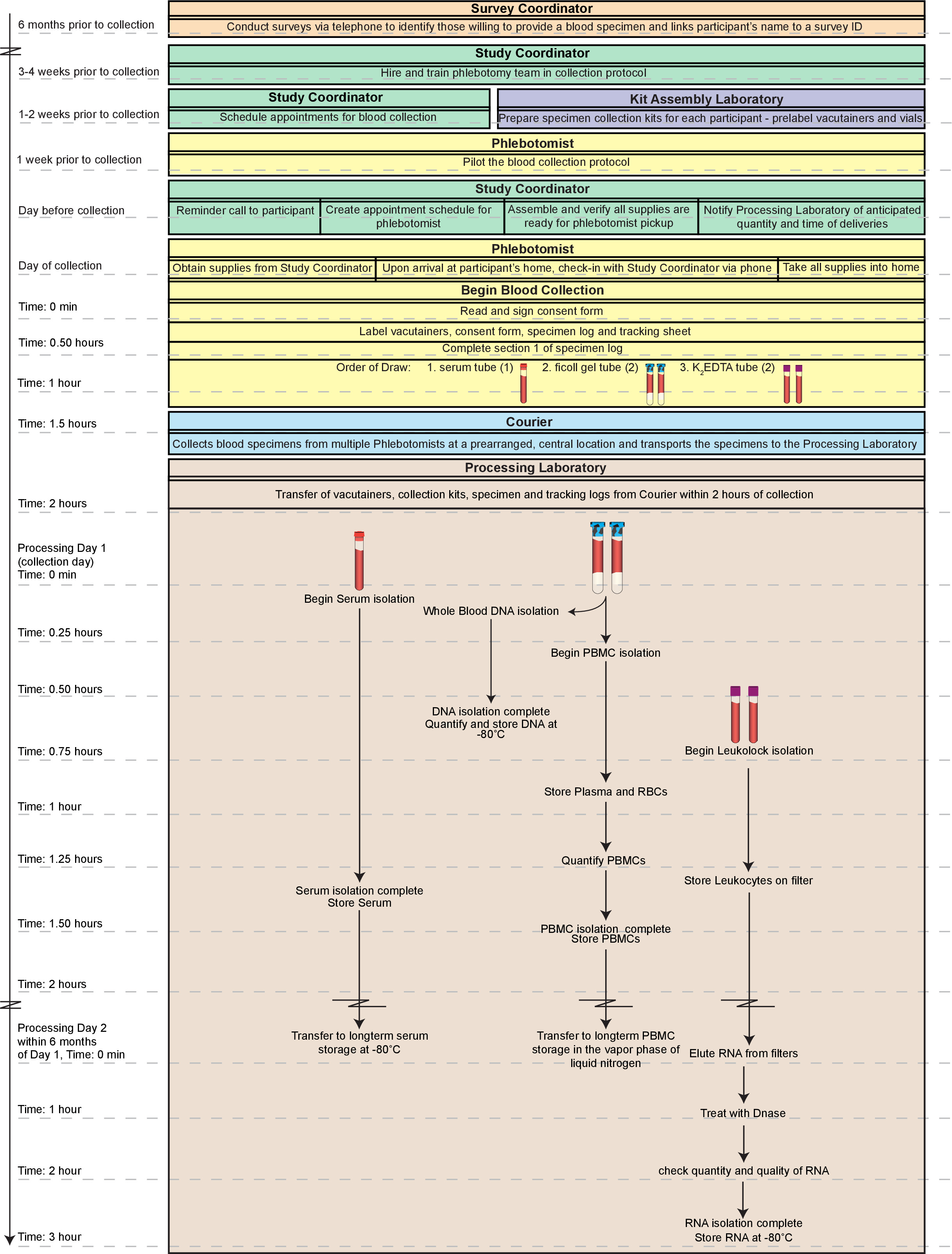
図1.全体的な作業の流れ。ここに描かれ、全体のプロセスは同意気難しいを識別するから血液検体を得るための物流を含み採血自体にipants。高品質の、画分(末梢血単核細胞; PBMCを、DNA、血清、及びRNA)新鮮な全血の収集の2時間以内に製造することができ、全てのアッセイ対応標本は2日以内に使用可能であることができます。試料を直ちに試験することがないようにしている場合はさらに、この方法によって調製画分を、長期保存に適しています。ここで説明するタイムライン全体を一日(〜5時間の合計)で完了することができました。しかし、そのような日は、特に技術と豊富な経験を持つ単一の技術者のために非常に労働集約的であろう。したがって、我々は、少なくとも二つの技術の間に1日目の手順を分割し、2日目に、RNA処理を完了したお勧めします。この図の拡大版をご覧になるにはこちらをクリックしてください。
プロトコル
デトロイト近所健康調査を見直し、ミシガン州の施設内倫理委員会の大学によって承認されました。すべての参加者は事前の研究への参加にインフォームドコンセントを提供しました。
1.概要
- 適切エンドポイントデータの分析を通じて募集のすべての段階を文書化します。時間が許す限りのステージと重なりを切り替え、同時に1日目のプロトコルを実行します。段階のシーケンスは、性能効率を最適化するために書かれている。 図1は全体のプロセスの概要を提供します。
注:用語、「参加者は「同意個体から引き出される匿名化血液サンプルを示すために全体を通して使用されます。カッコ内の時間は、以下のハンズオンタイムを示しています。追跡シートと試料ログの例は、それぞれ、 補足表S1及びS2に見出すことができます。サンプルは、家庭でphlebotomistsによって収集され、個人の研究コーディネーターによって同意参加者として識別され、(さらに前処理の詳細を補足情報(SI)1を参照)宅配便で研究所に輸送。
2. 1日目のセットアップ
- 1×リン酸緩衝生理食塩水(PBS)を準備します。
- 56ºCにヒートブロックを予熱。
- 当日の配達(参加者あたり2)用のマイクロ遠心チューブの適切な数に20μlずつ小分けすることによって、プロテアーゼを(SI 2を参照)を用意します。
- ラベルに示されているように、必要であれば、100%のエタノールを加え、緩衝液AW1およびAW2(DNAの純度を高めるDNA単離キットに付属の洗浄緩衝液)が使用可能な状態であることを確認してください。
- 4℃に冷却遠心機をクールダウン。
- 提供ゴム製セプタムキャップで1×PBSのボトルのキャップを交換して、転送スパイクとゴム隔壁を貫通、転送SPIの上にスクリューキャップを保持蒸発を防ぐために、KE。 RNAの安定化溶液のボトルを繰り返します。
- バッファ、遠心分離し、熱ブロックの調製後、サンプル追跡シート上バキュテナー配達の時間を記録する( 表SIを参照してください )。
3. 1日目:DNA、PBMCおよび白血球RNAの処理全血試料(2時間)
- 概説
- 採血及び処理開始時間の間の遅延を最小化するのに十分な時間を割り当てます。赤血球の混入が増加し、単核細胞の回収率の低下を回避するために、採血の2時間以内にフィコール含むバキュテナーの処理を開始します。
- フィコールゲル勾配を含む2バキュテナー、2、K 2エチレンジアミン四酢酸(EDTA)バキュテイナー、および成人の参加者につき1血清バキュテナーのコレクションを想定しています。研究室へのバキュテナーの送達されると、技術者はサンプルのアクセプタンスを追跡シートに署名しています。頼みます試料ログのバキュテナーごとに文書化された開始時間ですぐに処理しました。
- 血清分離ステージ1(1分)
- 試料ログの開始時刻を文書化( 表SI 2を参照)。 (ブレーキと加速がOFFの状態で)遠心7.0ミリリットル血清(赤)バキュテナー(参加者1名につき1)エアゾールキャップ付きスイングバケットローターを用いて、(バイオセーフティーレベル2、BSL2が認定)20分、1300×gで、4ºCのため。
- DNA単離のステージ1(15分)
注:この分離手順の詳細については、製造業者のプロトコル13を参照してください 。- 開始時刻を文書化します。 BSL2細胞培養フードでは、その後、プロテアーゼの220μlのアリコート(参加者ごとに400μlの合計)のそれぞれにバキュテナーの1の上部から全血200μlを添加するフィコールゲルを5回を含むバキュテナーを反転。セントリに進み、フード内でプロテアーゼ+血のマイクロチューブを残しますステップ3.4.1でバキュテナーを含むフィコールのfugation。
注:心の中でステップ3.4.1でバキュテナーを回転するとき( すなわち、それは 2バキュテナーのそれぞれから200μLを除去する必要があります)遠心機のバランスをとる必要性を保ち、最大の収集量と真空採血を使用してください。さらに、青バキュテナーの処理中に適切な分離を確実にするために、バキュテナーに残っている血液のレベルは、フィコール層の上に未満2.5インチであってはなりません。
- 開始時刻を文書化します。 BSL2細胞培養フードでは、その後、プロテアーゼの220μlのアリコート(参加者ごとに400μlの合計)のそれぞれにバキュテナーの1の上部から全血200μlを添加するフィコールゲルを5回を含むバキュテナーを反転。セントリに進み、フード内でプロテアーゼ+血のマイクロチューブを残しますステップ3.4.1でバキュテナーを含むフィコールのfugation。
- PBMC単離のステージ1(1分)
- 開始時間を文書化バキュテナーに8-10回を含むフィコール.Invert(赤血球の混入が増加し、単核細胞の回収率の低下を回避するために、採血の2時間以内でなければなりません)。 (ブレーキとアクセルオフで)遠心30分、1,600×gで、22℃のためのエアゾールキャップ(BSL2認定)とスイングバケットローターを使用してバキュテナー(参加者あたり2)。
- DNA単離のステージ2(20分)
- フードに戻り、プロテアーゼ+血液マイクロ遠心チューブ(ステップ3.3.1)のそれぞれに200μlのBuffer ALを追加します。キャップは、ボンネットから渦15秒、フラッシュスピンを削除します。
- ヒートブロックで56ºC、10分インキュベートします。
- ヒートブロックからチューブを外します。軽くスピン。 BSL2フードに戻ります。 200μlの100%エタノールを追加します。キャップは、ボンネットから渦15秒、フラッシュスピンを削除します。残りのステップは、フードの外に完了することができます。
- (2 mlコレクションチューブ)ラベルされたスピンカラムに(ステップ3.5.3の30分以内)溶解液を適用します。エアロゾルを介し交差汚染を避けるためにキャップを閉じます。遠心6000×gで、1分。
- ろ液を含むコレクションチューブを捨てると新しい2 mlコレクションチューブにスピンカラムを置きます。
- 、縁を濡らさずにカラムに500μlのBuffer AW1を添加するキャップを閉じ、遠心6000×gで、1分。
- filtraを含むコレクションチューブを捨てますTEと新しい2 mlコレクションチューブにスピンカラムを置きます。
- 、縁を濡らさずにカラムに500μlのBuffer AW2を添加するキャップを閉じ、遠心2万XG、3分。
- ろ液を含むコレクションチューブを捨てると、(キットに含まれていない)を新しい1.5 mlのコレクションチューブにスピンカラムを配置し、20,000×gで遠心分離し、1分。
- ろ液を含むコレクションチューブを捨てると新しい1.5 mlのコレクションチューブにスピンカラムを置く(キットには含まれていません)。
- 各列に200μlのBuffer AEあるいは水を加え、室温で5分間インキュベートします。遠心6000×gで、1分。
- 同じコレクションチューブに溶出する手順を繰り返し3.5.11。
- 参加者ごとに2列から溶出したDNAをプール。参加者ごとの総収量〜800μL。
- 時間が許すときに分光光度計を用いてサンプルを定量化します。
- specimeにそれぞれの濃度を記録し、2ミリリットルのクライオバイアルに、必要に応じて小分けのDNAn個のログ。転送は、長期保存のために-80℃でcryoboxと場所に凍結バイアル。冷凍庫の開始時間を文書化します。
- 白血球のRNA単離のステージ1(30分)
注:バイオセーフティレベル2認定の細胞培養フード内で実行します。この分離の詳細については、製造元の指示15を参照してください 。- 転送スパイクとK 2 EDTAバキュテナーのゴム隔膜を突き刺します。ステップ3.6.11で使用するためのシースとスクリューキャップを保持します。 BSL2標準プラクティスの後、血液感染性病原体への曝露を避けるように注意してください。
- 転送スパイクの上に白いスリップコネクタを取り付けます。
- 白いスリップコネクタにフィルタの入口(フレア端部)を接続し、対応する参加者IDとフィルタラベルを付けます。
- フィルタの出口(テーパ状端)に覆わ25⅝G針を取り付けます。配信前に、フィルタアセンブリはかなりため、プロセスを迅速化の準備、フィルタは、シース針を追加し、使用するまで培養管ラックにアセンブリを設定し、転送スパイクに白いスリップコネクタを取り付け、推奨されます。
- K 2 EDTAチューブシステムの組み立てに続いて、安全に(金属へらの先を使用)針をあらわにします。空の10ミリリットル真空採血管(血清レシーバーチューブ)に針を刺すと、K 2 EDTAバキュテナー/フィルター/レシーバ管アセンブリを反転。 BSL2標準プラクティスの後、血液感染性病原体への曝露を避けるように注意してください。
- フィルタのくさび状のセクションでは、血液がクリアされるまで血液が通過フィルタ処理することを許可します。ろ過は、約2分かかり、濾過中に試験管ラックに配置することができます。
- アセンブリからフィルタを削除します。ろ液の入ったチューブに針を残すとシャープス容器内にアセンブリ全体を廃棄します。
- で、1×PBSのボトルに転送スパイク〜5 mlシリンジを取り付けボトルVERT、および3ミリリットルを撤回。
- (3-5秒あたりの低下)は、フィルタの入口にPBSで注射器を取り付け、フィルターを洗い流します。生物学的廃棄物容器にフロースルーを収集します。プランジャーを後退させることなく、フィルタから注射器を取り外します。
- 濾過およびPBS洗浄に続いて、新たな5 mlシリンジとステップ3.6.8に記載した方法を用いてRNAの安定化剤を3mlを引き出します。ステップ3.6.9のようにフィルタをフラッシュします。 RNAの安定剤をフィルター上に残っている必要があります。プランジャーを後退させることなく、フィルタから注射器を取り外します。
- RNA安定剤で飽和し、フィルタを出る転送スパイクから保持シーススクリューキャップ付きフィルタの入口と出口を密封します。フィルタは、この時点で保存することができます。 5.4.7へのステップ5.3を完了するために、時間が許す(〜2時間)まで-80ºCでフィルタを保存してください。
注:コレクションの翌年まで-80ºCで保存フィルタはdecreaなしで処理されましたRNAの品質にSE。
- PBMC単離のステージ2(30分)
- 遠心分離機(ステップ3.4.1)からバキュテナーを含むフィコールを削除し、BSL2フードで継続。バキュテナーは 、図2のように分離が表示されます。そうでない場合は、 表2を参照してくださいする必要があります。
- バキュテナーはBSL2フードに返されると、ストッパーを外し、単核(クリア/ホワイト)層に近い取得せずに血清学的ピペットを用いてトップ、黄色がかった、プラズマ層( 図2)の1.5ミリリットルを撤回。 (2バキュテナーからプール - - 1参加者)クリオバイアル5ミリリットルにプラズマを転送します。収集したボリュームを記録します。ストレージ命令のステップ3.7.6を参照してください。
注:最良の分離と最大のPBMCの収量は、採血前に少なくとも12時間絶食している参加者から来ます。 - U -残りの血漿と白っぽく、単核層( 図2ゲル層上のすべてのもの)を転送1の円錐チューブに参加者ごとにバキュテナーを含む2フィコールのそれぞれから単核層をプール、15ミリリットルコニカルチューブに、血清学的ピペットを歌います。
- 15ミリリットルコニカルチューブで全量を1×PBSを追加します。キャップチューブと5回転倒。 15分、300×gで、22℃(ブレーキとアクセルオフで)遠心。
- フード内フィコール含むバキュテイナーに戻り、周りの渦とフィコールゲル層の外側を緩め、可能であればそれを削除する5¾「パスツールピペットを用いて、赤血球(RBC)を収集。クリオバイアル5mlまでのRBC(〜4.5ミリリットル)を収集し、転送するために血清学的ピペットを使用してください。収集したボリュームを記録します。
- 制御された速度冷凍コンテナに(ステップ3.7.5におけるプラズマステップ3.7.2および赤血球)の両方の5ミリリットルクライオバイアルを移し、彼らはcryoboxに移し、に戻すことができ、その時間の後、少なくとも24時間、-80ºCに置か長期保存のために-80ºC。
- COを返しますステップ3.7.4での遠心分離が完了し、ペレットを乱すことなく、PBSのすべてが、〜500μLを吸引フードにnicalチューブ。 PBSの〜200μlのこの段階で、ペレットの上に放置された場合にPBMCの収量は大きくなります。
- 10ミリリットルにボリュームをもたらすために、新鮮な1×PBSを追加します。静かにペレットを再懸濁。キャップチューブと5回転倒。 10分、300×gで、22℃(ブレーキとアクセルオフで)遠心。
- 血清分離ステージ2(10分)
注意:BSL2フード内で実行します。- 必要に応じて、2ミリリットルクライオバイアルに、遠心分離(ステップ3.2.1)以下、血清バキュテナーから上部の血清層を分注し。典型的な収量は、2.5 mlの( 表1)です。ボリュームを記録します。例えば、クライオバイアル1に200μlずつ小分け4クリオバイアル、クライオバイアル2に千μLを使用し、凍結バイアル3と4に残りを分割。
- 長期保存のために-80ºCでcryoboxと場所に凍結バイアルを転送します。冷凍庫の開始を文書化時間。
- PBMC単離のステージ3(15分)
- ペレットを乱すことなく、できるだけ多くの上清/ PBSと遠心分離(ステップ3.7.8)と、吸引した後、フードに戻ります。中1の凍結2.5ミリリットルPBMCにおけるピペッティングにより再懸濁ペレットを(SI 2を参照します)。
- 中2の凍結2.5ミリリットルPBMCを(SI 2を参照)は、ステップ3.9.1での細胞/培地の溶液に加えます。穏やかに攪拌。
- 小分け0.65ミリリットルのマイクロチューブに細胞溶液10μl(さらに希釈が必要な場合があります)。 0.65ミリリットルマイクロ遠心チューブに0.4%トリパンブルー染色の10μLを加え、数回ピペッティングして混ぜます。詳細については、製造元の取扱説明書16を参照してください 。
- ピペット混合の3分以内に細胞カウンターにチャンバースライドと場所のスライドをカウント細胞内への液10μl。ズームインと細胞を集中。 PBMCの数を取得するには、「セルのカウント "を押します。
- 小分け、実行可能な場合PBMC番号はクライオバイアルに、必要に応じて、ミリリットルあたり3万個の細胞(MC / ml)を超え、3.9.9に進みます。少なくとも3、MC / mlの各濃度で最大5クライオバイアルに保管したPBMC。
- 生存PBMC数が3未満の場合、MC / mlで、5ミリリットルによって実行可能なMC / mlで乗算することにより細胞の総数を計算します。 3 MC / mlの少なくとも1つのチューブが存在するであろうように、4、3、2、1ミリリットルによりその数を割ます。
- 遠心分離機300 XG(ブレーキとアクセルOFF)で5分間細胞/凍結培地溶液を含むコニカルチューブ。遠心分離した後、(4、3、2、1ミリリットル)上で計算したボリュームを残し凍結培地(上清)の適切な量を吸引。
- クライオバイアルを1ml /でクライオバイアルの適切な数(1-4)に残りの上清アリコートに、少なくとも3のMC / mlにペレットを再懸濁。最終凍結培地は、10%ジメチルスルホキシド(DMSO)/ 20%ウシ胎児血清(FBS)/ 70%ロズウェルパーク記念研究所(RPMI)1640。
- Documクライオバイアルあたりの細胞数をENT。制御された速度冷凍コンテナにクライオバイアルを移し、凍結バイアルをcryoboxに移し、長期保存のために液体窒素タンク(気相)に置くことも、その時間の後、少なくとも24時間、-80ºCで置きます。ドキュメントの冷凍庫は、開始時刻。
4. 2日目のセットアップ
- ヒートブロックで80℃にヌクレアーゼフリーチューブにヌクレアーゼを含まない0.1mMのEDTAの一部(フィルタあたり220μl)を加熱します。
- 洗浄溶液1及び2を準備し(SI 2を参照)。
5. 2日目:長期サンプル保存および白血球フィルタ処理(3時間)
- 概要。
- フィルターに白血球の適用の6ヶ月以内に、この手順を実行します。
注:全体的に、2日目の処理は約3時間を要し、それが標識されている間、「2日目、「重要な要件は、フィルタ処理部は、時日に行うべきであるということです実験室で発生した日なし1処理はありません。
- フィルターに白血球の適用の6ヶ月以内に、この手順を実行します。
- 長期サンプル貯蔵(15分)
- 前1日目処理のための研究室に新しいバキュテナーの配信に、毎日、この手順を実行します。適切に標識されたcryoboxesに1日目に制御された速度の冷凍コンテナで、O / Nを保存したクライオバイアルを転送し、長期保存のために-80ºCまたは液体窒素(気相)に戻します。エンドポイントアッセイのために追跡サンプルの場所を促進するために、サンプルの種類( 例えば、DNA、PBMC、赤血球など )に基づいて、クリオバイアルを整理します。
- 白血球のRNAフィルタ処理(45分)。
注意:この手順の詳細については、製造元の指示17を参照してください 。- RT(約5分の解凍)にフィルタを持参。
- シースを取り外し、フィルターからキャップをねじ込みます。 5ミリリットルの注射器のプランジャーを後退させ、フィルタの入口(フレア端部)に接続し、プランジャーを押し下げますRNA安定化剤を放出します 生物学的廃棄物容器内にフィルタポートから。
- RNA単離のためのフェノールとグアニジンイソチオシアネート液4mlで新しい5ミリリットル注射器をロードし、フィルタの入口に取り付け、フィルターを通してソリューションをフラッシュするためにプランジャーを押し下げ、標識された15ミリリットルコニカルチューブにライセートを収集(参加者あたり2)。
- フィルタにそれを再取り付けし、同15ミリリットルコニカルチューブにフィルターディスクにトラップされた残留サンプルを排出するプランジャーを押し下げ、プランジャを後退させる、フィルターから注射器を外します。フィルターと注射器を廃棄します。
- 、コニカルチューブに800μlのBCPを追加しっかりとチューブを閉じ、激しく30秒間準備を振ります。
- 室温で5分間インキュベートします。 2,000×gで10分間遠心。
- たてラベル15ミリリットルコニカルチューブ(〜2.5ミリリットル)に水(上)相を転送します。
- ヌクレアーゼフリー水ANの水相の0.5倍のボリュームを追加します。よく混ぜdは。その後、100%エタノール水溶液の体積の1.25倍を追加して、再度混ぜます。
注:2.5ミリリットルのために水の体積、ミックス、ヌクレアーゼを含まない水の1.25ミリリットルを追加し、その後、100%エタノール4.7ミリリットルを追加(2.5ミリリットル×0.5 = 1.25ミリリットルのヌクレアーゼを含まない水THEN 2.5ミリリットル+ 1.25ミリリットル= 3.75ミリリットル新しい水の体積THEN 3.75ミリリットルのx 1.25 = 4.7ミリリットル100%エタノール)。このステップでは、small RNA画分を含み、全RNAの単離を可能にします。分離からの低分子RNAを省略するための方法は、マニュアル17に記載されています。 - 5ミリリットルのシリンジからプランジャーを取り外し、その場所にスピンカートリッジを挿入します。真空マニホールドにカートリッジ/注射器アセンブリを取り付けます。底がカットオフと真空マニホールドへのより安全な接続のために、1.5mlの微小管の内部カートリッジ/シリンジアセンブリを配置します。
- 慎重にそれはカートリッジに引っ張られるように、よりサンプルを追加し、上の真空でゆっくりスピンカートリッジにステップ5.3.8から試料を適用します。
注:真空がない場合現在、http://www.ambion.com/techlib/misc/leuko_iso.pdfでの遠心分離法を参照してください。 - 1.5mlの微小管にスピンカートリッジを移し、洗浄1.遠心分離機のスピンカートリッジ/チューブアセンブリ5 750μlを添加する - 12,000×gで10秒。
- チューブからろ液を捨て、同じマイクロ遠心チューブにスピンカートリッジを返します。
- 12,000×gで10秒 - 5のためのウォッシュ2および遠心分離機のスピンカートリッジ/チューブを750μlのを追加します。ステップ5.3.12のようにろ液を捨てます。同じマイクロ遠心チューブにスピンカートリッジを返します。
- ステップ5.3.13のように洗浄2および遠心分離の別の750μlの繰り返し。ろ液を捨てます。同じマイクロ遠心チューブにスピンカートリッジを返します。フィルターを乾燥させるために1分間最高速度でスピンカートリッジ/チューブを遠心。
- 新鮮にスピンカートリッジを転送し、1.5μlをマイクロ遠心チューブにラベルされました。
- 80&#に予熱ヌクレアーゼフリー0.1mMのEDTA(200μlのを追加します。スピンカートリッジフィルター参加者ごとに(2)の中心C)176。 1分間室温でインキュベートします。
- RNAを溶出するために12,000×gで1分間遠心。ろ液を保持します。スピンカートリッジを廃棄してください。
- 新しい1.5 mlマイクロチューブ、ラベルに2、100μlのアリコートにそれぞれ200μlのろ液を分割し、氷上に維持します。この時点で、参加者あたり2フィルタを起動すると、参加者あたりのRNAの4100μlアリコートが得られます。
- DNase処理(1時間)
注:この処理の詳細は、製造業者のプロトコル18を参照してください 。- 私は(ピペッティング誤差を考慮して)一定分量+ 1ごとにDNアーゼIバッファー10μlと2μlのrDNaseを組み合わせることにより、マスターミックスを作成します。
注意:4つのサンプルについて、100μlのアリコートを50μlのDNアーゼI緩衝液+10μlのrDNase Iを使用 - ステップ5.3.18からのRNAのアリコートのそれぞれに小分けステップ5.4.1でマスターミックス12μLを、穏やかに混合します。 37でインキュベートしますヒートブロック中で30分間°C。
- DNアーゼ不活性化試薬をボルテックスし、各アリコートに11.2μlを添加、よく混ぜます。インキュベーション中に2〜3回ボルテックス2分間室温でインキュベートします。
- 1.5分間10,000×gで遠心分離します。
- 新しい1.5 mlチューブに上清(RNA)を転送します。同じ参加者からのアリコートを、ここにプールすることができます。
- 濃度を得るために、分光光度計で各サンプルを実行します。 RNAの品質分析は、バイオアナライザを(ステップ5.5を参照)を使用してお勧めします。
- 必要に応じて、クライオバイアルにRNAを分取。バイオアナライザー分析は、後の分析のためにマイクロ遠心チューブに、すぐに実行サンプルのアリコート1.5μlのされません。濃度及び冷凍庫の開始時間を文書化します。 -80℃で保存サンプル。
- 私は(ピペッティング誤差を考慮して)一定分量+ 1ごとにDNアーゼIバッファー10μlと2μlのrDNaseを組み合わせることにより、マスターミックスを作成します。
- バイオアナライザー分析(1時間)
- 製造業者のプロトコル19に従ってください 。実行が完了すると、データは自動的に保存されたが、wが再度保存されていますより小さく、より認識可能なファイル名i番目。期待される結果( 図3):ラダー6のピークを持っている必要があり、サンプルは(25秒でそれぞれ44秒、50秒で2リボソームピーク、及び1初期マーカーピーク)3つのピークを持っている必要があります。
結果
これは、全体の手順は、遺伝子マイクロアレイ及びRT-PCR分析により発現、エピジェネティックな修飾の検出、および細胞サブセットの変化を含む下流のアプリケーションの多くにおいて、分析のための高品質材料を生産することが不可欠である。 表1は、材料の平均収量と品質を示しますプロセスのそれぞれから。 図3は、白血球 RNAの単離およびフィルタ処理方法の品質の出力の例を提供します。 図3の左上の画像は、キャピラリー電気泳動から得られたゲル画像です。各レーンは、劣化を示すことになる最小のシャドウイングを持つ2つの別個のバンドを生成する必要があります。ゲル以下のクロマトグラムは、ピークの位置と大きさに基づいて決定することができる劣化のレベルとタイプで追加の外観を提供します。 (;劣化した低)へのRNA完全性番号(RIN)が1の範囲で別の品質の尺度であります10(高;純粋な、良い品質のRNA)。
このようなハイスループット方法は、時折エラーに向いているが、品質管理を確保するための処理の様々な段階を通して、いくつかのチェックポイントがあります。フィコール含むバキュテナーの遠心分離後に2が表示され、適切な分離を図 。 表2に示すように、真空採血は、遠心分離速度の誤差、低収集量、または空腹時の参加者の不足など、この分離が表示されない場合があり、いくつかの理由があります。
この手順を使用して単離し標本のサブセット(N = 100)は11をパイロシーケンシングすることにより、これらの結果の妥当性を含めHumanMethylation27(HM27)DNA解析BeadChip製品によって成功して分析されています。ジェノタイピングは、亜硫酸水素パイロシーケンシングを目標とし、リアルタイムRT-PCRが正常にワイルドマンとウディン研究所20,21,22,23で行われています。パーで分離された血清、BeadChipを遺伝子型決定および分析の両方のためのDNAの単離と対立正常IL-6およびC反応性タンパク質活性24について分析しました。孤立したPBMC由来のT細胞サブセットが正常に25-28フローサイトメトリーによって分析されています。さらに、変更された白血球からRNA手順ワイド遺伝子発現プロファイリング29のゲノムが施されています。
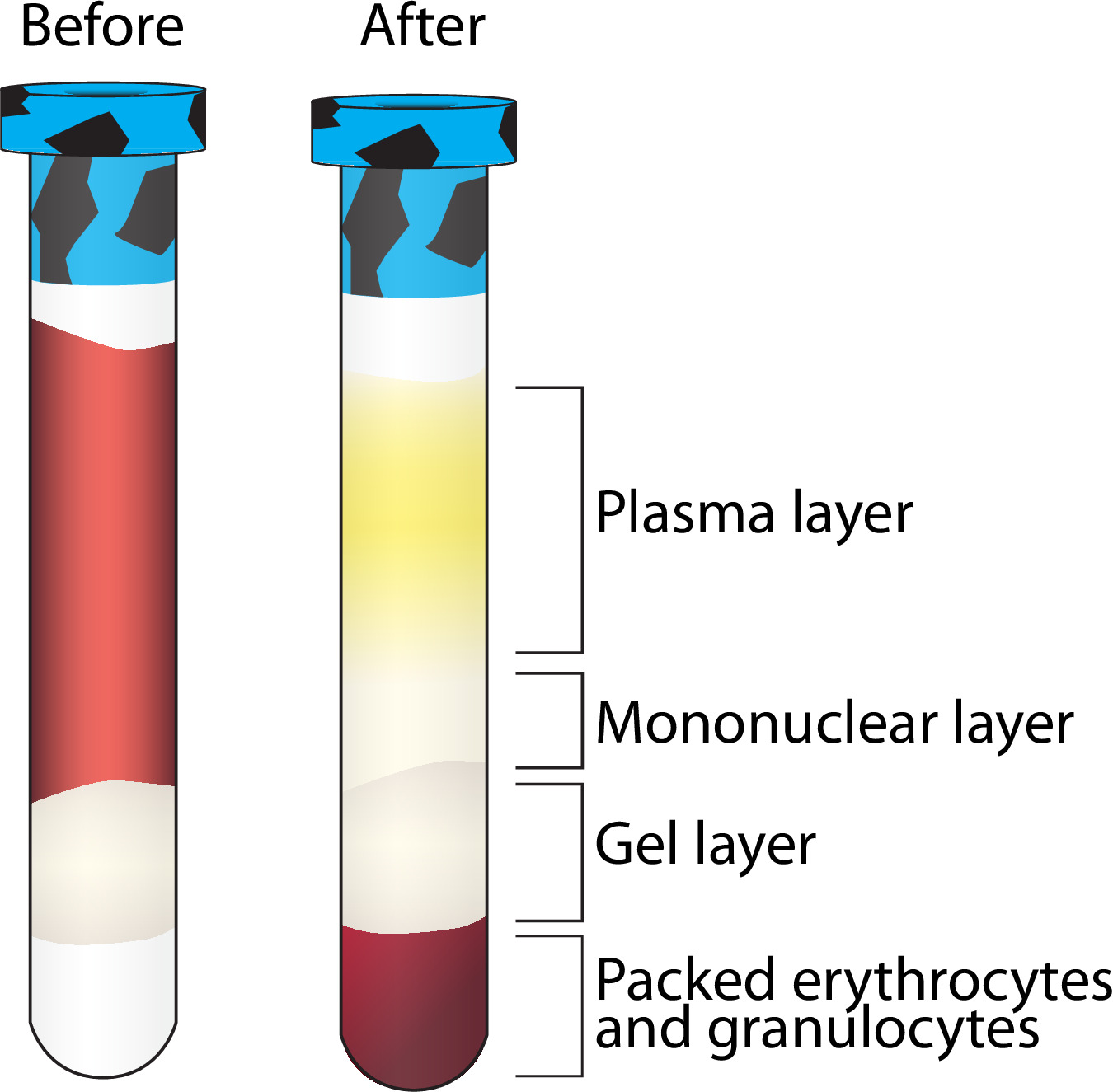
フィコール含むバキュテナーの遠心分離後、図2層分離。遠心分離後、複数の血液成分の分離の可視化。他の層は-80℃で保存されている一方で、単核層はさらに精製される。 この図の拡大版をご覧になるにはこちらをクリックしてください。
:FO」jove_content」 
説明白血球RNAの単離およびフィルタ処理方法(プロトコル3.6と5.3を参照)で単離されたRNAの完全性番号(RINs)8以上で18Sおよび28SリボソームRNAを表す2つの明瞭なバンドを表示図3.期待される白血球のRNAプロセシングの結果。バイオアナライザー結果。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 総平均収量(N≈500) | 標準品質 | |
| 血清 | 2.30ミリリットル | N / A |
| 全血からのDNA | 39.97μgの | 260/280 = 1.74の吸光度 |
| PBMC | 2225万生細胞 | 全体的な分離の少なくとも95%の生存率 |
| 白血球からのRNA | 44.09μgの | 260/280 = 2.01の吸光度 RNA完全性番号(RIN)= 6.48 |
表1予想利回りに記載の方法を用いて処理したサンプルの平均量と質。
| 問題 | 潜在的なソリューション |
| フィコールを含むバキュテナー遠心分離後には分離しません | バキュテイナーは容量いっぱいにされていません - 適切な処理のための最低限の収集量は6ミリリットルです。 |
| 遠心分離機の設定を確認し、速度はg力であることを確認してください。正しくない場合は、g力とリスピンに設定されています。 | |
| 低PBMC共同UNT | 血液の量が低すぎる描きます。 |
| ステップ3.7.8でペレットに近すぎる吸引 | |
| 非絶食参加。 | |
| 血清バキュテナー遠心分離後の分離いいえ | 遠心分離機の設定を確認し、速度はg力であることを確認してください。正しくない場合は、g力とリスピンに設定されています。 |
| ナノドロップ1000を用い予期しない濃度 | 測定は、適切なサンプルタイプ( 例えば、DNAまたはRNA)のためであることを確認します。 |
表2のトラブルシューティング。記載された方法および潜在的なソリューションと遭遇する一般的な問題。

補足表1トラッキングシート。あちこちバキュテナーを追跡する例実験室での配信にm個の採血。 この表を見るにはこちらをクリックしてください。
補足表2標本ログ。ラボへの配送時にバキュテナーの処理を文書化するために使用される文書の例。 この表を見るにはこちらをクリックしてください。

補足表3クライオバイアル番号付けシステム。各参加者のために使用される番号システムの例。 この表を見るにはこちらをクリックしてください。
補足1.前処理の詳細は研究コーディネーター、宅配便や瀉血専門医の職務の詳細。 補足情報1を見るにはこちらをクリックしてください。

補足情報2.レシピ。必要な試薬のためのレシピのリストが表示されます。 補足情報2を見るにはこちらをクリックしてください。
ディスカッション
我々は成功し、デトロイト近所健康調査では1,600以上の全血サンプルを処理するために適用されている合理化されたプロトコルを記載しています。これらの技術の多くは、既存の文献で利用可能であるが、各ステップ間の正確なタイミングの変更など、私たちのステップバイステップのコンパイルは、成功した下流のアプリケーションの広い範囲で生物学的標本のさまざまなを生成し、最適化、効率的なプロトコルを反映して、 DNAメチル化、mRNA発現および免疫学的分析を含みます。これらの標本は、すでに実験、査読論文に発表されたおよび/ または国会議11,20,21,23,24,29で発表されたのさまざまな結果でテストされています。このプロトコルは、このようにDNHSに似た集団ベースの研究では、生物学的標本を収集しようとしている他の研究者を対象とすべきです。
このような高throughp内のサンプルを処理する場合UTの方法は、すべての段階で正確な記録を維持するために最も重要です。私たちは、冒頭でクライオバイアルすべての情報を格納するためのデータベースを開発することをお勧めします。このデータベースは、ボリューム、濃度、品質、バーコード、および保管場所(ボックス内の収納ボックスの数と位置)を含む各クリオバイアル内の試料のすべての側面を含める必要があります。私たちは、予め標識クリオバイアルとバーコードが含まれている収納ボックスの準備をお勧めします。さらに、我々はそれが便利で、各参加者に固有の各チューブのためのバーコードを含む「マスター」ドキュメント(表S3)を有することを発見しました。これは、サンプルに不要な凍結/解凍サイクルを導入し、サンプルの過度の取り扱いなしでデータベースにクライオバイアルデータの迅速な入力を可能にし、手動でバーコードで入力するにはヒューマンエラーの可能性を排除します。 -150液体窒素-178のそれはラベルが極端に付着することも不可欠である(例えば、気相ºC)温度。マニュアルには時間がかかることが、配送時の効率的な処理の必要性を、私たちは、少なくとも二つの技術者がプロセスを分割持つことが最大の効率を生成することを見出しました。
この方法の制限は、コレクションのサイトへ研究室の近くです。特にPBMC単離のために、サンプルは、赤血球の混入の有意な増加を回避するために、採取後2時間以内に処理されなければならない、生存単核細胞の減少。このように、研究室では、発生する可能性のあるトラフィック関連の問題に対処するために、収集サイトから、30分以上でなければなりません。また、ここで概説プロトコルを実施することを提案して任意の研究室では、最適なサンプル処理を確実にするために手に2つの技術が必要になります。また、各研究室では、上記で概説したステップごとに必要な機器へのアクセス権を持っている必要があります。このように、少ないスタッフと研究室および/または制限された機器のwおそらく、このプロトコルを実施することができませウルド。
このプロトコルの利点は、個人の同意の家庭に直接検体を収集する機能です。これは、典型的には、恐らくは保険や交通機関の不足のため、医療の助けを求めるないだろう精神的または他の健康問題を持つ個人に到達するための研究を可能にします。また、同様のトリガーを経験したが、彼らの精神的健康の症状の点で異なっている同じコミュニティ内に住んでいる罹患個体と非罹患個体との比較を可能にします。このように、標本を得ることはフィールドにphlebotomistsの正確なタイミングとの連携が必要となります。私たちの研究室は、私たちが研究していたコミュニティ内に位置したため、瀉血専門医は、通常、二から三家からのサンプルを収集し、最初のコレクションの2時間ウィンドウ内に研究室にサンプルを提供することができます。効率性は、私たちのサンプル処理の鍵である、そのように、私たちは内に複数のphlebotomistsを持っていましたフィールドは、正確な調整の必要性を増加させます。研究室では、離れて2時間間隔をあけ配信あたり最大8個の参加者と複数の血液配信を受けました。 phlebotomistsは指定された場所で会った、唯一の瀉血専門医は、単一のバッチとして研究所に検体を提供して彼らのコレクションを組み合わせました。ここで説明する方法は、容易に多くの他の表現型を研究するために適合させることができ、収集生物学的試料は、下流アッセイの多くにおいて使用され得ます。
開示事項
著者は、彼らが競合する利害を持っていないことを宣言します。
謝辞
We would like to thank Henriette Mair-Meijers for invaluable attention to detail and hours devoted to processing the blood collections. We are grateful for the graphic design expertise of Natalie Jameson Kiesling. We also appreciate the approval of the manufacturers (Qiagen (Valencia, CA), BD Biosciences (San Jose, CA), Life Technologies (Grand Island, NY)) mentioned herein to publish the use of their products as described. Funding for this work was generously provided by the National Institutes of Health award numbers DA022720, RC1MH088283, and DA022720-05-S1.
資料
| Name | Company | Catalog Number | Comments |
| QIAamp DNA Blood Mini Kit | Qiagen | 51104 | Day 1: DNA isolation |
| Phosphate-buffered saline (PBS) | Sigma | P5493-1L | Day 1: PBMC isolation |
| 5 ¾” Pasteur pipets | Fisher | 13-678-6A | Day 1: PBMC isolation |
| Fetal Bovine Serum (FBS), heat inactivated | Life Technologies | 10082147 | Day 1: PBMC isolation |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418-500ml | Day 1: PBMC isolation |
| RPMI Medium 1640, liquid | Invitrogen | 11875119 | Day 1: PBMC isolation |
| 0.4% trypan blue stain | Invitrogen | T10282 | Day 1: PBMC isolation |
| Countess Cell Counting Chamber | Invitrogen | C10283 | Day 1: PBMC isolation |
| Countess Automated Cell Counter or cell counting device such as a microscope and hemocytometer | Invitrogen | C10281 | Day 1: PBMC isolation |
| LeukoLOCK Fractionation & Stabilization Kit | Ambion | 1933 | Day 1: Leukocyte RNA isolation |
| 25 G x 5/8 in. needles | Becton Dickinson | 305122 | Day 1: Leukocyte RNA isolation |
| Syringes (5 ml) | Becton Dickinson | 309646 | Days 1 and 2: Leukocyte RNA isolation |
| Denaturing Lysis Solution | Ambion | 8540G | Day 2: Leukocyte RNA isolation |
| 5 M NaCl | Life Technologies | 24740011 | Day 2: Leukocyte RNA isolation |
| TRI Reagent | Ambion | 9738 | Day 2: Leukocyte RNA isolation |
| Bromo-3-chloro-propane (BCP) | Sigma | B-9673 | Day 2: Leukocyte RNA isolation |
| spin cartridges | Ambion | 10051G | Day 2: Leukocyte RNA isolation |
| 0.1 mM EDTA | Ambion | 9912 | Day 2: Leukocyte RNA isolation |
| DNA-free Kit | Ambion | AM1960 | Day 2: DNase treament |
| RNA 6000 Ladder | Agilent | 5067-1529 | Day 2: Bioanalyzer analysis |
| RNA 6000 Nano Series II Kit | Agilent | 5067-1511 | Day 2: Bioanalyzer analysis |
| RNaseZAP | Ambion | AM8782 | Day 2: Bioanalyzer analysis |
| Ethanol >99% | Sigma | E7023-500ml | |
| Isopropanol >99% | Sigma | I9516-500ml | |
| Nuclease-free ultra pure water | Invitrogen | 9938 | |
| Pipette tips (nuclease-free) | Eppendorf | 22491253 | |
| Pipetter (serological) | Eppendorf | 2223020-4 | |
| Pipetters (for volumes under 1 ml) | Eppendorf | 3120000-054 | |
| Pipettes (serological) | Fisher | 13-678-27E | |
| Controlled rate freezing containers | Nalgene | 5100-0001 | |
| Cryoboxes (to hold 2 ml and 5 ml cryovials and 1.5 ml microcentrifuge tubes) | Fisher | 03-395-464 | |
| Test tube rack | Thermo Scientific | 14-804-134 | |
| 15 ml polypropylene tubes | Fisher | 14-959-49D | |
| 1.5 ml and 0.65 microcentrifuge tubes | Fisher | 07-200-534 and 07-200-185 | |
| 2 ml and 5 ml cryovials | Fisher | 10-500-26 and 10-269-88F | |
| 8 ml CPT vacutainer | BD Biosciences | 362761 | 2 tubes |
| 6 ml K2 EDTA vacutainer | BD Biosciences | 367863 | 2 tubes |
| 8.5 ml SST vacutainer | BD Biosciences | 367988 | 1 tube |
| Vortexer | Fisher | 2215365 | |
| Dry bath incubator with heating block for microcentrifuge tubes | Fisher | 11-715-1250 | |
| Filtration/vacuum system for use within the cell culture hood | Fisher | 01-257-87 | |
| Fixed-angle rotor for microcentrifuge tubes with aerosol-tight lid | Eppendorf | 22637002 | |
| Refrigerated centrifuge with a swing-bucket rotor and aerosol-tight caps for 16 x 125 mm vacutainers and 15 ml polypropylene tubes | Eppendorf | 22628157 | 2, one does not need to be refrigerated |
| Nanodrop 2000 (recommended for accuracy of small volumes) or other spectrophotometric device | Fisher | 13-400-411 | |
| Agilent Bioanalyzer | Agilent Technologies | G2940CA | |
| Liquid nitrogen tank | Thermo Scientific | 11-676-56 | |
| Sharps container | Fisher | 22-037-970 | |
| Biological waste container | Thermo Scientific | 1223P52 | |
| Biosafety Level 2 certified cell culture hood | Thermo Scientific | 13-261-315 |
参考文献
- Hernandez, M. E., Martinez-Fong, D., Perez-Tapia, M., Estrada-Garcia, I., Estrada-Parra, S., Pavon, L. Evaluation of the effect of selective serotonin-reuptake inhibitors on lymphocyte subsets in patients with a major depressive disorder. Eur Neuropsychopharmacol. 20, 88-95 (2010).
- Weigelt, K., et al. TREM-1 and DAP12 expression in monocytes of patients with severe psychiatric disorders EGR3, ATF3 and PU.1 as important transcription factors. Brain Behav Immun. 25, 1162-1169 (2011).
- Robertson, M. J., et al. Lymphocyte subset differences in patients with chronic fatigue syndrome, multiple sclerosis and major depression. Clin Exp Immunol. 141, 326-332 (2005).
- Rotter, A., Asemann, R., Decker, A., Kornhuber, J., Biermann, T. Orexin expression and promoter-methylation in peripheral blood of patients suffering from major depressive disorder. J Affect Disord. 131, 186-192 (2011).
- Klengel, T., et al. Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nat Neurosci. 16, 33-41 (2013).
- Segman, R. H., Shefi, N., Goltser-Dubner, T., Friedman, N., Kaminski, N., Shalev, A. Y. Peripheral blood mononuclear cell gene expression profiles identify emergent post-traumatic stress disorder among trauma survivors. Mol Psychiatry. 10, 500-513 (2005).
- Smith, B. H., et al. Cohort Profile: Generation Scotland: Scottish Family Health Study (GS:SFHS). The study, its participants and their potential for genetic research on health and illness. Int J Epidemiol. 42, 689-700 (2013).
- Mallone, R., et al. Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive T cell responses: position statement of the T-Cell Workshop Committee of the Immunology of Diabetes Society. Clin Exp Immunol. 163, 33-49 (2011).
- Duvigneau, J. C., Hartl, R. T., Teinfalt, M., Gemeiner, M. Delay in processing porcine whole blood affects cytokine expression. J Immunol Methods. 272, 11-21 (2003).
- Debey, S., et al. Comparison of different isolation techniques prior gene expression profiling of blood derived cells: impact on physiological responses, on overall expression and the role of different cell types. Pharmacogenomics J. 4, 193-207 (2004).
- Uddin, M., et al. Epigenetic and immune function profiles associated with posttraumatic stress disorder. Proc Natl Acad Sci U S A. 107, 9470-9475 (2010).
- Kessler, R. C., Wang, P. S. The descriptive epidemiology of commonly occurring mental disorders in the United States. Annu Rev Public Health. 29, 115-129 (2008).
- . QIAamp® DNA Mini and Blood Mini Handbook Available from: https://www.qiagen.com/us/resources/resourcedetail?id=67893a91-946f-49b5-8033-394fa5d752ea (2010)
- Koenen, K. C., et al. SLC6A4 methylation modifies the effect of the number of traumatic events on risk for posttraumatic stress disorder. Depress Anxiety. 28, 639-647 (2011).
- Walsh, K., Uddin, M., Soliven, R., Wildman, D. E., Bradley, B. Associations between the SS variant of 5-HTTLPR and PTSD among adults with histories of childhood emotional abuse: Results from two African American independent samples. J Affect Disord. 161, 91-96 (2014).
- Bustamante, A. C., et al. Childhood maltreatment is associated with epigenetic differences in hypothalamic-pituitary-adrenal (HPA) axis genes in the Detroit Neighborhood Health Study. , (2013).
- Sipahi, L., et al. Longitudinal epigenetic variation of DNA methyltransferase genes is associated with vulnerability to post-traumatic stress disorder. Psychol Med. 44, 3165-3179 (2014).
- Uddin, M., Koenen, K. C., Aiello, A. E., Wildman, D., de los Santos, R., Galea, S. Epigenetic and inflammatory marker profiles associated with depression in a community-based epidemiologic sample. Psychol Med. 41, 997-1007 (2011).
- Uddin, M., et al. Post-traumatic stress disorder is associated with immunosenescent T cell phenotypes in the Detroit Neighborhood Health Study. , (2011).
- Uddin, M., et al. Post-traumatic stress disorder is associated with immunosenescent T cell phenotypes in the Detroit Neighborhood Health Study. , (2011).
- Uddin, M. Biological signatures of post-traumatic stress disorder in the Detroit Neighborhood Health Study. , (2010).
- Aiello, A. E. Cytomegalovirus antibodies as a marker of immunosenescence in the Detroit Neighborhood Health Study. , (2010).
- Bustamante, A. C., et al. . Distinct gene expression profiles characterize lifetime PTSD and childhood maltreatment in the Detroit Neighborhood Health Study. , (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved