Method Article
Применение люминесцентных наночастиц по изучению ремоделирования Endo-лизосом Системе внутриклеточных бактерий
В этой статье
Резюме
Эта статья описывает методы синтеза и флуоресцентных меток наночастиц (NPS). АПЛ были применены в импульсно-погони экспериментов для обозначения эндо-лизосомальное систему эукариотических клеток. Манипуляции с эндо-лизосомальных системы по деятельности внутриклеточного патогена Сальмонелла энтерика последовали живых клеток изображений и количественно.
Аннотация
Флуоресцентные наночастицы (NPS) с желаемой химической, оптических и механических свойств перспективные методы этикетке внутриклеточных органелл. Здесь мы представляем метод с использованием золото-БСА RHODAMINE NPS для обозначения эндо-лизосомальных систему эукариотических клеток и контролировать манипуляции принимающих клеточных путей внутриклеточной возбудителя Сальмонелла энтерика. АПЛ были легко усвоены HeLa клеток и локализуется в конце эндосомах / лизосом. Сальмонеллез индуцированной перестройки пузырьков и накопления наночастиц в Salmonella- индуцированных мембранных структур. Мы развернули пакет программного обеспечения Imaris для количественного анализа конфокальной микроскопии изображений. Число объектов и их распределение по размерам в неинфицированных клетках отличались от тех, в Salmonella -infected клеток, что указывает на чрезвычайно ремоделирование эндо-лизосомальных системе WT Salmonella.
Введение
Флуоресцентные наночастицы (NPS), в том числе металлических наночастиц, квантовых точек, полимерных наночастиц, кремния наночастиц, углеродных точек и т.д., привлекли значительное внимание в течение последних десятилетий в 1,2 раза. По сравнению с традиционными органических красителей, флуоресцентные наночастицы показывают желаемые химические, оптические и механические свойства, такие как сильный уровень сигнала, устойчивость к фотообесцвечивание и высокой биосовместимостью 3,4. Эти преимущества делают их метод выбора для внутриклеточного зондирования и получения изображений живых клеток. Кроме того, различные электронно-плотные НЧ видны с помощью электронной микроскопии (ЭМ), что облегчает их использование в коррелированной микроскопического анализа, который позволяет сочетание живой клетке отслеживание световой микроскопии (LM) и более высоким разрешением на уровне ультраструктуры ЭМ 5. Например, золото НЧ были давно эффективно использованы в качестве биосенсоров в живых клетках для чувствительной диагностики, а также в области иммуно-маркировки 6. Последние летtudies показывают, что золото НЧ с различным размером и формой может быть легко поглощать большим разнообразием клеточных линий и регулярно транспортировать через эндосомный пути, следовательно, имеют большой потенциал применяется для внутриклеточного слежения пузырьков транспортировки и эндо-лизосомальных системы маркировки 7,8 ,
Патогенных микроорганизмов, таких как Сальмонелла энтерика, Shigella Флекснера и листерий, разработали различные механизмы, чтобы вторгнуться без фагоцитоза клеток-хозяев 9. После того, как усвоены, возбудители, либо локализованные в цитоплазме или поглощенных в мембраносвязанных отсеков, широко взаимодействуют с окружающей их средой принимающих и модулировать их, чтобы способствовать их собственное выживание 10. Например, Сальмонелла энтерика находится, и повторяет в внутриклеточный phagosomal отсек называется Salmonella -содержащих вакуоль (SCV) при заражении 11. Со сроком погашения SCVтрафиков к аппарату Гольджи, проходит постоянного взаимодействия с эндоцитотического пути, и индуцирует образование обширных трубчатых структур, таких как Salmonella индуцированной нитей (SIF), сортировка нексин канальцы, Salmonella, индуцированной носители секреторной мембраны белка (3) SCAMP3 канальцев и т.д. 12-14.. Изучение того, как эти бактериальные патогены манипулировать клетке-хозяине путей имеет важное значение для понимания инфекционной болезни.
Здесь золото-БСА-родамина НЧ были использованы в качестве жидких индикаторов для обозначения узла сотовой системы эндо-лизосомами, и человеческий желудочно-кишечного патогена Сальмонелла энтерика серовар Typhimurium (Salmonella) был использован в качестве модели бактерии изучить взаимодействие патогена с провести эндоцитотический пути. Внутриклеточные золото-BSA-родаминовые НП в неинфицированных клеток и клеток, инфицированных WT сальмонеллами или мутантных штаммов были обследованы с помощью конфокальной лазерной сканирующей микроскопии (CLSM).Тогда программное обеспечение Imaris был использован для количественного определения распределения наночастиц, указывая, что сальмонеллез индуцированной крайней перестановку эндосомах / лизосом. После описания этого метода, аналогичные эксперименты могут быть разработаны, чтобы отслеживать долгосрочное судьбу интернализованного НП и исследовать влияние различных экзогенных веществ или эндогенных факторов на эндоцитоза пути эукариотических клеток.
протокол
1. Синтез 10 нм наночастиц золота (Gold NPS) 15
- Подготовьте раствор А: добавить 2 мл 1% -ного водного хлорида золота в 160 мл Milli-Q или бидистиллированной воды,.
- Приготовьте раствор B: добавить 8 мл 1% Тринатрийцитрат х 2 H 2 O и 160 мкл 1% дубильной кислоты в 32 мл Milli-Q, или дважды дистиллированной, водой.
- Разминка Раствор А и B до 60 ° С и смешивают их при перемешивании. Сразу Соблюдайте темно-синий цвет. Заметим, красным цветом, после примерно 15 мин. Затем нагревают до 95 ° С, сохранить 5 мин и охлаждают раствор до комнатной температуры.
- Добавить каплю суспензии НП на углеродную покрытием сетки и дайте высохнуть на воздухе. Проверьте размер и морфологию наночастиц с помощью просвечивающей электронной микроскопии.
2. Покрытие Gold Соседства с BSA и маркировки с Rhodamine N-гидроксисукцинимидным эфир (NHS) 16
- Добавить 900 мкл золотых NPS в 1,5 мл пробирку Эппендорфа, центрифуге при 15000 х г в течение 30 мин. Opнально, подготовить несколько трубок может сразу.
- Жидкость над осадком сливают, вновь приостановить осадок в 900 мкл стерилизованной Milli-Q воды и добавить 100 мкл 2 мг / мл BSA / PBS, смешивают в вихревом при 800 оборотах в минуту в течение 30 мин.
- Для удаления избытка BSA, центрифугировать подготовку при 15000 х г в течение 60 мин.
- Удалите супернатант и вновь приостановить золото-BSA ИГ 125 мкл PBS, добавить 12,5 мкл 1 М бикарбоната.
- Непосредственно перед использованием, подготовить 10 мг / мл раствора родамина NHS / ДМСО, добавляют 30 мкл родамина NHS / ДМСО раствора к 1 мл суспензии золото-БСА NPS. Инкубируют реакционную смесь в течение 2 ч (или O / N) при комнатной температуре в течение 800 оборотов в минуту перемешивания, избегая воздействия света.
- Очищают золото-BSA-родамин NPS через диализа против PBS при 4 ° С с 5 буферных изменений за период 36 - 48 часов.
- Для стабилизации NPS, добавить 10 мкл 200 мг / мл BSA / PBS в каждой 1 мл золото-BSA-родаминовых НП. Для удаления свободного или отпущена BSA-родамин, центрифуги на 15,000 мкг в течение 60 мин. Ресуспендируют осадок в 2 мг / мл BSA / PBS, измерения OD 520, и хранят при температуре 4 ° С, во избежание воздействия света.
- Развести НП 10 раз с Milli-Q или дважды дистиллированной воды, добавить каплю на покрытую углеродом, сетки, и дайте высохнуть на воздухе. Проверьте размер и морфологию наночастиц с помощью просвечивающей электронной микроскопии (ПЭМ).
Примечание: Все материалы, используемые для приготовления НП были стерилизованы и операция была проведена в капот культуре клеток или на скамейке рядом пламени.
3. Культура клеток HeLa
- HeLa клетки, экспрессирующие постоянно ЛАМПА1-GFP культивируют в среде DMEM с 10% эмбриональной телячьей сыворотки (FCS) и выращивали при 37 ° С в атмосфере, содержащей 5% СО 2.
- Семенной клеток при плотности 50000 на лунку в камере слайд 8-а (Ibidi) и инкубируют O / N.
4. Культура бактерий
- Использование Сальмонелла энтерика серовар Typhimurium НКТЦ 12023 Wild-типа (WT) штамм. Для сравнения, использовать мутантные штаммы, Δ ssaV дефектные в SPI2-T3SS и Δ SIFA недостающие ключевым эффекторной Сифа для SIF. Использование Штаммы, содержащие плазмиды pFPV25.1 для конститутивной экспрессии GFP повышенной.
Примечание: Бактериальные штаммы обычно выращивают в Лурии-Бертани бульона (LB) с добавлением 50 мкг / мл карбенициллина (WT) и LB с добавлением 50 мкг / мл карбенициллина и / или 50 мкг / мл канамицина (Δ ssaV, Δ SIFA ) необходимых для поддержания плазмид. - Посев одну колонию бактерий в 3 мл LB с соответствующими антибиотиками и расти O / N при 37 ° С при встряхивании условий аэрации, затем разбавленным 1:31 в свежей LB и продолжают рост в течение 3,5 ч. В этом момент времени, культуры достигают поздней лог-фазы и бактерий очень агрессивным. "Валец 'удобно для инкубации культур пробирку с аэрацией.
5. Заражение HeLa клетокSalmonella и золото-BSA-RHODAMINE НП Пульс Chase-маркировки (рис 1 для схемы)
- Измерить OD 600 из суб-культивировали бактерий и разбавьте до OD 600 = 0,2 в 1 мл PBS (~ 3 × 10 8 КОЕ / мл), добавляют соответствующие количества бактерий к клеткам HeLa в 8-луночных слайдов камеры, чтобы достичь множество инфекции (МВД) 100.
- Выдержите в течение 30 мин в клеточной инкубатора, вымыть 3 раза с PBS для удаления не усвоенные бактерии (на этот раз точка была установлена, как 0 ч после заражения, или 0 ч PI). Добавить 300 мкл свежей культуральной средой, содержащей 100 мкг / мл гентамицина и поддерживать в течение 1 часа. Затем заменить среду свежей средой, содержащей 10 мкг / мл гентамицина для остальной части времени инкубации.
- После инкубации с культуральной среде, содержащей 100 мкг / мл гентамицина в течение 1 ч, среду заменяют на среду визуализации (Орлов MEM без FCS, L-глутамина, фенол красный и бикарбонат натрия, 30 мМ HEPES, рН 7,4) COntaining 10 мкг / мл гентамицина. Золото-БСА-родамин НЧ добавляют к HeLa клеток, чтобы получить конечную концентрацию OD 520 = 0,1.
Примечание: золото-БСА-родамина НЧ также могут быть добавлены к клеткам перед заражением, либо при различных временных точках пи - После 1 ч инкубации удалить среды, промыть 3 раза PBS, и добавить 300 мкл свежей среды визуализации, содержащей 10% FCS и 10 мкг / мл гентамицина для остальной части времени инкубации.
Примечание: Длительность инкубации может варьировать в зависимости от концентрации наночастиц и клеточных линий, используемых. Для RAW264.7 макрофагов, мы наблюдали, что 30-минутной инкубации с НЧ при концентрации OD 520 = 0,05 позволило достаточно интернализации.
6. изображений
- Используйте конфокальной системы визуализации, таких как конфокальной лазерной сканирования (CLSM) или вращающийся диск (SD) микроскопа с влажной камере Окружающая среда для изображения с высоким разрешением на различных временных точках.
- Включите C Температураontrol систему и подождите, пока он не стабилен. Оптимизация параметров визуализации, таких как увеличение, скорость сканирования, разрешение, Z-Stack и т.д. Используйте соответствующие параметры возбуждения / эмиссии для GFP и золото-BSA-родаминовых НП. Для этого протокола, используйте 400 Гц скорость сканирования, разрешение 512 х 512 пикселей и Z-размер шага 0,25 мкм. Excite GFP и золото-BSA-родамин, используя лазер AR (488 нм) и He-Ne лазер (543 нм), соответственно. Включить светлого поля (BF) канал для наблюдения формы клеток. Для других микроскопия системы и условия инфекция, установка, должны быть соответствующим образом скорректированы.
ПРИМЕЧАНИЕ: Используйте ту же Ar лазер в качестве источника BF канала и светового сигнала был обнаружен с фото множитель (ФЭУ) детектор. - В указанное время-точек П., монтировать камеры слайды 8-а, содержащие инфицированные клетки на предметном столике микроскопа и запись изображений.
7. Анализ изображений
- Использование программного обеспечения для анализа изображений микроскопии (см Материалы и настольные принадлежности), чтобы проанализировать реконструкцию эндо-лизосомальных системы внутриклеточной сальмонеллы. Откройте файл, нажав «Открыть» и выбрать файл.
ПРИМЕЧАНИЕ: Кроме того, программное обеспечение с открытым исходным кодом пакетов, таких как ImageJ или ФИДЖИ могут быть использованы для количественного анализ изображения. - На панели инструментов Объекты превзойти вид щелчком по иконке
 чтобы добавить новый элемент поверхности. Нажмите на
чтобы добавить новый элемент поверхности. Нажмите на  (Следующий).
(Следующий). - Для анализа интересующей нас области (ROI), выберите сегмент ROI. В области просмотра, прямоугольного сечения, граничит накладывается на изображения, представляющий ROI. Введите значения в соответствующем направлении x, y, и z-поля, или непосредственно нажмите на стрелки в окне предварительного просмотра прямоугольника, чтобы изменить размер и положение ROI. Тогда нажмите
= "/ Файлы / ftp_upload / 52058 / 52058icon2.jpg" /> (Next).
- Как канала источника, выберите канал 3 (сигнал для Gold-BSA-родамина NPS). Проверьте гладкий вариант для настройки плавности результирующей области. Определить значение вручную или принять автоматически сгенерированное значение. Для порога, выберите опцию абсолютная интенсивность.
- Для регулировки порога, выберите вариант ручной и установите значение. В области просмотра, порог поверхность предварительный просмотр, отображаются серым цветом.
- На вкладке классифицировать поверхностей Полученная поверхность могут быть отфильтрованы по различным критериям. Фильтр по умолчанию 'число вокселей> 10 "и другие фильтры также могут быть включены, нажав кнопку" Добавить ". Если фильтрация не нужна, а затем удалить все фильтры, нажав на кнопку Удалить. Нажмите
 (Следующий).
(Следующий). - Для завершения создания поверхностей, нажмите на/files/ftp_upload/52058/52058icon3.jpg "/> (Finish). В списке объектов, теперь снимите флажок в поле для элемента объема и вновь созданной поверхности отображается в области просмотра.
- Экспорт статистики. Теперь, в превзойти зрения цвет предметов варьируется от фиолетового до красного в зависимости от их площади. И "земля Числа Area 'таблица показывает статистическую информацию (например, ID номер и прочих объектов). Экспорт всех статистику поверхности 1 в файл Excel, нажав на кнопку
 (Сохранить).
(Сохранить).
Результаты
Золотые наночастицы были получены с помощью хорошо разработанным способом путем снижения золотохлористоводородной кислоты цитрата и дубильной кислоты. Как показано на фиг.2А, синтезированные наночастицы золота были квази-сферическую форму с размерами приблизительно 10 нм. BSA покрытие и родамин маркировка не влияет на их морфологию или размера (рис 2b).
Было сообщено, что золотые наночастицы можно легко захватываются различными клетками млекопитающих и в конечном итоге в эндоцитических систем 7. В соответствии с предыдущими работами, ярко-красные сигналы флуоресценции наблюдается в HeLa клеток после 1 ч инкубации с золото-BSA-родаминовых НП (рис 3, WT 5 ч PI), что указывает на эффективное внедрение НПС клетками. Большинство красных сигналов были найдены локализуется с зелеными сигналов, показывая, что наночастицы были заключены в конце эндосомах или лизосом. Однако, в отличие от равномерного распределения наночастиц в конце эндосомах / лизосомв неинфицированных клеток (рис 3, макет), их места были в значительной степени перестроены в WT Salmonella -infected клеток. В ранней фазе инфекции (рис 3, WT 5 ч PI), Salmonella повторяет в SCV и SIF пройти быструю расширение или движение сокращения. В этот момент времени, доля национальных парков был найден в SCV и SIF, а другую фракцию, по-прежнему располагался в свободных конца эндосомах / лизосом. В 8 ч PI (фиг.3, WT 8 ч PI), был сформирован стабилизированный сеть SIF, и большинство НЧ оказались накопленных в течение трубчатых структур, тогда как только очень небольшая часть осталась расположен в свободных поздних эндосом / лизосом. В мутантные штаммы Δ ssaV и Δ SIFA выставлены различные поведения. Как показано на рисунке 3 (Δ ssaV), в 8 ч пи, Δ ssaV был заключен внутри SCV, а не SIF структуры не были сформированы. Некоторые наночастицы были обнаружены вокруг лососяЭлла внутри SCV, но большинство парков были по-прежнему находится в свободном конце эндосомах / лизосом. Для штамма Δ Сифа (рис 3, Δ Сифа), побег из Salmonella в цитоплазму произошло, и не наблюдалось никакой связи между НП и бактерий.
В нашем предыдущем исследовании было установлено, что SIF дисплей высокой динамические свойства в ранней фазе инфекции (3 - 5 ч PI), но стабилизируется в более поздний период (> 8 ч PI) 12. Таким образом, мы задаемся вопросом, является ли Salmonella в начале и в конце фазы инфекции имеют сравнимую возможность перестроиться распределение внутриклеточных НП. Как показано на фиг.4, золото НЧ инкубировали с клетками HeLa O / N до заражения, или в разные моменты времени после инфицирования (1 - 7 ч PI) в течение 1 ч, во всех случаях большинство интернализированных НЧ наблюдались, накопленных в SCV или SIF.
Микроскопическое Observations показали, что заражение по результатам сальмонеллы, массивной перестройки эндо-лизосомальных системы клеток-хозяев. В качестве следующего шага мы использовали пакет программного обеспечения Imaris проанализировать сальмонеллы, индуцированного клетки-хозяина фенотипы в количественном выражении. Использование изображение одного инфицированного HeLa клетки в 8 ч пи в качестве примера, шаг за шагом инструкции для количественного анализа изображен на фиг.5. Через интенсивности порога 15 и "числа вокселей> 10 'фильтра, 3D объекты были взяты из исходного файла изображения. Объекты должны были быть внутриклеточные структуры, в которых золото-BSA-родамин НП расположенные с. В этом примере 67 объектов были извлечены в общей сложности, с суммированного области, как 1,974.64 мкм 2. Самый большой объект, который локализуется с сетью SIF, имеет площадь 1,836.23 мкм 2, а остальные меньше, чем 50 мкм 2. Для сравнения, один пример, показывающий квантторитетных результат анализа не-инфицированной клетки были приведены в. Здесь 431 объектов были извлечены в общей сложности, в течение которого среднее значение площади 5 мкм 2 и самый большой объект имеет площадь 34 мкм 2. Суммарный площадь объектов составляет 2252 мкм 2, что сравнимо с инфицированной клетки на рисунке 4 (1975 мкм 2). Тем не менее, количество объектов намного больше, чем другой (431 и 67 объектов соответственно), что свидетельствует о значительной степени слияние пузырьков с Salmonella индуцированной трубчатых конструкций.
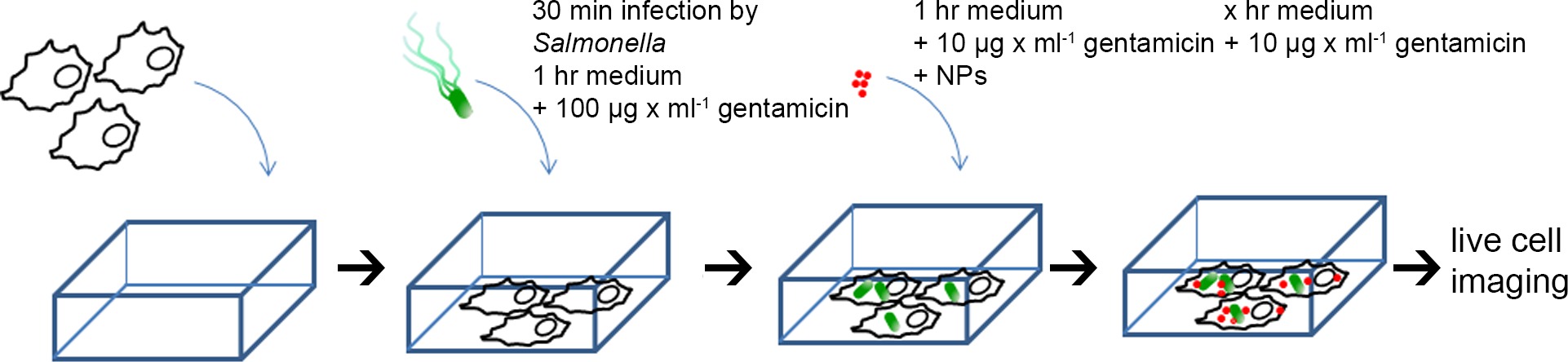
Рисунок 1. Схема для приготовления HeLa клеток для изображений живых клеток. HeLa клетки высевают в камере слайдов, макет-инфицированных или инфицированных различными штаммами Salmonella в течение 30 мин, промывали три раза ЗФР, а затем incubat ред средой, содержащей 100 мкг / мл гентамицина в течение 1 часа. Затем среду заменяли на среду, содержащую визуализации 10 нм золото-БСА-родамина НЧ (OD 520 = 0,1) и 10 мкг / мл гентамицина, инкубировали в течение 1 ч, а затем преследовали NP-среде без для остальной части эксперимента , Изображений живых клеток проводили в различные моменты времени после инфицирования (PI). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
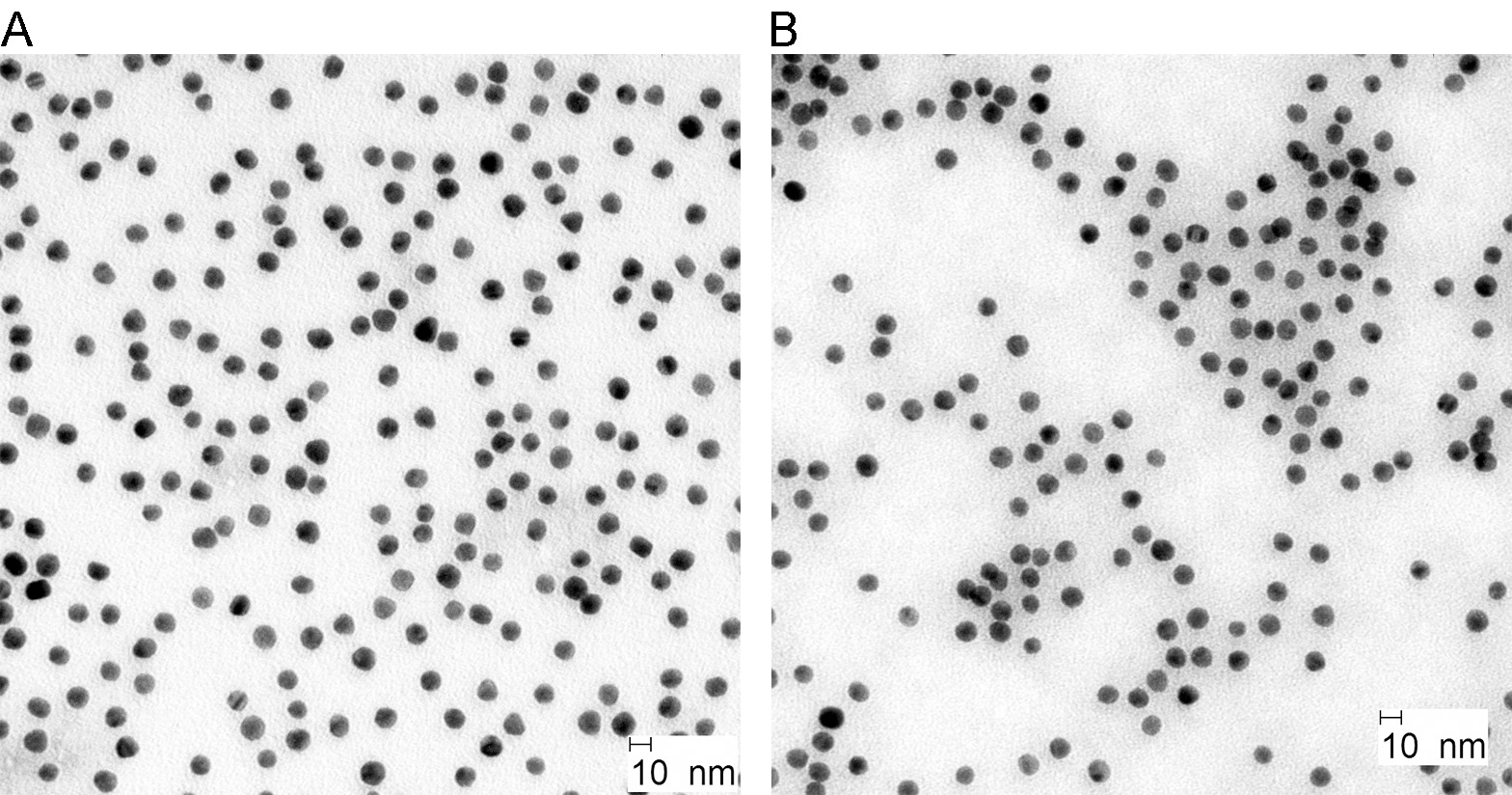
Рисунок 2. ПЭМ-изображения коллоидного золота парков до () и после маркировки (б). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 3. Ремоделирование клетки-хозяина эндо-лизосомальных системы внутриклеточными клеток Salmonella. HeLa были макет-инфицированных или инфицированных сальмонеллой Вт, Δ ssaV или Δ SIFA мутантные штаммы, и пульс / погоню с 10 нм золото-BSA-родаминовых НП ( ОД 520 = 0,1) проводили, как описано на фиг.1. Максимальные проекции интенсивности CLSM Z-стеки показаны. Шкала бары, 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 4. Доступность системы эндо-лизосом в разных фазах заражения сальмонеллой. HeLaклетки импульсно 10 нм золото-БСА-родамина НЧ (OD 520 = 0,1) O / N до инфекции, или в течение 1 часа при различных временных точках, как показано пи. Изображений живых клеток проводили при 8 - 9 ч пи максимальная интенсивность проекции CLSM Z-стеки показаны. Шкала бары, 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
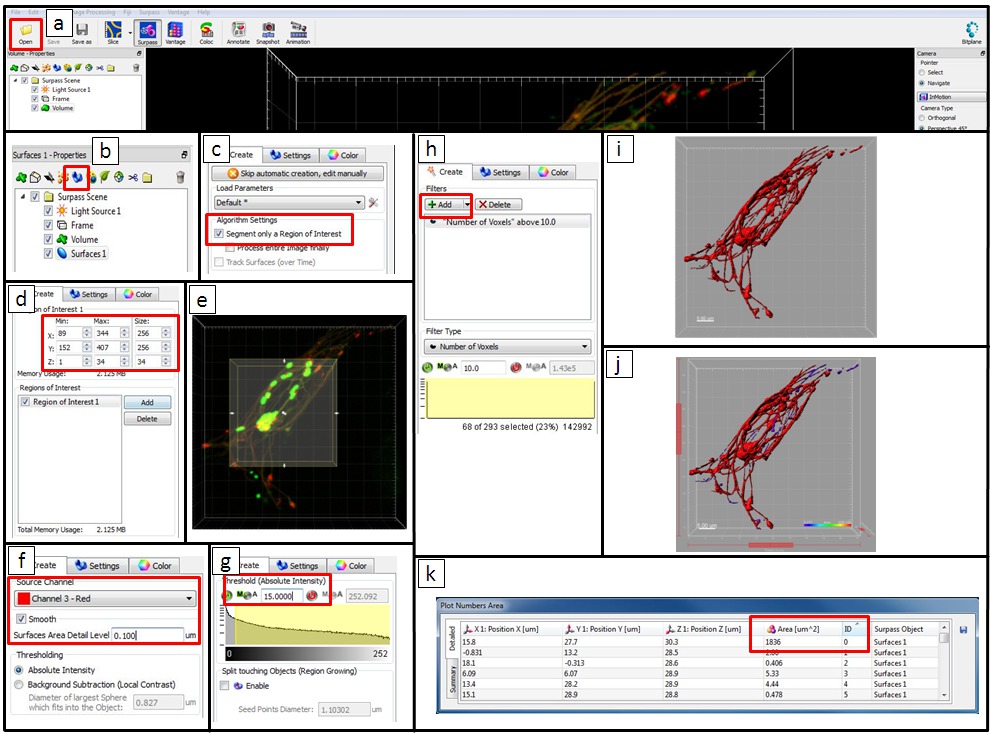
Рисунок 5. Шаг за шагом инструкции для количественного анализа Imaris, используя изображение зараженного HeLa клетки в 8 ч пи в качестве примера. () Открыть данные, нажав кнопку "Открыть" и выбрать файл. (B) На панели инструментов Объекты превзойти зрения добавить новый элемент поверхности. (C) Для анализа ROI, затем выберите сегмент А рентабельность инвестиций. (D) Введите значения в соответствующем направлении x, y, и Z-поля или (E) непосредственно нажмите на стрелки в окне предварительного просмотра прямоугольника, чтобы изменить размер и положение ROI. В этом примере, ROI не нужно, и все изображение анализировали. (F) в качестве канала источника выберите канал 3 (сигнал золото-BSA-родамина NPS). Проверьте гладкий вариант для настройки плавности результирующей области. Определить значение вручную или принять автоматически сгенерированное значение. Здесь была использована 0,1 мкм. Для "пороговых" выберите опцию "абсолютная интенсивность". (G), для регулировки порогового выбора ручного варианта и установить значение (в данном примере 15 было использовано). В области просмотра поверхности порог предварительного просмотра отображаются серым цветом. (H) На вкладке "Оцените поверхностей" Полученная поверхность могут быть отфильтрованы по различным критериям. Фильтр по умолчанию 'число вокселей> 10 ».Фильтр можно регулировать путем ввода нового значения и другие фильтры могут быть добавлены. В этом примере, мы сохранили фильтра 'Количество вокселей> 10 ». (I), чтобы завершить создание поверхности нажмите на кнопку "Готово". В списке объектов теперь снимите флажок окно для элемента объема и вновь созданной поверхности отображается в области просмотра в красный цвет. (J) В превзойти зрения цвет предметов меняться от фиолетового до красного в зависимости от их площади. (K) 'земля Числа Area' таблица показывает статистическую информацию. Экспорт статистики в файл Excel. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
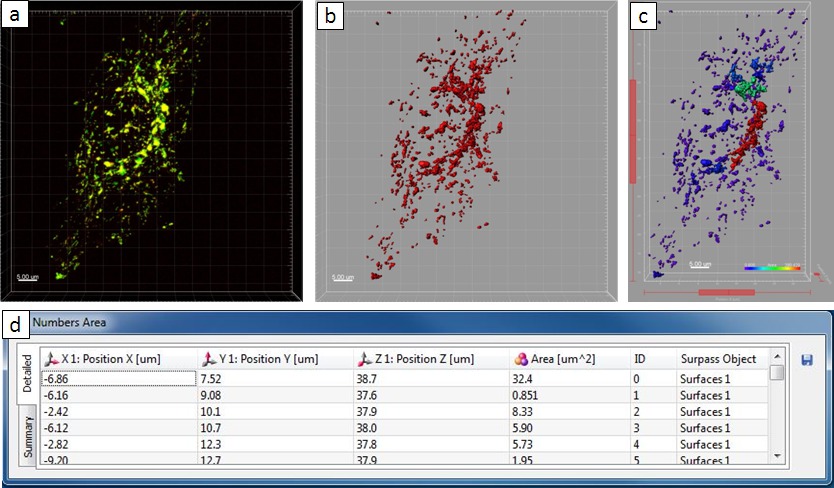
Рисунок 6. Количественный результат анализа не-инфицированной клетки. ( ) конфокальной микроскопии изображение. (B) вновь созданной поверхности. (C) новая поверхность в превзойти зрения. (D) "земля Числа Area 'таблица показывает статистическую информацию. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Обсуждение
Эндо-лизосомальных система клетках млекопитающих контролирует важные физиологические процессы, в том числе поглощения питательных веществ, гормонов опосредуется сигнальной трансдукции, иммунного надзора и презентации антигена 17. До сих пор, множество маркеров были использованы для мечения эндоцитических пути и отслеживания исследований. Например, Lysotracker зонды люминесцентные acidotropic зонды, разработанные молекулярных проб (Life Technologies, США) для лизосом маркировки, которые могут избирательно накапливаться в клеточных отсеках с низким внутренним рН и эффективно этикетке живые клетки при концентрациях наномолярных 18. Тем не менее, долгое время инкубации Lysotracker зондов с клетками может вызвать увеличение лизосом рН и привести к потенциальным физиологических изменений лизосом 19. Некоторые крупные биомолекулы, такие как флуорофорных меченных декстранов, также часто используются для эндосом / лизосом маркировки. Тем не менее, с низким уровнем фотостабильность, короткие циркуляции жизнь, и рсохранение OOR при фиксации препятствовать их приложения в долгосрочной изображений живых клеток и корреляционно-микроскопические исследования 16,19. Здесь, золото-BSA-родаминовые НП были использованы в качестве жидкости индикаторов для обозначения хоста системы сотовой связи эндо-лизосом. Наблюдались высокая эффективность поглощения и сильные внутриклеточные сигналы флуоресценции. Почти полное колокализация Соседства с лизосом гликопротеина LAMP1, который высоко обогащенного на мембране конце эндосомах / лизосом, проверяется надлежащей маркировки системы эндо-лизосом по НЧ. Совместное использование флуоресцентных наночастиц с другими маркерами, такими как Lysotracker может предоставить дополнительную информацию о клетки-хозяина везикулярного торговли и созревания.
Стоит отметить, что сотовый интернализации наночастиц в значительной степени зависит от их физических размеров и химических компонентов. Мы протестировали золото-БСА-родамин NPS размером 5 нм, 10 нм, 15 нм и 30 нм, и аналогичным внутриклеточного распределения внаблюдались побочные HeLa клетки (результаты не показаны). Мы использовали HeLa клетки, удобное клеточной линии для сальмонеллез исследований. Тем не менее, золото-BSA-родамин НП также может быть легко усвоены различных других клеточных линий и первичных клеток поддаются. Например, мы наблюдали Salmonella индуцированной трубчатые структуры и маркировки НП в СНО, COS-7, CaCo2, или 3Т3 клеток, а также в интерферона-γ-стимулированной RAW264.7 макрофагов, как клетки клеточных линий или первичных мышиных макрофагов и дендритные клетки. Тем не менее, каждая линия клеток потребует регулировки инфекции и протоколов импульсов / Chase.
Сообщалось, что краситель-ловушку НЧ диоксида кремния может быть использован в качестве биосовместимого долгоживущие и высокой фотостабильным лизосом маркера 19, и мы также сравнивали поведение родамина легированного кремния наночастиц с различной величины (30 - 1000 нм). Надлежащей маркировки конце эндосомах / лизосом кварцевыми ИГ неинфицированных клеток и накопление наночастиц в SНаблюдалось резюме и SIF в клетках Salmonella -infected. Тем не менее, из-за образования агрегатов наночастиц или большого размера отдельных наночастиц диоксида кремния, распределение наночастиц по сальмонеллы индуцированной трубчатых структур не было однородным (данные не показаны).
Характерной особенностью SCV, а также SIF является наличие высококвалифицированных богатых лизосомальных гликопротеинов, таких как LAMP1 12. Здесь линия клеток HeLa, стабильно экспрессирующих ЛАМПА1-GFP был использован для удобства живых клеток изображений системы эндо-лизосом и SCV и SIF структуры. Штаммы Salmonella конститутивно экспрессирующих GFP повышенную были использованы в экспериментах с инфекцией, чтобы указать местоположение бактерий , Из-за одинакового размера и формы внутриклеточных бактерий, бактерий GFP флуоресценции в целом легко отличить от GFP меткой на эндо-лизосомальных мембран. Тем не менее, для будущих экспериментов, в которых флуоресцентный сигнал от бактерий и мембраны прoteins должны быть точно дифференцируются другие белки флуоресцентной Fusion, например, mTurquoise, рекомендуется быть интегрированы. Это, однако, приводит к дополнительным раундов освещения и получения изображения, несущие риск более высокой фото-повреждения в экспериментах с живыми клетками.
Чтобы узнать основные гены и механизмы для бактериальные патогены манипулировать клетке-хозяине путей, многочисленные мутанты должны быть созданы и их выступления должны быть тщательно сравнить. Например, Salmonella мутантные штаммы Δ ssaV и Δ SIFA которые сильно ослаблена в системной вирулентности и внутриклеточной репликации 20,21. Оба штамма Δ ssaV и Δ Сифа не вызывают SIF, и, кроме того Δ SIFA Salmonella потерять мембрану SCV в ходе инфекции 12. Сравнение фенотипы WT и мутантных штаммов играет важную роль в понимании способность к Salmonella гemodel клетка-хозяин везикулярного трафика. На основе микроскопического исследования, очевидно, что БТ Salmonella разрушить клетки-хозяина эндоцитических пути в гораздо большей степени по сравнению с Δ Δ ssaV и SIFA мутантных штаммов. Эта функция может позволить внутриклеточной сальмонеллы, чтобы получить больше питательных веществ для их внутриклеточного выживания и репликации.
Конфокальной микроскопии изображения наглядно демонстрируют реконструкцию клетки-хозяина системы эндо-лизосом внутриклеточными бактериями. Тем не менее, количественный анализ изображений требуется для точного сравнения. В способе, описанном здесь, программное обеспечение Imaris используется для извлечения 3D объекты, которые имеют интенсивность флуоресценции в канале 3> 15 и количество вокселей> 10. Эти объекты, как предполагается, будет внутриклеточные мембранные структуры, содержащие золото-BSA-родамин NPS. Порог интенсивности флуоресценции и фильтры могут быть определены в соответствии с качеством изображения, но Shoulбы быть постоянным для сравнения различных условий или деформации. Здесь показаны примеры не-инфицированной клетки и -infected клетки WT Salmonella в 8 ч пи, с 431 и 67 объектов, выделенных соответственно. Несмотря на кажущуюся разницу, это не рационально сравнить только количество объектов, так как размер ячеек не то же самое. Одно из решений состоит в нормализации количества объектов, суммированного области (в данном примере, 2252 мкм 2 и 1975 мкм 2, соответственно) или сумма флуоресцентных интенсивностей объектов внутри клеток. В качестве альтернативы, также возможно проследить одну ячейку до инфекции и в различных временных точках пи для сравнения распределение наночастиц на различных стадиях инфекции.
В заключение следует отметить, в этом способе золото-БСА-родамина НЧ были применены для обозначения эндо-лизосом систему эукариотических клетках. Манипуляция хост сотовой системы эндо-лизосом с помощью intracellulaR возбудитель наблюдалось живой CLSM клеток и результатов количественного анализа показали экстремальные перестановки поздних эндосом / лизосом мас сальмонеллы. Salmonella был использован в качестве модели возбудителя в данном исследовании, но внутриклеточного поведения других бактериальных патогенов, таких как Shigella Флекснера и листерий также может быть исследована с использованием этого подхода. В принципе, золото-BSA-родамина НЧ может быть усвоены большим разнообразием клеточных линий, поэтому перспективны быть широко применяется в исследованиях следственных взаимодействие эндоцитоза пути с расходящимися эндогенных или экзогенных веществ.
Раскрытие информации
No conflicts of interest declared.
Благодарности
This work was supported by the Deutsche Forschungsgemeinschaft by grant Z within Sonderforschungsbereich 944 ‘Physiology and Dynamics of Cellular Microcompartments’ and HE1964/18 within priority program 1580.
Материалы
| Name | Company | Catalog Number | Comments |
| Gold chloride | Sigma-Aldrich | 520918 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Tri-sodium citrate | Sigma | C8532 | |
| Bovine serum albumin | Sigma | A2153 | |
| NHS-Rhodamine | Pierce | 46406 | |
| DMSO | Sigma | D8418 | |
| HEPES | Sigma | H3375 | |
| Gentamicin | Applichem | A1492 | |
| Kanamcyin | Roth | T832 | |
| Carbenicillin | Roth | 6344 | |
| 8-well chamber slides | Ibidi | 80826 | tissue culture treated, sterile |
| Imaris Software | Bitplane | version 7.6 | various configurations available |
Ссылки
- Coto-Garcia, A. M. Nanoparticles as fluorescent labels for optical imaging and sensing in genomics and proteomics. Anal. Bioanal. Chem. 399, 29-42 (2011).
- Xie, J., Lee, S., Chen, X. Nanoparticle-based theranostic agents. Adv. Drug Deliv. Rev. 62, 1064-1079 (2010).
- Ruedas-Rama, M. J., Walters, J. D., Orte, A., Hall, E. A. Fluorescent nanoparticles for intracellular sensing: a review. Anal. Chim. Acta. 751, 1-23 (2012).
- Wu, C., Chiu, D. T. Highly fluorescent semiconducting polymer dots for biology and medicine. Angew. Chem. Int. Ed. Engl. 52, 3086-3109 (2013).
- Giepmans, B. N., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nat. Methods. 2, 743-749 (2005).
- Kumar, D., Saini, N., Jain, N., Sareen, R., Pandit, V. Gold nanoparticles: an era in bionanotechnology. Expert Opin. Drug Deliv. 10, 397-409 (2013).
- Dykman, L. A., Khlebtsov, N. G. Uptake of engineered gold nanoparticles into mammalian cells. Chem. Rev. 114, 1258-1288 (2014).
- Chithrani, B. D., Ghazani, A. A., Chan, W. C. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6, 662-668 (2006).
- Finlay, B. B., Cossart, P. Exploitation of mammalian host cell functions by bacterial pathogens. Science. 276, 718-725 (1997).
- Bhavsar, A. P., Guttman, J. A., Finlay, B. B. Manipulation of host-cell pathways by bacterial pathogens. Nature. 449, 827-834 (2007).
- Malik-Kale, P., et al. Salmonella - at home in the host cell. Front. Microbiol. 2, 125(2011).
- Rajashekar, R., Liebl, D., Seitz, A., Hensel, M. Dynamic remodeling of the endosomal system during formation of Salmonella-induced filaments by intracellular Salmonella enterica. Traffic. 9, 2100-2116 (2008).
- Schroeder, N., Mota, L. J., Meresse, S. Salmonella-induced tubular networks. Trends Microbiol. 19, 268-277 (2011).
- Drecktrah, D., Knodler, L. A., Howe, D., Steele-Mortimer, O. Salmonella trafficking is defined by continuous dynamic interactions with the endolysosomal system. Traffic. 8, 212-225 (2007).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. Eur. J. Cell Biol. 38, 87-93 (1985).
- Zhang, Y., Hensel, M. Evaluation of nanoparticles as endocytic tracers in cellular microbiology. Nanoscale. 5, 9296-9309 (2013).
- Pollard, T. D., Earnshaw, W. C., Lippincott-Schwartz, J. Chapter 22. Cell Biology. , (2007).
- LysoTracker and LysoSensor Probes. , Life Technologies Corporation. Carlsbad, CA. (2013).
- Shi, H., He, X., Yuan, Y., Wang, K., Liu, D. Nanoparticle-based biocompatible and long-life marker for lysosome labeling and tracking. Anal. Chem. 82, 2213-2220 (2010).
- Hensel, M. Genes encoding putative effector proteins of the type III secretion system of Salmonella pathogenicity island 2 are required for bacterial virulence and proliferation in macrophages. Mol. Microbiol. 30, 163-174 (1998).
- Beuzon, C. R., et al. Salmonella maintains the integrity of its intracellular vacuole through the action of SifA. EMBO J. 19, 3235-3249 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены