Method Article
형광 나노 입자의 응용 프로그램은 세포 내 세균에 의해 엔도 - 리소좀 시스템의 리모델링을 연구하기 위해
요약
이 문서에서는 합성 및 나노 입자의 형광 라벨 NPS ()하는 방법을 설명합니다. NPS는 진핵 세포의 엔도 - 리소좀 시스템에 레이블을 펄스 - 체이스 실험에 적용되었다. 세포 내 병원균 살모넬라 엔테의 활동에 의한 엔도 - 리소좀 시스템의 조작은 라이브 세포 이미징 및 정량화 따랐다.
초록
바람직한 화학, 광학 및 기계적 특성을 가진 형광 나노 입자 (NPS는) 세포 내 소기관에 레이블 유망한 도구입니다. 여기서, 우리는 진핵 세포의 엔도 리소좀 시스템 라벨과 세포 내 병원체 살모넬라 엔테 의해 호스트 세포질 통로의 조작을 모니터링하기 위해 골드 - 로다 BSA NPS를 이용하는 방법을 소개한다. NPS는 용이 늦은 엔도 솜 / 리소좀으로 HeLa 세포에 의해 내부화 된 및 집중 하였다. 살모넬라 감염 Salmonella- 유도 막 구조체 및 소포 및 축적 된 NP의 재 배열을 유도. 우리는 공 촛점 현미경 이미지의 정량적 분석을 위해 Imaris 소프트웨어 패키지를 배포. 개체의 개수 및 비감염 세포에서 크기 분포가 매우 WT 살모넬라 엔도 리소좀 시스템의 개장 나타내는 살모넬라 -infected 세포들로부터 구별 하였다.
서문
등의 금속 NP에, 양자점, NP는 폴리머, 실리카 NP는, 탄소 도트 포함한 형광 나노 입자 (NPS는), 지난 수십 년 동안 1,2- 상당한 주목을 받고있다. 기존의 유기 염료에 비해 형광 NPS는 이러한 강한 신호 강도 photobleaching에 저항과 높은 생체 적합성과 같은 3,4- 바람직한 화학적, 광학적 및 기계적 특성을 보여준다. 이러한 장점은 그 세포 내 감지 및 라이브 세포 이미징에 대한 선택의 방법합니다. 또한, 전자 밀도가 된 NP의 다양한 EM 5 초 미세 수준에서 광학 현미경 (LM)과 높은 해상도로 추적 라이브 셀의 조합을 할 수 있습니다 상관 현미경 분석에 대한 사용을 촉진, 전자 현미경 (EM)로 볼 수 있습니다. 예를 들어, 금 NPS는 효율적 민감한 진단 살아있는 세포뿐만 아니라 면역 표지 (6)의 분야에서 바이오 센서로서 사용 장시간왔다. 최근의tudies 다른 크기 및 형상 골드 NPS에서 세포주 많은 다양한 흡수는 일상적 엔도 좀 경로를 통해 운송, 따라서 큰 잠재력의 존재는 세포 내 소포 반송 추적 및 엔도 리소좀 시스템 라벨링 적용될 용이하게 할 수 있음을 나타내 7,8 .
살모넬라 엔테, 시겔 flexneri 및 리스테리아 균 등의 미생물 병원균, 비 식세포 숙주 세포 9 침입하는 다른 메커니즘을 개발했습니다. 내면화 한 후, 병원균, 중 세포질에 지역화 또는 막 결합 구획에 압수은, 자신의 호스트 환경과 상호 작용하고 자신의 생존 (10)를 선호하는 이들을 조절. 예를 들어, 살모넬라 엔테는 상주하며 세포 내 phagosomal 구획 감염 11시 살모넬라 함유 공포 (SCV)를 지칭 내에서 복제합니다. 성숙 SCV, 골지체으로 트래픽 세포 내 이입 경로와 지속적으로 상호 작용을 진행하고, 살모넬라 유도 된 필라멘트와 같은 광범위한 관상 구조, (SIF), 넥신 세관 정렬, 살모넬라 유도 된 분비 캐리어 막 단백질 3 (SCAMP3) 세관 등의 형성을 유도 . 12 ~ 14. 이러한 병원성 세균이 숙주 세포 경로를 조작하는 방법을 공부하는 것은 이해 감염성 질환에 필수적이다.
여기서, 금 BSA-로다 된 NP는 숙주 세포 엔도 리소좀 시스템에 라벨 유체 추적자로 사용하여, 인간의 위장관 병원체 살모넬라 엔테 혈청 형 티피 뮤 리움 (살모넬라)와 병원체의 상호 작용을 연구하는 모델 박테리아로서 사용 세포 내 이입 통로를 개최. WT 살모넬라 돌연변이 균주에 감염된 비감염 세포와 세포에서의 세포 내 금 BSA-NP에 로다는 공 초점 레이저 주사 현미경 (CLSM)에 의해 촬영 하였다.이어서 Imaris 소프트웨어는 살모넬라 감염 엔도 좀 / 리소좀 극단적 재 배열을 유도 나타내는 NPS에서의 분포를 정량화하는 데 사용되었다. 이 방법의 설명에 이어, 유사한 실험은 내재화 된 NP의 장기 거동을 추적 및 진핵 세포의 세포 내 이입 경로에 다양 외인성 또는 내인성 인자 물질의 영향을 조사하기 위해 설계 될 수있다.
프로토콜
10 nm의 금 나노 입자 (골드 NP에) 15 1. 합성
- 솔루션을 준비 : 160 ml의 밀리-Q, 또는 두 번 증류 물에 2 ml의 1 % 수성 금 염화을 추가합니다.
- 용액 B를 준비 : 32 ml의 밀리-Q, 또는 두 번 증류 물에 8 ml의 1 % 트라이 구연산 나트륨 × 2 H 2 O 160 ㎕의 1 % 타닌산을 추가합니다.
- 60 ° C에 용액 A와 B를 따뜻하게하고 교반하면서 그들을 섞는다. 바로 다크 블루 색상을 관찰합니다. 약 15 분 후 붉은 색을 관찰한다. 그 후, 95 ° C까지 가열 5 분을 유지하고 RT에 대한 해결책을 냉각.
- 탄소 코팅 격자에 NP 현탁액의 드롭을 추가하고 공기를 건조 할 수 있습니다. 투과형 전자 현미경으로 된 NP의 크기 및 형태를 확인한다.
로다 민 N-히드 록시 숙신 에스테르 (NHS)와 BSA와 레이블 골드 NP에 2. 코팅 (16)
- 30 분 동안 15,000 XG에 1.5 ㎖의 에펜 도르프 튜브에 900 μL에게 원심 분리기를 금 NPS를 추가합니다. 연산전통적, 5 월 한 번에 여러 개의 튜브를 준비합니다.
- 900 μL의 펠렛 살균 밀리 Q 물을 다시 중단하고 100 μL 2 ㎎ / ㎖ BSA / PBS를 추가, 상층 액을 버리고 30 분 동안 800 rpm으로 소용돌이에 섞는다.
- 초과 BSA를 제거하려면 60 분 동안 15,000 XG에서 준비를 원심 분리기.
- 상층 액을 제거하고, 125 μl의 PBS에서 금 BSA NPS를 다시 일시 중지, 1 M 중탄산 12.5 μl를 추가합니다.
- 즉시 사용하기 전에, 로다 민 NHS / DMSO의 10 ㎎ / ㎖ 용액을 제조 금 BSA NP에 현탁액 1ml를 할 로다 민 NHS / DMSO 용액 30 μl를 추가합니다. 빛에 노출을 피하고, 800 rpm으로 혼합 동안 실온에서 2 시간 (또는 O / N)에 대한 반응을 품어.
- 48 시간 - 36의 기간 동안 5 버퍼 변경 4 ºC에서 PBS에 대한 투석을 통해 금 BSA-로다 민 NPS를 정화.
- , NPS를 안정화 각 1 ml의 금 BSA-로다 민 NP에에 200 ㎎ / ㎖ BSA / PBS의 10 μl를 추가합니다. 15, 무료 또는 BSA-로다 민 발표 원심 분리기를 제거하려면,60 분 동안 000 XG. 빛에 대한 노출을 피하기 위해, 4 ° C에서 OD (520), 및 저장소를 측정, 2 ㎎ / ㎖ BSA / PBS에 펠렛을 재현 탁.
- 밀리-Q 또는 더블 증류수로 NP에 10 배 희석, 탄소 코팅 격자 상에 드롭을 추가하고, 공기를 건조 할 수 있습니다. 투과 전자 현미경 (TEM)으로 NP에의 크기 및 형태를 확인한다.
주 : NP 제제에서 사용되는 모든 재료는 멸균시키고, 동작은 세포 배양 후드에서 화염 또는 옆 벤치에 행 하였다.
HeLa 세포 3. 문화
- 영구적 LAMP1-GFP를 발현하는 HeLa 세포를 10 % 소 태아 혈청 (FCS)와 DMEM에서 배양하고, 5 % CO 2를 함유하는 분위기하에 37 ℃에서 성장된다.
- 8 잘 챔버 슬라이드 (Ibidi)에서 잘 50,000의 밀도로 세포를 종자 및 / N을 O를 품어.
박테리아 4. 문화
- 사용 살모넬라 엔테 혈청 형 Typhimurium의 NCTC 12023 줘야D 타입 (WT) 변형. 비교를 위해, SIF에 대한 키 이펙터 시파 부족 SPI2-T3SS 및 Δ 시파에서 Δ ssaV 결함이있는 돌연변이 균주를 사용합니다. 강화 된 GFP의 구성 적 발현 플라스미드 pFPV25.1을 품고 균주를 사용합니다.
참고 : 세균 균주가 50 ㎍ / ㎖의 카르 베니 실린 및 / 또는 50 ㎍ / ㎖의 카나마이신 (Δ ssaV, Δ 시파의 추가와 함께 50 ㎍ / ml의 카르 베니 실린 (WT)와 LB의 추가와 함께 (LB) 루리아 - 베르 타니 국물에 일상적으로 배양 )의 플라스미드를 유지하는 데 필요한. - 다음 신선한 LB에 1:31 희석 3.5 시간 동안 성장을 계속, 적절한 항생제로 3 ㎖ LB에서 박테리아의 단일 콜로니를 접종하고 폭기 진탕 조건에서 37 ºC에서 / N을 O 성장. 이 시간 시점에서 배양 후반 로그 상에 도달하고 박테리아 매우 침습적이다. '롤러 드럼'폭기 테스트 튜브 문화를 배양하는 것이 편리하다.
HeLa 세포의 감염에 의해 5.살모넬라 균과 골드 BSA-로다 민 NPS는 체이스 - 라벨 (방식에 대한 그림 1 참조) 펄스
- 계대 배양 균의 OD (600)를 측정하고 1 ㎖의 PBS (~ 3 × 108 CFU / ㎖) 600 = 0.2 중독 묽은의 다양성을 달성하기 위해 8 웰 챔버 슬라이드에서 HeLa 세포에 박테리아의 적당량을 추가 감염 100 (MOI).
- 비 내면화 박테리아를 제거하기 위해 PBS로 3 회, 세포 배양기에서 30 분 동안 인큐베이션 세척 (이 시점을 0 시간의 감염 후, 0 시간 또는 파이로 설정 하였다). 100 ㎍ / ㎖의 겐타 마이신을 함유하는 신선한 배지 300 μl를 추가하고 1 시간 동안 유지한다. 그런 다음 배양 시간의 나머지 10 ㎍ / ㎖의 겐타 마이신을 포함하는 새로운 매체와 매체를 교체하십시오.
- 1 시간 동안 100 ㎍ / ㎖의 젠타 마이신을 함유하는 배양 배지로 배양 한 후, 배지는 공동 (30 mM의 HEPES, pH가 7.4, FCS, L 글루타민, 페놀 레드 및 중탄산 나트륨없이 이글스 MEM) 매질을 묘화로 대체10 ㎍ / ㎖의 겐타 마이신을 ntaining. 골드 BSA-로다 NPS는 OD = 0.1 (520)의 최종 농도를 얻기 위해 HeLa 세포에 첨가 하였다.
참고 : 골드 BSA-로다 민 NPS는 또한 감염 전에, 또는 다양한 시간 포인트 파이에서 세포에 첨가 할 수있다 - 1 시간 배양 한 후, 배지를 제거 PBS로 3 회 세척하고, 배양 시간의 나머지 10 % FCS 및 10 ㎍ / ㎖의 겐타 마이신을 포함하는 새로운 영상 매체의 300 μl를 추가합니다.
참고 : 배양 기간이 사용 된 NP 및 세포주의 농도에 따라 달라질 수 있습니다. RAW264.7 대 식세포를 위해, 우리는 충분히 내재화 허용 OD 520 = 0.05의 농도로 된 NP와 그 30 분의 인큐베이션을 관찰했다.
6. 이미징
- 서로 다른 시간 지점에서 고해상도 이미징을위한 가습 환경 챔버와 공 초점 레이저 주사 (CLSM) 또는 회전 디스크 (SD) 현미경으로 공 초점 이미징 시스템을 사용합니다.
- 온도 C에 스위치가 안정 될 때까지 시스템을 조작부 기다립니다. 이러한 확대, 스캔 속도, 해상도, Z-스택 등 GFP에 적합한 여기 / 방출 설정을 사용하여 금 BSA-로다 민 NP에 같은 이미지 설정을 최적화합니다. 이 프로토콜의 경우, 512 X 512 픽셀의 400 Hz의 스캔 속도, 해상도 및 0.25 μm 인 Z-스텝 크기를 사용한다. GFP 각각 아르곤 레이저 (488 nm의)와 헬륨 네온 레이저 (543 nm의)를 사용하여 금 BSA-로다 민을 흥분. 세포의 형태를 관찰하기위한 명 시야 (BF) 채널을 포함. 현미경 시스템 및 다른 감염 조건의 경우, 설정은 적절하게 조정되어야한다.
참고 사진 승수 (PMT) 검출기로 검출 된 BF 채널과 신호의 광원과 같은 아르곤 레이저를 사용합니다. - 표시된 시간 - 점에서 PI, 스테이지 현미경 및 기록 이미지에 감염된 세포를 함유하는 8 웰 챔버 슬라이드 마운트.
이미지 7. 분석
- 현미경 이미지 분석 소프트웨어를 사용 (참조 재료 및 장비의 표) 세포 내 살모넬라 균에 의해 엔도 - 리소좀 시스템의 개조를 분석합니다. '열기'를 클릭하고 파일을 선택하여 데이터를 엽니 다.
참고 : 또한, 같은 ImageJ에 나 피지 같은 오픈 소스 소프트웨어 패키지 양적 이미지에 사용될 수있다 분석한다. - 아이콘 뷰를 능가 클릭의 개체 도구 모음에서
 새로운 표면 항목을 추가 할 수 있습니다. 에 클릭
새로운 표면 항목을 추가 할 수 있습니다. 에 클릭  (다음).
(다음). - 관심 (ROI)의 지역을 선택 세그먼트 ROI를 분석합니다. 보기 영역에서 이미지 위에 겹쳐 사각형 테두리가 절에서는 투자 수익 (ROI)을 대표한다. Y-, 해당 x 축에 값을 입력하고 Z- 필드 또는 직접 크기와 ROI의 위치를 변경하려면 미리보기 사각형에 화살표를 클릭합니다. 다음을 클릭합니다
= "/ 파일 / ftp_upload / 52058 / 52058icon2.jpg"/> (다음).
- 소스 채널로 선택 채널 3 (금 BSA-로다 민 NP에 대한 신호). 결과 영역의 부드러움을 설정하는 부드러운 옵션을 선택합니다. 수동으로 값을 정의 또는 자동으로 생성 된 값을 적용합니다. 임계 값의 경우, 절대 강도 옵션을 선택합니다.
- 임계 조정 용의 옵션을 선택하고 값을 설정. 보기 영역에서, 표면 임계 미리보기가 회색으로 표시됩니다.
- 탭 분류 표면에 생성 된 표면은 여러 기준에 의해 필터링 할 수 있습니다. 기본 필터는 다른 필터 '복셀> (10)의 수'는 '추가'를 클릭하여 포함시킬 수있다. 필터링이 필요없는 경우, 삭제 버튼을 클릭하여 모든 필터를 삭제합니다. 클릭
 (다음).
(다음). - 표면 생성을 완료하려면 클릭/files/ftp_upload/52058/52058icon3.jpg은 "/> (마침). 개체 목록에서 지금 확인되지 않은 항목의 볼륨 및 새로 생성 한 표면의 상자 것은보기 영역에 표시됩니다.
- 통계를 내 보냅니다. 이제 능가보기에서 대상의 색상은 지역에 따라 보라색에서 빨간색으로 변화한다. 그리고 '플롯 번호 영역'표는 통계 정보 (예를 들어, ID 번호와 객체의 영역)를 보여줍니다. 클릭하여 Excel 파일을 사면 (1)의 모든 통계를 내 보냅니다
 (저장).
(저장).
결과
골드 NPS는 구연산과 타닌산에 의해 염화 금산의 감소를 통해 확립 된 방법을 통해 생성되었다. 도 2a에 도시 된 바와 같이, 합성 금 NPS는 약 10 nm의 크기와 모양에 준 구형이다. BSA 코팅 및 로다 민 - 라벨은 형태 나 크기 (그림 2B)에 영향을 미치지 않았다.
이것은 금 NP에 용이 다양한 포유 동물 세포에 의해 흡수 및 세포 내 이입 시스템 (7)에서 종료 할 수 있다고보고되었다. 기존의 연구에 따르면, 밝은 적색 형광 신호는 세포의 NP에 효과적으로 내재화를 나타내는, 금 BSA - 로다 민 NP는 (도 3, WT 5 열연 PI)와 함께 1 시간 배양 후 HeLa 세포에서 관찰되었다. 빨간 신호의 대부분은 국민 연금이 늦게 엔도 솜 또는 리소좀에 국한되었다는 것을 보여주는, 녹색 신호와 colocalized 발견되었다. 그러나 후반 엔도 솜 / 리소좀에서 NP에의 균일 한 분포와는 달리감염되지 않은 세포 (그림 3, 모의)에서, 그 위치는 크게 WT 살모넬라 -infected 세포 재 배열되었다. (그림 3, WT 5 시간 파이) 감염의 초기 단계에서 살모넬라 균은 SCV에서 복제하고 SIF는 빠른 확장 또는 수축 운동을 겪는다. 다른 분획 아직 자유 늦은 엔도 솜 / 리소좀에있는 동안,이 시점에서, NP에의 분획, SCV 및 SIF에서 발견되었다. 8 시간의 PI에서 (도 3, WT 8 시간의 PI), SIF의 안정화 된 네트워크를 형성하고, 단지 매우 작은 부분이없는 늦은 엔도 솜 / 리소좀에있는 남아있는 동안 가장 된 NP는 관형 구조체 내에 축적 발견되었다. 돌연변이 균주 Δ ssaV과 Δ 시파는 별개의 행동을 보였다. 그림 3 (Δ ssaV)에 나타낸 바와 같이 더 SIF 구조가 형성되지 동안, 8 시간 파이에서, Δ ssaV은 SCV 내부에 국한되었다. 일부 국민 연금 연어 주변 관찰되었다SCV 내부 엘라하지만, NP에의 대부분은 여전히 무료 후반 엔도 솜 / 리소좀에 위치했다. Δ 시파 변형 (그림 3, Δ SIFA)의 경우, 세포질에 살모넬라 균의 탈출이 발생하고, NP에 박테리아 사이의 연관성은 관찰되지 않았다.
우리의 이전 연구에서이 발견 된 그 SIF 디스플레이 매우 동적 인 감염의 초기 단계에있는 호텔 (3-5 시간의 PI),하지만 나중에 기간 (> 8 시간 파이) (12)에서 안정화된다. 감염의 초기와 후기 단계에서 살모넬라 균이 세포 내 NP에의 분포를 재 배열 비교 능력이 있는지 여부를 따라서, 우리는 궁금합니다. 내재화 된 NP 대부분 축적 관찰 모든 경우에서 1 시간 동안 - (7- 열연 PI 1),도 4에 도시 된 바와 같이, 골드 된 NP는 HeLa 세포 O / N 감염 전 또는 감염 후 상이한 시간 점에서 함께 인큐베이션시켰다 SCV 또는 SIF.
현미경 observ관리 포인트는 숙주 세포의 엔도 - 리소좀 시스템의 대규모 재 배열에서 살모넬라 결과에 의해 그 감염을 밝혔다. 다음 단계로서, 우리는 살모넬라 정량적 방식으로 유도 된 숙주 세포의 표현형 분석을 위해 Imaris 소프트웨어 패키지를 사용 하였다. 예로서 8 시간 파이 하나 감염 헬라 세포의 이미지를 사용하여, 정량 분석을위한 단계적인 명령은도 5에 도시되어있다. (15)의 강도 임계치와 '복셀 수가> 10'필터 내지도 3d 객체는 원래의 이미지 파일로부터 추출 하였다. 개체는 금 BSA-로다 민 국민 연금에 위치하는 세포 내 구조로되어 있었다. 이 예에서, 개체는 67 μm의 1,974.64 2와 합산 면적 총 추출 하였다. 다른보다 작은 50㎛의 2 동안 SIF 네트워크와 colocalized 큰 목적은, 1,836.23 2㎛ 정도의 영역을 갖는다. 비교를 위해 일례를 도시 퀀트감염되지 않은 세포의 itative 분석 결과에 주어졌다. 여기서, 431 개체 전체에서 추출하고, 이는 내부 면적의 평균값은 5 μm의 2이고, 가장 큰 오브젝트가 34 μm의 (2)의 영역이있다. 객체의 영역 합산은도 4에 감염된 세포 (1975 μm의 2)에 필적 2252 2 ㎛이다. 그러나, 오브젝트의 개수는 살모넬라 - 유도 관상 구조와 소포 2.10.8 융합을 나타내는 다른 하나 (431, 물체 (67) 각각)보다 훨씬 크다.
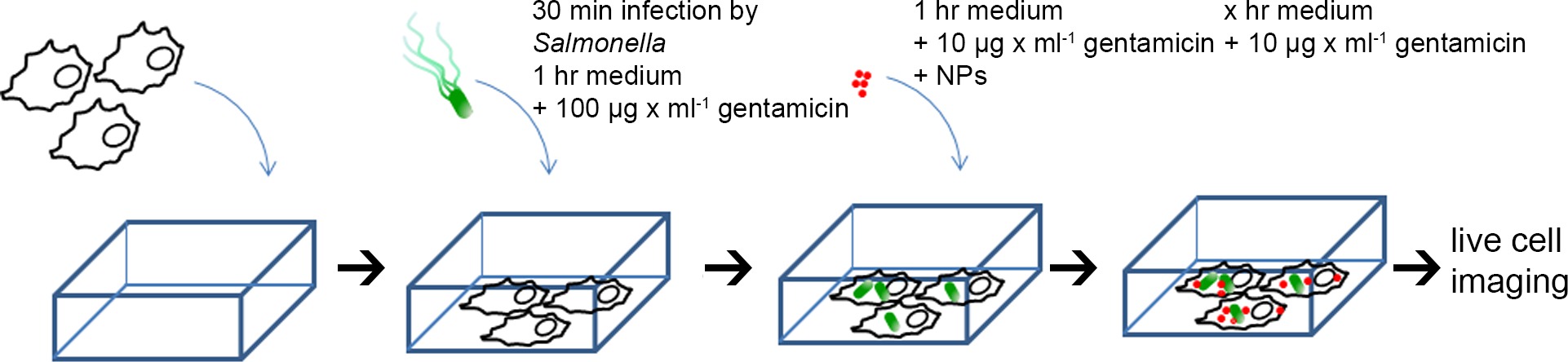
생균 이미징 HeLa 세포의 제조도 1 반응식. HeLa 세포를 챔버 슬라이드에서 시드 모의 감염된, 또는 30 분 동안 다양한 살모넬라 균주에 감염된 후 incubat, PBS로 3 회 세척 매체는 1 시간 동안 100 ㎍ / ㎖의 젠타 마이신을 함유하는과 ED. 이어서, 배지를 함유 배지 촬상로 대체 실험의 나머지 NP 배지에서 1 시간 동안 인큐베이션 한 후 쫓기는 10 nm의 금 - BSA - 로다 민 NP는 (OD 520 = 0.1) 및 10 ㎍ / ml의 겐타 마이신, . 라이브 세포 이미징이 서로 다른 시점에서 수행 된 감염 (PI)에 게시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
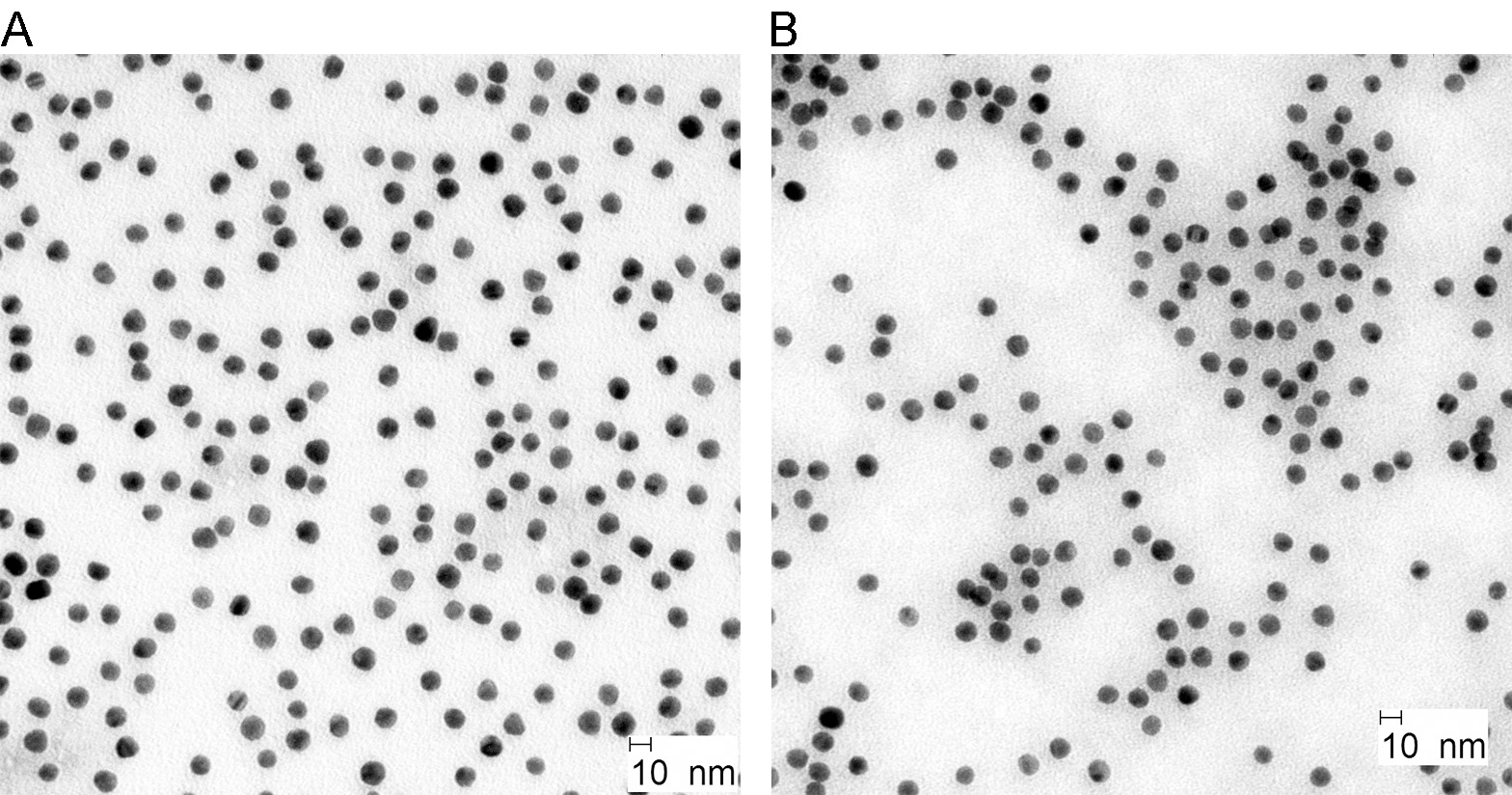
그림 전에 콜로이드 골드 NP에 2. TEM 이미지 (A) 및 라벨링 (B) 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

세포 내 살모넬라. 헬라 세포에 의해 호스트 세포 엔도 - 리소좀 시스템의 그림 3. 리모델링 모의에 감염된 10 nm의 금 BSA-로다 민 된 NP와 돌연변이 균주 및 펄스 / 체이스, 또는 살모넬라 WT, Δ ssaV 또는 Δ 시파에 감염했다 ( 도 1에 기재된 바와 같이 OD = 0.1 (520))을 수행 하였다. CLSM의 Z-스택 극대 강도 돌기가 도시된다. 스케일 바, 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 살모넬라 감염의 다양한 단계에서 엔도 - 리소좀 시스템 4. 접근성. 헬라세포는 10 nm의 금 BSA-로다 민 NP에 펄스 화 된 (OD 520 = 0.1) O / N 이전에 감염, 또는 지시 된 바와 같이 다양한 시간 포인트 파이에서 1 시간 동안. 표시됩니다 CLSM의 Z-스택의 9 시간 파이 최대한의 강도 예측 - 라이브 세포 이미징은 8시에 실시 하였다. 스케일 바, 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
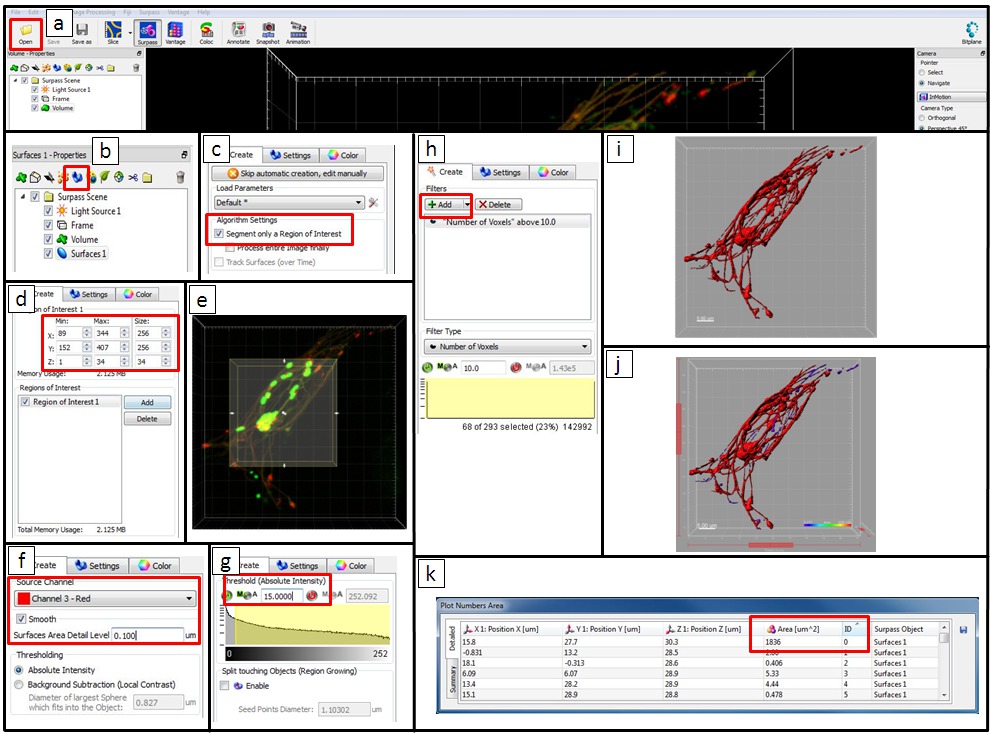
예를 들어 8 시간 파이에 감염 헬라 세포의 이미지를 사용 Imaris하여 정량 분석을위한 단계 명령에 의해 그림 5 단계. (A)는 '열기'를 클릭하고 파일을 선택하여 데이터를 엽니 다. 능가 뷰의 개체 도구 모음에서 (B) 새로운 표면 항목을 추가 할 수 있습니다. (C)는 다음 세그먼트에게 투자 수익 (ROI)을 선택, 투자 수익 (ROI)을 분석합니다. (D) Y-, 해당 x 축에 값을 입력하고 Z-필드 또는 (E)는 직접 크기와 ROI의 위치를 변경하려면 미리보기 사각형에 화살표를 클릭합니다. 이 예에서, ROI는 필요하지시키고, 전체 이미지가 분석되었다. 소스 채널로 (F)는 채널 3 (금 BSA-로다 민 NP에의 신호)을 선택합니다. 결과 영역의 부드러움을 설정하는 부드러운 옵션을 선택합니다. 수동으로 값을 정의 또는 자동으로 생성 된 값을 적용합니다. 여기서, 0.1㎛ 내지 사용 하였다. '임계 값'은 '절대 강도'옵션을 선택합니다. 임계 값 조정용 (G)가 수동 옵션을 선택하고 설정 값 (본 예 15에서 사용 하였다). 보기 영역에서 표면 임계 미리보기가 회색으로 표시됩니다. 탭 '분류 표면'결과 표면에 (H)는 다양한 기준으로 필터링 할 수 있습니다. 기본 필터는 '복셀> (10)의 수'입니다.필터는 새로운 값을 입력함으로써 조절 될 수 있고, 다른 필터가 추가 될 수있다. 이 예에서, 우리는 필터 '복셀> (10)의 수'를 유지했다. (I)는 '마침'에 표면 생성 클릭을 완료합니다. 개체 목록에서 지금 않은 체크 항목 볼륨 및 새로 생성 한 표면의 상자가 빨간색으로보기 영역에 표시됩니다. 피사체의 색이 자신의 지역에 따라 빨간색, 보라색 다를 능가하는 관점에서 (J). (K) '플롯 번호 영역'표는 통계 정보를 보여줍니다. Excel 파일로 내보내기 통계. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
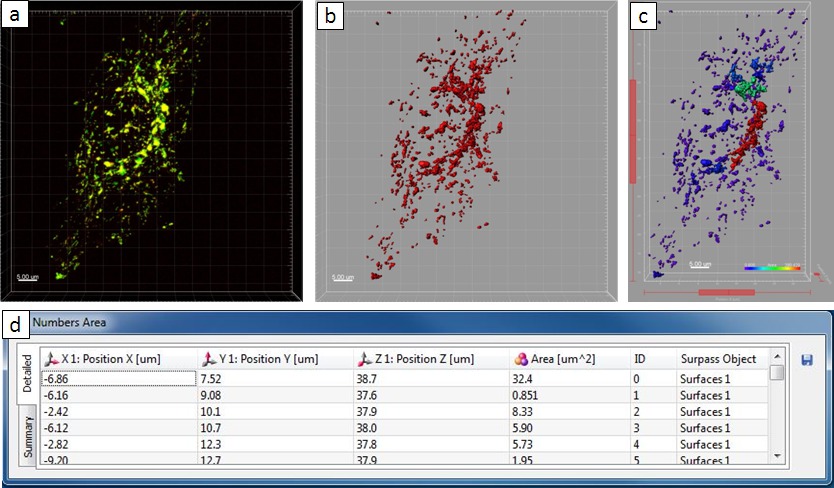
감염되지 않은 세포의 그림 6. 정량 분석 결과. ( A) 공 초점 현미경 이미지. (B) 새로 생성 한 표면. (C) 능가보기의 새로운면. (D) '플롯 번호 영역'표는 통계 정보를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
포유류 세포의 엔도 리소좀 시스템은 영양소 흡수, 호르몬 - 매개 신호 전달, 면역 감시 및 항원 제시 (17)과 같은 중요 생리 학적 과정을 제어한다. 지금, 마커의 다양한 세포 내 이입 경로 및 추적 연구의 표지에 사용 된 최대. 예를 들어, LysoTracker 프로브는 선택적으로 낮은 내부 pH가 세포 구획에 축적하고 효과적으로 나노 몰 농도 18 살아있는 세포에 레이블을 지정할 수 있습니다 리소좀 라벨링에 대한 분자 프로브 (생명 기술, USA)에 의해 개발 된 형광 acidotropic 프로브입니다. 그러나, 세포 LysoTracker 프로브의 긴 시간 배양 리소좀 pH의 증가를 유도하고 리소좀 (19)의 잠재적 인 생리적 변화가 발생할 수 있습니다. 이러한 형광 표지 된 덱스 트란과 같은 일부의 생체는 자주 엔도 / 리소좀 라벨에 사용된다. 그러나, 낮은 광 안정성, 짧은 순환 수명, P주시를 OOR 유지 장기 라이브 세포 이미징에 응용 프로그램을 방해하고 상호 현미경은 16, 19를 연구합니다. 여기서, 금 BSA-로다 NPS는 숙주 세포 엔도 리소좀 시스템에 라벨 유체 추적자로 사용 하였다. 높은 흡수 효율 및 세포 내 강한 형광 신호가 관찰되었다. 매우 늦은 엔도 솜 / 리소좀의 막에 풍부한 리소좀 당 단백질 램프 1과 NP에의 거의 완전한 colocalization을은 NPS에서 엔도 - 리소좀 시스템의 적절한 라벨을 확인했습니다. 예컨대 Lysotracker 같은 다른 형광 표식 된 NP의 사용을 조합하면, 숙주 세포 소낭 매매 및 성숙에 대한 상보적인 정보를 제공 할 수있다.
그것은 NP에의 세포 내면화가 물리적 크기와 화학적 구성 요소에 따라 크게 좌우 될 수 있음을 언급 할 가치가있다. 우리는 5 나노, 10 나노, 15 나노 및 30 나노 미터의 크기와 유사한 세포 내 분포와 금 BSA-로다 민 NPS를 테스트 한측면 HeLa 세포는 (결과 미도시)이 관찰되었다. 우리는 살모넬라 균 감염 연구를위한 편리한 세포주로 HeLa 세포를 사용했다. 그러나, 골드 BSA - 로다 민 NP에 또한 용이하게 다양한 세포주 및 일차 전지 내재화 의무가 될 수있다. 예를 들어, 우리는 살모넬라 CHO에서 NP, COS-7, CaCo2, 또는 3T3 세포에 의해 관상 구조 및 라벨 - 유도뿐만 아니라 인터페론 γ 자극 RAW264.7 대식 같은 세포주 세포 또는 기본 뮤린 대 식세포에서 관찰 수지상 세포. 그러나, 각각의 세포주를 감염 및 펄스 / 추적 프로토콜들의 조정을 요구할 것이다.
이는 염료 포획 실리카 NPS에서 생체 적합성이 장기적인, 및 높은 광 안정성 리소좀 마커 (19)로서 사용될 수 있다고보고, 우리는 또한 다양한 크기와 로다 도핑 된 실리카 된 NP의 동작과 비교 한 내용 (30 - 1000 나노 미터). S에서 NP에의 감염되지 않은 세포와 축적 실리카 NPS에서 후반 엔도 솜 / 리소좀의 적절한 라벨링살모넬라 -infected 세포에서 CV 및 SIF이 관찰되었다. 그러나, NP는 단일 또는 실리카 된 NP의 큰 크기, 살모넬라 - 유도 관상 구조와 함께 분배 된 NP의 응집체의 형성에 의한 (데이터 미기재) 균일하지 않았다.
뿐만 아니라 SIF SCV의 특징은 LAMP1 12 리소좀 매우 풍부 당 단백질의 존재이다. 여기서, 안정적 LAMP1-GFP를 발현 된 HeLa 세포주 엔도 리소좀 시스템의 생균의 이미징 편의상 SCV 및 SIF 구조를 사용 하였다. 구조적으로 강화 된 GFP를 발현 살모넬라 균주 박테리아의 위치를 나타 내기 위해 감염 실험에 사용했다 . 때문에 세포 내 세균의 균일 한 크기와 모양에, 일반적으로 박테리아 GFP의 형광 엔도 - 리소좀 막에 GFP 라벨 쉽게 구별이다. 그러나, 미래의 실험 세균 막 홍보에서 형광되는 신호oteins 정확하게 구별하는 다른 형광 융합 단백질, 예를 들어, mTurquoise해야, 통합하는 것이 좋습니다. 그러나, 이것은 실험 생균 높은 광 손상의 위험을 베어링, 조명 및 이미지 획득의 추가적인 라운드를 초래한다.
병원성 세균이 숙주 세포 경로를 조작하는 데 필수적인 유전자 및 메커니즘을 찾기 위해 수많은 돌연변이가 생성 될 필요가 자신의 공연을 신중하게 비교해야합니다. 예를 들어, 살모넬라 균 돌연변이 균주 Δ ssaV과 Δ 시파 매우 전신 독성 및 세포 내 복제 (20, 21)에 감쇠. 두 Δ와 Δ SIFA ssaV 균주 SIF를 유도하는 데 실패하고, 별도로 Δ SIFA 살모넬라 감염 (12)의 과정 동안 SCV 막을 잃는다. WT의 표현형과 변이주를 비교하면, R에 살모넬라의 능력을 이해하는 수단이있다emodel 숙주 세포 소낭 트래픽. 현미경 검사에 기초하여, WT 살모넬라 ssaV Δ와 Δ SIFA 변이주에 비해 훨씬 더 높은 정도의 숙주 세포 내 이입 경로를 파괴하는 것은 명백하다. 이 기능은 세포 생존과 복제에 대한 더 많은 영양분을 얻기 위해 세포 내 살모넬라 균을 활성화 할 수 있습니다.
공 초점 현미경 화상이 선명 세포 내 세균에 의해 호스트 세포 엔도 - 리소좀 시스템의 리모델링을 보여줍니다. 그러나, 화상의 정량 분석은 정확한 비교를 위해 필요하다. 여기에 설명 된 방법에서, Imaris 소프트웨어 형광 채널 3> (15)에 강도와 이러한 개체 금 BSA-로다 NPS를 함유하는 세포의 막 구조로 가정되는 복셀> (10)의 번호가 3D 객체를 추출하기 위해 사용된다. 형광 강도 임계치와 필터는 화상의 품질에 따라 정의 될 수 있지만 shoul다른 조건 또는 균주를 비교하기위한 일정하게 유지 될 거라고. 감염되지 않은 세포 각각 추출 된 431 67 개체와 8 시간 파이에서 WT 살모넬라 -infected 셀의 예는 여기에있는 바와 같다. 셀의 크기가 동일하지 않기 때문에 외관상의 차이에도 불구하고, 오브젝트의 수만을 비교할 합리적 아니다. 하나의 해결책은 (이 예에서는 2 ㎛ 및 2252 ㎛의 2 1975 각각) 합산 영역 개체 수를 정상화 또는 셀 내부의 객체 형광 세기의 합이다. 대안으로, 감염의 다른 단계에서의 NP는 분포를 비교하기 위해 하나 감염 세포와 전 - 상이한 시간 점에서 PI를 추적 할 수도있다.
결론적으로,이 방법에서는 금 BSA-로다 NPS는 진핵 세포의 엔도 리소좀 시스템에 라벨을 도포 하였다. intracellula 의해 숙주 세포 엔도 리소좀 시스템의 조작R 병원체가 살아있는 세포 CLSM 및 정량 분석 결과에 의해 관찰되었다 늦게 엔도 좀의 극단적 인 재 배열을 표시 / WT 살모넬라 균. 살모넬라 균에 의한 리소좀는 모델이 연구에서 병원균 있지만, 이러한 시겔 flexneri 및 리스테리아 균 등의 세균 병원균의 세포 내 행동으로 사용되었다 또한이 방법을 사용하여 조사 할 수있다. 원칙적으로, 금 - BSA - 로다 민 NP에 따라서 넓게 발산 내인성 또는 외인성 물질과 세포 내 이입 경로의 상호 작용을 조사하는 연구에 적용되고 유망한 세포주 큰 다양성에 의해 내재화 될 수있다.
공개
No conflicts of interest declared.
감사의 말
This work was supported by the Deutsche Forschungsgemeinschaft by grant Z within Sonderforschungsbereich 944 ‘Physiology and Dynamics of Cellular Microcompartments’ and HE1964/18 within priority program 1580.
자료
| Name | Company | Catalog Number | Comments |
| Gold chloride | Sigma-Aldrich | 520918 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Tri-sodium citrate | Sigma | C8532 | |
| Bovine serum albumin | Sigma | A2153 | |
| NHS-Rhodamine | Pierce | 46406 | |
| DMSO | Sigma | D8418 | |
| HEPES | Sigma | H3375 | |
| Gentamicin | Applichem | A1492 | |
| Kanamcyin | Roth | T832 | |
| Carbenicillin | Roth | 6344 | |
| 8-well chamber slides | Ibidi | 80826 | tissue culture treated, sterile |
| Imaris Software | Bitplane | version 7.6 | various configurations available |
참고문헌
- Coto-Garcia, A. M. Nanoparticles as fluorescent labels for optical imaging and sensing in genomics and proteomics. Anal. Bioanal. Chem. 399, 29-42 (2011).
- Xie, J., Lee, S., Chen, X. Nanoparticle-based theranostic agents. Adv. Drug Deliv. Rev. 62, 1064-1079 (2010).
- Ruedas-Rama, M. J., Walters, J. D., Orte, A., Hall, E. A. Fluorescent nanoparticles for intracellular sensing: a review. Anal. Chim. Acta. 751, 1-23 (2012).
- Wu, C., Chiu, D. T. Highly fluorescent semiconducting polymer dots for biology and medicine. Angew. Chem. Int. Ed. Engl. 52, 3086-3109 (2013).
- Giepmans, B. N., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nat. Methods. 2, 743-749 (2005).
- Kumar, D., Saini, N., Jain, N., Sareen, R., Pandit, V. Gold nanoparticles: an era in bionanotechnology. Expert Opin. Drug Deliv. 10, 397-409 (2013).
- Dykman, L. A., Khlebtsov, N. G. Uptake of engineered gold nanoparticles into mammalian cells. Chem. Rev. 114, 1258-1288 (2014).
- Chithrani, B. D., Ghazani, A. A., Chan, W. C. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6, 662-668 (2006).
- Finlay, B. B., Cossart, P. Exploitation of mammalian host cell functions by bacterial pathogens. Science. 276, 718-725 (1997).
- Bhavsar, A. P., Guttman, J. A., Finlay, B. B. Manipulation of host-cell pathways by bacterial pathogens. Nature. 449, 827-834 (2007).
- Malik-Kale, P., et al. Salmonella - at home in the host cell. Front. Microbiol. 2, 125(2011).
- Rajashekar, R., Liebl, D., Seitz, A., Hensel, M. Dynamic remodeling of the endosomal system during formation of Salmonella-induced filaments by intracellular Salmonella enterica. Traffic. 9, 2100-2116 (2008).
- Schroeder, N., Mota, L. J., Meresse, S. Salmonella-induced tubular networks. Trends Microbiol. 19, 268-277 (2011).
- Drecktrah, D., Knodler, L. A., Howe, D., Steele-Mortimer, O. Salmonella trafficking is defined by continuous dynamic interactions with the endolysosomal system. Traffic. 8, 212-225 (2007).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. Eur. J. Cell Biol. 38, 87-93 (1985).
- Zhang, Y., Hensel, M. Evaluation of nanoparticles as endocytic tracers in cellular microbiology. Nanoscale. 5, 9296-9309 (2013).
- Pollard, T. D., Earnshaw, W. C., Lippincott-Schwartz, J. Chapter 22. Cell Biology. , (2007).
- LysoTracker and LysoSensor Probes. , Life Technologies Corporation. Carlsbad, CA. (2013).
- Shi, H., He, X., Yuan, Y., Wang, K., Liu, D. Nanoparticle-based biocompatible and long-life marker for lysosome labeling and tracking. Anal. Chem. 82, 2213-2220 (2010).
- Hensel, M. Genes encoding putative effector proteins of the type III secretion system of Salmonella pathogenicity island 2 are required for bacterial virulence and proliferation in macrophages. Mol. Microbiol. 30, 163-174 (1998).
- Beuzon, C. R., et al. Salmonella maintains the integrity of its intracellular vacuole through the action of SifA. EMBO J. 19, 3235-3249 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유