Method Article
Applicazione di nanoparticelle fluorescenti per studiare rimodellamento del sistema Endo-lisosomiale da batteri intracellulari
In questo articolo
Riepilogo
Questo articolo descrive i metodi per la sintesi e l'etichettatura fluorescente di nanoparticelle (NP). Le NP sono stati applicati in esperimenti di pulse-chase di etichettare il sistema endo-lisosomiale di cellule eucariotiche. Manipolazione del sistema endo-lisosomiale dalle attività del patogeno intracellulare Salmonella enterica sono state seguite da imaging cellulare dal vivo e quantificato.
Abstract
Nanoparticelle fluorescenti (NP) con proprietà ottiche e meccaniche chimiche desiderabile, sono strumenti promettenti per etichettare organelli intracellulari. Qui, si introduce un metodo che utilizza oro-BSA-rodamina PN per etichettare il sistema endo-lisosomiale di cellule eucariotiche e monitorare manipolazioni di accoglienza vie cellulari dal patogeno intracellulare Salmonella enterica. Le NP sono stati prontamente internalizzati dalle cellule HeLa e localizzate in tardo endosomi / lisosomi. Infezione da Salmonella indotto riassetto delle vescicole e accumulo di NP in strutture a membrana Salmonella- indotte. Abbiamo implementato il pacchetto software Imaris per analisi quantitative di immagini di microscopia confocale. Il numero di oggetti e la loro distribuzione dimensionale in cellule non infette erano distinte da quelle in cellule -infected Salmonella, indicando estremamente rimodellamento del sistema endo-lisosomiale by WT Salmonella.
Introduzione
Nanoparticelle fluorescenti (NP), comprese le nanoparticelle di metallo, i punti quantici, nanoparticelle polimeriche, NP di silice, punti di carbonio, ecc, hanno attirato una notevole attenzione nel corso degli ultimi decenni 1,2. Rispetto ai tradizionali coloranti organici, NP fluorescenti mostrano chimiche, proprietà ottiche e meccaniche desiderabili, come forte intensità del segnale, resistenza photobleaching ed alta 3,4 biocompatibilità. Questi vantaggi loro il metodo di scelta per il rilevamento intracellulare e imaging cellulare dal vivo fanno. Inoltre, una varietà di elettroni NP-dense sono visibili mediante microscopia elettronica (EM), facilitando il loro utilizzo per l'analisi microscopica correlata, che consente combinazione di cellule vive di inseguimento con microscopio ottico (LM) e la risoluzione superiore a livello ultrastrutturale con EM 5. Ad esempio, NP oro sono stati da tempo utilizzati in modo efficiente come biosensori nelle cellule sensibili per la diagnosi vita così come nel campo della immuno-etichettatura 6. S recentiTUDI indicano che NP oro con forme e dimensioni diverse possono essere facilmente assorbimento da una grande varietà di linee cellulari e trasportare regolarmente attraverso la via endosomal, hanno quindi grande essere potenziale applicato per il monitoraggio del trasporto intracellulare di vescicole e l'etichettatura sistema endo-lisosomiale 7,8 .
Agenti patogeni microbici, come la Salmonella enterica, Shigella flexneri e Listeria monocytogenes, hanno sviluppato diversi meccanismi di invadere le cellule ospiti non fagocitiche 9. Dopo essere stato interiorizzato, gli agenti patogeni, sia localizzate nel citoplasma o sequestrati in compartimenti di membrana, interagiscono molto con i loro ambienti host e modulano questi per favorire la propria sopravvivenza 10. Ad esempio, Salmonella enterica risiede e replica all'interno di un vano phagosomal intracellulare definito il -contenenti vacuolo Salmonella (SCV) dopo l'infezione 11. Il SCV stagionaturatraffici verso l'apparato di Golgi, subendo continue interazioni con il percorso endocitica, e induce la formazione di estese strutture tubolari, come Salmonella filamenti -indotta (SIF), ordinamento tubuli nexin, Salmonella carrier secretoria indotta proteine di membrana (3) SCAMP3 tubuli, etc . 12-14. Studiare come questi batteri patogeni manipolano percorsi host-cellule è fondamentale per la comprensione di malattie infettive.
Qui, NP gold-BSA-rodamina sono stati utilizzati come traccianti fluido per etichettare il cellulare sistema endo-lisosomiale di accoglienza, e l'umano patogeno gastrointestinale Salmonella enterica sierotipo Typhimurium (Salmonella) è stato utilizzato come modello batterio per studiare le interazioni del patogeno con il ospiterà pathway endocitico. Intracellulari NP gold-BSA-rodamina nelle cellule e le cellule non infette infettate con WT Salmonella o ceppi mutanti sono stati ripresi da un microscopio confocale a scansione laser (CLSM).Poi software Imaris è stato utilizzato per quantificare la distribuzione di NP, che indica che l'infezione da Salmonella indotto estrema riassetto endosomi / lisosomi. Dopo la descrizione di questo metodo, gli esperimenti analoghi possono essere progettati per tenere traccia destino a lungo termine delle NP interiorizzato e per indagare l'influenza di varie sostanze esogene o fattori endogeni sulla via endocitica delle cellule eucariotiche.
Protocollo
1. Sintesi di 10 nm oro nanoparticelle (NP Oro) 15
- Preparare la soluzione A: aggiungere 2 ml di 1% acquosa di cloruro di oro in 160 ml Milli-Q, o doppio distillata, acqua.
- Preparare la soluzione B: aggiungere 8 ml 1% trisodico citrato x 2 H 2 O e 160 ml 1% di acido tannico in 32 ml Milli-Q, o doppio distillata, acqua.
- Riscaldare soluzione A e B a 60 ° C e mescolare agitando. Osservare immediatamente un colore blu scuro. Osservare il colore rosso dopo circa 15 min. Poi riscaldare fino a 95 ° C, 5 min mantenere e raffreddare la soluzione a RT.
- Aggiungere una goccia della sospensione NP su una griglia di carbonio rivestito e lasciare asciugare all'aria. Controllare la dimensione e la morfologia delle NP mediante microscopia elettronica a trasmissione.
2. Rivestimento di oro NP con BSA e etichettatura con Rhodamine N-hydroxysuccinimidyl Ester (NHS) 16
- Aggiungere 900 microlitri NP oro in una provetta Eppendorf da 1,5 ml, centrifugare a 15.000 xg per 30 min. Opzionale, preparare più tubi possono contemporaneamente.
- Eliminare il surnatante, risospendere il pellet in 900 ml sterilizzato Milli-Q acqua e aggiungere 100 ml 2 mg / ml BSA / PBS, mescolare in un Vortex a 800 rpm per 30 min.
- Per rimuovere l'eccesso di BSA, centrifugare la preparazione a 15.000 xg per 60 min.
- Eliminare il surnatante, e ri-sospendere i NP oro BSA in 125 microlitri PBS, aggiungere 12,5 ml di 1 M di bicarbonato.
- Immediatamente prima dell'uso, preparare una soluzione di 10 mg / ml di rodamina NHS / DMSO, aggiungere 30 ml di soluzione rhodamine / DMSO NHS a 1 ml della sospensione oro-BSA NP. Incubare la reazione per 2 ore (o O / N) a RT 800 rpm durante la miscelazione, evitando l'esposizione alla luce.
- Purificare le NP d'oro-BSA-rhodamine tramite dialisi contro PBS a 4 ° C con 5 cambi tampone nel periodo di 36 - 48 ore.
- Per stabilizzare NP, aggiungere 10 ml di 200 mg / ml BSA / PBS in ogni 1 ml NP gold-BSA-rodamina. Per rimuovere la centrifuga gratuito o rilasciato BSA-rodamina, a 15,000 xg per 60 min. Risospendere il pellet in 2 mg / ml BSA / PBS, misurare OD 520, e conservare a 4 ° C, evitando l'esposizione alla luce.
- Diluire le NP 10 volte con Milli-Q o acqua bidistillata, aggiungere una goccia su una griglia di carbonio rivestita, e lasciare asciugare all'aria. Controllare la dimensione e morfologia delle NP mediante microscopia elettronica a trasmissione (TEM).
NOTA: Tutti i materiali utilizzati per la preparazione NP sono stati sterilizzati e l'operazione è stata condotta in una cappa di coltura cellulare o su una panchina accanto a una fiamma.
3. Cultura di cellule HeLa
- Cellule HeLa esprimenti stabilmente LAMP1-GFP sono coltivate in DMEM con 10% siero fetale di vitello (FCS) e coltivate a 37 ° C in atmosfera contenente il 5% di CO 2.
- Seme le cellule ad una densità di 50.000 per bene in un 8-pozzo vetrino camera (Ibidi) e incubare O / N.
4. Cultura di batteri
- Usa Salmonella enterica sierotipo Typhimurium NCTC 12023 wild-type (WT) ceppo. Per confronto, utilizzare ceppi mutanti Δ SSAV difettosi nel SPI2-T3SS e Δ SIFA privi effettori chiave Sifa per SIF. Utilizzare ceppi ospitano plasmide pFPV25.1 per l'espressione costitutiva di una maggiore GFP.
NOTA: ceppi batterici sono regolarmente coltivate in Luria-Bertani brodo (LB) con l'aggiunta di 50 mg / ml carbenicillina (WT) e LB con l'aggiunta di 50 mg / ml carbenicillina e / o 50 mg / ml kanamicina (Δ SSAV, Δ SIFA ) di richiesta per mantenere plasmidi. - Inoculare una singola colonia di batteri in 3 ml LB con antibiotici appropriati e crescere O / N a 37 ° C, in condizioni che agitano per l'aerazione, quindi diluire 1:31 in fresco LB e continuare la crescita per 3,5 ore. A questo punto-punto, le culture raggiungono la fase log tardi e batteri sono altamente invasiva. A 'tamburo roller' è conveniente per incubare culture provetta con aerazione.
5. L'infezione di cellule HeLa daSalmonella e oro-BSA-Rodamina NP Pulse Chase-etichettatura (vedi Figura 1 per programma)
- Misurare OD 600 dei batteri sub-coltura e diluire a OD 600 = 0.2 in 1 ml di PBS (~ 3 × 10 8 cfu / ml), aggiungere quantità appropriate di batteri alle cellule HeLa in vetrini camera 8 pozzetti per ottenere una molteplicità di infezione (MOI) di 100.
- Incubare per 30 minuti in incubatrice cellulare, lavare 3 volte con PBS per rimuovere i batteri non internalizzati (questo punto il tempo è stato impostato come 0 ore dopo l'infezione, o 0 hr pi). Aggiungere 300 ml di terreno di coltura fresco contenente 100 mg / ml di gentamicina e mantenere per 1 ora. Quindi sostituire il mezzo con mezzo fresco contenente 10 ug / ml gentamicina per il resto del tempo di incubazione.
- Dopo l'incubazione con mezzo di coltura contenente 100 ug / ml gentamicina per 1 ora, il mezzo viene sostituito con mezzo di imaging (Eagles MEM senza FCS, L-glutammina, rosso fenolo e bicarbonato di sodio, con HEPES 30 mM, pH 7,4) containing 10 mg / ml di gentamicina. NP oro-BSA-rodamina vengono aggiunti alle cellule HeLa per ottenere una concentrazione finale di OD 520 = 0.1.
NOTA: NP Gold-BSA-rodamina può anche essere aggiunto alle cellule prima dell'infezione, o in vari punti temporali pi - Dopo 1 ora di incubazione, rimuovere il terreno, lavare 3 volte con PBS e aggiungere 300 ml di mezzo fresco contenente immagini 10% FCS e 10 ug / ml gentamicina per il resto del tempo di incubazione.
NOTA: Durata di incubazione può variare a seconda della concentrazione di NP e linee cellulari utilizzate. Per macrofagi RAW264.7, abbiamo osservato che 30 min incubazione con NP ad una concentrazione di OD 520 = 0,05 consentito internalizzazione sufficiente.
6. Imaging
- Utilizzare un sistema di imaging confocale come un confocale a scansione laser (CLSM) o disco rotante (SD) microscopio con una camera umidificata ambiente per immagini ad alta risoluzione in diversi punti temporali.
- Accendere la temperatura control sistema e attendere che sia stabile. Ottimizzare le impostazioni di imaging come l'ingrandimento, velocità di scansione, la risoluzione, Z-stack ecc Utilizzare adeguate impostazioni di eccitazione / emissione per GFP e NP gold-BSA-rodamina. Per questo protocollo, utilizzare una velocità di scansione di 400 Hz, risoluzione di 512 x 512 pixel e formato Z-passo di 0,25 micron. Excite GFP e oro-BSA-rodamina utilizzando un laser Ar (488 nm) e un laser HeNe (543 nm), rispettivamente. Include un campo chiaro (BF) canale per osservare la forma delle cellule. Per gli altri sistemi di microscopia e condizioni di infezione, l'impostazione deve essere adeguato di conseguenza.
NOTA: utilizzare lo stesso laser Ar come la sorgente luminosa del canale BF e il segnale è stato rilevato con un rilevatore fotomoltiplicatore (PMT). - A indicata punti temporali pi, montare le diapositive camera 8 pozzetti contenenti cellule infettate sul palco microscopio e registrare le immagini.
7. Analisi di Immagini
- Utilizzare microscopia software di analisi dell'immagine (vedi Materiali e Table di Equipment) per analizzare il rimodellamento del sistema endo-lisosomiale by intracellulare Salmonella. Aprire i dati cliccando su 'Open' e scegliendo il file.
NOTA: In alternativa, i pacchetti di software open source, come ImageJ o FIJI possono essere utilizzati per l'immagine analisi quantitative. - Nella barra degli strumenti oggetti del click Surpass vista sull'icona
 aggiungere un nuovo elemento di superficie. Clicca su
aggiungere un nuovo elemento di superficie. Clicca su  (Il Prossimo).
(Il Prossimo). - Per analizzare una regione di interesse (ROI), selezionare un segmento ROI. In un area di visualizzazione, una sezione rettangolare, delimitata sovrapposto sull'immagine sta rappresentando il ROI. Immettere i valori nelle direzioni x corrispondente, Y e campi Z-, o cliccare direttamente sulle frecce nel rettangolo di anteprima per modificare le dimensioni e la posizione della ROI. Quindi fare clic su
= "/ Files / ftp_upload / 52058 / 52058icon2.jpg" /> (Avanti).
- Come canale sorgente, selezionare Canale 3 (segnale per Gold-BSA-Rhodamine NP). Selezionare l'opzione liscio per impostare la morbidezza della superficie risultante. Definire un valore manualmente o accettare il valore generato automaticamente. Per Soglia, selezionare l'opzione Intensità Assoluto.
- Per la regolazione della soglia, selezionare l'opzione manuale e impostare un valore. Nell'area di visualizzazione, un'anteprima soglia superficie viene visualizzato in grigio.
- Sulla scheda Classificare Superfici superficie risultante può essere filtrato da vari criteri. Un filtro predefinito è 'il numero di voxel> 10', e altri filtri può essere inclusa, cliccando su 'Aggiungi'. Se un filtraggio non è necessario, quindi eliminare tutti i filtri facendo clic sul pulsante Elimina. Fare clic
 (Il Prossimo).
(Il Prossimo). - Per completare la creazione di superficie, cliccate su/files/ftp_upload/52058/52058icon3.jpg "/> (Fine). Nell'elenco Oggetto, ora deselezionare la casella per il volume prodotto e nuova superficie creata viene visualizzata nell'area di visualizzazione.
- Esportare le statistiche. Ora, nella vista superare i colori dei soggetti variano da porpora a rosso in base alla loro superficie. E il tavolo 'Numbers Superficie Totale' mostra le informazioni statistiche (ad esempio, il numero ID e l'area degli oggetti). Esportare tutte le statistiche di superficie 1 in un file Excel per click
 (Save).
(Save).
Risultati
NP d'oro sono stati generati attraverso un metodo consolidato attraverso la riduzione dell'acido cloroaurico per citrato e acido tannico. Come mostrato in Figura 2A, PN oro sintetizzati erano quasi-forma sferica con una dimensione di circa 10 nm. BSA-rivestimento e rodamina-etichettatura non hanno influenzato la loro morfologia e dimensione (Figura 2B).
E 'stato riportato che le NP d'oro possono essere facilmente assorbiti da varie cellule di mammiferi e finirono nei sistemi endocitiche 7. In conformità con le opere precedenti, luminose segnali di fluorescenza rossa sono stati osservati in cellule HeLa dopo 1 ora di incubazione con NP gold-BSA-rodamina (Figura 3, WT 5 ore pi greco), che indica effettiva interiorizzazione delle NP da parte delle cellule. La maggior parte dei segnali rossi sono stati trovati colocalized con segnali verdi, mostrando che le NP sono stati confinati in endosomi o lisosomi fine. Tuttavia, a differenza di una distribuzione uniforme di NP in tardo endosomi / lisosomiin cellule non infette (Figura 3, finto), le loro posizioni sono state ampiamente modificate in cellule -infected WT Salmonella. Nella prima fase di infezione (Figura 3, WT 5 ore pi greco), Salmonella replica all'interno del SCV e SIF sottoposti estensione veloce o movimento di contrazione. A questo punto di tempo, una frazione delle NP è stato trovato in SCV e SIF, mentre un'altra frazione trovava ancora in libero fine endosomi / lisosomi. A 8 ore pi (Figura 3, WT 8 ore pi), una rete di SIF stabilizzato è stato formato, e la maggior parte NP sono stati trovati accumulata nelle strutture tubolari, mentre solo una piccola parte rimasta trova libere fine endosomi / lisosomi. I ceppi mutanti Δ SSAV e Δ SIFA esibito comportamenti distinti. Come mostrato in Figura 3 (Δ SSAV), alle 8 ore pi, Δ SSAV era confinato all'interno SCV mentre sono formati senza strutture SIF. Alcuni NP sono stati osservati Salmon circostanteella all'interno del SCV, ma la maggior parte dei parlamenti nazionali sono stati ancora situati in libere fine endosomi / lisosomi. Per il ceppo Δ SIFA (Figura 3, Δ SIFA), fuoriuscita di Salmonella nel citoplasma si è verificato, ed è stata osservata alcuna associazione tra NP e batteri.
Nel nostro precedente studio si è riscontrato che visualizzazione SIF proprietà altamente dinamici nella prima fase di infezione (3 - 5 ore pi greco), ma stabilizzarsi nel periodo successivo (> 8 ore pi) 12. Pertanto, ci si chiede se la salmonella nelle fasi precoci e tardive dell'infezione hanno capacità paragonabili a riorganizzare la distribuzione delle NP intracellulari. Come mostrato in figura 4, NP d'oro sono state incubate con cellule HeLa O / N prima dell'infezione, o in diversi punti temporali dopo l'infezione (1 - 7 ore pi) per 1 ora, in tutti i casi la maggior parte delle NP interiorizzate sono stati osservati accumulato in SCV o SIF.
Osservati al microscopiozioni ha rivelato che l'infezione da Salmonella risultati in massiccia riorganizzazione del sistema endo-lisosomiale di cellule ospiti. Come passo successivo, abbiamo utilizzato il pacchetto software Imaris analizzare Salmonella indotta fenotipi della cellula ospite in modo quantitativo. Utilizzando l'immagine di una cellula HeLa infettate a 8 ore pi come esempio, un'istruzione passo-passo per l'analisi quantitativa è mostrata in Figura 5. Attraverso una soglia di intensità 15 e un 'numero di voxel> 10' filtro, 3D oggetti sono stati estratti dal file immagine originale. Gli oggetti dovevano essere strutture intracellulari in cui l'oro-BSA-rhodamine NP trova con. In questo esempio, 67 oggetti sono stati estratti in totale, con superficie riassunta come 1,974.64 micron 2. L'oggetto più grande, che colocalizzava con la rete SIF, ha una superficie di 1,836.23 micron 2, mentre gli altri sono più piccole di 50 micron 2. Per confronto, un esempio che mostra la quantluni risultato dell'analisi di una cella non infetto è stato dato in. Qui, 431 oggetti sono stati estratti in totale, entro il quale il valore medio area è 5 micron 2 e l'oggetto più grande ha una superficie di 34 micron 2. L'area riassunto degli oggetti è 2.252 micron 2, che è paragonabile alla cellula infetta in figura 4 (1.975 micron 2). Tuttavia, il numero di oggetti è molto più grande rispetto all'altro (431 e 67 oggetti, rispettivamente), che indica larga misura fusione delle vescicole con -indotta strutture tubolari Salmonella.
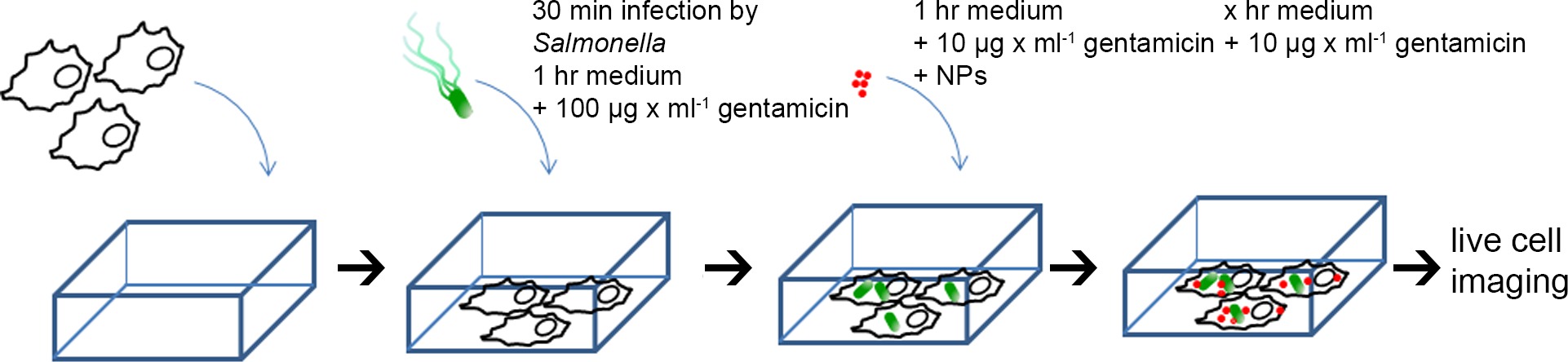
Figura 1. Schema per la preparazione di cellule HeLa per l'imaging cellulare dal vivo. Cellule HeLa sono state seminate in diapositive da camera, mock-infettate, o infettati con diversi ceppi di Salmonella per 30 min, lavato 3 volte con PBS, poi incubat ed con terreno contenente 100 mg / ml gentamicina per 1 ora. Successivamente, il terreno è stato sostituito con terreno contenente l'imaging 10 nm nanoparticelle di oro-BSA-rodamina (OD 520 = 0,1) e 10 ug / ml gentamicina, incubate per 1 ora, e poi inseguito da medium NP-libera per il resto dell'esperimento . Imaging cellulare dal vivo è stata effettuata in diversi momenti dopo l'infezione (pi). Cliccate qui per vedere una versione più grande di questa figura.
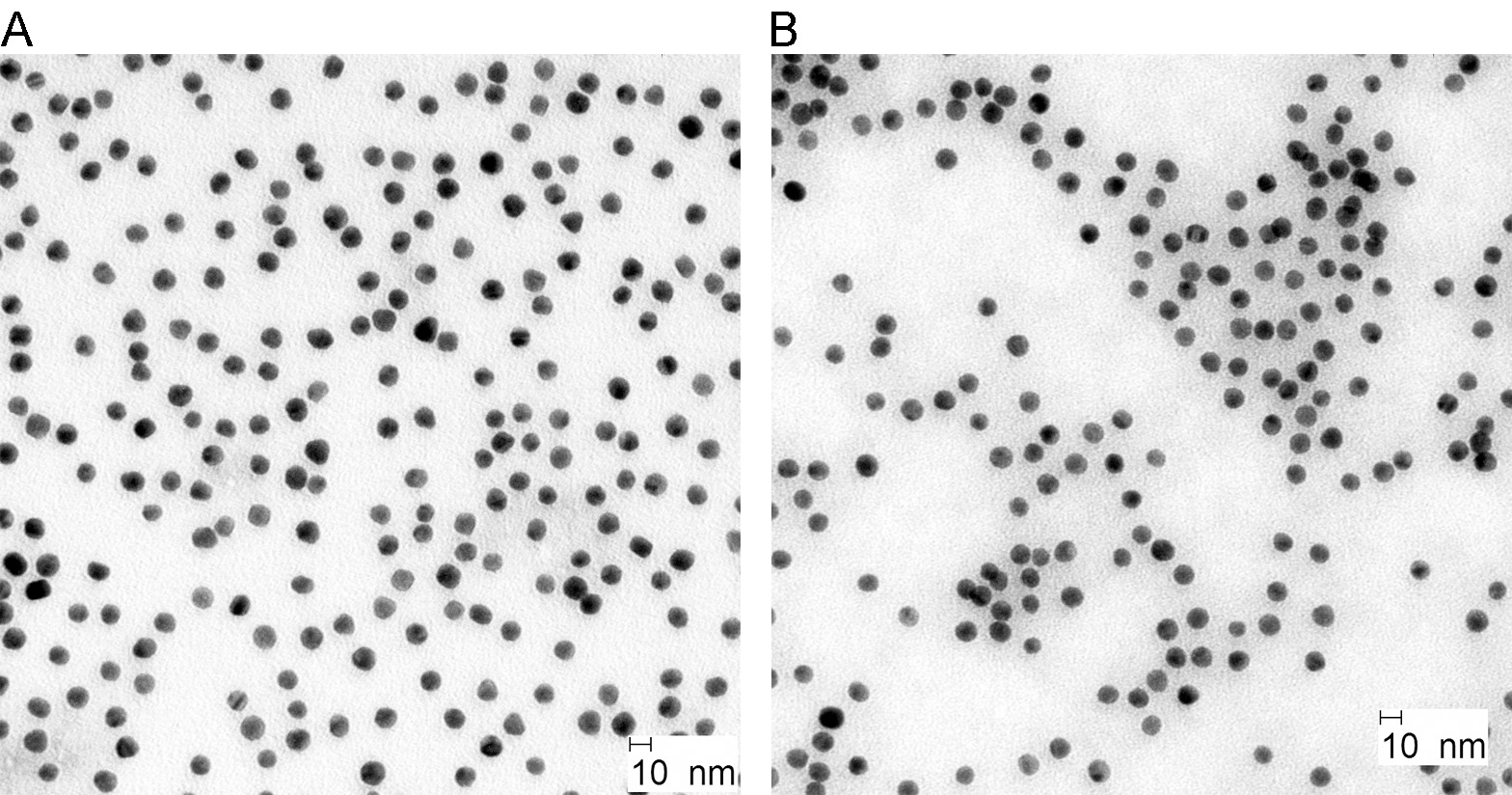
Figura 2. immagini TEM di oro colloidale NP prima (a) e dopo l'etichettatura (b). Cliccate qui per vedere una versione più grande di questa figura.

Figura 3. Ristrutturazione del sistema host endo-lisosomiale cellulare da parte delle cellule Salmonella. HeLa intracellulari erano mock-infetti, o infettati con Salmonella WT, Δ SSAV o Δ SIFA ceppi mutanti e impulsi / chase con 10 nm NP gold-BSA-rodamina ( OD 520 = 0.1) è stata eseguita come descritto in Figura 1. proiezioni intensità massime di CLSM Z-stack sono mostrati. Bar Scala, 10 micron. Cliccate qui per vedere una versione più grande di questa figura.

Figura 4. Accessibilità del sistema endo-lisosomiale in varie fasi di infezione da Salmonella. HeLale cellule sono state pulsata con 10 nm NP gold-BSA-rodamina (OD 520 = 0,1) O / N precedente infezione, o per 1 ora a diversi punti temporali pi come indicato. Imaging cellulare dal vivo è stata effettuata a 8-9 ore pi proiezioni intensità massima di CLSM Z-stack sono visualizzabili. Bar Scala, 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
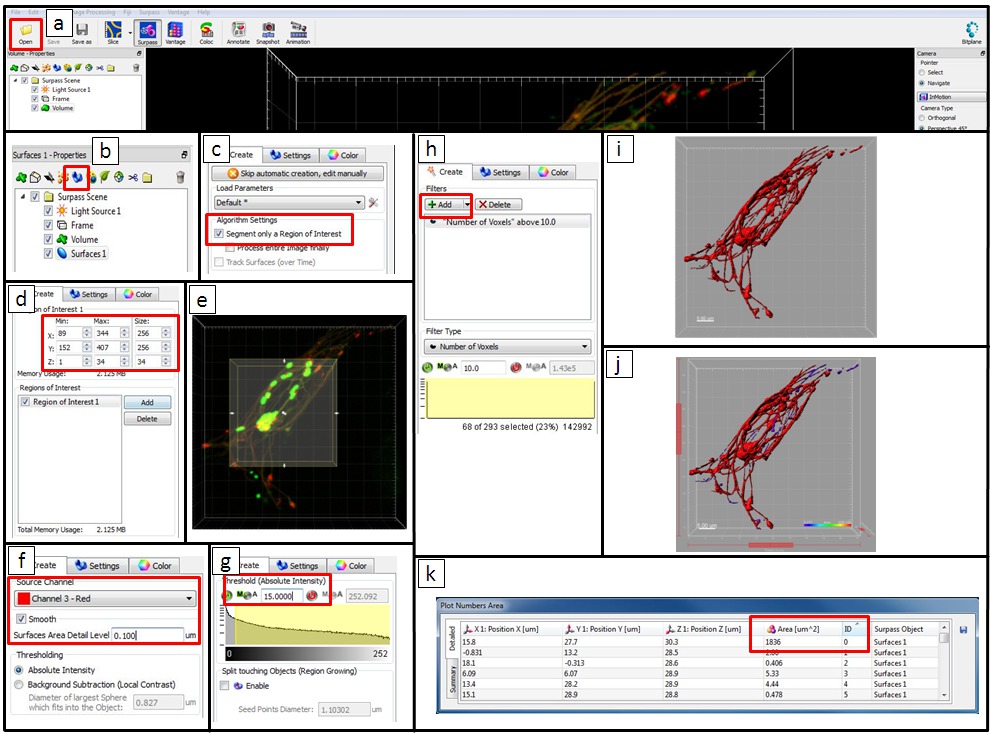
Figura 5. Passo per passo le istruzioni per l'analisi quantitativa per Imaris utilizzando l'immagine di una cellula HeLa infetto 8 ore pi come un esempio. (A) Aprire i dati cliccando su 'Open' e scegliendo il file. (B) Nel oggetti barra degli strumenti della vista Surpass aggiungere un nuovo elemento di superficie. (C) Per analizzare un ROI, quindi selezionare un segmento ROI. (D) Inserire i valori nelle direzioni x corrispondente, ye z-campi o (E) cliccare direttamente sulle frecce nel rettangolo di anteprima per modificare la dimensione e la posizione della ROI. In questo esempio, un ROI non necessita e l'intera immagine è stata analizzata. (F) come canale di origine selezionare il Canale 3 (segnale di Gold-BSA-Rhodamine NP). Selezionare l'opzione liscio per impostare la morbidezza della superficie risultante. Definire un valore manualmente o accettare il valore generato automaticamente. Qui, è stato utilizzato 0,1 micron. Per 'Threshold' selezionare l'opzione 'intensità assoluta'. (G) per la regolazione della soglia selezionare l'opzione manuale e impostare un valore (in questo esempio 15 è stato utilizzato). Nell'area di visualizzazione una soglia anteprima superficie viene visualizzato in grigio. (H) Nella scheda 'adesso Surfaces' la superficie risultante può essere filtrato da vari criteri. Un filtro predefinito è 'il numero di voxel> 10'. Ilfiltro può essere regolato immettere un nuovo valore e altri filtri può essere aggiunto. In questo esempio, abbiamo mantenuto il 'numero di voxel> 10' filtro. (I) per completare la creazione Surface cliccare su 'Finish'. Nell'elenco Object ora deselezionare la casella per il volume prodotto e nuova superficie creata viene visualizzata nell'area di visualizzazione in rosso. (J) Nella vista superare i colori dei soggetti variano da porpora a rosso secondo la loro area. (K) La 'Numbers Superficie Totale' tabella mostra le informazioni statistiche. Statistiche Esporta in un file Excel. Cliccate qui per vedere una versione più grande di questa figura.
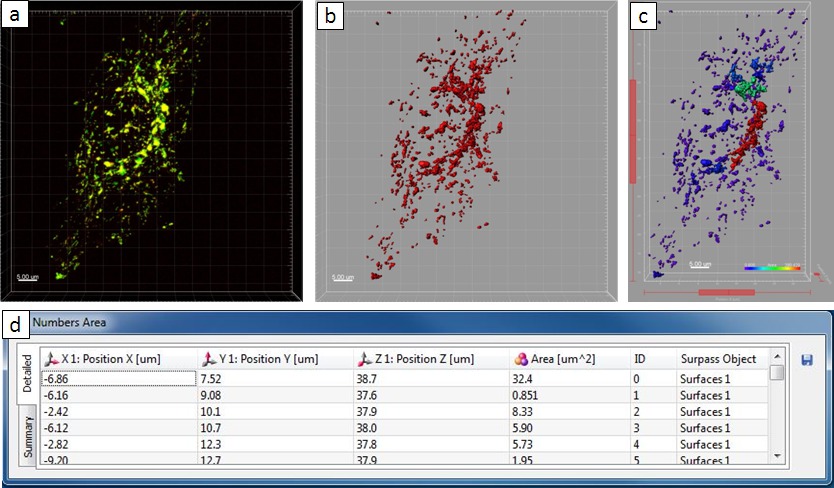
Figura 6. risultato dell'analisi quantitativa di una cellula non infetta. ( A) microscopio confocale. (B) La nuova superficie creata. (C) La nuova superficie in vista Surpass. (D) L''Numbers Superficie Totale' tabella mostra le informazioni statistiche. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Il sistema endo-lisosomiale di cellule di mammiferi controlla importanti processi fisiologici, tra cui l'assorbimento dei nutrienti, la trasduzione del segnale ormonale mediata, sorveglianza immunitaria, e l'antigene presentazione 17. Fino ad ora, una varietà di marcatori sono stati utilizzati per l'etichettatura dei pathway studi e monitoraggio endocitici. Ad esempio, le sonde LysoTracker sono sonde fluorescenti acidotropic sviluppati da Molecular Probes (Life Technologies, USA) per l'etichettatura lisosomi, che può accumularsi selettivamente in compartimenti cellulari con basso pH interno ed efficace etichettare le cellule viventi a concentrazioni nanomolari 18. Tuttavia, lungo tempo di incubazione di sonde LysoTracker con celle può indurre un aumento del pH lisosomiale e portare a potenziali cambiamenti fisiologici di lisosomi 19. Alcune grandi biomolecole, come destrani fluoroforo marcata, vengono spesso utilizzati per endosome / lisosomi etichettatura. Tuttavia, il basso-fotostabilità, vita breve circolanti, e pritenzione pavimento durante la fissazione ostacolare le loro applicazioni in-lungo termine, l'imaging cellulare dal vivo e il microscopio correlativa studia 16,19. Qui, NP gold-BSA-rodamina sono stati utilizzati come traccianti fluido per etichettare il cellulare sistema endo-lisosomiale host. Sono stati osservati ad alta efficienza di assorbimento e forti segnali di fluorescenza intracellulari. La colocalizzazione quasi completa di NP con lisosomiale LAMP1 glicoproteina, che è altamente arricchito sulla membrana di fine endosomi / lisosomi, verificato la corretta etichettatura del sistema endo-lisosomiale dai NP. Combinando l'uso di NP fluorescenti con gli altri marcatori, come Lysotracker può fornire informazioni complementari sulla cellula ospite traffico vescicolare e la maturazione.
Vale la pena ricordare che l'internalizzazione cellulare di nanoparticelle è fortemente dipendente dalle loro dimensioni fisiche e componenti chimici. Abbiamo testato NP gold-BSA-rodamina con una dimensione di 5 nm, 10 nm, 15 nm e 30 nm, e la distribuzione intracellulare similesono stati osservati cellule HeLa laterali (risultati non mostrati). Abbiamo utilizzato cellule HeLa come linea cellulare conveniente per gli studi di infezione da Salmonella. Tuttavia, NP oro-BSA-rhodamine possono anche essere facilmente internalizzati da varie altre linee cellulari e cellule primarie sono suscettibili. Per esempio, abbiamo osservato Salmonella indotta strutture e etichettatura tubolari da NP in CHO, COS-7, Caco2, o 3T3, così come in-γ-interferone stimolata RAW264.7 cellule della linea cellulare macrofagica-like o macrofagi murini primari e cellule dendritiche. Tuttavia, ogni linea cellulare richiederà regolazione della infezione e protocolli impulsi / chase.
È stato riportato che NP silice colorante intrappolato possono essere utilizzati come biocompatibile, lunga vita, e altamente fotostabile marcatore lisosoma 19, e anche rispetto al comportamento di rodamina-drogato NP silice con dimensione variabile (30 - 1000 nm). Etichettatura corretta di fine endosomi / lisosomi da silice NP nelle cellule non infettate e l'accumulo di NP in SÈ stata osservata CV e SIF in cellule Salmonella -infected. Tuttavia, a causa della formazione di aggregati di NP o le grandi dimensioni delle NP singoli silice, la distribuzione delle NP con Salmonella -indotta strutture tubolari non era uniforme (dati non mostrati).
Una caratteristica di SCV nonché SFI è la presenza di glicoproteine altamente abbondanti lisosomiali come LAMP1 12. Qui, una linea cellulare HeLa esprimono stabilmente LAMP1-GFP è stato utilizzato per la comodità di cellule vive del sistema endo-lisosomiale e le strutture SCV e SIF. Ceppi di Salmonella che esprimono costitutivamente rafforzata GFP sono stati usati in esperimenti di infezione per indicare posizione di batteri . A causa della forma e dimensioni uniformi dei batteri intracellulari, la fluorescenza GFP batterica in generale è facilmente distinguibile dall'etichetta GFP su membrane endo-lisosomiale. Tuttavia, per esperimenti futuri in cui fluorescente segnale da batteri e membrana proteins devono essere proprio differenziare, altre proteine di fusione fluorescenti, ad esempio, mTurquoise, si raccomanda di essere integrati. Ciò, tuttavia, comporta ulteriori cicli di illuminazione e di acquisizione delle immagini, con il rischio di una maggiore foto-danni in esperimenti cellule vive.
Per scoprire i geni e meccanismi essenziali per batteri patogeni di manipolare percorsi host-cellulari, numerosi mutanti devono essere creati e le loro prestazioni devono essere attentamente confrontato. Ad esempio, Salmonella ceppi mutanti Δ SSAV e Δ SIFA sono molto attenuate nella virulenza sistemica e replicazione intracellulare 20,21. Sia Δ SSAV e Δ SIFA ceppi non riescono a indurre SIF, e inoltre Δ Sifa Salmonella perdono la membrana SCV nel corso di infezione 12. Confrontando fenotipi di WT e mutanti è strumentale nella comprensione della capacità di Salmonella di remodel cellula ospite traffico vescicolare. In base all'esame microscopico, è ovvio che la WT Salmonella sovvertire ospitanti cellulari percorsi endocitiche in misura molto maggiore rispetto a Δ SSAV e Δ Sifa ceppi mutanti. Questa funzione potrebbe consentire Salmonella intracellulare di ottenere più sostanze nutritive per la loro sopravvivenza intracellulare e la replica.
Immagini microscopia confocale dimostrano chiaramente il rimodellamento di accoglienza cellulari sistema endo-lisosomiale da batteri intracellulari. Tuttavia, è necessaria l'analisi quantitativa delle immagini per confronto preciso. Nel metodo descritto qui, software Imaris viene utilizzato per estrarre oggetti 3D che hanno intensità di fluorescenza a Canale 3> 15 e il numero di voxel> 10. Questi oggetti dovrebbero essere strutture a membrana intracellulari contenenti oro-BSA-Rhodamine NP. La soglia di intensità di fluorescenza e filtri possono essere definite in base alla qualità delle immagini, ma Should essere mantenuta costante per confrontare le condizioni o ceppi diversi. Visualizzati sono esempi di una cellula non infetta e una cella -infected WT Salmonella a 8 ore pi, con 431 e 67 oggetti estratti, rispettivamente. Nonostante la differenza apparente, non è razionale di confrontare solo il numero degli oggetti, poiché la dimensione delle celle non sono gli stessi. Una soluzione è normalizzare il numero degli oggetti alla zona sommati (in questo esempio, 2.252 micron 2 e 1.975 micron 2, rispettivamente) o la somma delle intensità di fluorescenza delle cellule oggetti all'interno. In alternativa, è anche possibile seguire una cella prima dell'infezione ea diversi punti temporali pi per comparare la distribuzione delle NP a differenti fasi dell'infezione.
In conclusione, in questo metodo NP oro-BSA-rodamina sono stati applicati per etichettare sistema endo-lisosomiale di cellule eucariotiche. La manipolazione del cellulare sistema endo-lisosomiale ospitante da intracellular patogeno è stato osservato da CLSM cellule vive e risultati di analisi quantitativa indicato riarrangiamenti estreme di endosomi tardivi / lisosomi da WT Salmonella. Salmonella è stato utilizzato come modello patogeno in questo studio, ma il comportamento intracellulare di altri batteri patogeni, come Shigella flexneri e Listeria monocytogenes potrebbe anche essere studiata utilizzando questo approccio. In linea di principio, oro-BSA-rodamina NP potrebbero essere internalizzati da una grande varietà di linee cellulari, quindi sono promettenti essere ampiamente applicate in studi che esaminano interazione del pathway dell'endocitosi con sostanze endogene o esogene divergenti.
Divulgazioni
No conflicts of interest declared.
Riconoscimenti
This work was supported by the Deutsche Forschungsgemeinschaft by grant Z within Sonderforschungsbereich 944 ‘Physiology and Dynamics of Cellular Microcompartments’ and HE1964/18 within priority program 1580.
Materiali
| Name | Company | Catalog Number | Comments |
| Gold chloride | Sigma-Aldrich | 520918 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Tri-sodium citrate | Sigma | C8532 | |
| Bovine serum albumin | Sigma | A2153 | |
| NHS-Rhodamine | Pierce | 46406 | |
| DMSO | Sigma | D8418 | |
| HEPES | Sigma | H3375 | |
| Gentamicin | Applichem | A1492 | |
| Kanamcyin | Roth | T832 | |
| Carbenicillin | Roth | 6344 | |
| 8-well chamber slides | Ibidi | 80826 | tissue culture treated, sterile |
| Imaris Software | Bitplane | version 7.6 | various configurations available |
Riferimenti
- Coto-Garcia, A. M. Nanoparticles as fluorescent labels for optical imaging and sensing in genomics and proteomics. Anal. Bioanal. Chem. 399, 29-42 (2011).
- Xie, J., Lee, S., Chen, X. Nanoparticle-based theranostic agents. Adv. Drug Deliv. Rev. 62, 1064-1079 (2010).
- Ruedas-Rama, M. J., Walters, J. D., Orte, A., Hall, E. A. Fluorescent nanoparticles for intracellular sensing: a review. Anal. Chim. Acta. 751, 1-23 (2012).
- Wu, C., Chiu, D. T. Highly fluorescent semiconducting polymer dots for biology and medicine. Angew. Chem. Int. Ed. Engl. 52, 3086-3109 (2013).
- Giepmans, B. N., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nat. Methods. 2, 743-749 (2005).
- Kumar, D., Saini, N., Jain, N., Sareen, R., Pandit, V. Gold nanoparticles: an era in bionanotechnology. Expert Opin. Drug Deliv. 10, 397-409 (2013).
- Dykman, L. A., Khlebtsov, N. G. Uptake of engineered gold nanoparticles into mammalian cells. Chem. Rev. 114, 1258-1288 (2014).
- Chithrani, B. D., Ghazani, A. A., Chan, W. C. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6, 662-668 (2006).
- Finlay, B. B., Cossart, P. Exploitation of mammalian host cell functions by bacterial pathogens. Science. 276, 718-725 (1997).
- Bhavsar, A. P., Guttman, J. A., Finlay, B. B. Manipulation of host-cell pathways by bacterial pathogens. Nature. 449, 827-834 (2007).
- Malik-Kale, P., et al. Salmonella - at home in the host cell. Front. Microbiol. 2, 125(2011).
- Rajashekar, R., Liebl, D., Seitz, A., Hensel, M. Dynamic remodeling of the endosomal system during formation of Salmonella-induced filaments by intracellular Salmonella enterica. Traffic. 9, 2100-2116 (2008).
- Schroeder, N., Mota, L. J., Meresse, S. Salmonella-induced tubular networks. Trends Microbiol. 19, 268-277 (2011).
- Drecktrah, D., Knodler, L. A., Howe, D., Steele-Mortimer, O. Salmonella trafficking is defined by continuous dynamic interactions with the endolysosomal system. Traffic. 8, 212-225 (2007).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. Eur. J. Cell Biol. 38, 87-93 (1985).
- Zhang, Y., Hensel, M. Evaluation of nanoparticles as endocytic tracers in cellular microbiology. Nanoscale. 5, 9296-9309 (2013).
- Pollard, T. D., Earnshaw, W. C., Lippincott-Schwartz, J. Chapter 22. Cell Biology. , (2007).
- LysoTracker and LysoSensor Probes. , Life Technologies Corporation. Carlsbad, CA. (2013).
- Shi, H., He, X., Yuan, Y., Wang, K., Liu, D. Nanoparticle-based biocompatible and long-life marker for lysosome labeling and tracking. Anal. Chem. 82, 2213-2220 (2010).
- Hensel, M. Genes encoding putative effector proteins of the type III secretion system of Salmonella pathogenicity island 2 are required for bacterial virulence and proliferation in macrophages. Mol. Microbiol. 30, 163-174 (1998).
- Beuzon, C. R., et al. Salmonella maintains the integrity of its intracellular vacuole through the action of SifA. EMBO J. 19, 3235-3249 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon