Method Article
Aplicación de nanopartículas fluorescentes para estudiar Remodelación del Sistema Endo-lisosomal por bacterias intracelulares
En este artículo
Resumen
Este artículo describe métodos para la síntesis y marcaje fluorescente de nanopartículas (NPs). Los NPs se aplicaron en los experimentos de pulso-caza para etiquetar el sistema de endo-lisosomal de las células eucariotas. La manipulación del sistema de endo-lisosomal por las actividades del patógeno intracelular Salmonella enterica fueron seguidos por imágenes de células vivas y cuantificada.
Resumen
Nanopartículas fluorescentes (PN) con química deseable, propiedades ópticas y mecánicas son herramientas prometedoras para etiquetar orgánulos intracelulares. Aquí, presentamos un método que utiliza oro-BSA-rodamina PN para etiquetar el sistema endo-lisosomal de las células eucariotas y supervisar la manipulación de las vías celulares de acogida por el patógeno intracelular Salmonella enterica. Los parlamentos nacionales se internalizan fácilmente por las células HeLa y localizados en endosomas tardíos / lisosomas. Infección por Salmonella indujo reordenamiento de las vesículas y la acumulación de los PN en estructuras de membrana Salmonella inducidos. Desplegamos el paquete de software Imaris para análisis cuantitativos de imágenes de microscopía confocal. El número de objetos y su distribución de tamaño en las células no infectadas eran distintos de los de las células infectadas por Salmonella, lo que indica extremadamente remodelación del sistema de endo-lisosomal por WT Salmonella.
Introducción
Nanopartículas fluorescentes (PN), incluidos los PN de metal, puntos cuánticos, polímeros PN, PN sílice, puntos de carbono, etc., han atraído una atención considerable durante las últimas décadas 1,2. En comparación con los tintes orgánicos tradicionales, NPs fluorescentes muestran propiedades químicas deseables, ópticas y mecánicas, tales como fuerte intensidad de la señal, la resistencia a photobleaching y alta biocompatibilidad 3,4. Estas ventajas que el método de elección para la detección intracelular y imágenes de células vivas hacen. Además, una variedad de NPs electrón-densos son visibles por microscopía electrónica (EM), facilitando su uso para el análisis microscópico correlacionada, que permite la combinación de células vivas de seguimiento con microscopía de luz (LM) y mayor resolución a nivel ultraestructural con EM 5. Por ejemplo, los NPs de oro han sido mucho tiempo utilizado eficientemente como biosensores en células sensibles para el diagnóstico de vida, así como en el campo de la inmuno-etiquetado 6. S recientesos estudios indican que NP de oro con diferente tamaño y forma pueden ser fácilmente captación por una gran variedad de líneas celulares y transportar de forma rutinaria a través de la vía endosomal, por lo tanto tienen un gran potencial de ser aplicado para el seguimiento de la vesícula de transporte intracelular y el sistema de etiquetado endo-7,8 lisosomal .
Patógenos microbianos, como Salmonella enterica, Shigella flexneri y Listeria monocytogenes, se han desarrollado diferentes mecanismos para invadir las células huésped no fagocíticas 9. Después de ser interiorizado, los agentes patógenos, ya sean localizadas en el citosol o secuestradas en compartimentos de membrana, interactuando con su entorno de acogida y modulan estos para favorecer su propia supervivencia 10. Por ejemplo, Salmonella enterica reside y se replica dentro de un compartimiento intracelular phagosomal denomina -Con vacuola Salmonella (SCV) después de la infección 11. El SCV maduracióntráficos hacia el aparato de Golgi, sufriendo continuas interacciones con la vía endocítica, e induce la formación de estructuras tubulares extensos, tales como Salmonella filamentos inducidos (SIF), clasificación túbulos nexina, Salmonella portadoras secretora inducida por proteínas de membrana (3) SCAMP3 túbulos, etc. . 12-14. Estudiando cómo estos patógenos bacterianos manipulan las vías de la célula huésped es esencial para la comprensión de las enfermedades infecciosas.
Aquí, NPs de oro-BSA-rodamina fueron utilizados como trazadores de fluidos para etiquetar el sistema de endo-lisosomal celular del huésped, y el patógeno gastrointestinal Salmonella enterica serovar Typhimurium humana (Salmonella) se utilizó como un modelo de bacteria para estudiar las interacciones del patógeno con la acoger vía endocítica. PN oro-BSA-rodamina intracelular en las células no infectadas y las células infectadas con WT Salmonella o cepas mutantes se obtuvieron imágenes de un microscopio de escaneo láser confocal (CLSM).Entonces software Imaris se utilizó para cuantificar la distribución de los NPs, lo que indica que la infección por Salmonella inducida reordenamiento extremo de los endosomas / lisosomas. Después de la descripción de este método, los experimentos análogos pueden ser diseñados para rastrear el destino a largo plazo de los NPs internalizadas y para investigar la influencia de diferentes sustancias exógenas o factores endógenos en la vía endocítica de las células eucariotas.
Protocolo
1. Síntesis de 10 nm nanopartículas de oro (Gold PN) 15
- Preparar la solución A: añadir cloruro de oro acuosa 2 ml 1% en 160 ml Milli-Q, o doblemente destilada, agua.
- Preparar la solución B: añadir 8 ml 1% tri-citrato de sodio x 2 H 2 O y ácido tánico 160 l 1% en 32 ml Milli-Q, o doble destilada, agua.
- Calentar la solución A y B a 60 ° C y se mezclan con agitación. Observar un color azul oscuro de inmediato. Observe el color rojo después de unos 15 minutos. A continuación, calentar hasta 95 ° C, mantener 5 minutos y enfriar la solución a temperatura ambiente.
- Añadir una gota de la suspensión NP en una rejilla recubierta de carbono y dejar secar al aire. Compruebe el tamaño y la morfología de los PN mediante microscopía electrónica de transmisión.
2. El recubrimiento de oro PN con BSA y Etiquetado con Rodamina N-hidroxisuccinimidilo Ester (NHS) 16
- Añadir 900 l NP de oro en un tubo Eppendorf de 1,5 ml, se centrifuga a 15.000 xg durante 30 min. Opnalmente, preparar múltiples tubos pueden a la vez.
- Descartar el sobrenadante, volver a suspender el sedimento en 900 l de agua esterilizada Milli-Q y añadir 100 l 2 mg / ml de BSA / PBS, mezclar en un Vortex a 800 rpm durante 30 min.
- Para eliminar el exceso de BSA, centrifugar la preparación a 15.000 xg durante 60 min.
- Descartar el sobrenadante y vuelva a suspender los PN oro-BSA en 125 l de PBS, añadir 12,5 l de 1 M de bicarbonato.
- Inmediatamente antes de su uso, preparar una solución de 10 mg / ml de rodamina NHS / DMSO, añadir 30 l de solución de rodamina / DMSO NHS a 1 ml de la suspensión de oro-BSA NPs. Se incuba la reacción durante 2 horas (o O / N) a TA durante 800 rpm de mezcla, evitando la exposición a la luz.
- Purifica los PN-oro BSA-rodamina través de diálisis contra PBS a 4 ° C con 5 cambios de tampón durante el período de 36 - 48 h.
- Para estabilizar los PN, añadir 10 l de 200 mg / BSA / PBS ml en cada uno de los PN 1 ml de oro-BSA-rodamina. Para quitar la centrífuga libre o liberado BSA-rodamina, a los 15,000 g durante 60 min. Resuspender el precipitado en 2 mg / ml de BSA / PBS, medir OD 520, y se almacena a 4 ° C, evitando la exposición a la luz.
- Diluir los PN 10 veces con Milli-Q o agua doblemente destilada, añadir una gota sobre una rejilla recubierta de carbono, y dejar secar al aire. Compruebe el tamaño y la morfología de los PN mediante microscopía electrónica de transmisión (TEM).
NOTA: Todos los materiales utilizados para la preparación NP fueron esterilizados y la operación se llevó a cabo en una campana de cultivo celular o en un banco junto a una llama.
3. Cultura de células HeLa
- Células HeLa que expresan permanentemente LAMP1-GFP se cultivan en DMEM con 10% de suero de ternera fetal (FCS) y se cultivaron a 37 ° C en una atmósfera que contiene 5% de CO 2.
- Semillas de las células a una densidad de 50.000 por pocillo en un porta con cámara de 8 pocillos (ibidi) e incubar O / N.
4. Cultura de bacterias
- Uso Salmonella enterica serotipo Typhimurium NCTC 12023 wilde tipo d (WT) cepa. Para la comparación, utilizar cepas mutantes Δ ssaV defectuosos en el SPI2-T3SS y Δ SIFA carecen efector clave SIFA para SIF. Utilice las cepas que albergan plásmido pFPV25.1 para la expresión constitutiva de una mayor GFP.
NOTA: cepas bacterianas son cultivadas de forma rutinaria en caldo Luria-Bertani (LB) con la adición de 50 mg / ml de carbenicilina (WT) y LB con la adición de 50 mg / ml de carbenicilina y / o 50 mg / ml de kanamicina (Δ ssaV, Δ SIFA ) del requerido para mantener plásmidos. - Inocular una colonia de bacterias en 3 ml de LB con los antibióticos apropiados y crecer O / N a 37 ºC bajo condiciones de agitación para la aireación, luego diluido 1:31 en LB fresco y continuar el crecimiento durante 3,5 horas. En este punto del tiempo, los cultivos alcanzan la fase logarítmica tardía y las bacterias son altamente invasivos. A 'tambor rodillo' es conveniente para incubar cultivos en tubos de ensayo con aireación.
5. La infección de células HeLa porSalmonella y Gold-BSA-Rodamina PN pulso Chase-etiquetado (véase la figura 1 para el esquema)
- Mida OD 600 de las bacterias sub-cultivaron y diluir a OD 600 = 0.2 en 1 ml de PBS (~ 3 × 10 8 ufc / ml), añadir cantidades apropiadas de las bacterias a las células HeLa en portaobjetos de cámara de 8 pocillos para lograr una multiplicidad de infección (MOI) de 100.
- Incubar durante 30 min en la incubadora de células, lavar 3 veces con PBS para eliminar las bacterias no internalizados (este punto de tiempo se establece como 0 horas después de la infección, o 0 hr pi). Añadir 300 l de medio de cultivo fresco que contiene 100 mg / ml de gentamicina y mantener durante 1 hora. A continuación, sustituir el medio con medio fresco que contiene 10 mg / ml de gentamicina para el resto del tiempo de incubación.
- Después de la incubación con medio de cultivo que contiene 100 mg / ml de gentamicina durante 1 h, el medio se sustituye por medio de la formación de imágenes (Eagles MEM sin FCS, L-glutamina, fenol rojo y bicarbonato de sodio, con 30 mM HEPES, pH 7,4) containing 10 mg / ml de gentamicina. NPS-oro BSA-rodamina se añaden a células HeLa para obtener una concentración final de OD 520 = 0,1.
NOTA: NPs Gold-BSA-rodamina También se puede añadir a las células antes de la infección, o en diversos puntos de tiempo pi - Después de 1 h de incubación, retirar el medio, lavar 3 veces con PBS, y añadir 300 l de medio de formación de imágenes fresco que contiene 10% de FCS y 10 mg / ml de gentamicina para el resto del tiempo de incubación.
NOTA: La duración de la incubación puede variar dependiendo de la concentración de NP y las líneas celulares utilizadas. Para macrófagos RAW264.7, se observó que 30 min de incubación con NPs a una concentración de 520 OD = 0,05 permitido suficiente internalización.
6. Imaging
- Utilice un sistema de imagen confocal tal como un láser de barrido confocal (CLSM) o disco giratorio (SD) microscopio con una cámara de ambiente humidificado para imágenes de alta resolución en diferentes puntos de tiempo.
- Encienda la temperatura control sistema y espere hasta que se estabilice. Optimizar los ajustes de imagen como la ampliación, la velocidad de escaneo, resolución, Z-stack etc. Utilice los ajustes de excitación / emisión apropiados para GFP y PN oro-BSA-rodamina. Para este protocolo, utilizar una velocidad de exploración de 400 Hz, resolución de 512 x 512 píxeles y tamaño de Z a paso de 0,25 micras. Excite GFP y oro-BSA-rodamina usando un láser Ar (488 nm) y un láser de HeNe (543 nm), respectivamente. Incluir un (BF) del canal de campo brillante para observar la forma de las células. Por otro sistemas de microscopía y condiciones de infección, el ajuste tiene que ajustarse en consecuencia.
NOTA: Utilice el mismo láser Ar como fuente de luz de canal BF y la señal fue detectada con un detector fotomultiplicador (PMT). - En indicado puntos de tiempo pi, montar los portaobjetos de cámara de 8 pocillos que contienen células infectadas en la platina del microscopio y grabar imágenes.
7. Análisis de Imágenes
- Utilice microscopía software de análisis de imágenes (ver Materiales y Tabla de Equipo) para analizar la remodelación del sistema de endo-lisosomal por intracelular Salmonella. Abra los datos haciendo clic en "Abrir" y elegir el archivo.
NOTA: De forma alternativa, los paquetes de software de código abierto como ImageJ o FIJI se pueden utilizar para imagen análisis cuantitativos. - En la barra de herramientas de objetos de la vista Surpass clic en el icono
 añadir un nuevo elemento de superficie. Hacer clic en
añadir un nuevo elemento de superficie. Hacer clic en  (Siguiente).
(Siguiente). - Para analizar una región de interés (ROI), seleccione un segmento de retorno de la inversión. En un área de visualización, una sección rectangular con bordes superpuestos en la imagen representa el retorno de la inversión. Introduzca los valores en las direcciones x correspondiente, y-, y campos, z, o hacer clic directamente sobre las flechas en el rectángulo de vista previa para modificar el tamaño y la posición del ROI. Luego haga clic en
= "/ Files / ftp_upload / 52058 / 52058icon2.jpg" /> (Siguiente).
- Como canal de origen, seleccione el canal 3 (señal de Oro-BSA-Rodamina PN). Marque la opción suave para establecer la suavidad de la superficie resultante. Defina un valor manualmente o acepte el valor generado automáticamente. En Umbral, seleccione la opción Intensidad absoluta.
- Para el ajuste de umbral, seleccione la opción manual y establecer un valor. En el área de visualización, una vista previa umbral de superficie se muestra en gris.
- En la ficha Clasificar Superficies la superficie resultante se puede filtrar por diversos criterios. Un filtro por defecto es 'número de voxels> 10', y otros filtros también se puede incluir haciendo clic en 'añadir'. Si un filtrado no es necesario, a continuación, eliminar todos los filtros haciendo clic en el botón de eliminar. Haga clic en
 (Siguiente).
(Siguiente). - Para completar la creación de superficie, haga clic en/files/ftp_upload/52058/52058icon3.jpg "/> (Finalizar). En la lista de objetos, ahora se elimina la marca de la caja para el Volumen elemento y nueva superficie creada se muestra en el área de visualización.
- Exportar las estadísticas. Ahora, en la vista Superar el color de los temas varían de púrpura a rojo en función de su área. Y la mesa 'Números Parcela' muestra la información estadística (por ejemplo, número de identificación y el área de los objetos). Exportar todas las estadísticas de superficie 1 a un archivo de Excel con un clic
 (Guardar).
(Guardar).
Resultados
NP de oro se han generado a través de un método bien establecido a través de la reducción del ácido cloroaúrico por el citrato y ácido tánico. Como se muestra en la Figura 2A, los NPs de oro sintetizados eran casi de forma esférica con un tamaño de aproximadamente 10 nm. BSA-recubrimiento y rodamina-etiquetado no influyeron en su morfología o tamaño (Figura 2B).
Se ha informado de que NPs de oro pueden ser fácilmente absorbidos por las diversas células de mamíferos y terminaron en los sistemas endocítica 7. De acuerdo con trabajos previos, se observaron señales de fluorescencia de color rojo brillante en las células HeLa después de la incubación de 1 hora con NPs de oro-BSA-rodamina (Figura 3, WT 5 hr pi), lo que indica la internalización eficaz de los NPs por las células. La mayoría de las señales rojas fueron encontrados colocalized con señales verdes, lo que demuestra que los PN fueron confinados en endosomas o lisosomas finales. Sin embargo, a diferencia de la distribución uniforme de los PN en endosomas tardíos / lisosomasen las células no infectadas (Figura 3, mock), sus ubicaciones se reordenan en gran medida en las células infectadas con WT Salmonella. En la fase temprana de la infección (Figura 3, WT 5 h pi), Salmonella se replica dentro del SCV y SIF someterse extensión rápida o movimiento de contracción. En este punto de tiempo, una fracción de los NPs se encontró en SCV y SIF, mientras que otra fracción todavía se encuentra en endosomas tardíos / lisosomas libres. A las 8 h pi (Figura 3, WT 8 pi h), se formó una red estabilizada de SIF, y se encontraron la mayoría de los PN acumulada dentro de las estructuras tubulares, mientras que sólo una porción muy pequeña quedó situado en endosomas tardíos / lisosomas libres. Las cepas mutantes Δ ssaV y Δ SIFA mostraron comportamientos distintos. Como se muestra en la Figura 3 (Δ ssaV), a las 8 hr pi, Δ ssaV estaba confinado dentro de SCV, mientras que no se formaron estructuras SIF. Se observaron algunas PN rodea Salmónella dentro del SCV, pero la mayoría de los parlamentos nacionales aún estaban ubicados en endosomas tardíos / lisosomas libres. Para la cepa Δ SIFA (Figura 3, Δ SIFA), escape de Salmonella en el citoplasma se produjo, y no se observó asociación entre la PN y bacterias.
En nuestro anterior estudio se encontró que la pantalla SIF propiedades altamente dinámicos en la fase temprana de la infección (3-5 h pi), pero estabilizado en el último período (> 8 h pi) 12. Por lo tanto, nos preguntamos si la salmonela en las fases tempranas y tardías de la infección tiene capacidad comparable a reorganizar la distribución de los PN intracelulares. Como se muestra en la Figura 4, NP de oro se incubaron con células HeLa O / N antes de la infección, o en diferentes puntos de tiempo después de la infección (1-7 h pi) durante 1 hora, en todos los casos la mayoría de los PN internalizados se observaron acumulado en SCV o SIF.
Observ microscópicaciones reveló que la infección por Salmonella en los resultados de reordenamiento masiva del sistema endo-lisosomal de las células huésped. Como paso siguiente, se utilizó el paquete de software Imaris para analizar fenotipos de células huésped de Salmonella inducida de una manera cuantitativa. Utilizando la imagen de una célula HeLa infectadas a las 8 hr pi como un ejemplo, una instrucción de paso a paso para el análisis cuantitativo se representa en la Figura 5. A través de un umbral de intensidad de 15 y un "número de voxels> 10 'de filtro, 3D objetos fueron extraídos del archivo de imagen original. Se suponía que los objetos a ser estructuras intracelulares en el que el oro-BSA-rodamina NPs encuentra con. En este ejemplo, los objetos 67 se extrajeron en total, con un área resumió como 1,974.64 m 2. El objeto más grande, que colocalized con la red de SIF, tiene una superficie de 1,836.23 m 2, mientras que los otros son más pequeñas que 50 m 2. Para la comparación, un ejemplo que muestra el quantresultado del análisis itative de una célula no infectada fue dado. Aquí, los objetos 431 se extrajeron en total, dentro de la cual el valor promedio de la zona es 5 m 2 y el objeto más grande tiene una superficie de 34 m 2. El área sumada de los objetos es 2252 m 2, que es comparable a la célula infectada en la Figura 4 (1,975 m 2). Sin embargo, el número de objetos es mucho más grande que la otra (431 y 67 objetos, respectivamente), lo que indica gran medida fusión de vesículas con las estructuras tubulares inducidos por Salmonella.
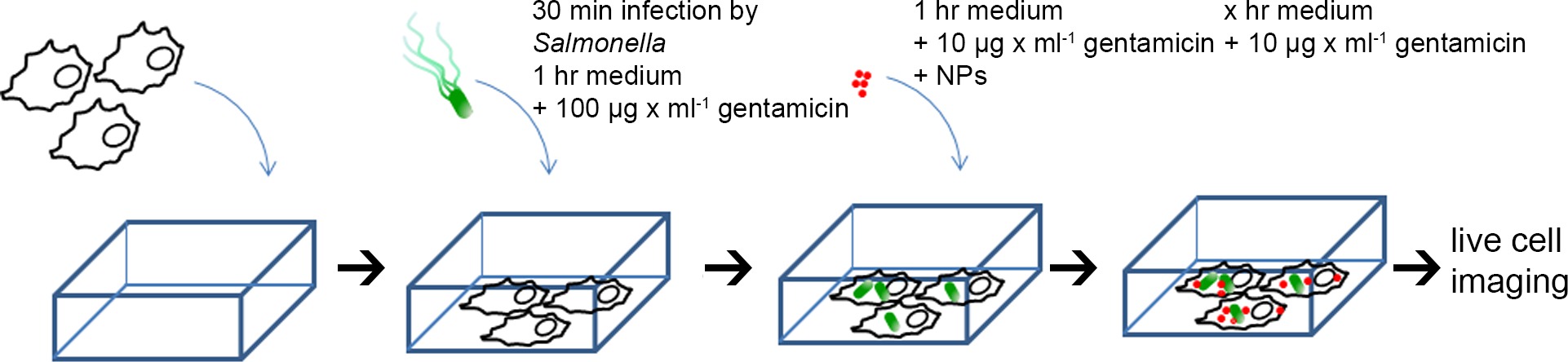
Figura 1. Esquema para la preparación de células HeLa por imágenes de células vivas. Células HeLa se sembraron en portaobjetos de cámara, infectadas de forma simulada, o infectados con diferentes cepas de Salmonella de 30 min, se lavó 3 veces con PBS, a continuación, incubat ed con medio que contiene 100 mg / ml de gentamicina durante 1 hr. Posteriormente, el medio fue reemplazado por imágenes de medio que contiene 10 nm de oro NPs-BSA-rodamina (OD 520 = 0,1) y 10 mg / ml de gentamicina, se incubaron durante 1 hr, y luego perseguido por medio de NP-libre para el resto del experimento . Imágenes de células vivas se realizó en diferentes momentos después de la infección (pi). Haga clic aquí para ver una versión más grande de esta figura.
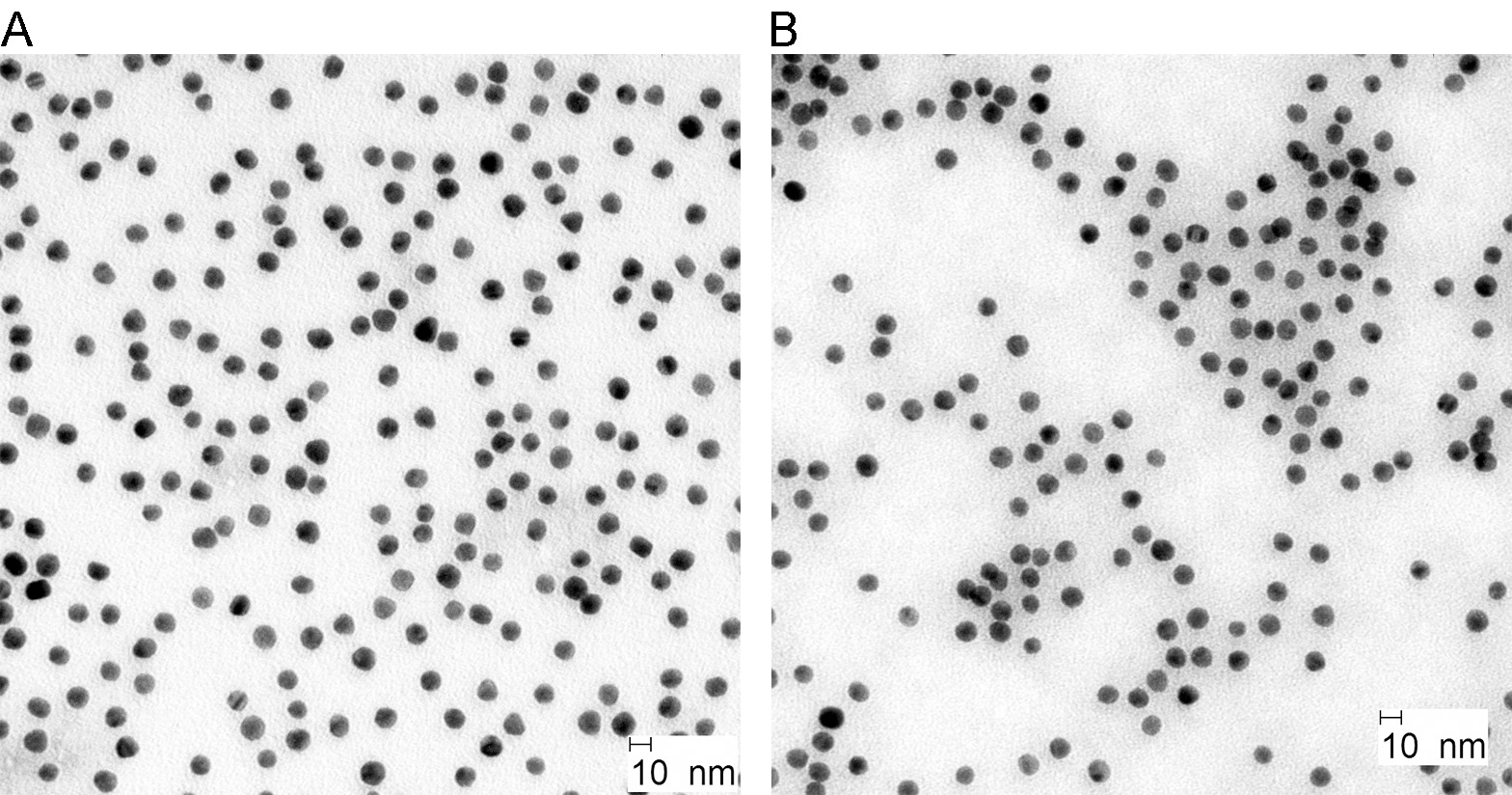
Figura 2. Imágenes de TEM de coloidales PN oro antes (a) y después de etiquetado (b). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Remodelación del host del sistema endo-lisosomal celular por las células de Salmonella. HeLa intracelulares eran modelo de infectados o infectadas con Salmonella WT, Δ ssaV o Δ SIFA cepas mutantes y pulso / Caza con 10 nm de oro PN-BSA-rodamina ( OD 520 = 0,1) se realizó como se describe en la Figura 1. proyecciones de intensidad máxima de CLSM Z-pilas se muestran. Las barras de escala, 10 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Accesibilidad del sistema endo-lisosomal en diversas fases de la infección por Salmonella. HeLalas células se pulsaron con 10 nm de oro NPs-BSA-rodamina (OD 520 = 0,1) O / N infección previa, o durante 1 hora a varios puntos de tiempo pi como se indica. Imágenes de células vivas se realizó a 8-9 pi hr proyecciones de intensidad máxima de CLSM Z-pilas se muestran. Las barras de escala, 10 micras. Haga clic aquí para ver una versión más grande de esta figura.
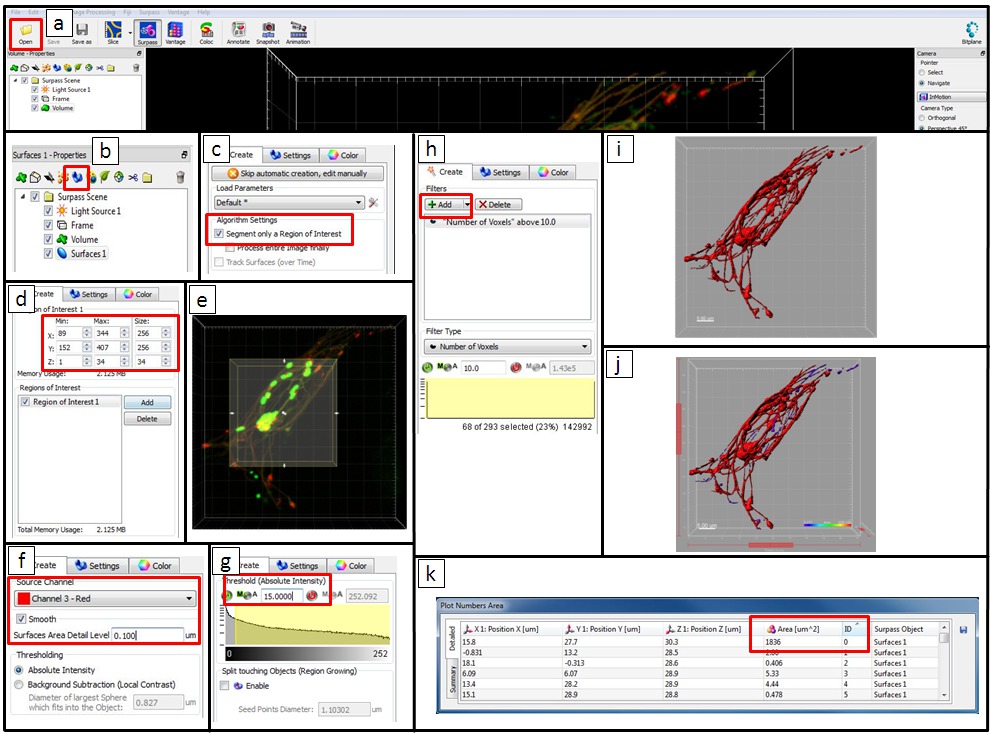
Figura 5. Paso a paso las instrucciones para el análisis cuantitativo por Imaris usando una imagen de una célula HeLa infectadas a las 8 h pi como ejemplo. (A) Abra los datos haciendo clic en "Abrir" y elegir el archivo. (B) En la barra de herramientas de objetos de la vista Surpass agregar un nuevo elemento de superficie. (C) Para analizar un retorno de la inversión, a continuación, seleccione un segmento de retorno de la inversión. (D) Introduzca los valores en las direcciones x correspondiente, y-, y z campos o (E) haga clic directamente sobre las flechas en el rectángulo de vista previa para modificar el tamaño y la posición de la ROI. En este ejemplo, un ROI no se necesita y la imagen entera se analizó. (F) Como canal de origen, seleccione el canal 3 (señal de Oro-BSA-Rodamina PN). Marque la opción suave para establecer la suavidad de la superficie resultante. Defina un valor manualmente o acepte el valor generado automáticamente. Aquí, se utilizó 0,1 m. Para 'Umbral' seleccione la opción 'Intensidad absoluta'. (G) Para el ajuste del umbral seleccionar la opción manual y establecer un valor (en este ejemplo 15 se utilizó). En el área de visualización de una superficie umbral vista previa se muestra en gris. (H) En la pestaña 'Clasificar Superficies' la superficie resultante se puede filtrar por diversos criterios. Un filtro por defecto es 'número de voxels> 10. Lafiltro se puede ajustar por introducir un nuevo valor y otros filtros puede agregarse. En este ejemplo, hemos mantenido el 'número de voxels> 10' filtro. (I) para completar la creación de superficies clic en "Finalizar". En la lista de objetos ahora desmarca la casilla para el volumen del elemento y la nueva superficie creada se muestra en el área de visualización en rojo. (J) En la vista Superar el color de los temas varían de púrpura a rojo en función de su área. (K) La tabla de números de las parcelas de la zona 'muestra la información estadística. Las estadísticas de exportación a un archivo de Excel. Haga clic aquí para ver una versión más grande de esta figura.
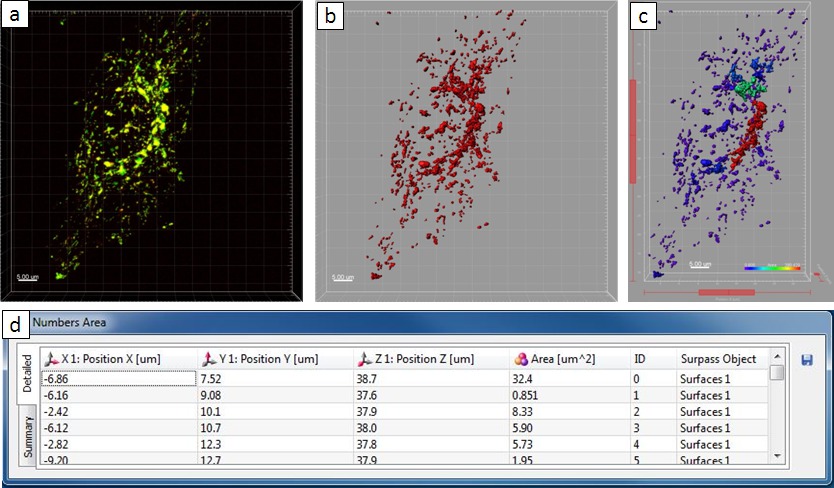
Figura 6. resultado del análisis cuantitativo de una célula no infectada. ( A) Imagen de microscopia confocal. (B) La nueva superficie creada. (C) La nueva superficie en la vista de superar. (D) La mesa 'Números Parcela' muestra la información estadística. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El sistema de endo-lisosomal de las células de mamíferos controles importantes procesos fisiológicos, incluyendo la absorción de nutrientes, la transducción de señales mediada por la hormona, la vigilancia inmune, y la presentación de antígeno 17. Hasta ahora, una variedad de marcadores se han utilizado para el etiquetado de los estudios de la vía endocítica y seguimiento. Por ejemplo, las sondas son sondas LysoTracker acidotropic fluorescentes desarrollados por Molecular Probes (Life Technologies, EE.UU.) para el etiquetado de lisosoma, que pueden acumularse selectivamente en los compartimentos celulares con bajo pH interno y eficaz etiquetar las células vivas a concentraciones nanomolares 18. Sin embargo, a largo tiempo de incubación de sondas LysoTracker con células puede inducir un aumento del pH lisosomal y conducir a posibles cambios fisiológicos de los lisosomas 19. Algunas biomoléculas grandes, tales como dextranos marcados con fluoróforo, también se utilizan con frecuencia para endosoma / etiquetado lisosomas. Sin embargo, bajo fotoestabilidad, la vida corta de circulación, y pretención de suelo durante la fijación obstaculizar sus aplicaciones en imágenes de células vivas a largo plazo y el microscopio correlativa estudia 16,19. Aquí, NPs de oro-BSA-rodamina fueron utilizados como trazadores de fluidos para etiquetar el sistema de endo-lisosomal celular del huésped. Se observaron alta eficiencia de absorción y fuertes señales de fluorescencia intracelular. La colocalización casi completa de la PN con lisosomal LAMP1 glicoproteína, que está altamente enriquecido en la membrana de endosomas tardíos / lisosomas, verificó el etiquetado adecuado del sistema endo-lisosomal por los parlamentos nacionales. Combinando el uso de los PN fluorescentes con los otros marcadores como Lysotracker puede proporcionar información complementaria sobre la célula huésped tráfico vesicular y la maduración.
Vale la pena mencionar que la internalización celular de NPs es altamente dependiente de sus dimensiones físicas y componentes químicos. Hemos probado NPs de oro-BSA-rodamina con un tamaño de 5 nm, 10 nm, 15 nm y 30 nm, y la distribución intracelular similar ense observaron células HeLa laterales (resultados no mostrados). Utilizamos las células HeLa como conveniente línea de células para estudios de infección por Salmonella. Sin embargo, NPS-oro BSA-rodamina también pueden ser internalizados fácilmente por varias otras líneas celulares y células primarias son susceptibles. Por ejemplo, se observó Salmonella inducida por estructuras tubulares y etiquetado por NP en CHO, COS-7, CaCo2, o células 3T3, así como en las células RAW264.7 de interferón-γ-estimulado similares a macrófagos línea celular o macrófagos murinos primarios y células dendríticas. Sin embargo, cada línea celular se requiere ajuste de la infección y los protocolos de pulso / de persecución.
Se ha informado de que NPs de sílice colorante atrapado se pueden utilizar como un biocompatible, de larga vida, y muy fotoestable marcador lisosoma 19, y también comparado el comportamiento de los NPs de sílice dopado con rodamina tamaño variable (30 - 1000 nm). Etiquetado adecuado de los endosomas tardíos / lisosomas por PN de sílice en las células no infectadas y la acumulación de los PN en SSe observó CV y SIF en células de Salmonella infectado con. Sin embargo, debido a la formación de agregados de NPs o el gran tamaño de NPs de sílice individuales, la distribución de NPs junto con estructuras tubulares inducidos por Salmonella no fue uniforme (datos no mostrados).
Un rasgo característico de SCV, así como SIF es la presencia de glicoproteínas altamente abundantes lisosomales tales como LAMP1 12. Aquí, una línea celular HeLa que expresan establemente LAMP1-GFP se utilizó para la conveniencia de imágenes de células vivas del sistema de endo-lisosomal y las estructuras SCV y SIF. Cepas de Salmonella que expresan constitutivamente mejorado GFP se usaron en los experimentos de infección para indicar la ubicación de las bacterias . Debido al tamaño uniforme y forma de las bacterias intracelulares, la fluorescencia GFP bacteriana, en general, es fácilmente distinguible de la etiqueta GFP en las membranas de endo-lisosomal. Sin embargo, para futuros experimentos en los que la señal fluorescente de las bacterias y pr membranaoteins necesitan estar, otras proteínas de fusión fluorescentes precisamente diferenciar por ejemplo, mTurquoise, se recomiendan para ser integrado. Esto, sin embargo, resulta en rondas adicionales de iluminación y de adquisición de imagen, teniendo el riesgo de mayor foto-daño en los experimentos de células vivas.
Para descubrir genes y mecanismos esenciales para los patógenos bacterianos para manipular las vías de la célula huésped, numerosos mutantes necesitan ser creados y sus actuaciones deben compararse con cuidado. Por ejemplo, las cepas mutantes de Salmonella Δ ssaV y Δ SIFA están muy atenuados en la virulencia sistémica y la replicación intracelular 20,21. Ambas cepas Δ Δ ssaV y SIFA fallan para inducir SIF, y adicionalmente Δ SIFA Salmonella pierden la membrana SCV durante el curso de la infección 12. Comparando los fenotipos de WT y cepas mutantes es instrumental en la comprensión de la capacidad de Salmonella a remodel célula huésped tráfico vesicular. Basado en el examen microscópico, es obvio que WT Salmonella subvertir anfitrionas vías endocítica celulares en un grado mucho mayor en comparación con cepas mutantes Δ Δ ssaV y SIFA. Esta función podría permitir Salmonella intracelular para obtener más nutrientes para su supervivencia intracelular y la replicación.
Imágenes de microscopía confocal demuestran claramente la remodelación de host del sistema endo-lisosomal celular por bacterias intracelulares. Sin embargo, se requiere un análisis cuantitativo de las imágenes para la comparación precisa. En el método descrito aquí, software Imaris se utiliza para la extracción de objetos en 3D que tienen la intensidad de fluorescencia en el canal 3> 15 y el número de voxels> 10. Estos objetos se supone que las estructuras de membrana intracelulares que contienen oro-BSA-Rodamina NPs. El umbral de intensidad de fluorescencia y los filtros pueden ser definidos de acuerdo con la calidad de las imágenes, pero should debe mantenerse constante para comparar diferentes condiciones o cepas. Aquí se presentan ejemplos de una célula no infectada y una célula infectado con WT Salmonella a las 8 h pi, con 431 y 67 objetos extraídos, respectivamente. A pesar de la aparente diferencia, no es racional para comparar sólo el número de los objetos, ya que el tamaño de las células no son lo mismo. Una solución es para normalizar el número de los objetos a la zona sumada (en este ejemplo, 2252 m 2 y 1.975 m 2, respectivamente) o la suma de las intensidades de fluorescencia de los objetos dentro de las células. Alternativamente, también es posible realizar un seguimiento de una célula antes de la infección y en diferentes puntos de tiempo pi con el fin de comparar la distribución de NPs en diferentes etapas de la infección.
En conclusión, en este método se aplicaron NPs de oro-BSA-rodamina para etiquetar el sistema de endo-lisosomal de las células eucariotas. La manipulación del sistema de endo-lisosomal celular del huésped por un intracellular patógeno fue observada por CLSM de células en vivo y los resultados de análisis cuantitativo indicó reordenamientos extremas de endosomas tardíos / lisosomas por WT Salmonella. Salmonella se utilizó como un modelo patógeno en este estudio, pero el comportamiento intracelular de otros patógenos bacterianos, tales como Shigella flexneri y Listeria monocytogenes también podría ser investigados utilizando este enfoque. En principio, el oro-BSA-rodamina NPS podría ser internalizados por una gran variedad de líneas celulares, por lo tanto son prometedores que se aplica ampliamente en estudios de investigación de la interacción de la vía endocítica con sustancias endógenas o exógenas divergentes.
Divulgaciones
No conflicts of interest declared.
Agradecimientos
This work was supported by the Deutsche Forschungsgemeinschaft by grant Z within Sonderforschungsbereich 944 ‘Physiology and Dynamics of Cellular Microcompartments’ and HE1964/18 within priority program 1580.
Materiales
| Name | Company | Catalog Number | Comments |
| Gold chloride | Sigma-Aldrich | 520918 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Tri-sodium citrate | Sigma | C8532 | |
| Bovine serum albumin | Sigma | A2153 | |
| NHS-Rhodamine | Pierce | 46406 | |
| DMSO | Sigma | D8418 | |
| HEPES | Sigma | H3375 | |
| Gentamicin | Applichem | A1492 | |
| Kanamcyin | Roth | T832 | |
| Carbenicillin | Roth | 6344 | |
| 8-well chamber slides | Ibidi | 80826 | tissue culture treated, sterile |
| Imaris Software | Bitplane | version 7.6 | various configurations available |
Referencias
- Coto-Garcia, A. M. Nanoparticles as fluorescent labels for optical imaging and sensing in genomics and proteomics. Anal. Bioanal. Chem. 399, 29-42 (2011).
- Xie, J., Lee, S., Chen, X. Nanoparticle-based theranostic agents. Adv. Drug Deliv. Rev. 62, 1064-1079 (2010).
- Ruedas-Rama, M. J., Walters, J. D., Orte, A., Hall, E. A. Fluorescent nanoparticles for intracellular sensing: a review. Anal. Chim. Acta. 751, 1-23 (2012).
- Wu, C., Chiu, D. T. Highly fluorescent semiconducting polymer dots for biology and medicine. Angew. Chem. Int. Ed. Engl. 52, 3086-3109 (2013).
- Giepmans, B. N., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nat. Methods. 2, 743-749 (2005).
- Kumar, D., Saini, N., Jain, N., Sareen, R., Pandit, V. Gold nanoparticles: an era in bionanotechnology. Expert Opin. Drug Deliv. 10, 397-409 (2013).
- Dykman, L. A., Khlebtsov, N. G. Uptake of engineered gold nanoparticles into mammalian cells. Chem. Rev. 114, 1258-1288 (2014).
- Chithrani, B. D., Ghazani, A. A., Chan, W. C. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6, 662-668 (2006).
- Finlay, B. B., Cossart, P. Exploitation of mammalian host cell functions by bacterial pathogens. Science. 276, 718-725 (1997).
- Bhavsar, A. P., Guttman, J. A., Finlay, B. B. Manipulation of host-cell pathways by bacterial pathogens. Nature. 449, 827-834 (2007).
- Malik-Kale, P., et al. Salmonella - at home in the host cell. Front. Microbiol. 2, 125(2011).
- Rajashekar, R., Liebl, D., Seitz, A., Hensel, M. Dynamic remodeling of the endosomal system during formation of Salmonella-induced filaments by intracellular Salmonella enterica. Traffic. 9, 2100-2116 (2008).
- Schroeder, N., Mota, L. J., Meresse, S. Salmonella-induced tubular networks. Trends Microbiol. 19, 268-277 (2011).
- Drecktrah, D., Knodler, L. A., Howe, D., Steele-Mortimer, O. Salmonella trafficking is defined by continuous dynamic interactions with the endolysosomal system. Traffic. 8, 212-225 (2007).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. Eur. J. Cell Biol. 38, 87-93 (1985).
- Zhang, Y., Hensel, M. Evaluation of nanoparticles as endocytic tracers in cellular microbiology. Nanoscale. 5, 9296-9309 (2013).
- Pollard, T. D., Earnshaw, W. C., Lippincott-Schwartz, J. Chapter 22. Cell Biology. , (2007).
- LysoTracker and LysoSensor Probes. , Life Technologies Corporation. Carlsbad, CA. (2013).
- Shi, H., He, X., Yuan, Y., Wang, K., Liu, D. Nanoparticle-based biocompatible and long-life marker for lysosome labeling and tracking. Anal. Chem. 82, 2213-2220 (2010).
- Hensel, M. Genes encoding putative effector proteins of the type III secretion system of Salmonella pathogenicity island 2 are required for bacterial virulence and proliferation in macrophages. Mol. Microbiol. 30, 163-174 (1998).
- Beuzon, C. R., et al. Salmonella maintains the integrity of its intracellular vacuole through the action of SifA. EMBO J. 19, 3235-3249 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados