Method Article
Винтовая Организация свертывания крови фактора VIII на липидный нанотрубок
В этой статье
Резюме
Мы представляем сочетание крио-электронной микроскопии, липидов нанотехнологии и структурного анализа применяется для решения мембраносвязанное структуру двух весьма гомологичных FVIII формах: человека и свиньи. Методология, разработанная в нашей лаборатории, чтобы спирально организовать две функциональные рекомбинантные формы FVIII на отрицательно заряженных липидных нанотрубок (LNT) описывается.
Аннотация
Крио-электронной микроскопии (Крио-EM) 1 является мощным подход исследовать функциональную структуру белков и комплексов в гидратной государственной и мембранной среды 2.
Фактор свертывания крови VIII (фактора VIII) 3 многодоменный плазмы крови гликопротеин. Дефект или недостаток фактора VIII является причиной гемофилии типа А - тяжелое расстройство кровотечения. По протеолитической активации фактора VIII связывается с серинпротеазы Фактор IXa на отрицательно заряженной мембраны тромбоцитов, которая имеет решающее значение для нормального свертывания крови 4. Несмотря на ключевую роль фактора VIII играет в коагуляции, структурная информация для его мембраносвязанного государства является неполной 5. Рекомбинантный FVIII концентрат является наиболее эффективным средством против типа гемофилии А и коммерчески доступны FVIII может быть выражена как человека или свиньи, как при формировании функциональных комплексов с человеческим фактором IXa 6,7. "> В этом исследовании мы представляем сочетание крио-электронной микроскопии (Крио-EM), липидов нанотехнологии и структурный анализ применяется для решения мембраносвязанное структуру двух весьма гомологичных форм фактора VIII:. Человеческий и свиной Методология, разработанная в нашей лаборатории на спирально организовать две функциональные рекомбинантные формы FVIII на отрицательно заряженных липидных нанотрубок (LNT) описывается. Представительные результаты показывают, что наш подход является достаточно чувствительным, чтобы определить различия в спиральной организации между ними высоко гомологичны в последовательности (идентичность последовательности 86% ) белки. Подробные протоколы для спиральной организации, Cryo-EM и электронной томографии (ET) сбора данных приведены. двумерной (2D) и трехмерной (3D) структурный анализ применяется для получения 3D-реконструкций человека и свиньи фактора VIII-LNT обсуждается. Представленные человека и свиньи структуры фактора VIII-LNT показать потенциал предлагаемой методологии для вычисэ функционал, связанный с мембраной организация свертывания крови фактора VIII с высоким разрешением.
Введение
Фактор свертывания крови VIII (FVIII) является большой гликопротеин 2332 аминокислот, организованных в шесть областей: A1-A2-B-A3-C1-C2 3. После активации тромбин FVIII действует как кофактор к фактору IXa в связанной с мембраной Тэнасе комплекса. Связывание активированного фактора VIII (FVIIIa) в FIXa в мембранный-зависимости образом повышает FIXa эффективность указанных протеолитических более 10 5 раз, что имеет решающее значение для эффективного свертывания крови 4. Несмотря на важную роль фактора VIII играет в коагуляции и образования комплекса Тэнасе, функциональная мембраносвязанный структура фактора VIII до сих пор не решен.
Для решения этой проблемы, одиночные липидного бислоя нанотрубки (LNT), богатые фосфатидилсерином (PS), способные связываться FVIII с высоким сродством 8, 9 и напоминающие поверхности активированных тромбоцитов были разработаны 10. Последовательный винтовая организация фактора VIII обязаны LNT было доказано быть эффективнойве для структуры определения фактора VIII мембраносвязанного государства по Cryo-EM 5. Функционализированный LNT являются идеальной системой для изучения белок-белковых и белок-мембрана взаимодействия спирально организованных мембранных белков, ассоциированных с Cryo-EM 11, 12. Криогенная EM имеет преимущество по сравнению с традиционными структурных методов, таких как рентгеновской кристаллографии и ЯМР, как образец сохраняется в ближайший к физиологической среде (буфер, мембраны, Ph), без добавок и изотопов. В случае фактора VIII, изучая мембраносвязанное структуру с этой техникой еще более физиологически значимым, так как LNT сильно напоминают по размеру, форме и составу псевдоподий из активированных тромбоцитов, где Тэнасе комплексы собирают в естественных условиях.
Дефекты и дефицит фактора VIII причины гемофилии А, тяжелым расстройством кровотечения, влияющих 1 в 5000 самцов человеческой популяции 4, 6. Наиболее еffective терапия для гемофилии А является пожизненное администрация рекомбинантного человеческого фактора VIII (hFVIII). Значительное осложнение рекомбинантного фактора VIII Гемофилия А терапии является развитие ингибирующих антител к человеческой форме, влияющих около 30% больных гемофилией А 13. В этом случае свиной FVIII (pFVIII) концентрат используется, как свиньи FVIII отображает низкой перекрестной реактивностью с ингибирующих антител против человеческого фактора VIII и форм функциональные комплексы с человеческим FIXa 7. Установление мембраносвязанное организацию как свиньи и форм человеческих FVIII важно понимать структурную основу функции кофактора фактора VIII и последствия для гемостаза крови.
В этом исследовании мы описываем сочетание липидов нанотехнологии, Cryo-EM и структурного анализа разработан, чтобы решить мембраносвязанное организацию двух весьма гомологичных форм фактора VIII. Представленные данные Крио-EM и 3D структуры для спирально организованной Porciпе и человеческого фактора VIII на отрицательно заряженной LNT показать потенциал предлагаемой нанотехнологии как основы для структуры определения фактора VIII и связанных с мембраной факторов и комплексов в физиологической среде мембраны коагуляции.
протокол
1. Подготовка образца
- Буфер обмена человеческого фактора VIII-BDD 14 и свиной FVIII-BDD 15 против HBS-Ca буфера (20 мМ HEPES, 150 мМ NaCl, 5 мМ CaCl 2, рН = 7,4) и концентрируют до 1,2 мг / мл. Держите белкового раствора при температуре -80 ° С.
- Подготовка липидов нанотрубок (LNT) путем смешивания GalactosylCeramide (GC) и фосфатидилсерин (PS) в 1:04 в / в соотношении в хлороформом. Упаривают хлороформ в атмосфере аргона и солюбилизации липидов в HBS буфере до 1 мг / мл. Держите LNT решение при 4 ° С.
2. Крио-электронной микроскопии фактора VIII-LNT
- Крио-ЭМ Подготовка образцов
- Тлеющий разряд 300 сетка Quantifoil R2 / 2 медных сетей (побочные углерода до) в смеси O 2 и H 2 газа в течение 10 сек при 50 W.
- Смешайте растворы FVIII и LNT в HBS-буфере Ca в 1:01 вес / вес отношение и инкубировать в течение 15 мин при комнатной температуре.
- Нанесите каплю 2,5 мклиз фактора VIII-LNT образца с гидрофильным электронной микроскопии сетки в Vitrobot Mark IV влажной камере (100% влажности).
- Клякса и флэш заморозить сетку (один пятно в течение 3,5 сек, промокните силу 1) в жидком C 2 H 6, охлаждается жидким N 2, чтобы получить аморфный лед.
- Храните сетки в ящики для хранения в жидком N 2 (LN2).
- Крио-ЭМ сбора данных
ПРИМЕЧАНИЕ: JEM2100-LaB6 (2010 год) оснащен операционной системой TEMCON, состоящей из компьютера, подключенного к электронным микроскопом, экраном с окнами чтения вакуумную систему, систему освещения, HT, объектив токи и так на и два панели: с обеих сторон, размещены по обе стороны колонны. Сдвиг луч X, Y ручки (SHIFT Y, SIFT Y) и многофункциональные (DEF / STIG) ручки находятся на обеих панелях. На левой панели находится регулятор освещения (BRIGTHNESS). На правой панели расположены: увеличение (МАГ / CAM длина) и фокусировки (Фокус) ручки и три Imaginг (MAG1, MAG2, LOWMAG) и дифракционной (DIFF) кнопки режимов. Мы приобретаем наши данные в MAG1 на альфа-2. Минимальная доза условия освещения (MDS), необходимые для сбора данных Крио-EM устанавливаются с F1 до F6 кнопок, верхнем ряду на правой панели. В этом протоколе используются общие настройки: F1 - поднять / опустить экран, F2 - режим поиска, F3 - режим фокусировки, F4 - Режим ФОТО, F5 - MDS OFF / ON и F6 - ЛУЧ ПУСТО, используются для защиты образца от радиации повредить, отклоняя луч.- Поместите Крио-держатель в крио-станции и наполнять сосуд Дьюара держателя и крио-станции с LN2. Когда температура достигает -192 ° C, открытый затвор на кончике держателя, место ранее заморожены Крио-EM сетки в отведенном для этого месте и закрепите с кольцевой зажим.
- Вставьте крио-держатель в электронном микроскопе. Заполните Дьюара в крио-держателем и анти-загрязнитель камеры с LN2. Подождите, пока держатель для стабилизации в течение 30-60 мин. Нажмите F6, иповерните нить на. Когда нить насыщенный, нажмите F6 и откройте затвор на держатель, чтобы посмотреть в сетку.
- Пресс Низкий Mag / альфа-1 (установлен на уровне 200X MAG) и размещает места тонким льдом на сетке.
- Перейти к MAG 1/alpha 2 установить минимальную дозу режим (MDS) и получать данные Крио-EM при низких электронных дозах, не повреждая образца.
- Нажмите F2, чтобы установить режим поиска. Установите увеличение в 40000 х. Увеличить пучок с BRIGTNESS ручки к минимальной дозе электронного ~ 0,04 э - / A 2 · с. Пресс DIFF для переключения в режим дифракции. Установите длину камеры до 120 см с ручкой МАГ / CAM длина. Найдите области на сетке в пределах предварительно выбранных районов в LOWMAG которые имеют липидные нанотрубки в отверстия углеродной пленки.
- Нажмите F4, чтобы установить режим фото при 40000-кратном увеличении и установить освещение с яркостью ручки в дозах 16-25 е - / A 2 · с. Нажмите кнопку Стандартный фокус установить фокус условия регулировки Z-высотаобразца с Z вверх / вниз (панель П контроль). Установите расфокусировки от -1,5 до -2,5 мкм.
- Совместите ПОИСК и режим ФОТО рисуя квадрат в окне Live View на цифровом мониторе фотокамеры в режим поиска соответствующей области для включения в образ в режиме фотосъемки.
- Нажмите F3, чтобы установить режим фокусировки при 100000-кратном увеличении. Фокус освещение для покрытия чип CCD (~ 4 - 5 Радиус см) и от оси не облучать область, которая будет отображается в режиме PHOTO. Отрегулируйте расфокусировки до ~ -1.5 и -2.5 мкм с FOCUS ручкой и правильным для астигматизма изображения с DEF / Стиг ручек.
- Выберите фактора VIII-LNT для включения в образ в режим поиска путем приобретения изображения в реальном времени в окне Live View на цифровом мониторе фотокамеры. Сосредоточьте фактора VIII-LNT на площади нарисованного на окне Live View.
- Запись цифрового изображения на ПЗС-камеры на 52000 X эффективного увеличения и 0,5 воздействия сек за счет перехода в режим Фото и нажав обретенияE кнопку на цифровой микрофотографии мониторе фотокамеры. Условия получения изображения устанавливаются такие как луч заготовки (жалюзи) открытой только тогда, когда образ приобрел в режиме фотосъемки.
- Проверьте качество и расфокусировки полученного изображения, нажав CTRL-F для получения быстрого преобразования Фурье (БПФ).
3. 3D Реконструкция
ПРИМЕЧАНИЕ: Программное обеспечение для анализа изображений используются для 2D и 3D анализа: EMAN2 и IHRSR находятся в свободном доступе. EMAN2 можно загрузить с http://blake.bcm.edu/emanwiki/EMAN2/Install. Программное обеспечение IHRSR можно получить от профессора Egelman: egelman@virginia.edu. Окончательные уточнения IHRSR запускаются на Техас расширенный Computing Center кластер: http://www.tacc.utexas.edu/ в Университете Техаса, Остин. Алгоритм восстановления 3D показано на рисунке 1 состоит из двух основных этапов: Первый выбора гомогенной набор спиральных сегментов (частиц) с эталонным бесплатно alignme 2Dнт (RFA) алгоритмы реализованы в EMAN 2, второй достижения 3D-реконструкция на основе винтовых параметров и обратно алгоритмов проекционных включены в IHRSR. Первый шаг использует программы, разработанные для выбора однородных наборов частиц для 3D реконструкции с одиночной SPA частиц (алгоритмов), на которые EMAN2 был специально разрабатываются и распространяются: http://blake.bcm.edu/emanwiki/EMAN2. Этот шаг был адаптирован к данным Крио-ЭМ. Второй шаг достигается с помощью алгоритма IHRSR, который специально предназначен для данного типа винтовых агрегатов, полученных с рекомбинантных форм фактора VIII. Этот алгоритм был документально по разным странам через научной литературе 12.
- Выполнить анализ 2D изображения с EMAN2 научной обработки изображений пакет: http://blake.bcm.edu/eman2/doxygen_html 16, чтобы выбрать однородную частицу (винтовая сегмент) Наборы для спиральной реконструкции.
- Выберите Крио-EM микрофотографии с straigHT и хорошо организованной спиральные трубки с цифровым программным обеспечением камеры и средств визуализации.
- Обратить, нормализуют и фильтр для рентгеновских пикселей в e2workflow.py GUI, реконструкции одной частицы опции (SPR): http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2projectmanager
- Импорт перевернутые, нормированные и рентгеновской пикселей отфильтрованные изображения в e2helixboxer.py GUI. Выберите фактора VIII-LNT спиральные трубки и сегмент в 256 х 256 пикселей (2.9 A / PIX) с 90% перекрытием с помощью: http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2helixboxer
- Оцените расфокусировки от оригинальных снимках и применять контрастный передаточную функцию (CTF) коррекции (только фаза коррекции) в спиральных сегментов из тех же снимках с e2ctf.py опции включены в e2workflow.py: http://blake.bcm. edu/emanwiki/EMAN2/Programs/e2ctf.
- Создать начальные частицы (спиральные сегменты) устанавливает в e2workflow.py GUI - SPR вариант: http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2workflow.
- Рассчитать средние 2D класса с алгоритм e2refine2d.py применения опорного бесплатно K-среднее классификацию, чтобы выбрать однородных наборов данных с тем же LNT диаметра и степени винтовой порядке (рис. 2), после сценария: 'e2refine2d.py - ИТЭР = 8 - naliref = 5 - nbasisfp = 8 - путь = r2d_001 - вход = INPUT.hdf - NCLs = 51 - simcmp = точка - simalign = rotate_translate_flip - classaligncmp = точка - classraligncmp = фаза - classiter = 2 - classkeep = 0,8 - classnormproc = normalize.edgemean - classaverager = средняя - normproj-classkeepsig ', изменение NCLs значение соответственно.
- Оцените начальные установленные в 150 классов »NCLs = 151" более 8 итераций с "classkeep = 0,8 'данные, а это означает, что частицы с менее 80% сходства с в среднем классе, исключаются из данного класса. http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2refine2d
- Слияние частиц из средних классовс ярко выраженным спиральным дифракции в e2display.py создать промежуточный набор данных.
- Классифицировать промежуточные данные, установленные в 50 классов »NCLs = 51", чтобы дифференцировать классы с таким же диаметром и степени упорядоченности.
- Слияние частиц из классов с таким же диаметром и степени упорядоченности e2display.py создать окончательный набор данных для трехмерной реконструкции: http://blake.bcm.edu/emanwiki/EMAN2/Programs/emselector.
- Выполните спиральную реконструкции с Итерационное Винтовая реальном пространстве Реконструкция (IHRSR) алгоритма, как описано в Egelman 17, 18.
- Оцените рост, DZ (а) спирали фактора VIII-LNT из объединенного преобразования Фурье из частиц в конечном наборе данных.
- Определите азимутальный угол ΔΦ (º), запустив параллельные уточнения IHRSR с постоянным Δz, увеличивая ΔΦ от 576; до 60 ° с шагом 5 °.
- Запустите 100 последовательных IHRSR циклов для каждого конечного набора данных с безликой цилиндра в качестве начального объема и начальных винтовых параметров Δz и ΔΦ, как определено в 3.2.1. и 3.2.2.
- Осмотрите окончательные объемы сходимости винтовых параметров и переписки между класса средних с 2D классификации окончательного набора данных и проекций от окончательного реконструкции IHRSR.
- Накладывают симметрию в конечные 3D реконструкции, соответствующие асимметричным распределением единичной наблюдаемого в конечных объемах асимметричных 3D: 4-кратный для человеческого фактора VIII-LNT и 5-кратное для свиного фактора VIII-LNT. Запустите еще 100 циклов уточнения для формирования окончательного симметризованное 3D-реконструкция.
- Рассчитайте корреляционная кривая Фурье Shell для обоих томов, сначала отделяя соответствующие установленные в четные и нечетные данные: 'e2proc2d.py - сплит = 2 '. Затем запустите 100 IHRSR уточнения последовательных, как описано в пункте 3.2.3. Рассчитайте FSC из 3D томах, созданных из четных и нечетных наборов данных: 'e2proc3d.py evenvolume.mrc fsc.txt - calcfsc = oddmap.mrc'.
- Визуализация и сегмент объемы фактора VIII-LNT в UCSF химеры.
- Откройте окончательные объемы, начиная с шага 3.2.5. в UCSF Химеры и установить уровень контура до 0,005 в Инструменты> объем данных> параметр программы просмотра VOLUME.
- В Сервис> объем данных> СЕГМЕНТ MAP, выберите объем в закладке отображения сегмента и нажмите сегмента к сегменту громкости.
- Сегменты Группа, соответствующая одной элементарной ячейки, выбрав с CTRL + SHIFT и нажав группы.
- Цвет сегменты по элементарной ячейки и спирали с Действия> цветной вариант, чтобы подчеркнуть особенности строения.
4. Электронной томографии
- Отрицательно Витражи фактора VIII-LNT Подготовка образцов
- <литий> Подготовка образцов фактора VIII-LNT как для экспериментов Крио-ЭМ.
- Тлеющего разряда углерода покрытием 300-сетки медную сетку (со стороны углерода вверх) в смеси O 2 и H 2 газа в течение 10 сек при 50 Вт, как для Крио-ЭМ экспериментов.
- Нанесите каплю 2,5 мкл фактора VIII-LNT подвески с 6-нм коллоидных наночастиц золота в сетке, промокните излишки жидкости и отрицательно пятно с применением 5 мкл 1% уранилацетатом решение в течение 2 мин. Промокните лишнюю жидкость и воздух сухой сетку.
- Электронной томографии Сбор данных
- Трансфер сетку в одиночный держатель наклона.
- Передача держатель в электронном микроскопе.
- Сбор наклона серии автоматически с программным обеспечением SerialEM 19 на 2 ° с шагом в угловом диапазоне от -60 ° до 60 ° и записи изображений с ПЗС-камеры на 52000 X эффективного увеличения, -6 до -10 мкм расфокусировки и электронной дозе 150 - 170 элементctrons / A 2 · с на томограмме.
- Электронной томографии Реконструкция фактора VIII-LNT
Примечание: Реконструировать наклонена серию pFVIII-LNT и hFVIII-LNT приобретенные в 4.2. с возможностью ETomo программного обеспечения УПМ следующем уроке: http://bio3d.colorado.edu/imod/doc/etomoTutorial.html- Использование окно терминала, открыть томограмму в 3DMOD. http://bio3d.colorado.edu/imod/doc/3dmodguide.html.
- Bin томограмма на 4 с УПМ BINVOL команду, чтобы уменьшить размер томограммы.
- Выберите правильный угол, чтобы повернуть липидов нанотрубки вдоль оси Y. в Binned томограммы, используя команду УПМ ROTATEVOL.
- Поверните полный томограмму с помощью команды УПМ ROTATEVOL.
- Обрезка выбранного липидный нанотрубки ориентированы вдоль оси ординат с помощью команды CLIP ИЗМЕНИТЬ РАЗМЕР УПМ.
- Откройте обрезанной суб-томограмму с 3DMOD.
- Нажмите на томограмме визуализировать расположение молекул фактора VIII вместеломтики в Z-оси и вдоль оси ординат в объеме суб-томограммы.
Результаты
Рекомбинантный человеческий и свиной фактора VIII были успешно организованы по спирали на отрицательно заряженные одного двухслойную LNT, напоминающие поверхности активированных тромбоцитов. Спиральная организация человеческого и свиного фактора VIII-LNT был последователен через собранных цифровых снимках (рис. 2). Контроль LNT и человека и свиньи фактора VIII-LNT спиральные трубки были отобраны и сегментирован с e2helixboxer.py GUI и начальных наборов данных, созданных с помощью e2workflow.py GUI, вариант одной частицы (табл. 1).
Спиральная порядок мембраносвязанного человека и свиньи фактора VIII-LNT оценивали преобразования Фурье из класса средних с e2display.py GUI (EMAN2) (рис. 3). Липидный бислой в лучших средних 2D класса управления LNT корректно. Внутренний и наружный листок и низкая плотность мембраны гидрофобного ядра четко видны ( Фиг.3А). Прогнозируемое плотность мембраносвязанных человека и свиньи FVIII молекул, ориентированных перпендикулярно к поверхности мембраны хорошо определен и четко показывает вариации в спиральной организации между двумя белками (фиг. 3В и 3С). Более выраженным поворот для человека фактора VIII-LNT спиральных труб показывает, что белок-белковые взаимодействия между соседними мембраной молекул фактора VIII последовательно различны для двух FVIII форм (Цифры 3B и 3C). Частицы класса средних показывая хорошую спиральную организацию (винтовая дифракционной картины) были объединены в e2display.py GUI с образованием промежуточного набор частиц (табл. 1). Частицы из промежуточных наборов частиц снова классифицированы в 50 классов с теми же ограничениями. Частицы из средних классов с одинаковым диаметром были объединены в окончательном данныхНаборы (табл. 1).
Первоначальные 3D реконструкции для человеческого и свиного фактора VIII-LNT проводились с 1000 представительных частиц из конечного человека и свиньи наборов данных фактора VIII-LNT. Сто последовательных IHRSR итераций проводились для каждого 3D-реконструкции с безликой цилиндра (160 Å внутренней и 500 Å наружный диаметр), а первоначального объема. Осевая рост (Δz) рассчитывается из объединенного преобразования Фурье спиральных сегментов (частицы комплект) равен 41 Å человеческого фактора VIII-LNT и 36 Å для свиного фактора VIII-LNT (рис. 4А и 4В). Первоначальный азимутальный угол (ΔΦ) определяется из итерационного поиска оценивается в 40,0 ° для человеческого фактора VIII-LNT и на 35,0 ° для свиного фактора VIII-LNT. Окончательные объемы на предмет наличия сходимости винтовых параметров и переписки между класса средних и прогнозов от окончательного Reconstrед ен ие, также в соответствии с критериями, описанными в 5. Выбранные 3D реконструкции и соответствующие спиральные параметры накладываются в качестве исходных объемов и начальных винтовых параметров для второго IHRSR уточнению 100 циклов, которые конвергентных до четырехлетнего начать спиральной организации для человеческого фактора VIII-LNT с Δz = 41,1 Å и ΔΦ = 42.0 ° и пять начать винтовая организация для свиного фактора VIII-LNT с Δz = 35,5 Å и ΔΦ = 34,8 °. Окончательное 100 IHRSR итераций введения в 4 раза и 5-кратное спиральную симметрию для человека и свиньи реконструкций фактора VIII-LNT соответственно осуществляются с начальными объемами и соответствующих винтовых параметров из последних асимметричных IHRSR уточнений (рис. 4C и 4D). Окончательные объемы показать 8 человеческий фактор VIII и 10 свиных FVIII мембраной молекул, организованных вокруг оси спирали (рис. 5А). Каждый человекФактора VIII молекула переводится 41,2 Å и вращается 42,0 ° от предыдущего, и каждый свиной молекула фактора VIII переводится 35,9 Å и вращается 35,2 º от предыдущего, соответствующих винтовых параметров последних 3D реконструкции (рис. 5б).
Восстановленные электронные томограммы подтвердить разницу в спиральной организации между человеческим и свиным фактора VIII-LNT, полученного при тех же экспериментальных условиях. Сравнение лучших видов из реконструированных томограмм и объемов 3D от спиральной реконструкции смотреть в направлении, перпендикулярном к оси спирали, еще раз подтверждает правильность 3D реконструкции рафинированных с винтовыми параметров IHRSR (рис. 6). Асимметричные размеры 2D элементарной ячейки для человеческого фактора VIII-LNT 3D реконструкции являются: а = 17,8 нм, б = 8,2, γ = 84 ° и для свиного фактора VIII-LNT 3D реконструкции: =18.4, б = 7,2 и γ = 70 ° (рис. 6). Размеры элементарной ячейки человеческого фактора VIII, организованного в мембраносвязанных 2D кристаллов: а = 8,1, б = 7,0 и γ = 67 °, что соответствует поверхности, покрытой одной молекуле фактора VIII если смотреть в направлении мембранного поверхности 20. Сравнивая размеры элементарной ячейки между FVIII организованные в 2D и винтовых кристаллов показывает, что как человеческие, так и свинина молекулы фактора VIII образуют димеры, когда спирально организована на поверхности LNT.

Рисунок 1. Анализ блок-схема Структура. Выполняемые для анализа 2D классификации в соответствии с эталонных алгоритмов без выравнивания, реализованных в EMAN2 16 обведены синим цветом. Выполняемые для анализа 3D осуществляется с итеративной винтовой реального алгоритмы пространство реконструкции (IHRSR) обведены красным. Итерационные циклы IHRSR обозначены пунктирными стрелками.
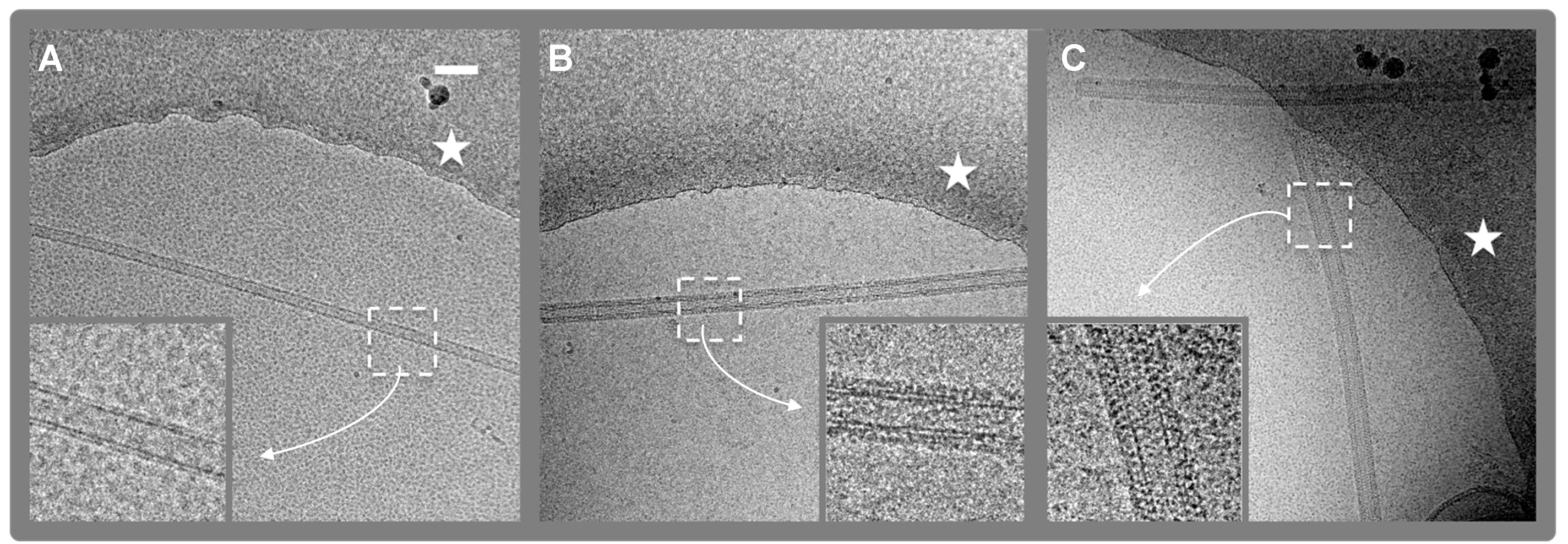
Рисунок 2. Крио-EM цифровые микрофотографии. (4096 х 4096 пикселей, 2.9 A / пикс) липидных нанотрубок (LNT) с и без связанного фактора VIII. А. Контроль LNT. Б. Человек фактора VIII-LNT. С. свиней фактора VIII-LNT . Край отверстие в пленке углерода, в котором FVIII-ЛСТ суспендируют в аморфный лед обозначается белой звездой. Плотность белков и липидов в черный. Увеличенного просмотров (вкладки) из 512 х 512 обрезается области (белый штриховой квадрат) иллюстрируют разницу в спиральной организации человека и свиньи фактора VIII, соответственно. Масштабная линейка составляет 100 нм.ig2highres.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
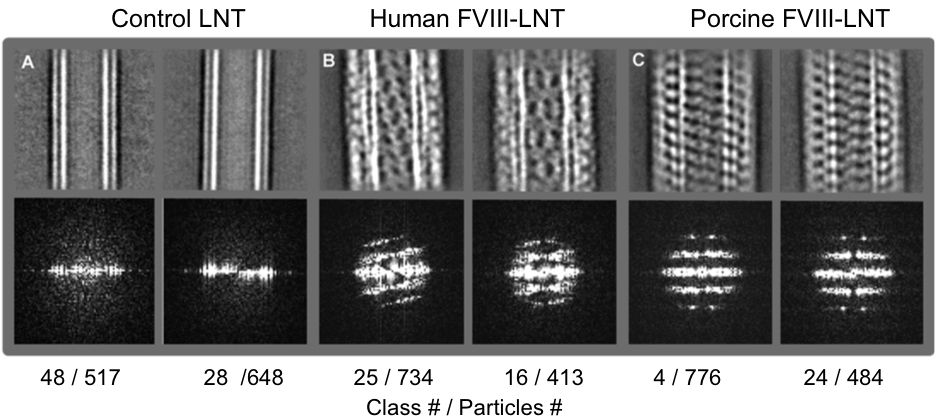
Средние Рисунок 3. Представитель 2D класса (верхний ряд) и соответствующие преобразования Фурье (нижний ряд) из промежуточных наборов частиц (табл. 1) классифицируется в 50 классах. А. Контроль LNT Б. Человек фактора VIII-LNT С. свиней фактора VIII-LNT. Класс число и число частиц, включенных в каждом классе указаны. Разница в спиральной того между человеческим и свиным FVIII хорошо видно на изображениях и подтверждено дифракционных картин, полученных из преобразований Фурье этих изображений. Пожалуйста, нажмите здесь, чтобы посмотретьувеличенное рисунке.
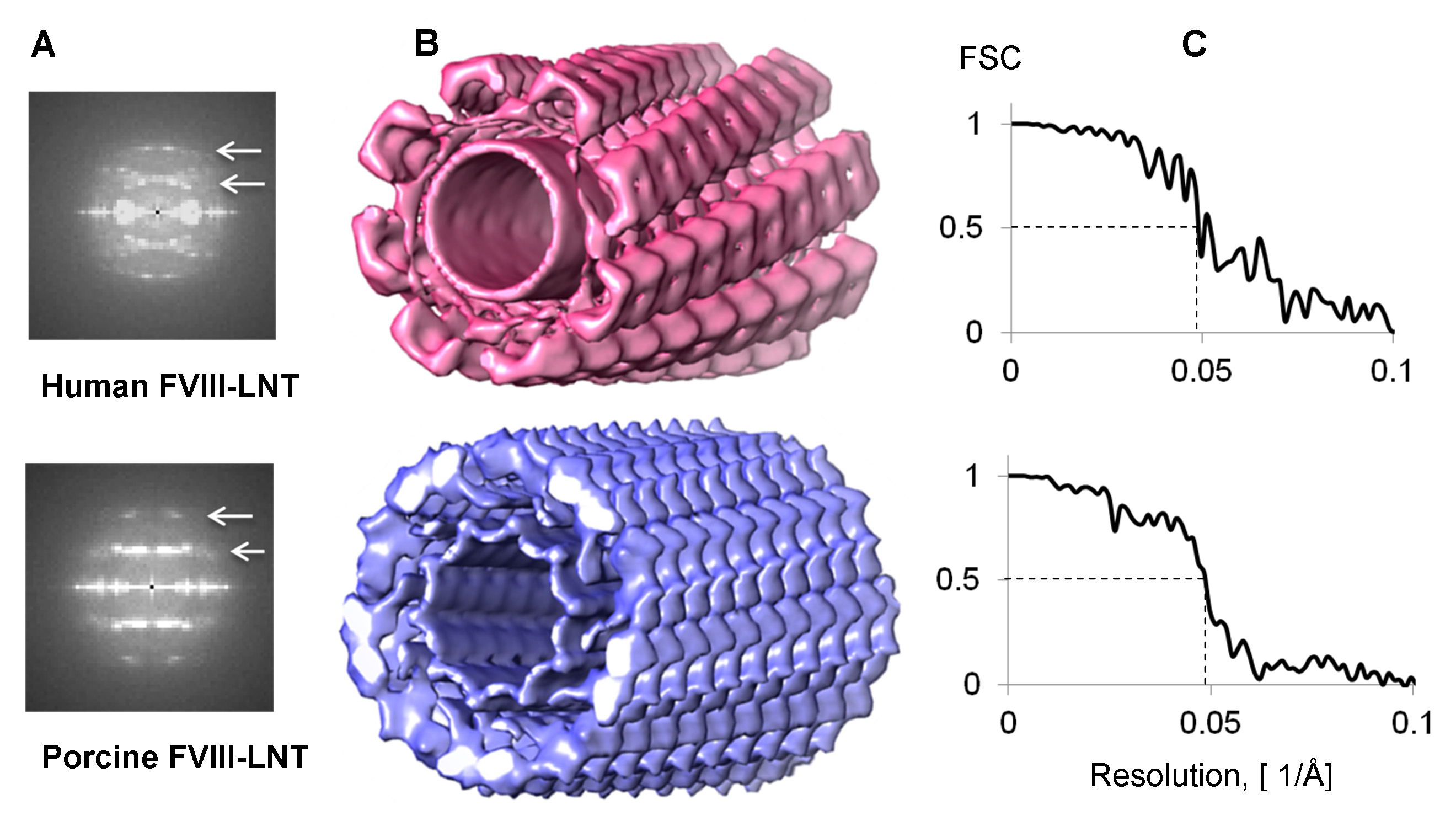
Рисунок 4. 3D спиральные реконструкции человеческого и свиного фактора VIII-LNT. А. комбинированных преобразования Фурье от 1000 спиральных сегментов. Первый и второй линии слой сосредоточены при выдержке 1/82 A-1 и 1/41 Å -1 для человеческого фактора VIII-LNT, а в 1/72 Å -1 и 1/36 Å -1 на свиные фактора VIII-LNT (белый стрелки). Б. Поверхность представление человека в розовом (Δz = 41.1 Å, ΔΦ = 42.0 º) и свиной в голубом (Δz = 35,9 А, ΔΦ = 35.2 º) фактора VIII-LNT 3D спиральные реконструкций. Оба тома представлены на 0,005 уровне контура (минимальная плотность равна 0 и максимальная плотность 0,02, рассчитанная в UCSF Chimeра, вариант 21 Объем зритель). Длина фактора VIII-LNT трубы составляет 256 пикселей на 2,9 A / пикс. Ш. Фурье Shell корреляции (ФСБ) участки для человека и свиньи фактора VIII-LNT показывая разрешение 20,5 Å в ФСБ = 0,5.

Рисунок 5. Винтовая организация человеческого и свиного фактора VIII-LNT. Сегментированной представления поверхности человека и свиньи фактора VIII-LNT винтовых реконструкций, показанных на рисунке 4В. Объемы сегментированы после наложения 4-кратной симметрией для человеческого фактора VIII-LNT и 5-кратным симметрии к свиного фактора VIII-LNT. Асимметричные блоки цветом желто-красный для человеческого фактора VIII-LNT и сине-зеленый для свиней фактора VIII-LNT. А. видом вдоль оси спирали, указанного с квадрата на человека и какпятиугольник для свиного фактора VIII-LNT. Человеческая структура фактора VIII-LNT показывает 8 молекул, организованных вокруг внешнего LNT мембраны и свиной структура фактора VIII показывает 10 молекул, организованные вокруг внешнего LNT мембраны, указано с числами. В. Просмотров перпендикулярно оси спирали. Человеческого фактора VIII-LNT является 4-начать спиральная структура и свиной фактора VIII-LNT находится в 5-начать спиральная структура. Отдельные один старт спирали указаны с номерами и цветом. Мы подчеркивали одну из спиралей от каждой структуры с (*) и зелеными линиями. Масштабная линейка составляет 20 нм.

Сравнение между спиральными и томографии 3D реконструкции. Человеческого фактора VIII-LNT (а) и свиных фактора VIII-LNT (С) винтовая 3D реконструкции Рисунок 6. Показаны perpendicular оси спирали. Каждый блок клеток и отдельные спирали имеют цветовую маркировку как показано на рисунке 5. Б. и D. являются представлениями плотность томографии реконструкций 3D, просматриваемые перпендикулярно оси спирали. 2D решетка отражает спиральную расположение молекул фактора VIII показана с зелеными линиями.
| Образцы | CLNT | hFVIII-LNT | pFVIII-LNT |
| Первоначальные Микрофотографии | 61 | 474 | 542 |
| Наборы начальной частицы | 29113 | 60395 | 64665 |
| Расфокусировкой (нм) | -4051 ± 502 | -3643 ± 737 | -3443 ± 1086 |
| Наборы промежуточная частица | 25907 | 27305 | 22773 |
| Наборы конечной частицы | 25907 | 10455 | 10430 |
Таблица 1. Статистика 2D анализа следующие алгоритм, представленный в блок-схеме на рисунке 3.
Обсуждение
В этой работе методика представлена различать два мембраносвязанных организаций высоко гомологичных белков: человеческий и свиной FVIII самоорганизующихся на липидных нанотрубок в условиях, встречающихся в организме человека.
В описанной процедуры, человеческий и свиной фактора VIII успешно организован по спирали на липидных нанотрубок, который является наиболее важным шагом. Следующим важнейшим шагом является сохранение образца в тонкой аморфного льда с помощью флэш-замораживание в ближайшее жидком азоте 2 температуры. Сохранение образца в аморфный лед и LN2 температуре сохраняет спиральные трубки гидратированных и белок-липидных макромолекулярных ансамблей физиологически активным. Окончательный важным шагом приобретает Крио-ЭМ данные достаточного количества и качества для 3D структуры с высоким разрешением в ближайшее температуры LN2. Сбор данных в ближайшем температуры LN2 дальше предотвращает обезвоживание образца в высоком Vacuum из микроскопа и радиационной ущерба от электронного пучка.
Для расчета мембраносвязанное структуру фактора VIII первым важным шагом является получение однородных частиц (спиральные сегменты) наборы, применяя 2D опорный бесплатно классификацию и объединить частиц из классов с того же диаметра и степени упорядоченности. Второй важный шаг заключается в установлении правильного первоначального объема и спиральные параметры (подъем и азимутальный угол) для спиральной реконструкции. Третий и последний важный шаг состоит в проверке спиральную структуру, сравнивая 3D карты, полученные спиральной и электронной томографии (без наложенного симметрии) реконструкций того же образца.
Представленная методика является уникальным в своей способности решить функциональную структуру мембранных белков, ассоциированных в вблизи физиологических условиях. LNT разработан в нашей лаборатории может бытьуспешно используется в качестве платформы для спиральной организации функциональных мембраной факторов свертывания крови и достичь лучшее разрешение, чем для фактора VIII, организованного в мембраносвязанных 2D кристаллов и в виде отдельных частиц. Наша цель заключается в дальнейшем увеличить разрешение наших винтовых реконструкций путем улучшения однородности и качества конечной наборов частиц. Сбор более Крио-EM микрофотографии на лучших условиях Крио-EM (пистолет Полевая эмиссия, энергетической фильтра, DE камеры детекторов) из фактора VIII-LNT спиральных нитей и, следовательно, в том числе больших начальных наборов частиц для реконструкции 2D добьемся этого. Улучшение винтовую сборку фактора VIII-LNT и 3D алгоритмы реконструкции позволит нам получить субнанометровым и рядом атомным разрешением, который будет однозначно определить мембраносвязанное организацию этот критический для белка свертывания крови.
Организация по спирали гомологичные формы FVIII дает нам также возможти охарактеризовать как разница в последовательности может коррелировать с различиями в структуре и функции. Разрешая человека и свиньи FVIII мембраной структуры от методов, описанных в этой статье, могут помочь определить последовательности, которые, когда изменение улучшат рекомбинантный функцию фактора VIII. Это знание будет иметь значительные клинические последствия для открытия новых лекарств в обоих тромбоза и гемостаза полей.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовый интерес и с ними можно связаться напрямую отношении любых процедур, опубликованных в этой рукописи.
Благодарности
Эта работа поддержана грантом Национального Ученый развития от American Heart Association: 10SDG3500034 и UTMB-NCB запуска средства для SSM. Авторы признают, средства Крио-EM и высокопроизводительные вычисления в Сили Центра структурной биологии UTMB ( www.scsb.utmb.edu ), а также д-ра. Стив Ludtke и Эд Egelman за помощь в спиральных алгоритмов реконструкции 2D и 3D.
Материалы
| Name | Company | Catalog Number | Comments |
| JEM2100 with LaB6 | JEOL Ltd. | JEM-2100 | operated at 200 kV |
| with TEMCON software | JEOL Ltd. | ||
| Gatan626 Cryo-holder | Gatan, Inc. | 626.DH | cooled to -175 °C |
| with temperature controler unit | Gatan, Inc. | ||
| Gatan 4K x 4K CCD camera | Gatan, Inc. | US4000 | 4,096 x 4,096 pixel at 15 μm/pixel physical resolution |
| Solarus Model 950 plasma cleaner | Gatan, Inc. | ||
| Vitrobot Mark IV | FEI | ||
| Carbon coated 300-mesh 3 mm copper grid | Ted Pella | 01821 | plasma cleaned for 10 sec on high power |
| Quantifoil R2/2 300 mesh | Electron Microscopy Sciences | Q225-CR2 | Carbon coated 300-mesh Cu grids with 2 mm in diameters holes |
| Uranyl acetate dihydrate | Ted Pella | 19481 | 1% solution, filtered |
| Galactosyl ceramide | Avanti Polar Lipids Inc. | 860546 | |
| Dioleoyl-sn-glycero-phospho-L-serine | Avanti Polar Lipids Inc. | 840035 | |
| EM software Digital Micrograph | Gatan, Inc. | http://www.gatan.com/DM/ | |
| EM software EMAN | free download | http://blake.bcm.edu/emanwiki/EMAN/ | |
| EM software Spider | free download | http://spider.wadsworth.org/spider_doc/spider/docs/spider.html | |
| EM software IHRSR | free download | Programs available from Edward H. Egelman http://people.virginia.edu/~ehe2n/ | |
| EM software (IMOD) | free download | http://bio3d.colorado.edu/imod/ | |
| EM software (SerialEM) | free download | ftp://bio3d.colorado.edu/pub/SerialEM/ | |
| UCSF-Chimera | free download | http://www.cgl.ucsf.edu/chimera/download.html |
Ссылки
- Henderson, R. Realizing the potential of electron cryo-microscopy. Quarterly Reviews of Biophysics. 37, 3-13 (2004).
- Fujiyoshi, Y., Unwin, N. Electron crystallography of proteins in membranes. Current opinion in structural biology. 18, 587-592 (2008).
- Toole, J. J., et al. Molecular cloning of a cDNA encoding human antihaemophilic factor. Nature. 312, 342-347 (1984).
- Fay, P. J. Factor VIII structure and function. International journal of hematology. 83, 103-108 (2006).
- Stoilova-McPhie, S., Lynch, G. C., Ludtke, S. J., Pettitt, B. M. Domain organization of membrane-bound factor VIII. Biopolymers. , (2013).
- Pipe, S. W. Hemophilia: new protein therapeutics. Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2010, 203-209 (2010).
- Gatti, L., Mannucci, P. M. Use of porcine factor VIII in the management of seventeen patients with factor VIII antibodies. Thrombosis and haemostasis. 51, 379-384 (1984).
- Parmenter, C. D., Cane, M. C., Zhang, R., Stoilova-McPhie, S. Cryo-electron microscopy of coagulation Factor VIII bound to lipid nanotubes. Biochemical and biophysical research communications. 366, 288-293 (2008).
- Parmenter, C. D., Stoilova-McPhie, S. Binding of recombinant human coagulation factor VIII to lipid nanotubes. FEBS letters. 582, 1657-1660 (2008).
- Wassermann, G. E., Olivera-Severo, D., Uberti, A. F., Carlini, C. R. Helicobacter pylori urease activates blood platelets through a lipoxygenase-mediated pathway. Journal of cellular and molecular medicine. 14, 2025-2034 (2010).
- Wilson-Kubalek, E. M., Chappie, J. S., Arthur, C. P. Helical crystallization of soluble and membrane binding proteins. Methods in enzymology. 481, 45-62 (2010).
- Egelman, E. H. Reconstruction of helical filaments and tubes. Methods in enzymology. 482, 167-183 (2010).
- Lusher, J. M. Development and introduction of recombinant factor VIII--a clinician's experience. Haemophilia : the official journal of the World Federation of Hemophilia. 18, 483-486 (2012).
- Thim, L., et al. Purification and characterization of a new recombinant factor VIII (N8). Haemophilia : the official journal of the World Federation of Hemophilia. 16, 349-359 (2010).
- Doering, C. B., Healey, J. F., Parker, E. T., Barrow, R. T., Lollar, P. High level expression of recombinant porcine coagulation factor VIII. The Journal of biological chemistry. 277, 38345-38349 (2002).
- Tang, G., et al. EMAN2: an extensible image processing suite for electron microscopy. Journal of structural biology. 157, 38-46 (2007).
- Egelman, E. H. A robust algorithm for the reconstruction of helical filaments using single-particle methods. Ultramicroscopy. 85, 225-234 (2000).
- Egelman, E. H. The iterative helical real space reconstruction method: surmounting the problems posed by real polymers. Journal of structural biology. 157, 83-94 (2007).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of structural biology. 152, 36-51 (2005).
- Stoilova-McPhie, S., Villoutreix, B. O., Mertens, K., Kemball-Cook, G., Holzenburg, A. 3-Dimensional structure of membrane-bound coagulation factor VIII: modeling of the factor VIII heterodimer within a 3-dimensional density map derived by electron crystallography. Blood. 99, 1215-1223 (2002).
- Goddard, T. D., Huang, C. C., Ferrin, T. E. Visualizing density maps with UCSF Chimera. Journal of structural biology. 157, 281-287 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены