Method Article
Helicoidal Organização dos Fatores de Coagulação Sanguínea VIII em Lipid Nanotubos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nós apresentamos uma combinação de microscopia de Cryo-electron, nanotecnologia lipídica, e a análise da estrutura aplicada para resolver a estrutura ligada a membrana de duas formas de FVIII altamente homólogas: humana e porcina. A metodologia desenvolvida em nosso laboratório para organizar de forma helicoidal as duas formas FVIII recombinante funcionais em nanotubos de lipídios negativamente carregados (LNT) é descrito.
Resumo
A microscopia crio-electrão (Cryo-EM) é uma abordagem poderosa para investigar a estrutura funcional de proteínas e complexos em um ambiente de estado e da membrana hidratada 2.
Factor de coagulação VIII (FVIII) 3 é um sistema multi-domínio de glicoproteína do plasma sanguíneo. Defeito ou deficiência de FVIII é a causa para o tipo de hemofilia A - um distúrbio de sangramento grave. Após a activação proteolítica, FVIII liga à serina-protease do Factor IX na membrana das plaquetas carregadas negativamente, que é crítica para a coagulação do sangue normal de 4. Apesar de o papel central de FVIII desempenha na coagulação, a informação estrutural para o seu estado ligado à membrana é incompleta 5. Concentrado de FVIII recombinante é o medicamento mais eficaz contra o tipo A hemofilia A e comercialmente disponível de FVIII pode ser expressa como o ser humano, ou de porcino, ambos os complexos funcionais que formam com o Factor IXa humano 6,7. "> Neste estudo apresentamos uma combinação de microscopia Cryo-elétron (Cryo-EM), a nanotecnologia ea estrutura lipídica análise aplicada para resolver a estrutura ligada à membrana das duas formas de FVIII altamente homólogas:. Humana e suína A metodologia desenvolvida em nosso laboratório para organizar de forma helicoidal das duas formas de FVIII recombinante funcional em nanotubos de lípidos carregados negativamente (LNT) é descrita. Os resultados representativos demonstram que a nossa abordagem é suficientemente sensível para determinar as diferenças na organização helicoidal entre os dois altamente homóloga em sequência (86% de identidade de sequência ) proteínas. protocolos detalhados para a organização helicoidal, Cryo-EM e tomografia eletrônica (ET) de aquisição de dados são dadas. The bidimensional (2D) e tridimensionais (3D) análise da estrutura aplicada para obter as reconstruções 3D de humanos e suínos FVIII-LNT é discutido. As estruturas de FVIII-LNT humana e porcina apresentados demonstram o potencial da metodologia proposta para Calculate a organização funcional, ligada à membrana de coagulação sanguínea do Factor VIII em alta resolução.
Introdução
A coagulação sanguínea do Factor VIII (FVIII) é um grande glicoproteína de 2332 aminoácidos organizados em seis domínios: A1-A2-B-A3-C1-C2 3. Após a activação da trombina de FVIII actua como co-factor para o Factor IXa no complexo de tenase ligada à membrana. A ligação de FVIII activado (FVIIIa) em FIXa de um modo conforme a membrana melhora a eficiência proteolítica FIXa mais do que 10 5 vezes, o que é crítico para a eficiência da coagulação sanguínea 4. Apesar do papel importante do FVIII desempenha na coagulação e a formação do complexo tenase, a estrutura de FVIII ligado à membrana funcional ainda não foi resolvido.
Para resolver esta questão, nanotubos de bicamada lipídica (LNT) ricos em fosfatidilserina (PS), capazes de FVIII de ligação com elevada afinidade 8, 9, e assemelhando-se a superfície de plaquetas activadas têm sido desenvolvidos 10. Organização helicoidal consecutiva de FVIII obrigado a LNT foi provado ser efetividadeve para a determinação da estrutura do FVIII estado ligado à membrana por Cryo-EM 5. Funcionalizado LNT são um sistema ideal para o estudo de proteínas de proteínas e interacções proteína-membrana de proteínas associadas à membrana de forma helicoidal organizadas por Cryo-EM 11, 12. Cryo-EM tem a vantagem em relação aos métodos tradicionais estruturais, tais como cristalografia de raios-X e RMN, que o espécime é preservado em mais próximo do ambiente fisiológico (tampão, membrana, pH), sem aditivos e isótopos. No caso de FVIII, estudar a estrutura ligada a membrana com esta técnica é ainda mais relevante fisiologicamente, como o LNT assemelham pelo tamanho, forma e composição da pseudopodia das plaquetas activadas, onde os complexos TENase montar in vivo.
Defeitos e deficiência de FVIII causa hemofilia A, uma doença hemorrágica grave que afeta 1 em cada 5.000 homens da população humana 4, 6. O mais eterapia ffective para hemofilia A é a administração do FVIII humano recombinante (hFVIII) ao longo da vida. Uma complicação importante da terapia de FVIII recombinante A hemofilia A é o desenvolvimento de anticorpos inibitórios para a forma humana que afecta aproximadamente 30% dos doentes com hemofilia A 13. Neste caso, o FVIII porcino (pFVIII) concentrado é usado, como FVIII exibe suína baixa reactividade cruzada com os anticorpos inibidores contra FVIII humano e formas de complexos funcionais com FIXa humano 7. Estabelecer a organização ligada à membrana de ambos suína e formas de FVIII humanos é importante para compreender a base estrutural da função co-fator FVIII e implicações para a hemostasia sangue.
Neste estudo, descrevemos uma combinação de nanotecnologia lipídico, Cryo-EM, e a análise da estrutura concebida para resolver a organização ligada à membrana de duas formas de FVIII altamente homólogas. Os dados Cryo-EM apresentados e estruturas 3D para porci helicoidal organizadone FVIII humano e em carregado negativamente LNT mostram o potencial da nanotecnologia proposto como base para a determinação da estrutura do FVIII e factores e complexos em um ambiente de membrana fisiológica coagulação ligadas à membrana.
Protocolo
1. Exemplo de Preparação
- Humana troca de tampão de FVIII-14 e do BDD-FVIII porcino BDD 15 contra tampão HBS-Ca (20 mM de HEPES, 150 mM de NaCl, 5 mM de CaCl2, pH = 7,4) e concentrado para 1,2 mg / ml. Manter a solução proteica à temperatura de -80 ° C.
- Preparar os nanotubos de lípidos (LNT), misturando galactosilceramida (GC) e fosfatidilserina (PS) a 1:04 w / w proporção em clorofórmio. Evapora-se o clorofórmio sob atmosfera de árgon e solubilizar os lípidos em tampão HBS de 1 mg / ml. Manter a solução LNT a 4 ° C.
2. Cryo-Microscopia eletrônica de FVIII-LNT
- Cryo-EM Preparação de Amostras
- Brilho de descarga a 300 mesh Quantifoil R2 / 2 grades de cobre (lado carbono up) em uma mistura de O 2 e H 2 gás por 10 seg a 50 W.
- Misturar as soluções de FVIII e LNT em tampão HBS-Ca em 1:1 w / w proporção e incubar durante 15 min à temperatura ambiente.
- Aplique uma gota de 2,5 mLde amostra de FVIII-LNT à grade microscopia electrónica hidrofílico na câmara humidificada Vitrobot Mark IV (100% de humidade).
- Blot e flash congelar a grade (uma mancha de 3,5 seg, força apagar 1) em líquido C 2 H 6, arrefecido por N2 líquido para obter gelo amorfo.
- Redes de lojas em caixas de armazenamento sob N2 líquido (LN2).
- Coleta de Dados Cryo-EM
NOTA: O JEM2100-LaB6 (ano 2010) está equipado com um sistema operacional TEMCON consistindo de um computador conectado à microscópio eletrônico, uma tela com janelas de leitura do sistema de vácuo, sistema de iluminação, HT, as correntes de lente e assim por diante, e dois painéis: esquerda e direita, colocado em ambos os lados da coluna. A mudança feixe de X, Y botões (SHIFT Y, SIFT Y) eo multifuncionais (DEF / STIG) botões são em ambos os painéis. No painel da esquerda é o botão de iluminação (Brigthness). No painel direito são: a ampliação (MAG / CAM COMPRIMENTO) e foco (Foco) maçanetas e os três imaging (MAG1, MAG2, LOWMAG) e um de difração (DIFF) modos de botões. Nós adquirimos os nossos dados em MAG1 em alpha 2. As condições mínimas doses de iluminação (MDS) necessários para a aquisição de dados Cryo-EM são definidas com F1 através de botões F6, top de linha no painel da direita. Neste protocolo as definições genéricas são usados: F1 - levantar / tela inferior, F2 - modo de pesquisa, F3 - Modo FOCUS, F4 - Modo PHOTO, F5 - MDS OFF / ON e F6 - BEAM BRANCO, usado para proteger o espécime de radiação danificar, desviando o feixe.- Coloque-titular crio o na estação crio e encher o Dewar do titular ea estação crio com LN2. Quando a temperatura atinge -192 ° C, obturador aberto na ponta titular, local previamente congelado grade Cryo-EM, para o lugar designado e prenda com um grampo de anel.
- Insira titular crio o no microscópio eletrônico. Encher o Dewar do titular crio o ea câmara anti-contaminador com LN2. Aguarde até que o titular se estabilize por 30-60 min. Pressione F6 e emtransformar o filamento em. Quando o filamento está saturado, pressione F6 e abra obturador no suporte para ver o grid.
- Imprensa Baixo Mag / alfa 1 (fixado em 200X mag) e localizar áreas com gelo fino na grade.
- Mudar para MAG 1/alpha 2 para definir o modo de dose mínima (MDS) e adquirir dados Cryo-EM em doses baixas de elétrons, sem danificar a amostra.
- Pressione F2 para definir o modo de pesquisa. Definir ampliação a 40.000 x. Aumentar feixe com botão brigtness a dose mínima de elétrons ~ 0,04 e - / a 2 · s. Imprensa DIFF para alternar para o modo de difração. Defina o comprimento da câmara a 120 cm, com botão de MAG / CAM comprimento. Localizar áreas da grade dentro das áreas pré-seleccionadas em LOWMAG que têm nanotubos de lípidos nos orifícios do filme de carbono.
- Pressione F4 para definir o modo de foto em 40.000 ampliação X e definir iluminação com botão BRILHO em doses de 16-25 e - / a 2 · s. Pressione o botão padrão Focus para definir as condições de foco ajustando o Z-alturada amostra com os Z Botões Cima / Baixo (painel de controle à direita). Definir desfocagem entre -1,5 e -2,5 m.
- Alinhe SEARCH e modo FOTO, desenhando um quadrado na janela VISTA AO VIVO no monitor da câmera digital no modo de pesquisa correspondente à área a ser trabalhada no modo de foto.
- Pressione F3 para definir o modo de foco em 100.000 ampliação X. Foco de iluminação para cobrir o chip CCD (~ 4-5 cm de raio) e fora do eixo para não irradiar a área a ser trabalhada no modo de foto. Ajuste de desfocagem para ~ -1,5 e -2,5 mM com o botão de foco e corrigir o astigmatismo da imagem com botões DEF / STIG.
- Selecione o FVIII-LNT a ser trabalhada no modo de Pesquisa por meio da aquisição de imagens ao vivo na janela de exibição ao vivo na tela da câmera digital. Centralize o FVIII-LNT no quadrado desenhado na janela de visualização em directo.
- Gravar uma imagem digital da câmera CCD de 52.000 X ampliação eficaz e 0,5 seg exposição mudando para o modo foto e clicando no AcquirBotão E na micrografia monitor da câmera digital. As condições de aquisição de imagem são definidas como o branco do feixe (SHUTTERS) aberto apenas quando a imagem é adquirida no modo de foto.
- Verifique a qualidade e desfocagem da imagem adquirida, pressionando CTRL-F para obter Transformada Rápida de Fourier (FFT).
3. Reconstrução 3D
NOTA: O software de análise de imagem utilizado para a análise 2D e 3D: EMAN2 e IHRSR estão disponíveis gratuitamente. EMAN2 pode ser baixado do http://blake.bcm.edu/emanwiki/EMAN2/Install. O software IHRSR pode ser obtido a partir de Prof Egelman: egelman@virginia.edu. Os refinamentos finais IHRSR são executados no Texas Advanced Computing agrupamento de centro: http://www.tacc.utexas.edu/ na Universidade do Texas, Austin. O algoritmo de reconstrução 3D mostrado na Figura 1 consiste em duas etapas principais: em primeiro lugar a seleção de um conjunto homogêneo de segmentos helicoidais (partículas) com a referência livre alignme 2Dnt (RFA) algoritmos implementados em EMAN 2, segunda alcançar uma reconstrução 3D com base nos parâmetros helicoidais e algoritmos de projeção de volta incorporadas IHRSR. O primeiro passo utiliza os programas desenvolvidos para a seleção de conjuntos de partículas homogêneas para a reconstrução 3D com partículas SPA Individual (algoritmos) para os quais EMAN2 foi especificamente desenvolvido e distribuído: http://blake.bcm.edu/emanwiki/EMAN2. Este passo foi adaptada aos dados Cryo-EM. O segundo passo é conseguido com o algoritmo IHRSR, que é concebido especificamente para o tipo de conjuntos helicoidais obtidos com as formas de Factor VIII recombinante. Este algoritmo foi extensivamente documentada através da literatura científica 12.
- Realizar análise de imagem em 2D com a suíte de processamento de imagem EMAN2 científico: http://blake.bcm.edu/eman2/doxygen_html 16 para selecionar partícula homogênea (segmento helicoidal) conjuntos para a reconstrução helicoidal.
- Selecione micrografias Cryo-EM com straight e bem organizada tubos helicoidais com o software da câmera digital e ferramentas de visualização.
- Inverter, normalizar e filtrar por raios-X pixels na GUI e2workflow.py, reconstrução partícula única opção (SPR): http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2projectmanager
- Importe as imagens invertidas, normalizados e de pixel de raios-X filtrados na GUI e2helixboxer.py. Selecione tubos helicoidais FVIII-LNT e segmento em 256 x 256 pixels (2.9 Å / PIX), com 90% de sobreposição usando: http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2helixboxer
- Avaliar a desfocagem das micrografias originais e aplicar a função de transferência de contraste (CTF) correção (apenas correção de fase) para os segmentos helicoidais dos mesmos micrografias com a opção e2ctf.py incorporado no e2workflow.py: http://blake.bcm. edu/emanwiki/EMAN2/Programs/e2ctf.
- Gerar partículas iniciais (segmentos helicoidais) define na GUI e2workflow.py opção - SPR: http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2workflow.
- Calcular médias classe 2D com o algoritmo e2refine2d.py aplicação referência livre de classificação k-média para selecionar os conjuntos de dados homogêneos com o mesmo LNT diâmetro e grau de ordem helicoidal (Figura 2), seguindo o roteiro: "e2refine2d.py - iter = 8 - naliref = 5 - nbasisfp = 8 - path = r2d_001 - input = INPUT.hdf - LCN = 51 - simcmp = dot - simalign = rotate_translate_flip - classaligncmp = dot - classraligncmp = fase - classiter = 2 - classkeep = 0,8 - classnormproc = normalize.edgemean - classaverager = média - normproj-classkeepsig ', alterando o valor NCLs conformidade.
- Classifique as definidas no 'LCN = 151' 150 classes de mais de 8 iterações com 'classkeep = 0,8' dados iniciais, o que significa que as partículas com menos de 80% de similaridade com a média classe são excluídos da classe dada. http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2refine2d
- Mesclar partículas a partir das médias de classecom difração helicoidal pronunciado em e2display.py para criar conjunto de dados intermediário.
- Classificar os dados intermediários estabelecidos em 50 classes 'LCN = 51' para diferenciar classes com mesmo diâmetro e grau de ordem.
- Mesclar partículas de classes com mesmo diâmetro e grau de ordem em e2display.py para criar o conjunto de dados final para a reconstrução tridimensional: http://blake.bcm.edu/emanwiki/EMAN2/Programs/emselector.
- Executar a reconstrução helicoidal com o algoritmo iterativo helicoidal real espaço Reconstrução (IHRSR), como descrito no Egelman 17, 18.
- Estime o aumento, Δz (A) da hélice FVIII-LNT do Fourier combinado transformar as partículas no conjunto de dados final.
- Defina o ângulo azimutal ΔΦ (º), executando refinamentos IHRSR paralelas com um Δz constante, aumentando ΔΦ de 576; a 60 ° em incrementos de 5 °.
- Executar 100 ciclos IHRSR consecutivos para cada conjunto com um cilindro inexpressivo como um volume inicial e os parâmetros iniciais Δz helicoidais e ΔΦ conforme definido no 3.2.1 dados finais. e 3.2.2.
- Inspecione os volumes finais para a convergência dos parâmetros helicoidais e correspondência entre as médias de classe da classificação 2D do conjunto final de dados e as projeções da reconstrução IHRSR final.
- Impor simetria para as reconstruções 3D finais, correspondente à unidade de distribuição assimétrica observada nos volumes 3D assimétricos finais: de 4 vezes para o FVIII humano-LNT e 5 vezes para a porcino FVIII-LNT. Correr mais 100 ciclos de refinamento para gerar uma reconstrução 3D simetrizada final.
- Calcule a curva de correlação Shell Fourier para ambos os volumes, primeiro separando os estabelecidos em pares e ímpares dados correspondentes: 'e2proc2d.py - split = 2 '. Em seguida, execute 100 IHRSR refinamentos consecutivos, tal como descrito no ponto 3.2.3. Calcule o FSC dos volumes 3D criadas a partir dos conjuntos de dados pares e ímpares: 'e2proc3d.py evenvolume.mrc fsc.txt - calcfsc = oddmap.mrc'.
- Visualize e Segmento os volumes FVIII-LNT em UCSF quimera.
- Abra os volumes finais da etapa 3.2.5. em UCSF Chimera e definir o nível de contorno para 0.005 no TOOLS> VOLUME DE DADOS> opção VIEWER VOLUME.
- Em Ferramentas> VOLUME DE DADOS> mapa de segmento, selecione o volume no guia mapa de segmento e clique em cada segmento de mercado o volume.
- Segmentos do Grupo corresponde a uma célula unidade, selecionando com CTRL + SHIFT e clique grupo.
- Cor dos segmentos por célula unitária e hélice com Ações> opção de cor para enfatizar as características estruturais.
4. Electron Tomografia
- Coradas negativamente FVIII-LNT Preparação de Amostras
- Preparar amostras de FVIII-LNT como para as experiências Cryo-EM.
- Fulgor descarrega grelha de cobre de malha 300-revestidas de carbono (do lado de carbono acima) numa mistura de O 2 e gás H2 durante 10 segundos a 50 W como para experiências Cryo-EM.
- Aplique uma gota de 2,5 mL de suspensão FVIII-LNT com 6 nm nanopartículas de ouro coloidal para a grade, seque o excesso de líquido e manchar negativamente pela aplicação de 5 mL solução 1% acetato de uranila por 2 min. Seque o excesso de líquido e secar a grade.
- Coleta de Dados Electron Tomografia
- Transfira a grade no suporte de inclinação única.
- Transfira o titular no microscópio eletrônico.
- Colete série de inclinação automaticamente com o software SerialEM 19 ° em incrementos de 2 num intervalo angular de -60 ° a 60 ° e gravar imagens com uma câmera CCD de 52.000 X ampliação efetiva, -6 a -10 mM desfocagem e da dose de elétrons de 150 - 170 elementosctrons / a 2 · s por tomografia.
- Electron Tomografia Reconstrução do FVIII-LNT
Nota: Reconstruir a série inclinado pFVIII-LNT e hFVIII-LNT adquirida em 4.2. com a opção ETomo do software IMOD seguindo o tutorial: http://bio3d.colorado.edu/imod/doc/etomoTutorial.html- Usando uma janela de terminal, abra a tomografia em 3dmod. http://bio3d.colorado.edu/imod/doc/3dmodguide.html.
- Bin o tomograma por 4 com o IMOD BINVOL comando para diminuir o tamanho da tomografia.
- Selecione o ângulo adequado para rodar o nanotubo lipídico ao longo do eixo Y no tomografia finalmente resolvido usando o comando IMOD ROTATEVOL.
- Gire a tomografia completa com o comando IMOD ROTATEVOL.
- Cortar o nanotubo lipídico selecionado orientada ao longo do eixo Y com o comando IMOD CLIP redimensionar.
- Abra o sub-tomografia cropped com 3dmod.
- Clique sobre o tomograma para visualizar o arranjo de moléculas de factor VIII ao longoas fatias no eixo Z e ao longo do eixo Y no volume sub-tomografia.
Resultados
FVIII suína recombinante humana e foram organizadas com sucesso de modo helicoidal em carregada negativamente simples LNT bicamada, assemelhando-se à superfície das plaquetas activadas. Helicoidal A organização do humano e de porcino FVIII-LNT foi consistente ao longo das micrografias digitais recolhidas (Figura 2). A LNT controle eo humano e FVIII-LNT tubos helicoidais suínos foram selecionados e segmentado, com o GUI e2helixboxer.py e conjuntos de dados iniciais criados com a GUI e2workflow.py, opção única partícula (Tabela 1).
A ordem helicoidal do humano ligado à membrana e porcino FVIII-LNT foi avaliada a partir da transformação de Fourier das médias de classe com a GUI e2display.py (EMAN2) (Figura 3). A bicamada lipídica no melhor controle LNT médias classe 2D é bem definida. O folheto interior e exterior e uma mais baixa densidade do núcleo hidrofóbico da membrana são claramente visíveis ( Figura 3A). A densidade das moléculas projectadas humanos e de FVIII porcino ligadas à membrana e orientadas para a perpendicular à superfície da membrana é bem definido e mostra claramente as variações na organização helicoidal entre as duas proteínas (Figuras 3B e 3C). A torção mais pronunciado para os tubos helicoidais de FVIII-LNT humanos indica que as interacções proteína-proteína entre as moléculas de FVIII ligadas à membrana adjacentes são sempre diferentes para as duas formas de FVIII (Figuras 3B e 3C). Partículas de classe média, mostrando boa organização helicoidal (padrão de difração helicoidal) foram fundidas na GUI e2display.py para formar um conjunto de partículas intermediário (Tabela 1). As partículas dos conjuntos de partículas intermediárias foram novamente classificados em 50 classes com as mesmas restrições. As partículas de média classe com o mesmo diâmetro foram fundidos no final dos dadosgrupos (Tabela 1).
Reconstruções 3D iniciais para o FVIII-LNT humana e porcina foram realizadas com 1000 partículas representativos do conjunto de dados de FVIII-LNT suína final e humana. Cem iterações IHRSR consecutivos foram executados para cada reconstrução 3D com um cilindro inexpressivo (160 Å interior e 500 de diâmetro externo Å), como volume inicial. O aumento axial (Δz) calculado a partir da Fourier combinado transformar os segmentos helicoidais (partículas definidos) é igual a 41 Å para humano FVIII-LNT e 36 Å para suínos FVIII-LNT (Figuras 4A e 4B). O ângulo azimutal inicial (ΔΦ) definida a partir da pesquisa iterativa é estimado em 40,0 ° para o FVIII humano-LNT e a 35,0 ° C durante o porcino FVIII-LNT. Os volumes finais são inspecionados para a convergência dos parâmetros helicoidais e correspondência entre as médias de classe e projeções do último Reconstrução, também seguindo os critérios descritos no 5. As reconstruções 3D selecionados e parâmetros helicoidais correspondentes são impostas como volumes iniciais e parâmetros helicoidais iniciais para um segundo refinamento IHRSR de 100 ciclos, que convergiram para uma organização de quatro começar helicoidal para o ser humano FVIII-LNT com Δz = 41,1 Å e ΔΦ = 42,0 ° e uma organização de cinco iniciar helicoidal para o suíno FVIII-LNT com Δz = 35,5 Â e ΔΦ = 34,8 °. Uma final 100 IHRSR iterações impondo um 4 vezes e uma simetria helicoidal de 5 vezes para o suíno reconstruções FVIII-LNT humano e, respectivamente, são realizadas com volumes iniciais e os correspondentes parâmetros helicoidais dos últimos refinamentos IHRSR assimétricas (Figuras 4C e 4D). Os volumes finais mostram 8 FVIII humano e 10 moléculas ligadas a membrana de FVIII suína organizadas em torno do eixo helicoidal (Figura 5A). Cada ser humanoMolécula de FVIII é traduzido de 41,2 Â e 42,0 ° rodado a partir do anterior e cada molécula de FVIII porcino é traduzido de 35,9 Â e 35,2 º rodado a partir do anterior, o que corresponde aos parâmetros helicoidais dos reconstruções 3D finais (Figura 5B).
As tomografias de electrões reconstruídos confirmar a diferença na organização helicoidal entre o FVIII-LNT humano e porcino obtido nas mesmas condições experimentais. Comparação dos principais pontos de vista das tomografias reconstruídos e os volumes 3D a partir da reconstrução helicoidal visto na direcção perpendicular ao eixo helicoidal, valida ainda mais a exatidão das reconstruções 3D refinados com os parâmetros IHRSR helicoidais (Figura 6). As dimensões da célula unitária 2D assimétricos para a reconstrução de FVIII humano-LNT 3D são: a = 17,8 nm, b = 8,2, γ = 84 ° e para o suíno reconstrução FVIII-LNT 3D: a =18,4, b = 7,2 e γ = 70 ° (Figura 6). As dimensões de célula unitária de FVIII humano organizado em cristais 2D ligada à membrana são: a = 8,1, b = 7,0 e γ = 67 °, o que corresponde à superfície coberta por uma molécula de FVIII viram para a membrana de superfície 20. Comparando as dimensões da célula unitária entre FVIII organizados em 2D e cristais helicoidais indica que tanto as moléculas de FVIII humano e porcino formam dímeros quando organizadas de forma helicoidal na superfície de LNT.

Estrutura análise do gráfico Figura 1. Fluxo. Os passos seguidos para a análise de classificação 2D baseado em algoritmos de alinhamento de referência livre implementadas em EMAN2 16 são circuladas em azul. As etapas para a análise 3D realizada com o real helicoidal iterativo algoritmos de reconstrução do espaço (IHRSR) está circulado em vermelho. Os ciclos iterativos IHRSR são indicadas com setas tracejadas.
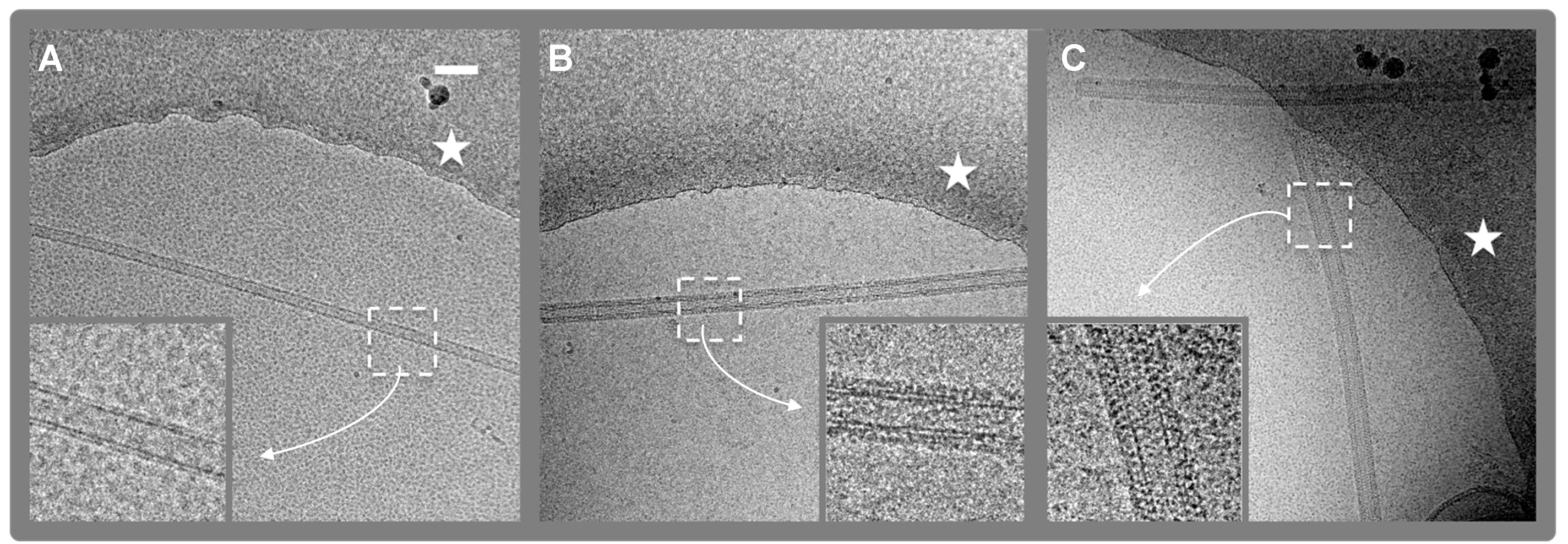
Figura 2. Micrografias Cryo-EM digitais. (4.096 x 4.096 pixels, 2,9 Å / PIX) de nanotubos de lípidos (LNT) com e sem FVIII vinculado. A. Controle LNT. B. Humano FVIII-LNT. C. Suínos FVIII-LNT . O bordo do orifício, no filme de carbono, em que o FVIII-LNT são suspensos em gelo amorfa é indicado com uma estrela branca. As densidades de proteínas e lipídios são em preto. As vistas ampliadas (inserir) de 512 x 512 áreas recortadas (branca tracejada quadrado) ilustram a diferença na organização helicoidal do FVIII humano e porcino, respectivamente. A barra de escala é de 100 nm.ig2highres.jpg "target =" _blank "> Clique aqui para ver uma versão maior desta figura.
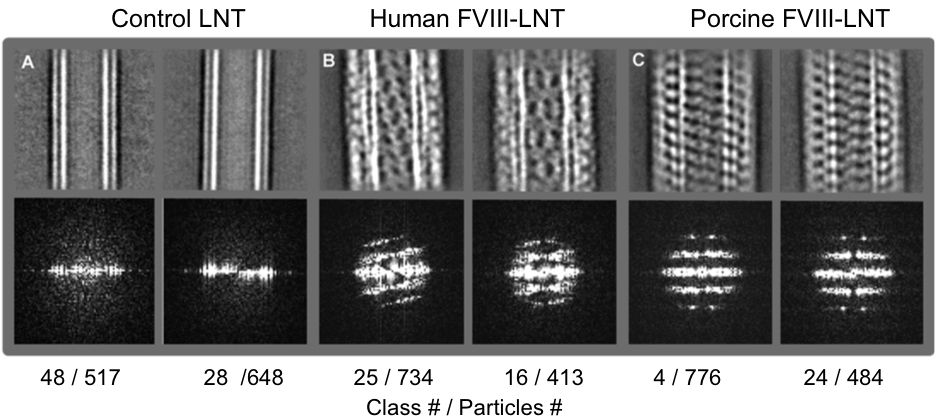
Figura 3. Médias classe Representante 2D (linha superior) e as correspondentes transformadas de Fourier (linha inferior) a partir dos conjuntos de partículas intermediárias (Tabela 1) classificados em 50 aulas. A. Controle LNT B. Humano FVIII-LNT C. Suínos FVIII-LNT. São indicados o número de classes e número de partículas incluídos em cada classe. A diferença, a fim helicoidal entre o FVIII humano e suíno é claramente visto nas imagens e confirmado pelos padrões de difração obtidos a partir do Fourier transforma essas imagens. Clique aqui para ver umaversão maior desta figura.
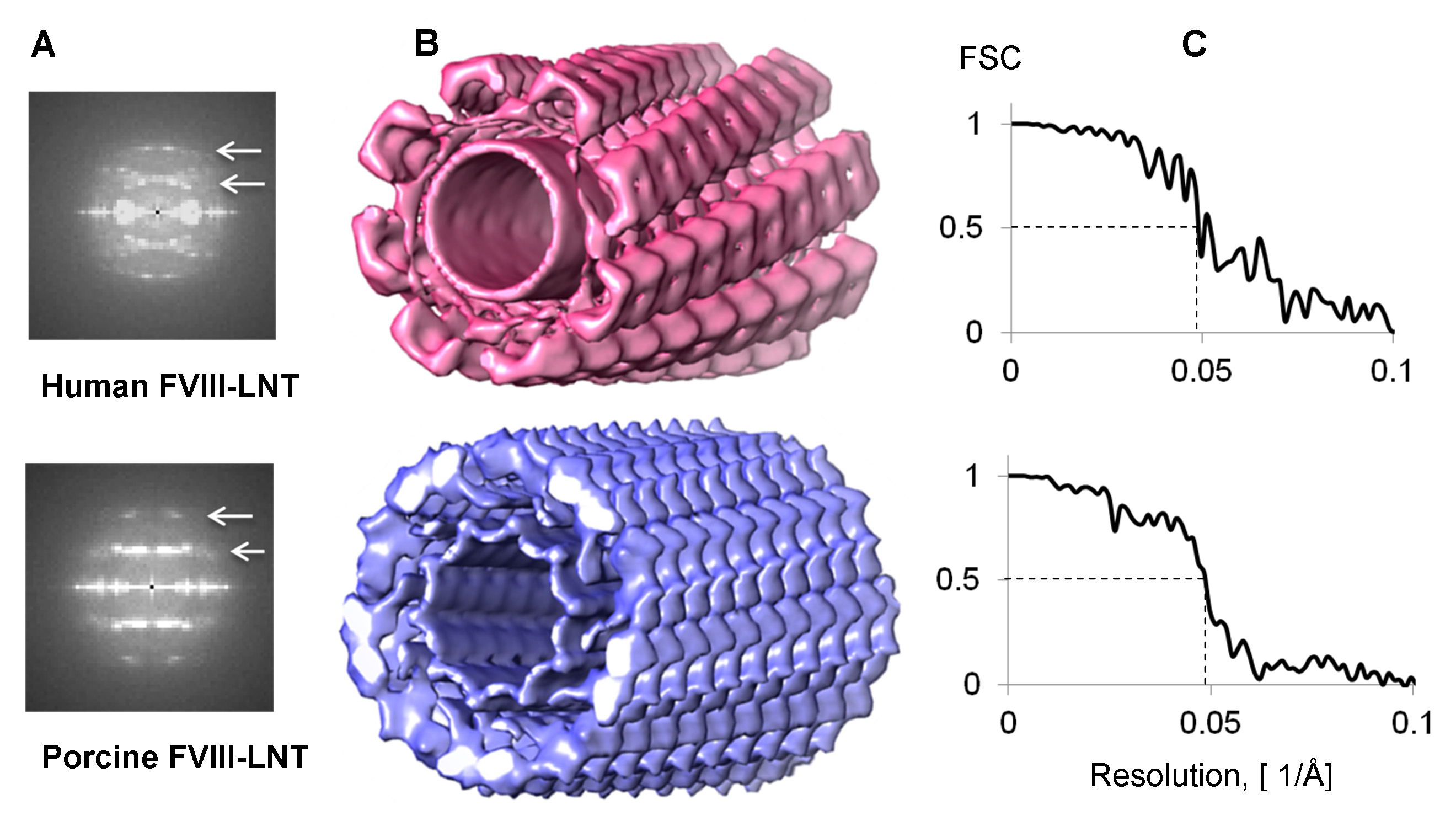
Figura 4. Reconstruções 3D helicoidais de FVIII-LNT. A. Combined Fourier humana e suína transformar a partir de 1.000 segmentos helicoidais. A primeira e segunda linha camada estão centradas em 1/82 a -1 e 1/41 a 1 para humano FVIII-LNT, e em 1/72 -1 e 1/36 a 1 para suíno FVIII-LNT (branco setas) B. representação. Superfície do humano na cor rosa (Δz = 41,1 Å, ΔΦ = 42,0 º) e suínos em azul (Δz = 35,9 Å, ΔΦ = 35,2 º) reconstruções helicoidais FVIII-LNT 3D. Ambos os volumes são apresentados em 0,005 nível de contorno (densidade mínima é de 0 e máximo de densidade de 0,02, calculado em UCSF Chimera, opção espectador Volume 21). O comprimento do tubo de FVIII-LNT é de 256 pixels de 2,9 Å / pix. Correlação C. Shell Fourier (FSC) parcelas para o homem eo suíno FVIII-LNT mostrando uma resolução de 20,5 Å em FSC = 0,5.

Figura 5. Organização helicoidal de FVIII-LNT representação da superfície humana e porcina. Segmentado de FVIII-LNT reconstruções helicoidais humana e porcina, mostrado na Figura 4B. Os volumes são segmentadas após impondo simetria de 4 vezes a do FVIII humano-LNT e simetria de 5 vezes para o suíno FVIII-LNT. As unidades assimétricas são codificados por cores amarelo-vermelho para o ser humano FVIII-LNT e azul-verde para os suínos FVIII-LNT. A. Vistas ao longo do eixo helicoidal indicado com um quadrado para o ser humano e comoum pentágono para o suíno FVIII-LNT. A estrutura de FVIII-LNT humano mostra oito moléculas organizadas em torno da membrana externa LNT e a estrutura de FVIII porcino mostra 10 moléculas organizadas em torno da membrana externa LNT, indicadas com números. B. Visto perpendicular ao eixo helicoidal. O FVIII humano-LNT é uma estrutura de 4-helicoidal e começar o suíno FVIII-LNT é uma estrutura de 5-começar helicoidal. O individual hélices de início são indicados com números e código de cores. Temos enfatizado uma das hélices de cada estrutura com um (*) e linhas verdes. A barra de escala é de 20 nm.

Figura 6. Comparação entre as reconstruções 3D helicoidais e tomografia. The humano FVIII-LNT (a) e suínos FVIII-LNT (C) reconstruções 3D helicoidal são mostrados perpendicular ao eixo helicoidal. Cada célula unitária e hélices individuais são como na Figura 5 com código de cores. B. e D. são representações de densidade dos reconstruções tomografia 3D, visto perpendicularmente ao eixo helicoidal. A estrutura 2D reflectindo o arranjo helicoidal das moléculas de FVIII é mostrado com linhas verdes.
| AMOSTRAS | clnt | hFVIII-LNT | pFVIII-LNT |
| Micrografias iniciais | 61 | 474 | 542 |
| Conjuntos de partículas iniciais | 29113 | 60395 | 64665 |
| Desfocagem (nm) | -4051 ± 502 | -3643 ± 737 | -3.443 ± 1.086 |
| Conjuntos de partículas intermediárias | 25.907 | 27.305 | 22.773 |
| Conjuntos de partículas finais | 25.907 | 10.455 | 10.430 |
Tabela 1. Análise estatística 2D seguintes o algoritmo apresentado no fluxograma na Figura 3.
Discussão
Neste trabalho é apresentada uma metodologia para diferenciar entre duas entidades ligadas à membrana das proteínas altamente homólogas: FVIII humano e porcino auto-montada em nanotubos lipídicas nas condições encontradas no corpo humano.
No processo descrito, o FVIII humano e porcino são organizados com sucesso de modo helicoidal em nanotubos de lípidos, que é a etapa mais crítica. O próximo passo crítico é o de preservar a amostra em gelo amorfo fino por congelamento do flash perto líquido N temperatura 2. Preservar a amostra em gelo amorfo e LN2 temperatura mantém os tubos helicoidais hidratados e os conjuntos macromoleculares proteína-lípido fisiologicamente ativa. O passo final é fundamental a aquisição de dados Cryo-EM de quantidade e qualidade suficiente para uma estrutura 3D de alta resolução em temperatura perto de LN2. Coleta de dados em temperatura perto LN2 impede uma maior desidratação da amostra no alto vacuum do microscópio e radiação danos do feixe de elétrons.
Para calcular a estrutura ligada à membrana do FVIII o primeiro passo crítico é a obtenção de partículas homogêneas (segmentos helicoidais) conjuntos aplicando classificação livre referência 2D e combinar partículas de classes com o mesmo diâmetro e grau de ordem. O segundo passo crítico é impor o volume certo inicial e parâmetros helicoidais (ascensão e ângulo azimutal) para a reconstrução helicoidal. A terceira e última etapa crítica é validar a estrutura helicoidal através da comparação dos mapas 3D obtidos pelo reconstruções do mesmo espécime helicoidal e eletrônica tomografia (sem simetria imposta).
A metodologia apresentada é única em sua capacidade de resolver a estrutura funcional de proteínas associadas à membrana em condições fisiológicas perto. A LNT desenvolvido em nosso laboratório pode serutilizado com sucesso como uma plataforma para a organização helicoidal de factores de coagulação do sangue ligados a membranas funcionais e alcançar uma melhor resolução do que para o FVIII organizado em cristais 2D ligada à membrana e como partículas individuais. O nosso objectivo é o de aumentar ainda mais a resolução dos nossos reconstruções helicoidais, melhorando a homogeneidade e qualidade dos conjuntos de partículas finais. Coleta mais micrografias Cryo-EM em melhores condições de Cryo-EM (arma Emissão de campo, filtro de energia, DE detectores da câmara) de FVIII-LNT filamentos helicoidais e, portanto, incluindo grandes conjuntos de partículas iniciais para a reconstrução 2D vai conseguir isso. Melhorar a montagem helicoidal FVIII-LNT e algoritmos de reconstrução 3D nos permitirá obter sub-nanométrica e perto de resolução atômica, o que inequivocamente definir a organização ligada à membrana desta proteína fundamental para a coagulação do sangue.
Organizar formas de FVIII helicoidal homólogos nos dá também a oportunidadesty caracterizar como diferença na seqüência pode correlacionar a diferenças na estrutura e função. Resolver os FVIII estruturas ligadas a membrana humanos e suínos pelos métodos descritos neste artigo podem ajudar a identificar as seqüências, que quando modificados irão melhorar a função FVIII recombinante. Este conhecimento vai ter implicações clínicas significativas para a descoberta de drogas em ambos os campos Trombose e Hemostasia.
Divulgações
Os autores declaram que não têm qualquer interesse financeiro que faça concorrência e eles podem ser contatados diretamente em relação a qualquer dos procedimentos publicados neste manuscrito.
Agradecimentos
Este trabalho é apoiado por uma concessão Nacional Scientist Desenvolvimento da American Heart Association: 10SDG3500034 e UTMB-BCN arranque fundos para SSM. Os autores reconhecem as instalações Cryo-EM e computação científica no Centro Sealy de Biologia Estrutural em UTMB ( www.scsb.utmb.edu ), bem como os drs. Steve Ludtke e Ed Egelman para obter ajuda com os algoritmos de reconstrução helicoidais 2D e 3D.
Materiais
| Name | Company | Catalog Number | Comments |
| JEM2100 with LaB6 | JEOL Ltd. | JEM-2100 | operated at 200 kV |
| with TEMCON software | JEOL Ltd. | ||
| Gatan626 Cryo-holder | Gatan, Inc. | 626.DH | cooled to -175 °C |
| with temperature controler unit | Gatan, Inc. | ||
| Gatan 4K x 4K CCD camera | Gatan, Inc. | US4000 | 4,096 x 4,096 pixel at 15 μm/pixel physical resolution |
| Solarus Model 950 plasma cleaner | Gatan, Inc. | ||
| Vitrobot Mark IV | FEI | ||
| Carbon coated 300-mesh 3 mm copper grid | Ted Pella | 01821 | plasma cleaned for 10 sec on high power |
| Quantifoil R2/2 300 mesh | Electron Microscopy Sciences | Q225-CR2 | Carbon coated 300-mesh Cu grids with 2 mm in diameters holes |
| Uranyl acetate dihydrate | Ted Pella | 19481 | 1% solution, filtered |
| Galactosyl ceramide | Avanti Polar Lipids Inc. | 860546 | |
| Dioleoyl-sn-glycero-phospho-L-serine | Avanti Polar Lipids Inc. | 840035 | |
| EM software Digital Micrograph | Gatan, Inc. | http://www.gatan.com/DM/ | |
| EM software EMAN | free download | http://blake.bcm.edu/emanwiki/EMAN/ | |
| EM software Spider | free download | http://spider.wadsworth.org/spider_doc/spider/docs/spider.html | |
| EM software IHRSR | free download | Programs available from Edward H. Egelman http://people.virginia.edu/~ehe2n/ | |
| EM software (IMOD) | free download | http://bio3d.colorado.edu/imod/ | |
| EM software (SerialEM) | free download | ftp://bio3d.colorado.edu/pub/SerialEM/ | |
| UCSF-Chimera | free download | http://www.cgl.ucsf.edu/chimera/download.html |
Referências
- Henderson, R. Realizing the potential of electron cryo-microscopy. Quarterly Reviews of Biophysics. 37, 3-13 (2004).
- Fujiyoshi, Y., Unwin, N. Electron crystallography of proteins in membranes. Current opinion in structural biology. 18, 587-592 (2008).
- Toole, J. J., et al. Molecular cloning of a cDNA encoding human antihaemophilic factor. Nature. 312, 342-347 (1984).
- Fay, P. J. Factor VIII structure and function. International journal of hematology. 83, 103-108 (2006).
- Stoilova-McPhie, S., Lynch, G. C., Ludtke, S. J., Pettitt, B. M. Domain organization of membrane-bound factor VIII. Biopolymers. , (2013).
- Pipe, S. W. Hemophilia: new protein therapeutics. Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2010, 203-209 (2010).
- Gatti, L., Mannucci, P. M. Use of porcine factor VIII in the management of seventeen patients with factor VIII antibodies. Thrombosis and haemostasis. 51, 379-384 (1984).
- Parmenter, C. D., Cane, M. C., Zhang, R., Stoilova-McPhie, S. Cryo-electron microscopy of coagulation Factor VIII bound to lipid nanotubes. Biochemical and biophysical research communications. 366, 288-293 (2008).
- Parmenter, C. D., Stoilova-McPhie, S. Binding of recombinant human coagulation factor VIII to lipid nanotubes. FEBS letters. 582, 1657-1660 (2008).
- Wassermann, G. E., Olivera-Severo, D., Uberti, A. F., Carlini, C. R. Helicobacter pylori urease activates blood platelets through a lipoxygenase-mediated pathway. Journal of cellular and molecular medicine. 14, 2025-2034 (2010).
- Wilson-Kubalek, E. M., Chappie, J. S., Arthur, C. P. Helical crystallization of soluble and membrane binding proteins. Methods in enzymology. 481, 45-62 (2010).
- Egelman, E. H. Reconstruction of helical filaments and tubes. Methods in enzymology. 482, 167-183 (2010).
- Lusher, J. M. Development and introduction of recombinant factor VIII--a clinician's experience. Haemophilia : the official journal of the World Federation of Hemophilia. 18, 483-486 (2012).
- Thim, L., et al. Purification and characterization of a new recombinant factor VIII (N8). Haemophilia : the official journal of the World Federation of Hemophilia. 16, 349-359 (2010).
- Doering, C. B., Healey, J. F., Parker, E. T., Barrow, R. T., Lollar, P. High level expression of recombinant porcine coagulation factor VIII. The Journal of biological chemistry. 277, 38345-38349 (2002).
- Tang, G., et al. EMAN2: an extensible image processing suite for electron microscopy. Journal of structural biology. 157, 38-46 (2007).
- Egelman, E. H. A robust algorithm for the reconstruction of helical filaments using single-particle methods. Ultramicroscopy. 85, 225-234 (2000).
- Egelman, E. H. The iterative helical real space reconstruction method: surmounting the problems posed by real polymers. Journal of structural biology. 157, 83-94 (2007).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of structural biology. 152, 36-51 (2005).
- Stoilova-McPhie, S., Villoutreix, B. O., Mertens, K., Kemball-Cook, G., Holzenburg, A. 3-Dimensional structure of membrane-bound coagulation factor VIII: modeling of the factor VIII heterodimer within a 3-dimensional density map derived by electron crystallography. Blood. 99, 1215-1223 (2002).
- Goddard, T. D., Huang, C. C., Ferrin, T. E. Visualizing density maps with UCSF Chimera. Journal of structural biology. 157, 281-287 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados