Method Article
脂質ナノチューブ上血液凝固第VIII因子の螺旋組織
要約
ヒトおよびブタ:我々は、2つの高度に相同なFVIII形態の膜結合構造を解決するために適用クライオ電子顕微鏡法、脂質ナノテクノロジー、および構造解析の組み合わせを提示する。螺旋状に負に荷電した脂質ナノチューブ(LNT)上の二つの機能の組換えFVIIIフォームを整理するために私たちの研究室で開発された方法論が記載されている。
要約
低温電子顕微鏡法(低温電子顕微鏡)1は、水和状態と膜環境2内のタンパク質との複合体の機能的な構造を調査するための強力なアプローチである。
凝固因子VIII(FVIII)3は、マルチドメイン血漿糖タンパク質である。重度の出血性疾患 - FVIIIの欠損または欠乏が血友病A型の原因である。タンパク質分解活性化されると、FVIIIは正常な血液凝固4のために重要である、負に帯電した血小板膜上のセリンプロテアーゼIXa因子に結合する。 FVIII凝固で果たす重要な役割にもかかわらず、その膜結合状態の構造情報は、5不完全です。組換えFVIII濃縮物は、血友病A型に対する最も有効な薬物であり、市販のFVIIIは、ヒト又はブタ、ヒト第IXa因子6,7の両方の機能的複合体を形成するように表すことができる。 ">本研究では、低温電子顕微鏡法(低温電子顕微鏡)の組み合わせを提示し、脂質ナノテクノロジー、構造解析は、2つの高度に相同的FVIII形の膜結合構造を解決するために適用される:ヒトとブタの研究室で開発された方法論螺旋状に負に荷電した脂質ナノチューブ(LNT)に二つの機能の組換えFVIIIフォームを整理することは記載されている。代表的な結果は、我々のアプローチは、シーケンス内の高度に相同性2(86%の配列同一性との間に螺旋状の組織の違いを定義するのに十分に敏感であることを証明している)タンパク質ヘリカル組織、低温電子顕微鏡と電子断層撮影(ET)データ取得のための詳細なプロトコールは、二次元(2D)所与の三次元(3D)構造解析は、ヒトおよびブタの3次元再構成を得るために適用されるFVIII-LNTが議論されている。提示、ヒトとブタFVIII-LNT構造はcalculatするために提案手法の可能性を示す高解像度での血液凝固因子VIIIのe機能、膜結合組織。
概要
血液凝固第VIII因子(FVIII)は、6つの領域で編成2,332アミノ酸の大きな糖タンパク質である:A1-A2-B-A3-C1-C2 3。トロンビンの活性化FVIIIは膜結合テナーゼ複合体中の第IXa因子の補因子として機能したら。膜に依存した方法でのFIXaに活性化FVIII(FVIIIaの)の結合は、効率的な血液凝固4のために重要である、FIXaのタンパク質分解効率を10以上の5倍を強化します。 FVIIIは、凝固およびテナーゼ複合体形成に果たす重要な役割にもかかわらず、機能的な膜結合FVIII構造が解決されていている。
これに対処するために、高親和8,9とFVIIIと結合し、活性化血小板表面に似ていることが可能なホスファチジルセリン(PS)に富む単一脂質二重層ナノチューブ(LNT)は、10が開発されている。 LNTにバインドされたFVIIIの連続した螺旋状の組織がeffectiであることが証明されました低温電子顕微鏡5によるFVIII膜結合状態の構造決定のためのVEの。官能化されたLNTは低温電子顕微鏡11、12によって螺旋状に編成膜関連タンパク質のタンパク質-タンパク質及びタンパク質-膜の相互作用を研究するために理想的なシステムです。試料を添加し、同位体なしで生理的環境(バッファ、膜、pH)で、最も近いで保存されているように低温電子顕微鏡は、X線結晶解析やNMRなどの伝統的な構造的な方法に比べて利点があります。 LNTは、サイズ、形状および組成テナーゼ複合体がインビボでアセンブル活性化血小板の偽足により密接に似ているように、FVIIIの場合、この手法で膜結合構造を研究することは、さらにより生理学的に関連する。
欠陥およびFVIIIの原因血友病A、人口4、6の1 5000の男性に影響を与える重大な出血性疾患の欠乏。ほとんどの電子血友病Aのffective療法は、組換えヒトFVIII(hFVIII)の生涯にわたる投与である。組換え第VIII因子血友病A治療の重要な合併症は、血友病A患者13の約30%に影響を与える人間の形に阻害抗体の開発である。ブタFVIIIがヒトFIXaを7ヒトFVIIIおよびフォームの機能的複合体に対する阻害抗体との低い交差反応性を表示するように、この場合には、ブタFVIII(pFVIII)濃縮物を、使用される。ブタおよびヒトFVIIIの両形態の膜結合組織を確立することは、FVIII補因子機能と血液止血のための含意の構造的基礎を理解することが重要です。
本研究では、脂質ナノテクノロジー、クライオEM、及び2つの高度に相同なFVIII形態の膜結合組織を解決するために設計された構造解析の組み合わせを記載している。螺旋状に組織化さporciに提示低温電子顕微鏡データと3次元構造負に帯電したLNT上のNEとヒトFVIIIはFVIIIおよび生理的膜環境における膜結合型凝固因子との複合体の構造決定のための基礎として提案されたナノテクノロジーの可能性を示す。
プロトコル
1。サンプルの調製
- HBS-CA緩衝液に対する緩衝為替ヒトFVIII-BDD 14とブタFVIII-BDD 15(20のHEPES、150mMのNaCl、5mMのCaCl 2、pH値= 7.4)および1.2 mg / mlのに集中する。 -80℃でタンパク質溶液を保持
- 1:04 W /クロロホルム中w比でガラクトシルセラミド(GC)およびホスファチジルセリン(PS)を混合することによって、脂質ナノチューブ(LNT)を準備します。アルゴン下でクロロホルムを蒸発させ、1 mg / mlのにHBS緩衝液中の脂質を可溶化する。 4℃でLNT溶液を保つ
FVIII-LNTの2。低温電子顕微鏡
- 低温電子顕微鏡サンプル調製
- 300は、50 W.で10秒間のO 2とH 2ガスの混合物中のQuantifoil R2 / 2銅グリッド(炭素側アップ)メッシュグロー放電
- のw / w比1:1のCa-HBS緩衝液中のFVIIIおよびLNT溶液を混合し、室温で15分間インキュベートする。
- 2.5μLのドロップを適用VitrobotマークIV加湿チャンバー(100%湿度)における親水電子顕微鏡グリッドにFVIII-LNTサンプル。
- ブロットおよびFlashは、液体、C 2 H 6グリッド(3.5秒1ブロット、しみ力1)を凍結、アモルファス氷を得るために、液体N 2で冷却。
- 液体N 2(LN2)下収納ボックスに保管してグリッド。
- 低温電子顕微鏡データ収集
NOTE:JEM2100-LaB 6の(2010年)は、電子顕微鏡、真空系、照明系、HT、レンズ電流と、いわゆるオンを読み取る窓がスクリーン、二つに接続されたコンピュータからなるTEMCONオペレーティングシステムが装備されているパネル:LEFTおよびRIGHT、列の両側に配置された。 X、Yのノブ(シフトY、SIFT Y)および多機能(DEF / STIG)ノブが両方のパネル上にあるビームシフト。左側のパネル上の照明(BRIGTHNESS)ノブです。右側のパネルで以下のとおりです。倍率(MAG / CAMの長さ)、フォーカス(FOCUS)ノブと3イマジンG(MAG1、MAG2、LOWMAG)と回折(DIFF)モードボタン。私たちは、アルファ2でMAG1で私たちのデータを取得する。低温電子顕微鏡データの取得に必要な最低限の線量照明条件(MDS)は、右側のパネルにF6ボタン、一番上の行を通じてF1を設定されている。このプロトコルでは、一般的な設定が使用されています。F1 - /下画面を上げ、F2 - 検索モード、F3 - フォーカスモード、F4 - 写真モード、F5 - MDS ON / OFFおよびF6 - 放射線から標本を遮蔽するために使用されるビームBLANK、ビームを偏向による損傷。- 低温ステーションにクライオホルダーを配置し、ホルダーとLN2とのクライオ駅のデュワーを埋める。温度が-192℃、ホルダー先端の開いたシャッターに到達すると、場所は以前に指定された場所に低温電子顕微鏡グリッドを凍結させ、リングクランプで固定します。
- 電子顕微鏡にクライオホルダーを挿入します。クライオホルダーとLN2と反汚す人室のデュワーを補充します。保有者が30〜60分間安定するのを待ちます。そして上のF6キーを押しますフィラメントの電源を入れます。グリッドを表示するには、ホルダーのフィラメントが飽和し、F6キーを押しオフ、オープンシャッター。
- を押して、低マグ/アルファ1(200×等で設定される)し、グリッド上に薄い氷の領域を探します。
- 最小用量(MDS)モードを設定し、試料を損傷することなく、低電子用量でクライオEMデータを取得するMAGの1/alpha 2に切り替える。
- F2キーを押して検索モードを設定します。 40,000 xで倍率を設定します。 / A 2·sの-最小の電子線量にBRIGTNESSノブ〜0.04 eでビームを拡大します。を押しDIFFは、回折モードに切り替えます。 MAG / CAMの着丈ノブ120 cmのカメラ長を設定します。カーボン膜の穴に脂質ナノチューブを持つLOWMAGで事前選択された領域内でグリッド上の領域の位置を確認します。
- F4キーを押して40,000倍の倍率でのフォトモードを設定し、16〜25 Eの投与量での輝度つまみで照明を設定する- / A 2·sである。 Z高さを調整するフォーカス条件を設定するのプレス標準フォーカスボタンZ UP / DOWNボタン(右側のコントロールパネル)で試料の。 -1.5と-2.510μmのデフォーカスを設定します。
- 写真モードでは、画像化される領域に対応する検索モードでのデジタルカメラの液晶モニターにライブビュー]ウィンドウの四角形を描画して検索し、写真モードに合わせます。
- F3キーを押して、10万倍の倍率でのフォーカスモードを設定します。 PHOTOモードで画像化される領域を照射しないよう - (5cmの半径〜4)および軸外CCDチップを覆うように照明を当てる。フォーカスノブとDEF / STIGノブと画像の乱視の正しいで〜-1.5 -2.5μmのデフォーカスを調整します。
- FVIII-LNTデジタルカメラのモニターにライブビュー]ウィンドウでライブ画像を取得することにより、検索モードで画像化することを選択します。ライブビュー画面上に描かれた正方形の中のFVIII-LNTを中央に。
- 写真モードに切り替えるとACQUIRをクリックすることで、52000 X実効倍率と0.5秒の露出で、CCDカメラ上でデジタル画像を記録デジタル顕微鏡のカメラの画面にはEボタン。画像取得条件は、画像をPHOTOモードで取得された場合にのみオープンビームブランク(シャッタ)として設定される。
- 高速フーリエ変換(FFT)を得るために、Ctrl + Fキーを押すことによって取得された画像の質とフォーカスをチェックしてください。
3。3次元再構成
注:2次元および3次元解析に用いた画像解析ソフト:EMAN2とIHRSRが自由に利用できます。 EMAN2はhttp://blake.bcm.edu/emanwiki/EMAN2/Installからダウンロードすることができます。 egelman@virginia.edu:IHRSRソフトウェアはEgelman教授から得ることができる。最終IHRSRの改良がテキサスで実行されるコンピューティング·センタークラスター拡張:テキサス州、オースティン大学でhttp://www.tacc.utexas.edu/を。 図1に示した3次元再構成アルゴリズムは、主に2つのステップで構成されます。最初に2次元のリファレンス無料alignmeとらせんセグメント(粒子)の均質なセットを選択するNT(RFA)のアルゴリズムは、第二の螺旋のパラメータとIHRSRに内蔵された逆投影アルゴリズムに基づいて3次元再構成を実現し、EMAN 2に実装されています。 http://blake.bcm.edu/emanwiki/EMAN2:最初のステップは、単一粒子のSPA EMAN2は、具体的に開発され、配布されたため(アルゴリズム)と3次元再構成のため、均一な粒子のセットを選択するために開発されたプログラムを利用しています。このステップは、低温電子顕微鏡データに適応されています。第二工程は、特に組換え第VIII因子形態を用いて得られた螺旋状アセンブリのタイプのために設計されてIHRSRアルゴリズムを用いて達成される。このアルゴリズムは、科学文献12を通して広範囲に文書化されています。
- 均質な粒子の螺旋再構成のために(ヘリカルセグメント)のセットを選択することがhttp://blake.bcm.edu/eman2/doxygen_html 16:EMAN2科学的な画像処理スイートを2次元画像解析を行う。
- straigと低温電子顕微鏡顕微鏡写真を選択します。HTおよびデジタルカメラのソフトウェアおよび視覚化ツールを使用してらせん状のチューブをよく組織。
- 反転、e2workflow.py GUIのX線ピクセル、単一の粒子の再構築(SPR)のオプションを標準化し、フィルター:http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2projectmanager
- e2helixboxer.py GUI で 、反転し、正規化し、X線ピクセルがフィルタ処理した画像をインポートします。使用して90%のオーバーラップで256×256ピクセル(2.9Å/ PIX)で、FVIII-LNTのヘリカル管とセグメントを選択します。http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2helixboxer
- オリジナルの写真からフォーカスを評価しe2workflow.pyに組み込まe2ctf.pyオプションを使用して、同じ写真かららせんセグメントにコントラスト伝達関数(CTF)修正(のみ位相補正)を適用:http://blake.bcm。 edu/emanwiki/EMAN2/Programs/e2ctf。
- 初期粒子(らせんセグメント)を生成e2workflow.py GUIで設定します - SPRオプション:http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2workflow。
- ITER = 8 - 'e2refine2d.py:e2refine2d.pyアルゴリズムはスクリプト以下、同じ直径のLNTとヘリカル秩序度( 図2)との均質なデータセットを選択するために、参照の無料K-平均の分類を適用することで、2Dクラス平均を計算する - naliref = 5 - nbasisfp = 8 - パス= r2d_001 - 入力= INPUT.hdf - NCLS = 51 - simcmp =ドット - simalign = rotate_translate_flip - classaligncmp =ドット - classraligncmp =位相 - classiter = 2 - classkeep = 0.8 - classnormproc = normalize.edgemean - classaverager =平均 - normproj-classkeepsig '、それに応じてNCLS値を変更する。
- クラス平均に80%未満の類似性を持つ粒子は特定のクラスから除外されていることを意味し、 'classkeep = 0.8」と8回の繰り返しオーバー150クラス' = 151 NCLS 'に設定された初期データを分類します。 http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2refine2d
- クラス平均から粒子をマージ中間データセットを作成するe2display.pyの顕著なヘリカル回折と。
- 注文の同径と学位を持つクラスを区別するために50のクラス '= 51 NCLS'に設定された中間データを分類する。
- http://blake.bcm.edu/emanwiki/EMAN2/Programs/emselector:同じ直径と3次元再構成のための最終的なデータセットを作成するe2display.pyにおける秩序度を持つクラスからの粒子をマージします。
- Egelman 17、18で説明したように、反復ヘリカル実空間の再構築(IHRSR)アルゴリズムで螺旋再実行してください。
- 上昇を推定、組み合わせた変換からのFVIII-LNTヘリックスのΔzの(A)は、最終的なデータセットの中の粒子の変換。
- 5からΔΦを高め、一定のΔzのと並行してIHRSRの改良を実行することで、方位角ΔΦ(度)を定義76; 5°刻みで60°である。
- 3.2.1で定義された初期容量および初期ヘリカルパラメータΔzのとΔΦなどの特徴のシリンダーと、各最終的なデータセットのために100個の連続IHRSRサイクルを実行します。および3.2.2。
- クラス最終データセットの2D分類からの平均と最終IHRSR再建から突起間のらせん状のパラメータとの対応関係の収束のために最終的なボリュームを検査します。
- 最終的な非対称の3Dボリュームで観察非対称単位分布に対応し、最終的な3D再構成に対称性を課す:ヒトFVIII-LNT用の4倍とブタFVIII-LNT用の5倍。最終的な対称3次元再構成を生成するために、別の100の改良サイクルを実行します。
- 最初の偶数奇数で設定した対応するデータを分離することにより、両方のボリュームのためのフーリエシェル相関曲線を計算します。 'e2proc2d.pyで、 - スプリット= 2 '。 3.2.3で説明したように、その後100 IHRSR連続した改良を実行します。奇数と偶数のデータセットから作成された3DボリュームのFSCを計算します。 'e2proc3d.py evenvolume.mrc fsc.txt - calcfsc = oddmap.mrc'。
- CHIMERAにより作成中のFVIII-LNTボリュームを視覚化し、セグメント。
- ステップ3.2.5からの最終的なボリュームを開きます。 CHIMERAにより作成中とツール>ボリュームデータ]> [ボリュームビューアオプションで0.005にコンターレベルを設定します。
- [ツール]> [ボリュームデータ>セグメントマップ、セグメントマップ]タブで選択して音量やセグメントにセグメント上のボリュームをクリックします。
- CtrlキーとShiftキーとクリック·グループに選択して、1単位セルに対応するグループのセグメント。
- 単位セルによってセグメントを色と構造的特徴を強調するためのアクション>カラーオプションを指定してヘリックス。
4。電子トモグラフィー
- ネガティブ染色FVIII-LNTサンプル調製
- <李は>低温電子顕微鏡実験用としてFVIII-LNTのサンプルを準備します。
- グロークライオEM実験用として、50 Wで10秒間のO 2とH 2ガスの混合物中の炭素被覆300メッシュの銅グリッド(炭素面を上)に排出する。
- 、グリッドに6nmの金コロイドナノ粒子を2.5μlのFVIII-LNT懸濁液の滴を適用し、過剰の液体をブロットし、負に2分間、5μlの1%酢酸ウラニル溶液を適用することによって染色する。グリッドを乾燥させ、過剰な液体と空気ブロット。
- 電子断層撮影データ収集
- シングルチルトホルダーにグリッドを転送します。
- 電子顕微鏡でホルダーを転送します。
- 、52000 X実効倍率でCCDカメラで60°と記録画像にSerialEMソフトウェアと共に自動的に-60°の角度範囲にわたって19°2でカウントをチルトシリーズを収集-6 -10ミクロンのデフォーカスと150の電子線量に - 170エレメントctrons / A 2·sの断層ごと。
- FVIII-LNTの電子トモグラフィー再構築
注意:4.2で取得pFVIII-LNTとhFVIII-LNT傾斜シリーズを再構築。 http://bio3d.colorado.edu/imod/doc/etomoTutorial.html:チュートリアル次のIMODソフトウェアのETomoオプション付き- ターミナルウィンドウを使用して、3DMODに断層を開きます。 http://bio3d.colorado.edu/imod/doc/3dmodguide.html。
- ビンはIMOD BINVOLで4による断層は断層像のサイズを小さくするコマンド。
- IMOD ROTATEVOLコマンドを使用して、ビン化断層像にY軸に沿った脂質ナノチューブを回転させるために適切な角度を選択する。
- IMOD ROTATEVOLコマンドを使用して完全な断層像を回転させます。
- IMODクリップresizeコマンドでY軸に沿って配向選択した脂質ナノチューブをトリミング。
- 3DMODでトリミングされたサブ断層を開きます。
- に沿った第VIII因子分子の配置を可視化するために断層像をクリックしてくださいZ軸方向のサブ断層像ボリュームにおけるY軸に沿ってスライス。
結果
組換えヒトとブタFVIIIが正常に悪影響を活性化した血小板表面に似た、単一の二層LNTを請求螺旋状に組織された。人間とブタFVIII-LNTのらせん組織は( 図2)収集したデジタル顕微鏡写真を通じて一貫していた。制御LNTと人間とブタFVIII-LNTヘリカルチューブはe2helixboxer.py GUIとe2workflow.py GUI、単一粒子のオプション( 表1)で作成した初期データセットを選択し、セグメント化された。
膜結合型ヒト及びブタFVIII-LNTの螺旋順序はe2display.py GUI(EMAN2)( 図3)を使用してクラス平均像のフーリエ変換から評価した。最高の制御LNTの2Dクラス平均での脂質二重層はよく定義されています。内側と外側のリーフレットと膜の疎水性コアの低密度が(はっきりと見える図3A)。に向かって、膜表面に対して垂直方向に配向膜結合ヒトおよびブタFVIII分子の投影された密度は、十分に定義され、はっきりと二つのタンパク質( 図3Bおよび3C)の間に螺旋状組織内の変化を示している。ヒトFVIII-LNT螺旋管のためのより顕著なねじれは、隣接する膜結合型FVIII分子間のタンパク質-タンパク質相互作用二つFVIII形態( 図3Bおよび3C)が一貫して異なっていることを示している。良いらせん状組織(らせん状回折パターン)を示すクラス平均からの粒子は、中間粒子セット( 表1)を形成するe2display.py GUIで統合された。中間粒子セットからの粒子が再び同じ制約を50のクラスに分類された。同じ直径のクラス平均の粒子は、最終的なデータにマージされましたセット( 表1)。
人間とブタFVIII-LNTの初期の3D再構成は、最終的な人間とブタFVIII-LNTデータセットから千代表の粒子を用いて実施した。百の連続したIHRSR反復が最初の体積として、特徴のないシリンダー(160オングストローム内側と500Åの外径)で各3次元再構成のために実行されました。組み合わせた変換から計算された軸上昇(Δzが)らせんセグメント(粒子が設定)のフーリエブタFVIII-LNTのためのヒトFVIII-LNTおよび36 Aの41 Aに等しい( 図4Aおよび4B)。反復探索から定義された初期方位角(ΔΦ)は、ヒトFVIII-LNTおよびブタFVIII-LNT用35.0°で40.0度と推定されている。最終的なボリュームは最終reconstrからクラス平均と突起間のらせん状のパラメータとの対応関係の収束のために検査されるまた5に記載された基準以下のはじめ、。選択した3D再構成と対応する螺旋状のパラメータは、初期ボリュームとΔzのヒトFVIII-LNT用4スタートヘリカル組織に収束し、100サイクル= 41.1 AとΔΦ= 42.0°の第二IHRSR洗練のための初期のヘリカルパラメータとして課せられているおよびΔzは= 35.5 AとΔΦ= 34.8°とブタFVIII-LNTの5開始らせん状の組織。 4倍と人間とブタFVIII-LNTの再構成のための5倍の螺旋対称性を課す最終100 IHRSR反復がそれぞれ初期のボリュームと最後の非対称IHRSRの改良( 図4Cおよび4D)からの対応する螺旋状のパラメータを用いて行われる。最終的なボリュームは8ヒトFVIIIと螺旋軸( 図5A)を中心に編成10ブタFVIIIの膜結合分子を示している。各人間FVIII分子は、41.2Åで翻訳し、前の1から42.0°回転し、各ブタFVIII分子は35.9Åを翻訳され、最終的な3D再構成( 図5B)の螺旋パラメータに対応する、以前の1から35.2度に回転させられる。
再構築された電子断層像は、同じ実験条件で得られたヒトとブタFVIII-LNT間ヘリカル組織の違いを確認してください。螺旋軸に垂直な方向から見たヘリカル再構成から再構成された断層像と3次元ボリュームから上面図の比較は、さらにIHRSR螺旋パラメータ( 図6)で精製3D再構成の正確さを検証する。ヒトFVIII-LNT 3D再構成のための非対称2次元単位格子寸法は、次のとおりです。= 17.8ナノメートル、B = 8.2、γ= 84°、ブタFVIII-LNT 3D再構成のために:=18.4、B = 7.2、γ= 70°( 図6)。膜結合型の2次元結晶で編成ヒトFVIIIの単位格子寸法は以下のとおりです。= 8.1、B = = 67º7.0、γ、膜面20に向かって見て1 FVIII分子によって覆われた表面に相当する。 2Dで編成FVIIIおよびヘリカル結晶間の単位格子寸法を比較すると、螺旋状に、LNTの表面に組織したとき、ヒトとブタFVIII分子の両方が二量体を形成することを示しています。

EMAN2 16に実装基準フリーアラインメントアルゴリズムに基づいて、2次元分類分析は青丸で囲まれているために図1の構造解析フローチャートのステップが続く。 3D解析は、反復ヘリカル本当で実施するための手順に従っ宇宙再構成アルゴリズム(IHRSR)は赤で丸で囲まれています。反復IHRSRサイクルは破線の矢印で示してある。
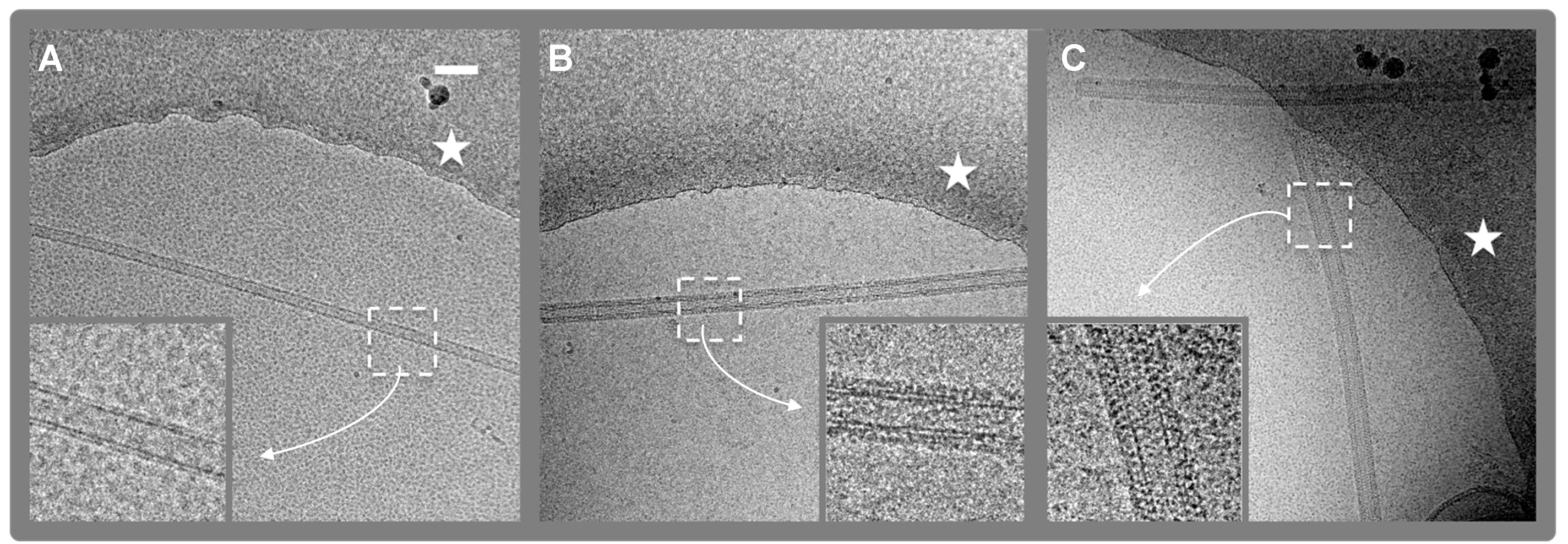
バインドされたFVIII。A.コントロールLNTとない。図2。低温電子顕微鏡デジタル顕微鏡写真。(4096 X 4096ピクセル、2.9Å/ PIX)脂質ナノチューブの(LNT)。B.ヒトFVIII-LNT℃のブタFVIII-LNT 。 FVIII-LNTはアモルファス氷中に懸濁された炭素膜の穴の縁は白い星で示されている。タンパク質と脂質の密度は黒である。 512×512の拡大図(挿入図)は、エリアをクロップド(白四角を点線)は、それぞれ、ヒト及びブタFVIIIの螺旋組織の違いを示す。スケールバーは100nmである。ig2highres.jpg "ターゲット=" _blank ">この図の拡大版を表示するには、こちらをクリックしてください。
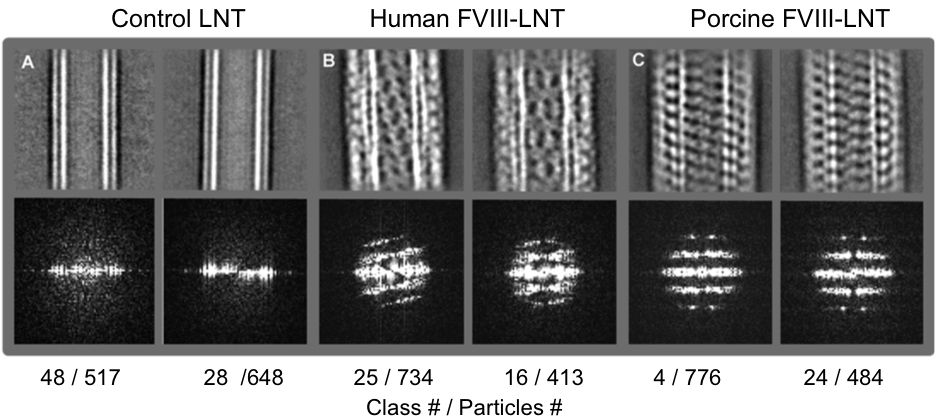
図3。代表の2Dクラス平均(一番上の行)と、50のクラス。A.コントロールLNT B.ヒトFVIII-LNT でブタFVIII-LNT に分類中間粒子セット ( 表1)からフーリエ変換(下の行)に対応する 。クラス番号と、各クラスに含まれて粒子の数が示されている。人間とブタFVIIIの間の螺旋順序の違いがはっきりと画像に見られるこれらの画像のフーリエ変換から得られた回折パターンによって確認された。 見るにはこちらをクリックしてくださいこの図の拡大版。
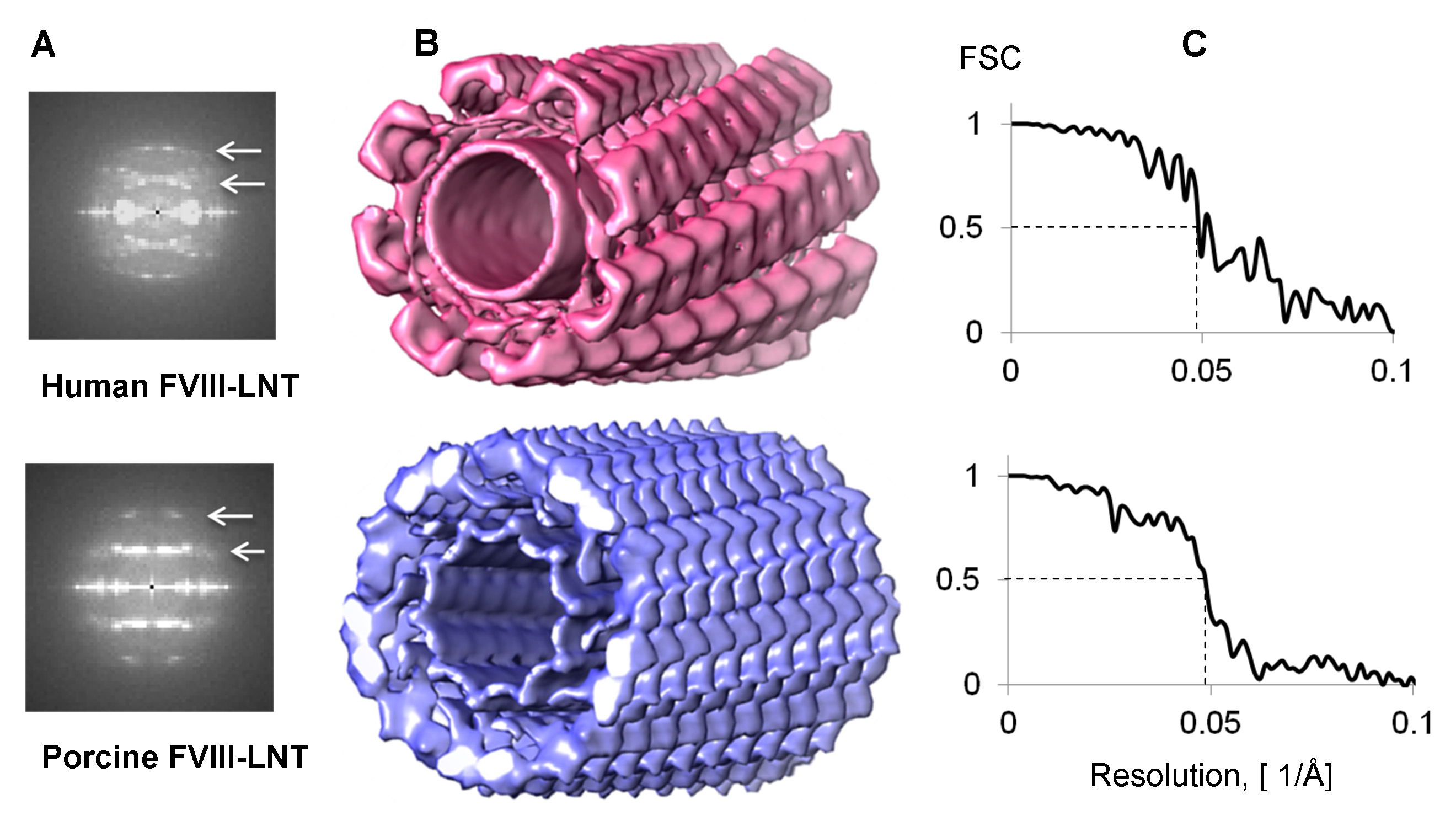
図4。人間とブタFVIII-LNTの3Dヘリカル再構成。A.複合フーリエ千らせんセグメントから変換。第一および第二層配線82分の1のA -1と41分の1ヒトFVIII-LNTするためのA -1、および1/72のA -1と36分の1Å-1ブタFVIII-LNT用(白を中心とする矢印)。B.表面ピンクにおける人間の表現(Δzだけ= 41.1 A、ΔΦ= 42.0度)、青(Δzは= 35.9 A、ΔΦ= 35.2度)、FVIII-LNT 3Dヘリカル再構成ブタ。両方のボリュームは(最小濃度が0と最大密度0.02であり、UCSFのチャイムに計算された0.005コンターレベルで提示されているRA、ボリュームビューアオプション21)。 FVIII-LNT管の長さは2.9Å/ PIXで256ピクセルです。C.フーリエシェル相関FSC = 0.5で20.5オングストロームの分解能を示す、ヒトとブタFVIII-LNT用(FSC)のプロット。

図5。図4(b)に示されるヒトとブタFVIII-LNTヘリカル再構成、 人間とブタFVIII-LNT。セグメント表面表現の螺旋組織 。ボリュームは、ヒトFVIII-LNTおよびブタFVIII-LNT〜5倍対称に4回対称性を課した後にセグメント化される。非対称単位は色ヒトFVIII-LNTと人間のための四角で示され、螺旋軸に沿っとしてブタFVIII-LNT。A. Viewsの青緑色のための黄赤色に符号化されるブタFVIII-LNT用の五角形。ヒトFVIII-LNT構造は、外側LNT膜を中心に構成8分子を示し、ブタFVIII構造は、外側LNT膜を中心に構成さ10分子が、数字で示されている。B.ビューの螺旋軸に対して垂直に示しています。ヒトFVIII-LNTは4起動らせん構造で、ブタFVIII-LNTは5スタートらせん構造である。個々の1つの開始ヘリックスは番号とカラーコード付きで示されている。我々は、(*)および緑色線で各構造体からのヘリックスのいずれかを強調してきた。スケールバーは20nmである。

図6。ヘリカルトモ3D再との比較。ヒトFVIII-LNT(A)とブタFVIII-LNT(C)ヘリカル3D再構成がperpeを示している螺旋軸にndicular。各単位セルと個々のヘリックスは、図5のように色分けされている。B。とD。螺旋軸に対して垂直に見た3Dトモグラフィ再構成の密度表現がある。 FVIII分子の螺旋配置を反映した2次元格子が緑色の線で示されている。
| SAMPLES | CLNT | hFVIII-LNT | pFVIII-LNT |
| 初期顕微鏡写真 | 61 | 474 | 542 |
| 初期パーティクル·セット | 29113 | 60395 | 64665 |
| デフォーカス(NM) | -4051±502 | -3643±737 | -3443±1086 |
| 中間パーティクル·セット | 25907 | 27305 | 22773 |
| 最終的なパーティクル·セット | 25907 | 10455 | 10,430 |
表1。図3にフローチャートに提示されたアルゴリズムを以下の2次元解析の統計情報。
ディスカッション
人間とブタFVIIIの自己組織化、人体に遭遇する条件で脂質ナノチューブ上:この作品では方法論は、高度に相同タンパク質の2膜結合組織を区別するために提示されている。
記載されている手順では、ヒトとブタFVIIIが正常に最も重要なステップである、脂質ナノチューブに螺旋状に整理されています。次の重要なステップは、近い液体N 2温度で瞬間冷凍により薄いアモルファス氷中に試料を保存することです。アモルファス氷と液体窒素温度でサンプルを保存することで水和ヘリカルチューブとタンパク質 - 脂質巨大分子集合体は、生理活性保ちます。最後の重要なステップは、近LN2温度で高解像度の3D構造のために十分な量及び質のクライオEMデータを取得する。近い液体窒素温度でのデータを収集すると、さらに高いV試料の脱水を防ぐ電子ビームから顕微鏡や放射線損傷のacuum。
FVIIIの膜結合構造を計算するには最初の重要なステップは、均質な粒子(らせんセグメント)を得ることで、2Dの基準自由な分類を適用することで設定し、注文の同径、学位を取得したクラスから粒子を配合しています。第二の重要なステップは、ヘリカル再構成のために右の最初の体積とヘリカルパラメータ(上昇と方位角)を課すことである。 3番目と最後の重要なステップは、(課せられた対称性なし)ヘリカルおよび電子断層撮影と同じ標本の復元によって得られた3次元地図データを比較することにより、らせん構造を検証することです。
提示方法は、近生理的条件で膜結合タンパク質の機能的構成を解決するその能力において独特である。我々の研究室で開発され、LNTができます正常に機能的な膜結合型血液凝固因子の螺旋組織のためのプラットフォームとして使用され、膜結合型二次元結晶及び単一粒子として編成FVIIIに対するより良好な分解能を達成する。我々の目標は、さらに、最終的な粒子の組の均一性および品質を改善することにより、我々のヘリカル再構成の分解能を増加させることである。 FVIII-LNTらせん状フィラメントの優れた低温電子顕微鏡条件(電界放出電子銃、エネルギーフィルタ、DEカメラ検出器)でより多くの低温電子顕微鏡顕微鏡写真を収集し、それゆえ、2D再構成のために、より大きな初期粒セットは、これを達成するなど、。 FVIII-LNTヘリカルアセンブリと3次元再構成アルゴリズムを改善することは私たちは、サブナノメートルと明確に血液凝固タンパク質のこの重要な膜結合組織を定義する原子分解能近くを得ることを可能にする。
螺旋状に相同FVIIIフォームを整理することも私たちに機会を与え配列の相違は、構造および機能の違いに相関させることができる方法を特徴づけるティ。この資料に記載された方法によって、ヒトとブタFVIIIの膜結合構造の解決は、変更されたときは、組換え第VIII因子の機能が改善されている、配列を同定することができます。この知識は、両方の血栓止血分野における創薬のための重要な臨床的意義を持つことになります。
開示事項
著者は、彼らが競合する経済的利害関係を持っていないし、彼らがこの原稿に公開された手順のいずれかについて、直接接触させることができることを宣言します。
謝辞
10SDG3500034とUTMB-NCB SSMに資金を起動します。この作品は、米国心臓協会から全国科学者開発助成金によってサポートされています。著者は、シーリーUTMBでの構造生物学研究センター(AT低温電子顕微鏡および科学計算施設を認めるwww.scsb.utmb.edu )だけでなく、博士。 2次元と3次元の螺旋再構成アルゴリズムのヘルプのためのスティーブLudtkeとエドEgelman。
資料
| Name | Company | Catalog Number | Comments |
| JEM2100 with LaB6 | JEOL Ltd. | JEM-2100 | operated at 200 kV |
| with TEMCON software | JEOL Ltd. | ||
| Gatan626 Cryo-holder | Gatan, Inc. | 626.DH | cooled to -175 °C |
| with temperature controler unit | Gatan, Inc. | ||
| Gatan 4K x 4K CCD camera | Gatan, Inc. | US4000 | 4,096 x 4,096 pixel at 15 μm/pixel physical resolution |
| Solarus Model 950 plasma cleaner | Gatan, Inc. | ||
| Vitrobot Mark IV | FEI | ||
| Carbon coated 300-mesh 3 mm copper grid | Ted Pella | 01821 | plasma cleaned for 10 sec on high power |
| Quantifoil R2/2 300 mesh | Electron Microscopy Sciences | Q225-CR2 | Carbon coated 300-mesh Cu grids with 2 mm in diameters holes |
| Uranyl acetate dihydrate | Ted Pella | 19481 | 1% solution, filtered |
| Galactosyl ceramide | Avanti Polar Lipids Inc. | 860546 | |
| Dioleoyl-sn-glycero-phospho-L-serine | Avanti Polar Lipids Inc. | 840035 | |
| EM software Digital Micrograph | Gatan, Inc. | http://www.gatan.com/DM/ | |
| EM software EMAN | free download | http://blake.bcm.edu/emanwiki/EMAN/ | |
| EM software Spider | free download | http://spider.wadsworth.org/spider_doc/spider/docs/spider.html | |
| EM software IHRSR | free download | Programs available from Edward H. Egelman http://people.virginia.edu/~ehe2n/ | |
| EM software (IMOD) | free download | http://bio3d.colorado.edu/imod/ | |
| EM software (SerialEM) | free download | ftp://bio3d.colorado.edu/pub/SerialEM/ | |
| UCSF-Chimera | free download | http://www.cgl.ucsf.edu/chimera/download.html |
参考文献
- Henderson, R. Realizing the potential of electron cryo-microscopy. Quarterly Reviews of Biophysics. 37, 3-13 (2004).
- Fujiyoshi, Y., Unwin, N. Electron crystallography of proteins in membranes. Current opinion in structural biology. 18, 587-592 (2008).
- Toole, J. J., et al. Molecular cloning of a cDNA encoding human antihaemophilic factor. Nature. 312, 342-347 (1984).
- Fay, P. J. Factor VIII structure and function. International journal of hematology. 83, 103-108 (2006).
- Stoilova-McPhie, S., Lynch, G. C., Ludtke, S. J., Pettitt, B. M. Domain organization of membrane-bound factor VIII. Biopolymers. , (2013).
- Pipe, S. W. Hemophilia: new protein therapeutics. Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2010, 203-209 (2010).
- Gatti, L., Mannucci, P. M. Use of porcine factor VIII in the management of seventeen patients with factor VIII antibodies. Thrombosis and haemostasis. 51, 379-384 (1984).
- Parmenter, C. D., Cane, M. C., Zhang, R., Stoilova-McPhie, S. Cryo-electron microscopy of coagulation Factor VIII bound to lipid nanotubes. Biochemical and biophysical research communications. 366, 288-293 (2008).
- Parmenter, C. D., Stoilova-McPhie, S. Binding of recombinant human coagulation factor VIII to lipid nanotubes. FEBS letters. 582, 1657-1660 (2008).
- Wassermann, G. E., Olivera-Severo, D., Uberti, A. F., Carlini, C. R. Helicobacter pylori urease activates blood platelets through a lipoxygenase-mediated pathway. Journal of cellular and molecular medicine. 14, 2025-2034 (2010).
- Wilson-Kubalek, E. M., Chappie, J. S., Arthur, C. P. Helical crystallization of soluble and membrane binding proteins. Methods in enzymology. 481, 45-62 (2010).
- Egelman, E. H. Reconstruction of helical filaments and tubes. Methods in enzymology. 482, 167-183 (2010).
- Lusher, J. M. Development and introduction of recombinant factor VIII--a clinician's experience. Haemophilia : the official journal of the World Federation of Hemophilia. 18, 483-486 (2012).
- Thim, L., et al. Purification and characterization of a new recombinant factor VIII (N8). Haemophilia : the official journal of the World Federation of Hemophilia. 16, 349-359 (2010).
- Doering, C. B., Healey, J. F., Parker, E. T., Barrow, R. T., Lollar, P. High level expression of recombinant porcine coagulation factor VIII. The Journal of biological chemistry. 277, 38345-38349 (2002).
- Tang, G., et al. EMAN2: an extensible image processing suite for electron microscopy. Journal of structural biology. 157, 38-46 (2007).
- Egelman, E. H. A robust algorithm for the reconstruction of helical filaments using single-particle methods. Ultramicroscopy. 85, 225-234 (2000).
- Egelman, E. H. The iterative helical real space reconstruction method: surmounting the problems posed by real polymers. Journal of structural biology. 157, 83-94 (2007).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of structural biology. 152, 36-51 (2005).
- Stoilova-McPhie, S., Villoutreix, B. O., Mertens, K., Kemball-Cook, G., Holzenburg, A. 3-Dimensional structure of membrane-bound coagulation factor VIII: modeling of the factor VIII heterodimer within a 3-dimensional density map derived by electron crystallography. Blood. 99, 1215-1223 (2002).
- Goddard, T. D., Huang, C. C., Ferrin, T. E. Visualizing density maps with UCSF Chimera. Journal of structural biology. 157, 281-287 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved