Method Article
Organización helicoidal de sangre Coagulación Factor VIII en lípidos nanotubos
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta una combinación de crio-microscopía electrónica, la nanotecnología de lípidos, y análisis de la estructura aplicada para resolver la estructura unida a la membrana de dos formas de FVIII altamente homólogas: humanos y porcinos. La metodología desarrollada en nuestro laboratorio para organizar helicoidalmente las dos formas de FVIII recombinantes funcionales en nanotubos de lípidos cargados negativamente (LNT) se describe.
Resumen
Crio-microscopía electrónica (Cryo-EM) 1 es un enfoque poderoso para investigar la estructura funcional de las proteínas y complejos en un entorno de estado y de la membrana hidratada 2.
Factor de coagulación VIII (FVIII) 3 es un multi-dominio de la glicoproteína del plasma sanguíneo. Defecto o deficiencia de FVIII es la causa para el tipo de hemofilia A - un trastorno hemorrágico grave. Tras la activación proteolítica, de FVIII se une a la serina proteasa Factor IXa en la membrana plaquetaria cargados negativamente, lo cual es crítico para la coagulación normal de la sangre 4. A pesar del papel fundamental FVIII juega en la coagulación, la información estructural de su estado unida a la membrana es incompleta 5. Concentrado de FVIII recombinante es el medicamento más eficaz contra la hemofilia tipo A y disponible comercialmente FVIII se puede expresar como ambos forman complejos funcionales con Factor humano IXa 6,7 humana o porcina,. "> En este estudio se presenta una combinación de crio-microscopía electrónica (crio-ME), el análisis de lípidos y la nanotecnología estructura aplicarse para resolver la estructura unida a la membrana de dos formas de FVIII altamente homólogas:. Humano y porcino La metodología desarrollada en nuestro laboratorio para organizar helicoidalmente las dos formas de FVIII recombinantes funcionales en nanotubos de lípidos cargados negativamente (LNT) se describe. Los resultados representativos demuestran que nuestro método es suficientemente sensible para definir las diferencias en la organización helicoidal entre los dos altamente homóloga en secuencia (86% de identidad de secuencia ) proteínas. protocolos detallados para la organización helicoidal, Cryo-EM y tomografía electrónica ET adquisición de datos () se dan. Los dos dimensiones (2D) y tridimensional (3D) análisis de la estructura aplican para obtener las reconstrucciones en 3D de humano y porcino Se discute FVIII-LNT. Las estructuras humanas y porcinas presentados FVIII-LNT muestran el potencial de la metodología propuesta para Calculate la organización funcional, unido a la membrana del Factor VIII de coagulación sanguínea en alta resolución.
Introducción
Factor de coagulación sanguínea VIII (FVIII) es una glicoproteína grande de 2332 aminoácidos organizados en seis dominios: A1-A2-B-A3-C1-C2 3. Tras la activación de trombina de FVIII actúa como cofactor para el factor IXa en el complejo activador unido a la membrana. La unión de FVIII activado (FVIIIa) de FIXa de una manera membrana dependiendo mejora FIXa eficiencia proteolítica más de 10 5 veces, que es crítico para la coagulación de la sangre eficiente 4. A pesar de la importante función de FVIII juega en la coagulación y la formación del complejo tenasa, la estructura de FVIII unido a la membrana funcional todavía no se ha resuelto.
Para hacer frente a esto, los nanotubos única bicapa lipídica (LNT) ricos en fosfatidilserina (PS), capaces de unirse con alta afinidad de FVIII 8, 9 y se asemeja a la superficie de las plaquetas activadas se han desarrollado 10. Organización helicoidal consecutiva de FVIII unido a LNT ha demostrado ser efective para la determinación estructural de estado unida a la membrana FVIII por Cryo-EM 5. Funcionalizado LNT son un sistema ideal para estudiar la proteína-proteína y las interacciones proteína-membrana de proteínas asociadas a la membrana helicoidal organizados por Cryo-EM 11, 12. Cryo-EM tiene la ventaja sobre los métodos estructurales tradicionales tales como la cristalografía de rayos X y RMN, como la muestra se conserva en más cercana a la ambiente fisiológico (tampón, membrana, pH), sin aditivos e isótopos. En el caso del FVIII, el estudio de la estructura unida a la membrana con esta técnica es aún más fisiológicamente relevantes, como la LNT se asemejan estrechamente por tamaño, forma y composición de los pseudópodos de las plaquetas activadas en donde los complejos de tenasa ensamblan in vivo.
Defectos y deficiencia de FVIII causa de la hemofilia A, un trastorno hemorrágico grave que afecta a 1 de cada 5.000 varones de la población humana 4, 6. La mayoría de los eterapia ffective para la Hemofilia A es la administración de toda la vida de FVIII recombinante humano (hFVIII). Una complicación importante de la terapia de FVIII recombinante La hemofilia A es el desarrollo de anticuerpos inhibidores para la forma humana que afecta aproximadamente al 30% de los pacientes de la hemofilia A 13. En este caso, se utiliza FVIII porcino (pFVIII) concentrado, como pantallas de FVIII porcino baja reactividad cruzada con anticuerpos inhibidores contra FVIII y forma complejos funcionales con FIXa humano 7 humana. El establecimiento de la organización unida a la membrana de ambos porcina y formas de FVIII humanos es importante entender las bases estructurales de la función y las repercusiones para la hemostasia sanguínea cofactor FVIII.
En este estudio, se describe una combinación de nanotecnología de lípidos, Cryo-EM, y análisis de la estructura diseñada para resolver la organización unido a la membrana de dos formas de FVIII altamente homólogas. Los datos de Cryo-EM presentados y estructuras 3D para porci helicoidal organizadoFVIII NE y humano cargado negativamente en LNT muestran el potencial de la nanotecnología propuesto como base para la determinación de la estructura de FVIII y factores y complejos en un entorno fisiológico de la coagulación de la membrana unidos a la membrana.
Protocolo
1. Preparación de la muestra
- El cambio de tampón de FVIII humano de BDD-14 y porcino de FVIII BDD-15 contra el tampón HBS-Ca (HEPES 20 mM, NaCl 150 mM, CaCl2 5 mM, pH = 7,4) y se concentran a 1,2 mg / ml. Mantenga la solución de proteína a -80 ° C.
- Preparar nanotubos de lípidos (LNT) mezclando galactosilceramida (GC) y fosfatidilserina (PS) en 01:04 w / w proporción en cloroformo. Evaporar el cloroformo en atmósfera de argón y solubilizar los lípidos en tampón HBS a 1 mg / ml. Mantenga la solución LNT a 4 ° C.
2. Cryo-Microscopía Electrónica de FVIII-LNT
- Cryo-EM Preparación de la muestra
- Resplandor de descarga de la malla 300 Quantifoil R2 / 2 rejillas de cobre (laterales de carbono a) en una mezcla de O 2 y H 2 gas durante 10 segundos a 50 W.
- Mezclar las soluciones de FVIII y LNT en tampón HBS-Ca al 01:01 w / w proporción y se incuba durante 15 min a temperatura ambiente.
- Aplique una gota de 2,5 lde la muestra de FVIII-LNT a la red de microscopía electrónica hidrófilo en la cámara humidificada Vitrobot Mark IV (100% de humedad).
- Blot y flash congelar la red (una mancha de 3,5 seg, fuerza borraré 1) en el líquido C 2 H 6, enfriados por N2 líquido para obtener hielo amorfo.
- Rejillas tienda en cajas de almacenamiento bajo N2 líquido (LN2).
- Cryo-EM Data Collection
NOTA: El JEM2100-LaB6 (año 2010) está equipada con un sistema operativo Temcon que consiste en un ordenador conectado a la microscopio electrónico, una pantalla con ventanas de lectura del sistema de vacío, sistema de iluminación, HT, corrientes de lentes y de modo-en, y dos paneles: izquierda y derecha, colocada en ambos lados de la columna. El cambio de barras en cruz, perillas Y (SHIFT Y, SIFT Y) y la multifunción (DEF / STIG) perillas están en ambos paneles. En el panel izquierdo es el botón de iluminación (brigthness). En el panel de la derecha se encuentran: la ampliación (MAG / CAM LONGITUD) y enfoque (FOCUS) perillas y los tres imaging (MAG1, MAG2, LOWMAG) y una difracción modos botones (DIF). Adquirimos nuestros datos en MAG1 en alfa 2. Las condiciones mínimas dosis de iluminación (MDS) necesarios para la adquisición de datos Cryo-EM se establecen con botones F1 a F6, fila superior del panel DERECHA. En este protocolo se utiliza la configuración genéricos: F1 - levantar / pantalla inferior, F2 - modo de búsqueda, F3 - modo de enfoque, F4 - Modo PHOTO, F5 - MDS OFF / ON y F6 - RAYO BLANCO, que sirve para proteger la muestra de la radiación dañar al desviar el haz.- Coloque la crio-soporte en la crio-estación y llenar el Dewar del titular y la crio-estación con LN2. Cuando la temperatura llega a -192 ° C, obturador abierto en la punta titular, el lugar previamente congelado rejilla Cryo-EM en el lugar designado y seguro con una abrazadera de anillo.
- Inserte la crio-soporte en el microscopio electrónico. Vuelva a llenar el Dewar de la crio-soporte y la cámara contra el contaminador con LN2. Espere a que el titular se estabilice durante 30 a 60 min. Presione F6 yconvertir el filamento en. Cuando el filamento está saturado, pulse F6 obturador y abra el soporte para ver la cuadrícula.
- Pulse Bajo Mag / alfa 1 (puesta a 200X mag) y localizar zonas con hielo delgado en la parrilla.
- Cambiar al MAG 1/alfa 2 para establecer dosis mínima modo (MDS) y adquirir datos de Cryo-EM a dosis bajas de electrones, sin dañar la muestra.
- Presione F2 para configurar el modo de búsqueda. Set de ampliación a 40.000 x. Agrandar viga con perilla brigtness a dosis mínima de electrones ~ 0.04 e - / Å 2 · s. Presione DIF para cambiar al modo de difracción. Ajuste la longitud de la cámara de 120 cm con mando MAG / CAM LONGITUD. Localiza las zonas de la cuadrícula dentro de las zonas de pre-seleccionados en LOWMAG que tienen nanotubos de lípidos en los agujeros de la película de carbono.
- Presione F4 para establecer el modo de fotos a 40.000 X de aumento y set de iluminación con botón BRILLO en dosis de 16 a 25 e - / A 2 · s. Pulse el botón Estándar Focus para establecer las condiciones de enfoque ajustando la altura Zde la muestra con los botones ARRIBA / ABAJO (Z del panel de control a la derecha). Establecer desenfoque entre -1,5 y -2,5 m.
- Alinear búsqueda y el modo FOTO dibujando un cuadrado en la ventana de Vista en vivo en la pantalla de la cámara digital en modo de búsqueda correspondiente al área a explorar en el modo Foto.
- Presione F3 para configurar el modo de enfoque a 100.000 aumentos. Enfoque de iluminación para cubrir el chip CCD (~ 4 - 5 cm de radio) y fuera del eje para no irradiar el área a explorar en el modo de FOTO. Ajuste de desenfoque a ~ -1,5 y -2,5 m con el botón de enfoque y correcta para el astigmatismo de la imagen con perillas DEF / STIG.
- Seleccione el FVIII-LNT en ser fotografiado en modo BUSCAR mediante la adquisición de imágenes en directo en la ventana de Vista en vivo en la pantalla de la cámara digital. Centre el FVIII-LNT en el cuadrado dibujado en la ventana de vista en directo.
- Grabar una imagen digital de la cámara del CCD en 52.000 magnificación X eficaz y 0,5 segundos de exposición al cambiar a modo Foto y hacer clic en el AcquirBotón E en la micrografía pantalla de la cámara digital. Las condiciones de adquisición de imágenes se establecen como el blanco del haz (PERSIANAS) abierto sólo cuando la imagen se adquiere en el modo Foto.
- Compruebe la calidad y el desenfoque de la imagen adquirida pulsando CTRL-C para obtener una transformada rápida de Fourier (FFT).
3. Reconstrucción 3D
NOTA: El software de análisis de imagen que se utiliza para el análisis 2D y 3D: EMAN2 y IHRSR son de libre acceso. EMAN2 se puede descargar desde http://blake.bcm.edu/emanwiki/EMAN2/Install. El software IHRSR se puede obtener de Profesor Egelman: egelman@virginia.edu. Los refinamientos IHRSR finales se ejecutan en el de Texas Advanced Computing cluster central: http://www.tacc.utexas.edu/ en la Universidad de Texas, Austin. El algoritmo de reconstrucción 3D se muestra en la figura 1 consta de dos pasos principales: En primer lugar la selección de un conjunto homogéneo de segmentos helicoidales (partículas) con la referencia gratuita alignme 2DNT (RFA) algoritmos implementados en EMAN 2, segunda lograr una reconstrucción en 3D basado en los parámetros helicoidales y algoritmos de retroproyección incorporados en IHRSR. El primer paso utiliza los programas desarrollados para la selección de conjuntos de partículas homogéneas para la reconstrucción 3D con sola partícula SPA (algoritmos) para los que EMAN2 ha sido desarrollado y distribuido en concreto: http://blake.bcm.edu/emanwiki/EMAN2. Este paso se ha adaptado a los datos de Cryo-EM. El segundo paso se consigue con el algoritmo IHRSR, que está diseñado específicamente para el tipo de los conjuntos helicoidales obtenidos con las formas de factor VIII recombinantes. Este algoritmo se ha documentado ampliamente a través de la literatura científica 12.
- Realizar el análisis de imágenes en 2D con la científica suite de procesamiento de imágenes EMAN2: http://blake.bcm.edu/eman2/doxygen_html 16 para seleccionar partículas homogénea (segmento helicoidal) juegos para la reconstrucción helicoidal.
- Seleccione micrografías Cryo-EM con straight y bien organizada tubos helicoidales con el software de la cámara digital y herramientas de visualización.
- Invertir, Normalizar y filtrar para los píxeles de rayos X en la GUI e2workflow.py, la reconstrucción de una sola partícula opción (spr): http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2projectmanager
- Importe las imágenes invertidas, normalizados y pixel de rayos X filtrada en la GUI e2helixboxer.py. Seleccione tubos helicoidales FVIII-LNT y segmento de 256 x 256 píxeles (2,9 Å / pix) con 90% de superposición usando: http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2helixboxer
- Evaluar el desenfoque de las micrografías originales y aplicar la función de transferencia de contraste (CTF) corrección (sólo corrección de fase) a los segmentos helicoidales de los mismos micrografías con la opción e2ctf.py incorporado en el e2workflow.py: http://blake.bcm. edu/emanwiki/EMAN2/Programs/e2ctf.
- Generar partículas iniciales (segmentos helicoidales) establece en el GUI e2workflow.py opción - SPR: http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2workflow.
- Calcular los promedios de clase en 2D con el algoritmo e2refine2d.py aplicar referencia libre de clasificación k-mean para seleccionar conjuntos de datos homogéneos con el mismo LNT diámetro y grado de orden helicoidal (Figura 2), siguiendo el guión: 'e2refine2d.py - iter = 8 - naliref = 5 - nbasisfp = 8 - path = r2d_001 - entrada = INPUT.hdf - NCLS = 51 - simcmp = dot - simalign = rotate_translate_flip - classaligncmp = dot - classraligncmp = fase - classiter = 2 - classkeep = 0,8 - classnormproc = normalize.edgemean - classaverager = media - normproj-classkeepsig ', cambiando el valor de este trastorno en consecuencia.
- Clasificar los datos iniciales establecidos en 'NCLS = 151' 150 clases de más de 8 repeticiones con 'classkeep = 0.8', lo que significa que las partículas con menos de 80% de similitud con el promedio de la clase están excluidas de la clase dada. http://blake.bcm.edu/emanwiki/EMAN2/Programs/e2refine2d
- Combinar las partículas de los promedios de la clasecon difracción helicoidal pronunciado en e2display.py para crear conjunto de datos intermedio.
- Clasificar las establecidas en 50 clases de 'NCLS = 51' para diferenciar las clases con el mismo diámetro y el grado de orden de los datos intermedios.
- Combinar las partículas de las clases con el mismo diámetro y grado de orden en e2display.py para crear el conjunto de datos finales para la reconstrucción en tres dimensiones: http://blake.bcm.edu/emanwiki/EMAN2/Programs/emselector.
- Realizar la reconstrucción helicoidal con el algoritmo iterativo helicoidal real espacio Reconstrucción (IHRSR), como se describe en Egelman 17, 18.
- Estimar la subida, Delta Z (A) de la hélice FVIII-LNT Del Fourier transformar combinado de las partículas en el conjunto de datos final.
- Definir el ángulo azimutal ΔΦ (º) mediante la ejecución de mejoras IHRSR paralelas con un Delta Z constante, aumentando ΔΦ de 576; a 60 ° en incrementos de 5 °.
- Correr 100 ciclos IHRSR consecutivos para el grupo con un cilindro sin rasgos como un volumen inicial y los parámetros helicoidales iniciales Delta Z y ΔΦ definidos en 3.2.1 cada dato de finales. y 3.2.2.
- Inspeccione los volúmenes finales de la convergencia de los parámetros helicoidales y la correspondencia entre los promedios de la clase de la clasificación 2D del conjunto final de datos y las proyecciones de la reconstrucción IHRSR final.
- Imponer la simetría de las reconstrucciones en 3D finales, correspondiente a la distribución unidad asimétrica observado en los últimos volúmenes 3D asimétricos: 4 veces para el FVIII humano-LNT y 5 veces para el FVIII porcino-LNT. Ejecute otros 100 ciclos de perfeccionamiento para generar una reconstrucción 3D symmetrized final.
- Calcula la curva de correlación Fourier Shell para ambos volúmenes separando primero los datos correspondientes establecidos en pares e impares: 'e2proc2d.py - split = 2 '. A continuación, ejecute 100 IHRSR refinamientos consecutivos como se describe en 3.2.3. Calcular la FSC de los volúmenes 3D creados a partir de los conjuntos de datos de pares e impares: 'e2proc3d.py evenvolume.mrc fsc.txt - calcfsc = oddmap.mrc'.
- Visualizar y Segmento los volúmenes FVIII-LNT en UCSF quimera.
- Abra los volúmenes finales de la etapa 3.2.5. en UCSF Chimera y establecer el nivel de contorno a 0.005 en el Herramientas> DATOS VOLUMEN> opción Volume Viewer.
- En Herramientas> DATOS VOLUMEN> mapa de segmentos, seleccione el volumen en la pestaña de mapa de segmentos y hacer clic en un segmento a otro volumen.
- Segmentos del Grupo correspondiente a una celda unidad mediante la selección con CTRL + SHIFT y el grupo de clic.
- Colorea los segmentos por celda unidad y la hélice con ACCIONES> opción COLOR destacar las características estructurales.
4. Tomografía electrónica
- Tinción negativa FVIII-LNT Preparación de la muestra
- Prepare muestras FVIII-LNT como para los experimentos de Cryo-EM.
- Las descargas luminiscentes rejilla de cobre recubierta de carbono de malla 300 (lado de carbono hacia arriba) en una mezcla de O 2 y H 2 de gas de 10 segundos a 50 W como para los experimentos de Cryo-EM.
- Aplicar una gota de 2,5 l de suspensión de FVIII-LNT con 6-nm nanopartículas de oro coloidal a la red, secar el exceso de líquido y manchar negativamente por la aplicación de 5 l solución de 1% de acetato de uranilo durante 2 min. Seque el exceso de líquido y secar la rejilla.
- Tomografía electrónica de recopilación de datos
- Transfiera la red en el soporte de inclinación individual.
- Transferir el titular en el microscopio electrónico.
- Recoger serie de inclinación automáticamente con el software SerialEM 19 a los 2 ° incrementos sobre un rango angular de -60 ° a 60 ° y grabar las imágenes con una cámara CCD a 52.000 X magnificación efectiva, -6--10 desenfoque micras y la dosis de electrones de 150 - 170 elementosctrons / A 2 · s por tomografía.
- Tomografía electrónica Reconstrucción de FVIII-LNT
Nota: Reconstruir la serie inclinada pFVIII-LNT y hFVIII-LNT adquirida en 4.2. con la opción Etomo del software IMOD siguiendo el tutorial: http://bio3d.colorado.edu/imod/doc/etomoTutorial.html- El uso de una ventana de terminal, abra la tomografía en 3dmod. http://bio3d.colorado.edu/imod/doc/3dmodguide.html.
- Papelera de la tomografía por 4 con el IMOD BINVOL comando para disminuir el tamaño de la tomografía.
- Seleccionar el ángulo correcto para girar el nanotubo de lípidos a lo largo del eje Y en la tomografía binned usando el comando IMOD ROTATEVOL.
- Gire la tomografía completa con el comando IMOD ROTATEVOL.
- Recortar el nanotubo de lípidos seleccionada orientada a lo largo del eje Y con el comando RESIZE CLIP IMOD.
- Abra la sub-tomografía recortada con 3dmod.
- Haga clic en la tomografía de visualizar la disposición de las moléculas del factor VIII a lo largo delos cortes en el eje Z ya lo largo del eje Y en el volumen sub-tomografía.
Resultados
FVIII porcino recombinante humana y se organizaron con éxito helicoidalmente en carga negativa única LNT bicapa, parecida a la superficie de las plaquetas activadas. La organización helicoidal de la humano y porcino de FVIII-LNT fue consistente a través de las micrografías digitales recogidas (Figura 2). Fueron seleccionados La LNT control y lo humano y tubos helicoidales FVIII-LNT porcinos y segmentados con la GUI e2helixboxer.py y conjuntos de datos iniciales creados con la interfaz gráfica de usuario e2workflow.py, la opción individual de partículas (Tabla 1).
El orden helicoidal de la humano unido a la membrana y porcino de FVIII-LNT se evaluó a partir de la transformada de Fourier de los promedios de clase con la GUI e2display.py (EMAN2) (Figura 3). La bicapa de lípidos en los mejores promedios de clase 2D LNT de control está bien definido. El prospecto interior y exterior y una menor densidad del núcleo hidrófobo de la membrana son claramente visibles ( Figura 3A). La densidad proyectada de las moléculas de humanos y de FVIII porcino unidas a la membrana orientada hacia y perpendicular a la superficie de la membrana está bien definido y muestra claramente las variaciones en la organización helicoidal entre las dos proteínas (Figuras 3B y 3C). El giro más pronunciado para los tubos helicoidales de FVIII-LNT humanos indica que las interacciones proteína-proteína entre las moléculas de FVIII unidas a la membrana adyacentes son consistentemente diferente para las dos formas de FVIII (Figuras 3B y 3C). Las partículas de los promedios de clase que muestran una buena organización helicoidal (patrón de difracción helicoidal) se fusionaron en la GUI e2display.py para formar un conjunto de partículas intermedio (Tabla 1). Las partículas de los conjuntos de partículas intermedias se clasificaron de nuevo en 50 clases con las mismas limitaciones. Las partículas de los promedios de la clase con el mismo diámetro se fusionaron en los datos finalesconjuntos (Tabla 1).
Reconstrucciones en 3D iniciales para el humano y porcino de FVIII-LNT se llevaron a cabo con 1000 partículas representativas de los conjuntos de datos de FVIII-LNT porcina final y humana. Un centenar de iteraciones IHRSR consecutivos se llevaron a cabo para cada reconstrucción en 3D con un cilindro sin rasgos (160 Å interior y diámetro exterior 500 Å), como volumen inicial. La subida axial (Delta Z) calculado a partir de la transformada de Fourier combinada de los segmentos helicoidales (partículas SET) es igual a 41 Å para el FVIII humano-LNT y 36 Å para porcino de FVIII-LNT (Figuras 4A y 4B). El ángulo azimutal inicial (ΔΦ) definida a partir de la búsqueda iterativa se estima en 40.0 ° para el humano FVIII-LNT y al 35,0 ° para el porcino FVIII-LNT. Los volúmenes finales se examinan para la convergencia de los parámetros helicoidales y la correspondencia entre los promedios de clase y proyecciones de la reconstr definitivaucción, también siguiendo los criterios expuestos en el 5. Las reconstrucciones 3D seleccionados y sus correspondientes parámetros helicoidales se imponen como volúmenes iniciales y parámetros helicoidales iniciales para un segundo refinamiento IHRSR de 100 ciclos que convergían a una de cuatro comenzar organización helicoidal para el ser humano FVIII-LNT con Delta Z = 41,1 Å y ΔΦ = 42,0 ° y un niño de cinco comenzar organización helicoidal para el porcino FVIII-LNT con Delta Z = 35,5 Å y ΔΦ = 34,8 °. A finales 100 IHRSR iteraciones que imponen un 4 veces y una simetría helicoidal 5 veces para el porcinos reconstrucciones de FVIII-LNT humana y, respectivamente, se llevan a cabo con volúmenes iniciales y los correspondientes parámetros helicoidales de los últimos refinamientos IHRSR asimétricos (Figuras 4C y 4D). Los volúmenes finales muestran FVIII humano 8 y 10 de FVIII moléculas unidas a la membrana de la especie porcina organizados alrededor del eje de la hélice (Figura 5A). Cada ser humanoMolécula de FVIII se traduce 41,2 Å y girar 42,0 ° de la anterior y cada molécula de FVIII porcino se traduce 35,9 Å y girar 35,2 º con respecto a la anterior, correspondiente a los parámetros helicoidales de las reconstrucciones en 3D finales (Figura 5B).
Las tomografías de electrones reconstruidas confirman la diferencia en la organización helicoidal entre el FVIII-LNT humano y porcino obtenido en las mismas condiciones experimentales. La comparación de las vistas superiores de las tomografías reconstruidos y los volúmenes 3D a partir de la reconstrucción helicoidal visto en la dirección perpendicular al eje helicoidal, valida aún más la exactitud de las reconstrucciones en 3D refinados con los parámetros helicoidales IHRSR (Figura 6). Las dimensiones de la celda unidad de 2D asimétricos para la reconstrucción de FVIII-LNT 3D humana son: a = 17,8 nm, b = 8,2, γ = 84 ° y para la reconstrucción de FVIII porcino-LNT 3D: A =18,4, b = 7,2 y γ = 70 ° (figura 6). Las dimensiones de la celda unidad de FVIII humano organizado en cristales 2D unidas a la membrana son: a = 8,1, b = 7,0 y γ = 67 º, lo que corresponde a la superficie cubierta por una molécula de FVIII visto hacia la superficie de la membrana 20. Al comparar las dimensiones de la celda unidad entre FVIII organizados en 2D y cristales helicoidales indica que tanto las moléculas de FVIII porcino humana y forman dímeros cuando se organiza de forma helicoidal en la superficie LNT.

Figura 1. Diagrama de flujo análisis de Estructura. Los pasos que se siguieron para el análisis de clasificación en 2D basado en algoritmos de alineación de referencia libre implementadas en EMAN2 16 están encerrado en azul. Los pasos seguidos para el análisis 3D lleva a cabo con el verdadero helicoidal iterativo algoritmos de reconstrucción del espacio (IHRSR) están marcadas en rojo. Los ciclos iterativos IHRSR se indican con flechas de trazos.
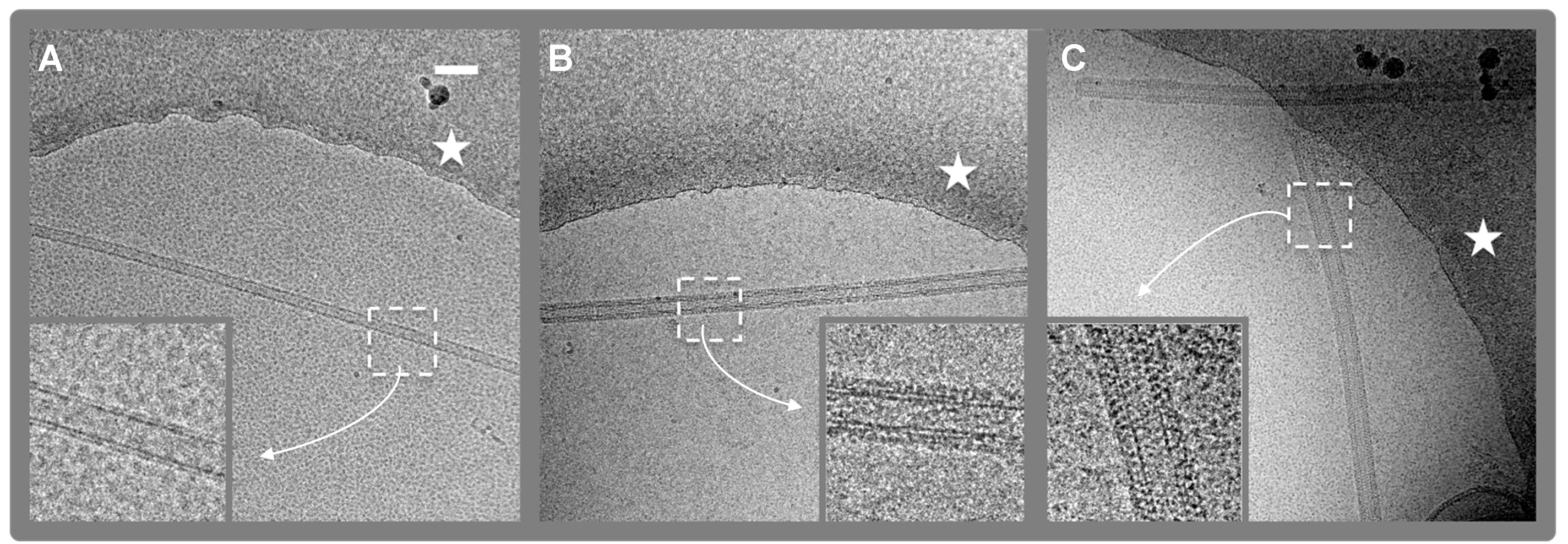
Figura 2. Micrografías Cryo-EM digitales. (4096 x 4096 píxeles, 2,9 Å / pix) de nanotubos de lípidos (LNT) con y sin FVIII unido. A. LNT control. B. humano FVIII-LNT. C. Porcino FVIII-LNT . El borde del agujero en la película de carbono en el que el FVIII-LNT se suspenden en hielo amorfo está indicada con una estrella blanca. Las densidades de proteínas y lípidos están en negro. Las vistas magnificadas (inserciones) de 512 x 512 zonas recortadas (blanco corrió cuadrado) ilustrar la diferencia en la organización helicoidal del FVIII porcino y humano, respectivamente. La barra de escala es de 100 nm.ig2highres.jpg "target =" _blank "> Haga clic aquí para ver una versión más grande de esta figura.
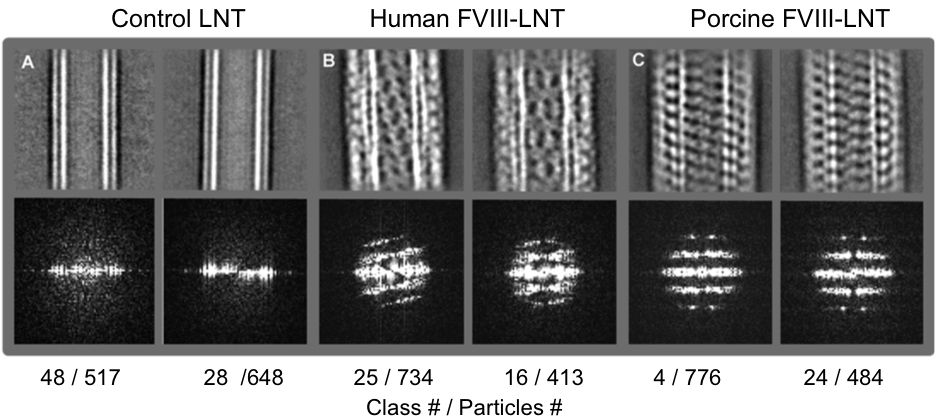
Figura 3. Promedios de clase Representante 2D (fila superior) y transformadas de Fourier correspondientes (fila inferior) de los conjuntos de partículas intermedias (Tabla 1) clasificados en 50 clases. A. Control de LNT B. humano FVIII-LNT C. Porcino FVIII-LNT. El número de clase y el número de partículas incluidas en cada clase se indican. La diferencia con el fin helicoidal entre el FVIII humano y porcino se ve claramente en las imágenes y confirmado por los patrones de difracción obtenidos a partir de las transformadas de Fourier de estas imágenes. Haga clic aquí para ver unaversión más grande de esta cifra.
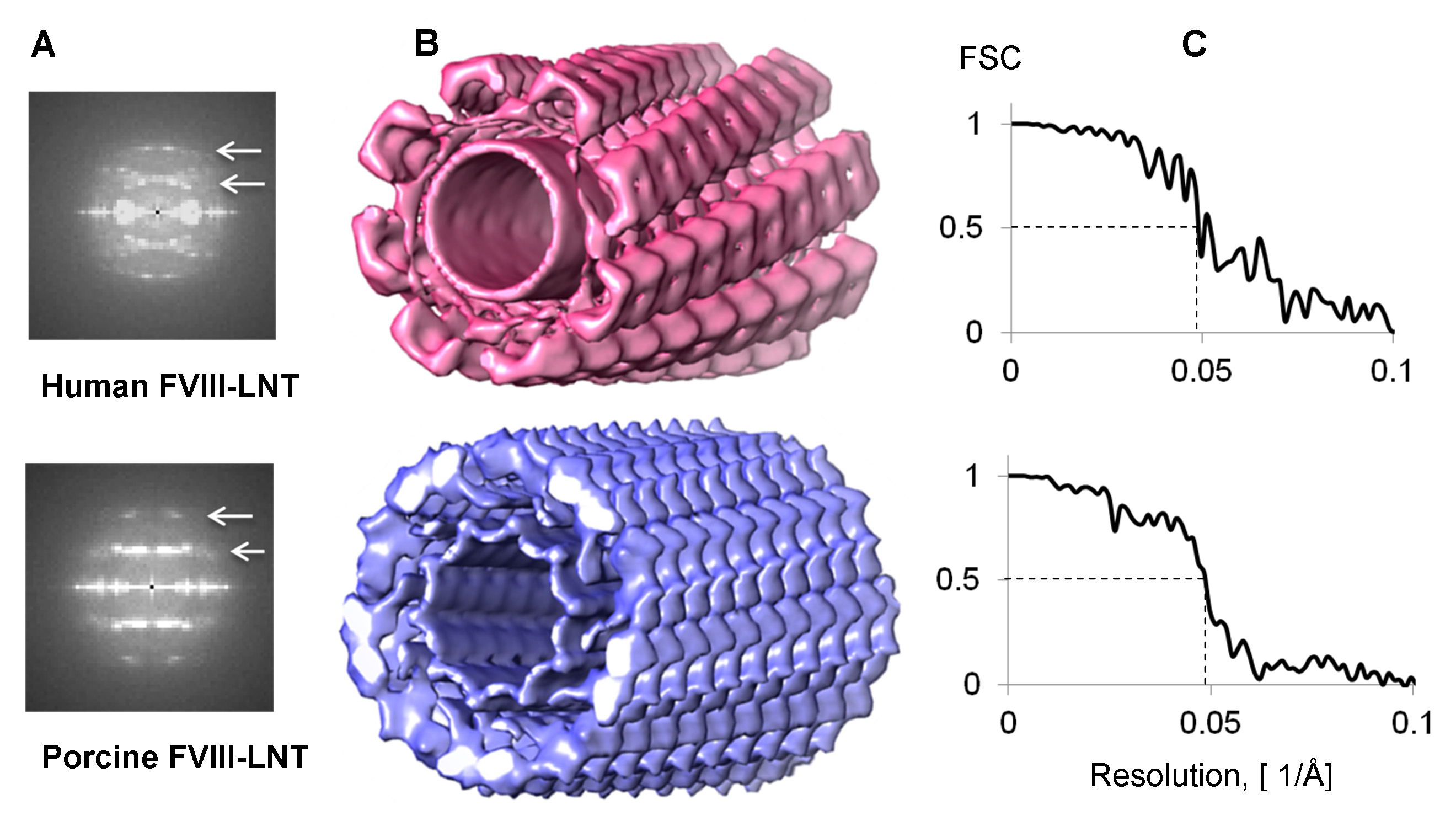
Figura 4. Reconstrucciones helicoidales 3D de humano y porcino FVIII-LNT. A. Combinada transformada de Fourier de 1.000 segmentos helicoidales. La primera y segunda línea de capa se centran en 1/82 a -1 y 1/41 a 1 para FVIII humano-LNT, y en 1/72 a 1 y 1/36 Å -1 para porcino FVIII-LNT (blanco flechas). B. Representación superficial de los derechos humanos en rosa (Delta Z = 41,1 Å, ΔΦ = 42,0 º) y porcino en azul (Delta Z = 35,9 Å, ΔΦ = 35,2 º) reconstrucciones helicoidales FVIII-LNT 3D. Ambos volúmenes se presentan al nivel de 0.005 contorno (densidad mínima es 0 y la máxima densidad de 0,02, según lo calculado en UCSF Chimera, la opción de visor de volumen 21). La longitud del tubo de FVIII-LNT es de 256 píxeles a 2,9 Å / pix. Correlación C. Fourier Shell (FSC) parcelas de uso humano y porcino FVIII-LNT mostrando una resolución de 20,5 Å al FSC = 0,5.

Figura 5. Organización helicoidal de. FVIII-LNT representación de la superficie segmentada humano y porcino de reconstrucciones helicoidales de FVIII-LNT humanos y porcinos, que se muestran en la Figura 4B. Los volúmenes están segmentados después de imponer la simetría de 4 veces a lo humano FVIII-LNT y la simetría de 5 veces al porcino FVIII-LNT. Las unidades asimétricas están codificadas por color amarillo-rojo para el ser humano FVIII-LNT y azul-verde para los porcinos FVIII-LNT. A. Vistas a lo largo del eje de la hélice indicado con un cuadrado para el ser humano y comoun pentágono para el porcino FVIII-LNT. La estructura de FVIII-LNT humana muestra 8 moléculas organizados alrededor de la membrana LNT exterior y la estructura de FVIII porcino muestra 10 moléculas organizados alrededor de la membrana LNT exterior, indican con números. B. Vistas perpendicular al eje de la hélice. El humano FVIII-LNT es un 4-empezar estructura helicoidal y el porcino FVIII-LNT es un 5-empezar estructura helicoidal. La individual hélices de inicio se indican con números y códigos de color. Hemos hecho hincapié en una de las hélices de cada estructura con un (*) y las líneas verdes. La barra de escala es de 20 nm.

Figura 6. Comparación entre los helicoidales y reconstrucciones en 3D de tomografía. El FVIII-LNT humana (A) y porcinos FVIII-LNT (C) reconstrucciones 3D helicoidal se muestran perpendicular al eje helicoidal. Cada celda unidad y hélices individuales están codificadas con colores como en la figura 5. B. y D. son representaciones de densidad de las reconstrucciones de tomografía 3D, vistos perpendicular al eje de la hélice. La celosía 2D que refleja la disposición helicoidal de las moléculas de FVIII se muestra con líneas verdes.
| MUESTRAS | clnt | hFVIII-LNT | pFVIII-LNT |
| Micrografías iniciales | 61 | 474 | 542 |
| Conjuntos de partículas iniciales | 29113 | 60395 | 64665 |
| Desenfoque (nm) | -4051 ± 502 | -3643 ± 737 | -3.443 ± 1.086 |
| Conjuntos de partícula intermedia | 25907 | 27305 | 22773 |
| Conjuntos de partícula final | 25907 | 10455 | 10430 |
Tabla 1. Estadísticas de análisis 2D siguientes el algoritmo presentado en el diagrama de flujo en la Figura 3.
Discusión
En este trabajo se presenta una metodología para diferenciar entre dos organizaciones unidas a la membrana de proteínas altamente homólogas: FVIII humano y porcino auto-ensamblado en nanotubos de lípidos en las condiciones encontradas en el cuerpo humano.
En el procedimiento descrito, humana y FVIII porcino se organizan con éxito helicoidalmente en nanotubos de lípidos, que es el paso más crítico. El siguiente paso fundamental es preservar la muestra en hielo amorfo delgada por el flash de congelación a líquido cerca N2 temperatura. Preservar la muestra en hielo y LN2 amorfa temperatura mantiene los tubos helicoidales hidratados y las asambleas macromoleculares lípido-proteína fisiológicamente activa. El paso crítico final está adquiriendo datos Cryo-EM de cantidad y calidad suficientes para una estructura en 3D de alta resolución a temperatura LN2 próximo. La recopilación de datos a temperatura LN2 cerca impide una mayor deshidratación de la muestra en el alto vacío de los daños microscopio y la radiación del haz de electrones.
Para calcular la estructura unida a la membrana de la de FVIII el primer paso crítico es obtener partículas homogéneas (segmentos helicoidales) mediante la aplicación de conjuntos de clasificación libre de referencia 2D y combinar partículas de clases con el mismo diámetro y grado de orden. El segundo paso crítico es imponer el volumen derecho inicial y los parámetros helicoidales (subida y el ángulo azimutal) para la reconstrucción helicoidal. El tercer y último paso crítico es el de validar la estructura helicoidal mediante la comparación de los mapas en 3D obtenidos por la tomografía helicoidal y electrones (sin simetría impuesta) reconstrucciones de la misma muestra.
La metodología presentada es único en su capacidad para resolver la estructura funcional de las proteínas asociadas a la membrana en condiciones fisiológicas cerca. El LNT desarrollado en nuestro laboratorio puede serutilizado con éxito como una plataforma para la organización helicoidal de factores de coagulación de la sangre unidos a la membrana funcionales y lograr una mejor resolución que para el FVIII organizada en cristales 2D unidas a la membrana y en forma de partículas individuales. Nuestro objetivo es aumentar aún más la resolución de nuestras reconstrucciones helicoidales mediante la mejora de la homogeneidad y la calidad de los conjuntos de partículas finales. Recopilación de más micrografías Cryo-EM en mejores condiciones de Cryo-EM (pistola de emisión de campo, filtrar la energía, detectores de cámaras DE) de FVIII-LNT filamentos helicoidales y por lo tanto incluyendo grandes conjuntos de partículas iniciales para la reconstrucción 2D logrará esto. La mejora de la asamblea helicoidal FVIII-LNT y algoritmos de reconstrucción 3D nos permitirá obtener sub-nanométrica y resolución casi atómica, que inequívocamente definir la organización unida a la membrana de esta crítica para la proteína de la coagulación sanguínea.
La organización de las formas de FVIII helicoidalmente homólogas nos da también la oporTy para caracterizar cómo diferencia en la secuencia se puede correlacionar a las diferencias en estructura y función. La resolución de las estructuras de FVIII membrana humanos y porcinos por los métodos descritos en este artículo puede ayudar a identificar las secuencias, que cuando se modifica mejorará la función de FVIII recombinante. Este conocimiento tiene implicaciones clínicas importantes para el descubrimiento de fármacos en ambos campos Trombosis y Hemostasia.
Divulgaciones
Los autores declaran que no tienen ningún interés financiero en competencia y se les puede contactar directamente con respecto a cualquiera de los procedimientos publicados en este manuscrito.
Agradecimientos
Este trabajo es apoyado por una beca de Desarrollo Nacional Científico de la Asociación Americana del Corazón: 10SDG3500034 y UTMB-BCN en marcha los fondos de SSM. Los autores reconocen las instalaciones Cryo-EM y Computación Científica en el Centro de Sealy de Biología Estructural en UTMB ( www.scsb.utmb.edu ), así como los Dres. Steve Ludtke y Ed Egelman ayuda con los algoritmos de reconstrucción helicoidales en 2D y 3D.
Materiales
| Name | Company | Catalog Number | Comments |
| JEM2100 with LaB6 | JEOL Ltd. | JEM-2100 | operated at 200 kV |
| with TEMCON software | JEOL Ltd. | ||
| Gatan626 Cryo-holder | Gatan, Inc. | 626.DH | cooled to -175 °C |
| with temperature controler unit | Gatan, Inc. | ||
| Gatan 4K x 4K CCD camera | Gatan, Inc. | US4000 | 4,096 x 4,096 pixel at 15 μm/pixel physical resolution |
| Solarus Model 950 plasma cleaner | Gatan, Inc. | ||
| Vitrobot Mark IV | FEI | ||
| Carbon coated 300-mesh 3 mm copper grid | Ted Pella | 01821 | plasma cleaned for 10 sec on high power |
| Quantifoil R2/2 300 mesh | Electron Microscopy Sciences | Q225-CR2 | Carbon coated 300-mesh Cu grids with 2 mm in diameters holes |
| Uranyl acetate dihydrate | Ted Pella | 19481 | 1% solution, filtered |
| Galactosyl ceramide | Avanti Polar Lipids Inc. | 860546 | |
| Dioleoyl-sn-glycero-phospho-L-serine | Avanti Polar Lipids Inc. | 840035 | |
| EM software Digital Micrograph | Gatan, Inc. | http://www.gatan.com/DM/ | |
| EM software EMAN | free download | http://blake.bcm.edu/emanwiki/EMAN/ | |
| EM software Spider | free download | http://spider.wadsworth.org/spider_doc/spider/docs/spider.html | |
| EM software IHRSR | free download | Programs available from Edward H. Egelman http://people.virginia.edu/~ehe2n/ | |
| EM software (IMOD) | free download | http://bio3d.colorado.edu/imod/ | |
| EM software (SerialEM) | free download | ftp://bio3d.colorado.edu/pub/SerialEM/ | |
| UCSF-Chimera | free download | http://www.cgl.ucsf.edu/chimera/download.html |
Referencias
- Henderson, R. Realizing the potential of electron cryo-microscopy. Quarterly Reviews of Biophysics. 37, 3-13 (2004).
- Fujiyoshi, Y., Unwin, N. Electron crystallography of proteins in membranes. Current opinion in structural biology. 18, 587-592 (2008).
- Toole, J. J., et al. Molecular cloning of a cDNA encoding human antihaemophilic factor. Nature. 312, 342-347 (1984).
- Fay, P. J. Factor VIII structure and function. International journal of hematology. 83, 103-108 (2006).
- Stoilova-McPhie, S., Lynch, G. C., Ludtke, S. J., Pettitt, B. M. Domain organization of membrane-bound factor VIII. Biopolymers. , (2013).
- Pipe, S. W. Hemophilia: new protein therapeutics. Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2010, 203-209 (2010).
- Gatti, L., Mannucci, P. M. Use of porcine factor VIII in the management of seventeen patients with factor VIII antibodies. Thrombosis and haemostasis. 51, 379-384 (1984).
- Parmenter, C. D., Cane, M. C., Zhang, R., Stoilova-McPhie, S. Cryo-electron microscopy of coagulation Factor VIII bound to lipid nanotubes. Biochemical and biophysical research communications. 366, 288-293 (2008).
- Parmenter, C. D., Stoilova-McPhie, S. Binding of recombinant human coagulation factor VIII to lipid nanotubes. FEBS letters. 582, 1657-1660 (2008).
- Wassermann, G. E., Olivera-Severo, D., Uberti, A. F., Carlini, C. R. Helicobacter pylori urease activates blood platelets through a lipoxygenase-mediated pathway. Journal of cellular and molecular medicine. 14, 2025-2034 (2010).
- Wilson-Kubalek, E. M., Chappie, J. S., Arthur, C. P. Helical crystallization of soluble and membrane binding proteins. Methods in enzymology. 481, 45-62 (2010).
- Egelman, E. H. Reconstruction of helical filaments and tubes. Methods in enzymology. 482, 167-183 (2010).
- Lusher, J. M. Development and introduction of recombinant factor VIII--a clinician's experience. Haemophilia : the official journal of the World Federation of Hemophilia. 18, 483-486 (2012).
- Thim, L., et al. Purification and characterization of a new recombinant factor VIII (N8). Haemophilia : the official journal of the World Federation of Hemophilia. 16, 349-359 (2010).
- Doering, C. B., Healey, J. F., Parker, E. T., Barrow, R. T., Lollar, P. High level expression of recombinant porcine coagulation factor VIII. The Journal of biological chemistry. 277, 38345-38349 (2002).
- Tang, G., et al. EMAN2: an extensible image processing suite for electron microscopy. Journal of structural biology. 157, 38-46 (2007).
- Egelman, E. H. A robust algorithm for the reconstruction of helical filaments using single-particle methods. Ultramicroscopy. 85, 225-234 (2000).
- Egelman, E. H. The iterative helical real space reconstruction method: surmounting the problems posed by real polymers. Journal of structural biology. 157, 83-94 (2007).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of structural biology. 152, 36-51 (2005).
- Stoilova-McPhie, S., Villoutreix, B. O., Mertens, K., Kemball-Cook, G., Holzenburg, A. 3-Dimensional structure of membrane-bound coagulation factor VIII: modeling of the factor VIII heterodimer within a 3-dimensional density map derived by electron crystallography. Blood. 99, 1215-1223 (2002).
- Goddard, T. D., Huang, C. C., Ferrin, T. E. Visualizing density maps with UCSF Chimera. Journal of structural biology. 157, 281-287 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados