Method Article
In vitro Coculture Assay для оценки патогена индуцированной нейтрофил трансэпителиальной миграции
В этой статье
Резюме
Нейтрофиловая трансэпителиальная миграция в ответ на мукосал бактериальную инфекцию способствует эпителиальной травме и клиническим заболеваниям. В пробирке была разработана модель, которая сочетает в себе патоген, нейтрофилов человека, и поляризованных слоев эпителиальных клеток человека, выращенных на трансуэлл фильтры для облегчения исследований к распутыванию молекулярных механизмов организации этого явления.
Аннотация
Слизистые поверхности служат защитными барьерами против патогенных организмов. Врожденные иммунные реакции активируются при зондировании патогена, что приводит к проникновению тканей с мигрирующими воспалительными клетками, в первую очередь нейтрофилами. Этот процесс может быть разрушительным для тканей, если чрезмерным или провел в нерешенном состоянии. Кокультурные модели in vitro могут быть использованы для изучения уникальных молекулярных механизмов, участвующих в патогенной индуцированной нейтрофиловой трансэпителиальной миграции. Этот тип модели обеспечивает универсальность в экспериментальном дизайне с возможностью контролируемых манипуляций с патогеном, эпителиальным барьером или нейтрофилом. Патогенная инфекция апической поверхности поляризованных эпителиальных монослой, выращенных на проницаемых трансвелловых фильтрах, провоцирует физиологически релевантную базолатерную к апикалиальной трансэпителиальной миграции нейтрофилов, применяемых к базолатеральной поверхности. Описанная в настоящем времени модель in vitro демонстрирует многочисленные шаги, необходимые для демонстрации миграции нейтрофилов через поляризованный эпителиальный монослой легких, который был заражен патогенной P. aeruginosa (PAO1). Описано посев и культивирование проницаемых трансвеллов с эпителиальными клетками легких человека, а также изоляция нейтрофилов от всей человеческой крови и культивирование ПАО1 и непатогенной кишечной палочки K12 (MC1000). Процесс эмиграции и количественный анализ успешно мигрировавших нейтрофилов, мобилизованных в ответ на патогенную инфекцию, показаны на основе репрезентативных данных, включая положительный и отрицательный контроль. Эта модельная система in vitro может быть использована и применена к другим слизистой поверхности. Воспалительные реакции, которые связаны с чрезмерным проникновением нейтрофилов, могут быть разрушительными для тканей организма и могут возникать при отсутствии патогенных инфекций. Лучшее понимание молекулярных механизмов, которые способствуют нейтрофиловой трансэпителиальной миграции путем экспериментальных манипуляций с системой анализа культуры in vitro, описанной в настоящем, имеет значительный потенциал для выявления новых терапевтических целей для целого ряда слизистых инфекционных, а также воспалительных заболеваний.
Введение
Слизистые поверхности служат физическими и иммунологическими барьерами, обеспечивающими защиту от внешних угроз, широко распространенных вокружающей среде 1,2. Этот защитный эпителиальный барьер может быть скомпрометирован, когда патогенные организмы вторгаются2. В случае бактериального патогена, эта встреча часто провоцирует воспалительный процесс, активируя врожденную иммунную систему и вызывая быструю мобилизацию гранулоцитов первого реагирования, известных какнейтрофилов 2-4. Химиотатические агенты, облегчающие набор нейтрофилов, частично вырабатываются слизистыми эпителиальными клетками, стремящихся избавить хозяина отпатогена-нарушителя 2-4. Чрезмерное или неразрешеное нейтрофиловое проникновение слизистой оболочки эпителиальной поверхности может вызватьзначительную патологию 1,5. Это следствие неспецифического повреждения тканей, вызванного антибактериальным нейтрофиловым арсеналом5-7. В таких случаях бактериальная клиренсная способность нейтрофилов омрачается разрушением тканей хозяина во время инфекционного оскорбления. Нарушение функции защитного эпителиального барьера может привести к усилению воздействия основных тканей на микроорганизмы и/или токсины, еще больше усугубивпатологию заболевания 8,9. Эти последствия можно наблюдать в нескольких системах органов, включая легкие и пищеварительныйтракт 1,5. Кроме того, неинфекционные воспалительные заболевания, такие как тяжелые приступы астмы, хроническая обструктивная болезнь легких (ХОБЛ), острый респираторный дистресс-синдром (ARDS) и воспалительные заболевания кишечника (IBD) отмечены патологическим нарушением слизистой эпителиального барьера чрезмерным нейтрофилическимответом 4,5,10-12.
Сложный процесс набора нейтрофилов после слизистой инфекции включает в себя несколько разрозненныхшагов 1,5,13,14. Во-первых, нейтрофиловы должны отойти от циркуляции через ряд взаимодействия клетки с клеткой к клетке, которые облегчают транс-эндотелиальноймиграции 1,13. Нейтрофилов далее перемещаться существующих интерстициального пространства, содержащего внеклеточнойматрицы 1,14. Чтобы достичь люмена инфицированной слизистой оболочки, нейтрофилов должны затем мигрировать черезэпителиальный барьер 1,4,5. Это сложное многоступенчатое явление часто расследуется в совокупности с использованием in vivo животных моделейинфекции 15. Такие модели полезны для установления необходимости конкретных факторов, таких как хемокины, молекулы адгезии, или сигнальные пути, которые участвуют в общем процессе, но в значительной степени недостаточны для решения молекулярных взносов, критически важных для каждого отдельного разобщеногошага 16. Кокультурные системы in vitro, моделируемые транс-эндотелиальные, транс-матрицы, или трансэпителиальной миграции нейтрофилов были особеннополезны в этом отношении 1,14,16,17.
Для расшифровки механизмов, ответственных за нейтрофиловую трансэпителиаловую миграцию в ответ на патогеннуюинфекцию 18-22, разработананадежная система анализа кокультуры. Эта модель включает в себя заражение апической поверхности поляризованных слоев эпителиальных клеток человека бактериальным патогеном с последующим применением свежеиспеченные человеческие нейтрофилы на базолатеральнойповерхности 18-22. Нейтрофилов мигрировать через эпителиальный барьер в ответ на эпителиальные производные химиотатические продукты, выделяется послепатогенной инфекции 18,21-23. Эта модельная система была использована с использованием кишечных и легких эпителиальных культур, подверженных соответствующим тканей конкретных бактериальных патогенов и обнародовал новые молекулярные механизмы, вероятно, важное значение для процесса набора нейтрофиловво время слизистой инфекции 3,8,19,24-28. Сила этой модели совместной культуры in vitro заключается в том, что дрениционистский подход позволяет исследователю экспериментально манипулировать патогеном, эпителиальным барьером и/или нейтрофилом в хорошо контролируемой, высокоразвумной, довольно недорогой системе. Insight, собранные из этого подхода могут быть эффективно использованы для проведения целенаправленного анализа разрозненных событий во время набора нейтрофилов с использованием in vivo инфекции модели 22,29,30.
Эта статья демонстрирует многочисленные шаги, необходимые для успешного создания этой воспроизводимой модели для изучения патогена индуцированной нейтрофиловой трансэпителиальной миграции. Эпителиальные барьеры легких, инфицированные патогеном Pseudomonas aeruginosa, представлены в данной статье; однако, другие эпителии тканей и патогенных микроорганизмов могут быть заменены незначительными изменениями. Посев и культивирование поляризованных слоев эпителиальных клеток легких на перевернутых коллагеновых проницаемых трансуэлловых фильтрах подробно описано в настоящем, как и рост патогенных P. aeruginosa и изоляция нейтрофилов от всей крови. Как эти компоненты объединяются для наблюдения патогена индуцированной нейтрофиловой трансэпителиальной миграции представлен вместе с соответствующими положительными и отрицательными контроля для создания воспроизводимых анализ. Универсальность этого подхода для изучения различных аспектов патогенной индуцированной нейтрофиловой трансэпителиальной миграции обсуждается со ссылкой на конкретные исследования в литературе.
протокол
Шаги (1-3) должны выполняться в стерильной среде под капотом ламинарного потока.
1. Коллагеновое покрытие трансвеллов
- Сделайте раствор коллагена 30 мкг/мл. Разбавить 3 мг/мл коллагенового бульона 1:100 в 60% этанола, который был пройден через блок фильтра 0,2 мкм.
- Вихрь разбавлен раствором 30 мкг/мл. Примечание: Не обязательно вихрь 3 мг / мл коллагена фондовый раствор, так как это решение является довольно вязким и пузырьки воздуха могут быть введены, потенциально снижая точность при пипетке.
- Удалите 0,33см 2 области роста трансвеллов с пор размером 3 мкм от внешней упаковки и поместите 24-хорошо пластины, содержащие 12 трансвеллов вверх дном внутри капота.
- Смойте нижнюю тарелку и отложите в сторону. Примечание: Transwells теперь будет вверх ногами отдыхая на крышке 24-хорошо пластины
- Включите горелку Bunsen. Пламя гемостата для бесплодия и дайте остыть.
- С помощью стерильного гемостата перенесите трансвеллы в чашку Петри диаметром 150 мм х 25 мм, удерживая ее в перевернутом положении. Примечание: Не забудьте сохранить стерильность пустой пластины 24-хорошо плюс крышка, которая будет использоваться для дома трансвеллов, как только они были посеяны с эпителиальными клетками.
- Pipette 70 мкл коллагенового раствора 30 мкг/мл на фильтровальную мембрану каждого перевернутого трансвелла. Примечание: Поверхностное натяжение должно удерживать этот объем раствора на месте, так как вокруг мембраны фильтра нет стенок при доступе к поверхности нижней стороны. Будьте осторожны, чтобы коллагеновый раствор не капал вниз по стороне трансвелла и не перемещал трансвеллы во время процедуры покрытия.
- Оставьте крышку чашки Петри как минимум на 4 часа, чтобы раствор этанола испарился. Для поддержания стерильности во время этого процесса держите вентилятор капота и ультрафиолетовый свет.
- После того, как трансвеллы высохли, они могут быть использованы немедленно или храниться при комнатной температуре до недели при условии, что крышка чашки Петри на месте и стерильность сохраняется.
2. Проход колбы эпителиальных клеток для посева Трансвеллс
(Этот протокол конкретно описывает обработку легочной эпителиальной клеточной линии H292 для генерации эпителиальных барьеров, выращенных на трансвеллах. Другие эпителиальные клеточные линии могут быть использованы с небольшими изменениями.)
- Подготовьте культурную среду, добавив 10% тепловую инактивированную сыворотку плода (HI-FBS) и 1x пенициллин/стрептомицин в RPMI 1640.
- Теплые средства массовой информации, трипсин-ЭДТА (T-EDTA) и D-PBS в водяной бане 37 oC.
- Удалите колбу Т-75, содержащую клетки, из инкубатора и оцените визуальное слияние с перевернутым микроскопом. Примечание: При использовании клеток H292 колбы должны быть близко или полностью совлияться.
- Аспирировать мультимедиа из колбы. Сократите время, что клетки сухие, имея следующее решение в капюшоне с крышкой ослабил.
- Добавьте 5 мл D-PBS в колбу Т-75 и вихрем. Избегайте создания пузырьков. Удалите PBS по устремлениям.
- Добавьте 3 мл T-EDTA в колбу Т-75 и закружить, чтобы покрыть дно.
- Удалите большую часть T-EDTA, оставив примерно 0,3 мл в колбе Т-75.
- Распределите небольшой оставшийся объем T-EDTA по площади поверхности клеток и поместите в увлажненные инкубаторы в стандартных условиях культуры (37 oC, 5% CO2).
- Через некоторое время удалите колбу из инкубатора. Примечание: Клетки должны легко отделяться от поверхности колбы, осторожно нажав колбу на бок. Клетки теперь должны быть округлыми и плавающими при визуализации под микроскопом. Среднее время, затязаемое для ячеек H292, составляет 5-10 мин.
- Добавьте 10 мл культурных средств массовой информации в колбу, чтобы нейтрализовать T-EDTA и повторно использовать ячейки. Нарисуйте клеточный раствор в наконечник пипетки и выброс на поверхность колбы, содержащей клетки примерно пять раз, чтобы повторно использовать все клетки.
- Передача повторного перерасхода клеток в 15 мл трубки для посева трансвеллов. Примечание: Концентрация повторно нажатых клеток H292, подготовленных таким образом, должна варьироваться от примерно 1 х 106-1,8 х 106 клеток/мл.
3. Посев коллагена покрытием Трансвеллс с эпителиальными клетками
- Добавьте 70 мкл повторного клеточного раствора из 15 мл трубки в каждую перевернутую трансвеллу с коллагеновым покрытием. Примечание: Решения клеток H292 с диапазоном концентрации между 1 х10 6-1,8 х 106 клеток / мл даст примерно 70000-120000 клеток / трансвелл.
- Смешайте клеточной подвески, осторожно инвертирования трубки периодически, чтобы предотвратить клетки от урегулирования на дно 15 мл трубки во время посева трансвеллов. Примечание: Не вихревые клетки и будьте осторожны, что наконечник пипетки не вступают в прямой контакт с коллагеновым мембранным фильтром.
- После того, как все перевернутые трансвеллы были посеяны с эпителиальными клетками, заменить Петри крышка чашки и тщательно место в инкубаторе культуры тканей, увлажненной, 37 oC, 5% CO2. Позаботьтесь, чтобы избежать нарушений клеточной подвески, которая была добавлена в мембрану фильтра с коллагеновым покрытием.
- Поддержание перевернутых трансвеллов в инкубаторе культуры тканей, увлажненной, 37 oC, 5% CO2 в одночасье. Примечание: Пузырь жидкости, содержащей клетки, должен оставаться связанным с проницаемой фильтруемой мембраной трансвелла на протяжении всей ночной инкубации. Если фильтровальная мембрана становится сухой из-за испарения жидкости или потому, что жидкость капает вниз стороне трансвеллов, эпителиальные слои не могут расти должным образом.
- На следующий день добавьте 1 мл мультимедиа в оригинальную стерильную пластину 24-колодец и переверните каждый перевернутый трансвелл с помощью стерилизованного гемостата в каждую хорошо содержащую 1 мл мультимедиа.
- Добавить 0,2 мл средств массовой информации в верхней камере каждого трансвелла и вернуться к культуре ткани инкубатор, увлажненной, 37 oC, 5% CO2.
- Перевернутые трансвеллы H292 могут использоваться от 8 дней до 1 месяца после посева. Примечание: Мы предлагаем ждать как минимум 8 дней после посева трансвеллов, чтобы убедиться, что эпителиальные монослойщики полностью сформированы и обладают функциональным барьером. Можно проверить эпителиальный барьер H292, определив, способен ли монослой ограничить трансэпителиальный поток белка редиса peroxidase (HRP) после добавления к базолатеральной поверхности18.
4. Подготовка бактерий к инфекции эпителиальных слоев на трансвеллах
- За день до эксперимента извлекайте одну колонию P. aeruginosa PAO1 из пластины Pseudomonas Isolation Agar и одну колонию K12 E. coli MC1000 из пластины Luria-Bertani (LB) Agar и поместите в отдельные трубки, содержащие 3 мл бульона LB. ВНИМАНИЕ: P. aeruginosa является патогеном человека, стандартные меры безопасности BSL2 должны быть приняты при обращении с этим организмом.
- Встряхните на ночь при 225 об/мин в среде 37 oC.
- На следующий день удалите 1 мл из плотных бактериальных культур и поместите в 1,5 мл трубок Эппендорфа.
- Спин в микрофуге при 15800 х г в течение 5 мин, а затем удалить супернатант.
- Заранее подготовьтесь к сбалансированному соляной раствору Hanks с кальцием и магнием (HBSS). Добавьте 23,8 г HEPES и 97,5 г порошка HBSS к 9,5 л дистиллированной воды. Добавьте в раствор небольшие количества 10 M NaOH, одновременно отслеживая рН до тех пор, пока не будет достигнут стабильный рН 7,4. Довекаем объем до 10 л и храним при 4 oC.
- Повторное производство каждой бактериальной гранулы с 1 мл HBSS. Vortex, чтобы быть уверенным, что даже бактериальная суспензия достигается.
- Спин снова на 15800 х г в течение 5 мин и удалить супернатант.
- Повторное производство гранул PAO1 с 0,6 мл HBSS и гранул MC1000 с 0,5 мл HBSS. Вихрь бактериальных суспензий.
- Дальнейшее разбавление PAO1 и MC1000 перерасход гранул 1:100 в HBSS. Например, добавьте 50 мл 0,6 мл гранул PAO1, перерасходуемых на 5 мл HBSS. Примечание: Использование оптических измерений плотности (OD) для определения плотности культуры, а также стандартной единицы формирования колонии (CFU) методологии разбавления, PAO1 и MC1000 решения, подготовленные таким образом, последовательно дают между 3 х10 7-6 х 107 CFU/ml. Плотность бактериальной культуры положительно коррелирует с измерением ОД культуры на уровне 600 нм, и эта корреляция может быть использована для оценки концентрации бактериальных клеток. Для подтверждения концентрации бактериальных клеток, культура может быть разбавлена до очень низкой предполагаемой концентрации и поцаралена на агарной пластине таким образом, что можно было бы ожидать, между 30-200 бактериальных клеток, которые присутствуют на пластине. Клетки распространяются по всей пластине и инкубируется в одночасье при 37 oC таким образом, что каждая клетка образует индивидуальную колонию клеток, которая достаточно велика, чтобы быть видимой и колонии могут быть подсчитаны.
5. Изоляция нейтрофилов от целой крови
- Кислотный раствор декстрозы (ACD) используется в качестве антикоагулянта и готовится путем добавления 6,9 г лимонной кислоты, 12,5 г цитрата натрия и 10 г декстрозы до 500 мл дистиллированной воды. После растворения всех компонентов раствор ACD стерилизуется, проходя через блок фильтра 0,2 мкм. Храните раствор ACD при 4 oC.
- Перед рисованием крови добавьте 5 мл ACD в 50 мл шприца и прикрепите 21 х 3/4 Г иглы бабочки с 12 в трубках.
- Нанесите турникет, протрите вену алкоголем и вставьте иглу. Примечание: Любой протокол исследования с участием людей должен быть одобрен институциональным советом по обзору, и от каждого донора крови должно быть предоставлено письменное информированное согласие. Например, эксперименты, проведенные с использованием этого протокола, были одобрены Советом по институциональному обзору больницы штата Массачусетс и назначен протокол #1999-P-007782.
- Медленно нарисуйте 45 мл крови, гарантируя, что кровь смешивается с ACD один раз в шприце.
- Когда 45 мл было нарисовано (50 мл общего объема), развязать турникет перед удалением иглы. Немедленно нанесите давление на рану стерильной марлей при снятии иглы.
- Передача крови медленно вниз стороне 50 мл трубки в течение примерно 5-10 сек.
- Спин в центрифуге при температуре 1000 х г с отключенным тормозом в течение 20 минут при комнатной температуре. Примечание: Дополнительный шаг, включающий разбавление всей крови в PBS- и тщательное наложение разбавленной крови на Ficoll-Paque до центрифугации могут быть использованы для достижения несколько более высокого уровня чистоты нейтрофилов более эффективно отделяя баффи пальто от гранулоцитов8. Опуская этот шаг служит, чтобы сэкономить время без резкого воздействия урожайности или чистоты для целей этого анализа, и, таким образом, мы выступаем за не включая наложения крови на Ficoll-Paque шаг.
- В то время как кровь вращается, очень медленно добавить 1 г желатина в 50 мл подогревом Хэнкса сбалансированный раствор соли без кальция и магния (HBSS(-)) для подготовки 2% желатина раствора. Держите раствор при 37 oC.
- Аспират и отбросить плазму из 50 мл трубки крови с помощью стеклянной пипетки отзыв, который был обработан с Sigmacote.
- Продолжайте аспирировать очень тщательно, чтобы удалить баффи пальто, которое содержит белые кровяные тельца, в том числе лимфоцитов.
- По мере того как buffy пальто медленно удаляется, беловатый желтый облачный материал над слоем красной кровяных телец (РБК) исчезнет. Прекратите стремление, как только баффи пальто удаляется и слой РБК может быть четко визуализированы при просмотре сверху трубки.
- Старайтесь не беспокоить слой РБК, так как гранулоциты, в основном нейтрофиловы, находятся вблизи поверхности слоя РБК, но не видны.
- К объему 15 мл слоя РБК добавьте 30 мл теплого 2% желатина (2x объем слоя РБК).
- Инвертировать трубку осторожно смешивать, заботясь, чтобы свести к минимуму образование пузырьков.
- Инкубация при 37 oC в течение 25 мин. Примечание: РБК должны агрегировать и осесть на дно. В качестве альтернативы желатину, большой молекулярный вес dextrans может быть использован для осадка РБК8.
- После инкубации перенесите верхний слой светло-красноватого раствора, который содержит гранулоциты, в новую 50-млную трубку с пипеткой, будьте осторожны, чтобы не нарушить оседлый темный слой РБК во время передачи. После того, как отделены, отбросить темный слой РБК.
- Спин передается свет красноватый раствор, содержащий гранулоциты и некоторые РБК в центрифуге на 1000 х г с тормозом активируется в течение 10 мин при комнатной температуре для того, чтобы гранулы клеток.
- Слейте или аспирировать супернатант тщательно, как красноватые гранулы клеток, которые образуют следующие центрифугации, как правило, свободно.
- Подготовь буфер рбк лиза заранее и храните при 4 oC, добавляя 8,29 г хлорида аммония (NH4Cl), 1 г бикарбоната натрия (NaHCO3)и 0,038 г ЭДТА до 1 л дистиллированной воды в стакане. Храните буфер РБК лиза при 4 oC.
- Resuspend и разбить красноватые гранулы клеток с небольшим объемом холодного буфера РБК лиза. Как только гранулы клетки в растворе, заполните трубку до 50 мл буфером РБК лиза. Примечание: На данный момент и идти вперед, держать клетки на льду или при 4 oC.
- Спин в центрифуге при 300 х г в течение 10 мин при 4 oC, а затем слить или аспирировать супернатант. Примечание: Супернатант будет несколько красноватый, содержащий лизные РБК. Гранулы должны быть желтовато-белыми в этой точке. Если в гранулах остаются значительные РБК, как указано в красноватой грануле, шаг 5.20-5.21 может быть повторен. Значительные РБК остаются в клеточной грануле, если красноватые гранулы из шага 5.20 недостаточно разбиты.
- Resuspend и разбить беловатые гранулы с небольшим объемом HBSS (-), а затем заполнить трубку до 50 мл с HBSS (-). Примечание: HBSS (-) и не HBSS должны быть использованы для повторного перерасхода беловатых гранул клеток. HBSS (-) не хватает кальция и магния.
- Спин снова в центрифуге при 300 х г в течение 10 мин при 4 oC.
- Слейте супернатант и повторно посовелите гранулы до конечного объема 1 мл HBSS (-).
- Добавьте 5 мкл 1 мл клеточной суспензии до 250 мкл HBSS (-) в трубке 1,5 мл Eppendorf и аккуратно смешайте вверх и вниз по пипетке.
- Добавьте 25 мкл разбавленной клеточной суспензии до 25 мкл 0,4% Трипан синий.
- Добавьте 12 мкл смеси с каждой стороны стандартного гемоцитометра.
- Подсчитайте количество живых клеток, которые исключили трипан синий краситель и присутствуют в среднем квадрате обеих сторон гемоцитометра.
- Чтобы рассчитать концентрацию клеток, умножьте среднее значение 2 квадрата на 100 (разбавленный фактор), а затем умножьте на 104, чтобы дать количество клеток/мл.
- Отрегулируйте окончательную концентрацию до 5 х 107 клеток/мл. Если больше 5 х 107 ячеек/мл, отрегулируйте, добавив HBSS (-). Если меньше, гранулы клеток и повторного в соответствующий объем.
- Держите клетки на льду до готовности к миграции анализа. Примечание: Эти клетки представляют популяцию гранулоцитов белых кровяных телец. Большинство гранулоцитов, изолированных от всей человеческой крови, являются нейтрофилами. Клетки хранятся на льду, подвешенном в HBSS (-) до тех пор, пока не будет добавлена миграционная анализ для поддержания клеток в состоянии тихие.
6. Подготовка эпителиальных слоев клеток для анализа миграции
(Этишаги не должны выполняться в стерильном капюшоне.)
- Удалить из инкубатора 24-хорошо пластины поддержки эпителиальных слоев, которые были культурно на нижней части мембраны трансвелл фильтра, по крайней мере восемь дней.
- Возьмитесь за край каждого трансвелла с гемоста, поднимите из 24-хорошо пластины и инвертировать трансуэлл над ведро отходов, чтобы отбросить культуры средств массовой информации из внутренней камеры трансвелла. Окуните каждый трансвелл в стакан для мытья, содержащий HBSS, чтобы заполнить внутреннюю камеру трансвелла HBSS. Выбросьте жидкость из внутренней камеры в ведро с отходами.
- Повторите шаг 6.2 для второй стирки в HBSS. После двух моет, поместите трансвеллы в новую пластину из 24-колодец, содержащую 1 мл HBSS в каждой хорошо. Примечание: Все мойки должны быть выполнены с HBSS, который нагревается до 37 oC.
- Наблюдайте верхнюю камеру каждого трансвелла для оценки целостности эпителиального слоя клеток. Примечание: HBSS не должен просачиваться в верхнюю камеру трансвелла и заполняться при размещении в колодец пластины из 24-х колодец, содержащей 1 мл HBSS.
- После тщательного наблюдения за каждым трансвеллом добавьте 0,2 мл HBSS в верхнюю камеру.
- Поместите в инкубатор при 37 oC, 5% CO2 во влажной камере в течение 30-60 минут, чтобы уравнотворить эпителиальные слои клеток.
7. Нейтрофил Трансэпителиальный миграционный анализ
- Удалите из инкубатора 24-хорошо пластины промытых трансвеллов, уравновешенных в HBSS.
- Возьмитесь за каждый трансвелл с гемостата и отбросить жидкость в верхней хорошо в ведро отходов.
- Поместите каждый трансвелл вверх дном в 150 мм х 25 мм Петри блюдо.
- К шести перевернутым Трансвеллам добавьте 25 мкл HBSS. Для трех перевернутых трансвеллов, заразить 25 йл P. aeruginosa (PAO1) разбавленной в HBSS, подготовленных, как описано в шаге 4. К заключительным трем перевернутым трансвеллам, заразить 25 йл кишечной палочки K12 (MC1000), разбавленной в HBSS, подготовленных, как описано в шаге 4. Это примерно 0,8 х 106-1,5 х 106 CFUs / эпителиальный слой для каждого бактериального вида, поскольку концентрация бактериальных растворов, подготовленных в шаге 4 составляет примерно 3 х 107-6 х 107 CFU/ml.
- Инкубация при 37 oC, 5% CO2 во влажной камере в течение 60 мин.
- Подготовка fMLP в качестве положительного контроля для миграции нейтрофилов, добавив 5 мкл из 10 мМ fMLP запасов до 5 мл HBSS, давая 10 МКМ решение.
- Вымойте трансвеллы, схвяв с гемостата и листать обратно в 24-хорошо мыть пластины, которая содержит 1 мл HBSS в нижних камерах. Добавьте 0,2 мл HBSS в верхние камеры.
- Возьмитесь за трансвелл с гемоста и снимите с первой пластины стирки. Перед размещением трансвеллов во вторую 24-хорошо вымытую пластину, содержащую 1 мл HBSS, выбросьте жидкость из верхней камеры в ведро с отходами. Добавьте 0,2 мл HBSS в верхнюю камеру.
- Повторите шаги 7.8 еще раз в общей сложности 3 моет. Примечание: Все трансвеллы должны подвергаться одинаковому режиму обработки и мытья, независимо от того, были ли они инфицированы бактериями, чтобы гарантировать, что все трансвеллы, подвергаемые анализу, манипулировали одним и тем же способом. 60 мин инфекции либо PAO1 или MC1000 не снижает жизнеспособность или изменить барьерные свойства монослойного H292, как оценивается лактат дегидрогеназы на основе токсикологического анализа и HRP поток анализа,соответственно 18,22.
- Приготовьте 24-хорошо миграционную пластину, добавив 1 мл HBSS в 12 скважин 24-хорошо пластины. Примечание: Эта пластина может быть подготовлена заранее.
- После третьей стирки выбросьте жидкость из верхних камер трансвеллов в ведро с отходами с помощью гемостата и поместите три неинфицированных трансвеллы в три скважины 24-колодной миграционной пластины, содержащей 1 мл HBSS, что представляет собой отрицательный контроль.
- Pipette 10 хл 10 МК раствора fMLP в каждой из трех скважин 24-ну миграционной пластины, содержащей 1 мл HBSS (100 нм).
- Поместите три неинфицированных трансвеллов в три скважины 24-ну миграционной пластины, содержащей 100 нм fMLP, что представляет собой положительный контроль за способностью изолированных нейтрофилов мигрировать.
- Поместите три трансвелла, инфицированных PAO1, и три трансвелла, инфицированных MC1000, в три скважины каждая, соответственно, из 24-ну миграционная пластина, содержащая 1 мл HBSS. Добавьте 0,1 мл HBSS в верхнюю камеру каждого трансвелла.
- В дополнение к 0,1 мл HBSS в каждом трансвелле, осторожно добавьте 20 мкл нейтрофиловой суспензии (5 х 107 клеток/мл), подготовленных, как описано в шаге 5. Примечание: Это представляет приблизительно 1 x 106 нейтрофилов/трансвеллов.
- Инкубация при 37 oC, 5% CO2 во влажной камере в течение 2 часов, чтобы позволить трансэпителиальной миграции нейтрофилов.
- Подготовь стандартную кривую для определения количества нейтрофилов, которые мигрировали через 2 часа. Добавьте 40 мкл подвески нейтрофила (5 x 107 клеток/мл) в 2 мл HBSS () и перенесите 1 мл в 1 мл HBSS () и выполните серийные 2 раза разбавления восемь дополнительных раз в общей сложности 10 стандартов, начиная от приблизительно 2000 клеток/мл до 1 х 106 ячеек/мл. Включите 1 мл HBSS (я) для пустого.
- После 2 часов миграции поднимите трансвеллы, схвячаясь гемоста и осторожно коснитесь внутренних стен 24-хорошой миграционной пластины. Откажитесь от трансвеллов.
- Оцените миграцию нейтрофилов в скважинах, просматривая скважины 24-хорошой миграционной пластины под перевернутым микроскопом с помощью цели 10X (см. рисунок 1 для изображений мигрирующих нейтрофилов в каждом условии).
- Добавьте 50 мкл 10% тритон X-100 к каждому хорошо используется в 24-ну миграционной пластины, каждый стандарт, и пустой.
- Поверните 24-хорошо миграционную пластину, стандарты и пустой на низкой скорости в течение 20 минут при 4 oC.
- Подготовь 1 М цитрат буфера заранее. Добавьте 52,5 г лимонной кислоты и 73,5 г цитрата натрия в 400 мл дистиллированной воды в стакане. Доведи рН до 4,2. Добавьте дистиллированную воду для окончательного раствора 500 мл. Храните раствор при 4 oC.
- Приготовьте в этот день субстратное решение ABTS. Добавьте 3 таблетки ABTS (по 10 мг каждая) и 5 мл буфера 1 м цитрата в 45 мл дистиллированной воды. Разрешить таблетки полностью раствориться в растворе. Удержание добавления 50 мкл 30% перекиси водорода до тех пор, пока не будет необходим субстратный раствор ABTS (см. шаг 7.27).
- Добавьте 50 мкл буфера цитрата к каждому хорошо используемому в 24-ну миграционной пластине, каждому стандарту и пустой.
- Передача 100 мкл каждого образца хорошо в дублировать на 96-хорошо пластины. Примечание: Очень важно тщательно смешивать содержимое в каждом образце задолго до перехода к пластине 96-колодец. Pipette раствор вверх и вниз, по крайней мере пять раз до передачи.
- Передача 100 мкл каждого стандарта и пустой на 96-хорошо пластины после смешивания (пустой в дубликате).
- Добавьте 50 мкл 30% перекиси водорода в раствор ABTS и вихрь.
- Добавьте 100 мкл субстратного раствора ABTS к каждому образцу на пластине из 96 колодец.
- Разрешить пластины развиваться в течение 5-10 минут в темноте. Примечание: Зеленый цвет должен развиваться в определенных скважинах, коррелирующих с количеством нейтрофилов, присутствующих в каждой скважине.
- Читайте на длине волны 405 нм с помощью микроплечница читателя.
- Рассчитайте количество нейтрофилов, которые мигрировали через эпителиальный слой, используя стандарты, при которых существует линейная положительная корреляция между известными числами нейтрофилов, подготовленных в качестве стандартов, и количеством активности пероксидасы, измеряемой оптической плотностью в 405 нм (см. рисунки 2 и 3 для репрезентативных данных). Примечание: Этот метод количественной оценки нейтрофила использует большое количество пероксидазы деятельности выставлены нейтрофилов из-за экспрессии миелопероксидазы. Можно рассматривать альтернативные подходы к количественной оценке нейтрофилов, такие как методы, включающие предрассовую нейтрофилы с радиоактивностью или соединениями флуоресценции.
Результаты
Несколько исследований показали, что патогенные эпителиальные слои облегчают нейтрофиловую трансэпителиаловуюмиграцию 3,8,19,24-28,31,32. Это происходит через патоген-специфической индукции эпителиальных клеток полученных нейтрофилов хемотаксического градиента3,23. Например, патогенные P. aeruginosa взаимодействующих с апической поверхности легких эпителиальных клеток вызывает значительное количество нейтрофилов мигрировать черезэпителиальный слой 18,22,25,26,33,34. Эта клинически релевантная система анализа может манипулировать во многих отношениях, чтобы раскрыть ключевые патогена и принимающей молекулярных вкладчиков в паре с соответствующими контроля.
Нейтрофилов, добавленных в поляризованные эпителиальные слои клеток, которые не были прединфицированы, не мигрируют в заметных количествах. Тем не менее, применение химио-привлекающих градиента через неинфицированный эпителиальный слой приведет значительное количество нейтрофилов в поперечнике. Важно включить как эти отрицательные, так и положительные меры контроля соответственно в каждый анализ при расследовании миграции нейтрофилов через патогенные инфицированные эпителиальные слои. Отрицательный контроль устанавливает фоновое количество нейтрофилов, которые пересекают эпителиальный слой при отсутствии сигнала. Это число должно быть очень низким, когда культурные эпителиальные клетки установили функциональный барьер. Высокая фоновая миграция усложняет интерпретацию результатов, достигнутых с помощью патогенно-инфицированного эпителия. Положительный контроль включает в себя применение градиента нейтрофилового химио-притягательного, таких как фМЛП через эпителиальный слой и служит для подтверждения того, что изолированные нейтрофилов являются функциональными. Кроме того, в случае, если эпителиальные слои предварительно обработана определенными реагентами для оценки их воздействия на патогенную трансэпителиаловую миграцию, градиент фМЛП служит для контроля за любыми эффектами, которые реагент может оказать на способность нейтрофилов ориентироваться в эпителианом слое независимо от патогенного опосредованного воздействия. Дополнительный контроль, часто используемый в этой системе анализа включает в себя инфекцию эпителиальных слоев с непатогенными бактериями параллельно с патогеном. Этот контроль может быть использован для различения соответствующих эпителиальных реакций после взаимодействия с бактериями, а также для оказания помощи в выявлении патогенных факторов, необходимых для стимулирования нейтрофиловой трансэпителиальной миграции.
Нейтрофиловую трансэпителиаловую миграцию можно оценить как качественно, так и количественно. По завершении инкубации 2 часа после добавления нейтрофилов к базолатеральной поверхности, трансвеллы удаляются и нейтрофилы, которые мигрировали полностью через эпителиальный слой в апиальной камере можно увидеть в нижней скважине 24-хорошо миграционной пластины. Репрезентативное изображение каждого состояния отображается на рисунке 1, визуализировавомс помощью перевернутого светового микроскопа. Было отмечено, что очень немногие нейтрофилы мигрируют через неинфицированный эпителиальный слой без навязанного химиотаксического градиента (HBSS) и представляют фоновые уровни в анализе(рисунок 1A). В отличие от этого, обилие трансмигратных нейтрофилов было очевидно, когда градиент fMLP предоставляется(рисунок 1B). Инфекция эпителия непатогенной кишечной палочкой MC1000 привела к нескольким видимым трансмигратным нейтрофилям, в то время как многие трансмигратные нейтрофилов наблюдались, когда эпителиальные слои были инфицированы легочной патогенной P. aeruginosa (PAO1) (рисунки 1C и 1D).
Нейтрофилов, которые мигрировали в эксперименте количественно путем измерения их активности миелопероксидазы. Стандартная кривая используется для оценки количества трансмигратных нейтрофилов. Количество нейтрофилов положительно коррелирует с количеством активности пероксидазы, измеряемой после лиза нейтрофилов со значениями, демонстрировали линейную связь в диапазоне нейтрофиловых чисел, выбранных для стандартной кривой (2 x 103-1 x 106 клеток/мл)(рисунок 2). Значительное число нейтрофилов мигрируют через эпителиальные слои в ответ на предоставленный градиент фМЛП или в ответ на эпителиальный слой, зараженный PAO1 (Рисунок 3). Количество нейтрофилов, мигрирующих при отсутствии стимулов (HBSS) или после апической эпителиальной инфекции с непатогенной кишечной палочкой MC1000, ниже предела обнаружения анализа(рисунок 3). Данные, представленные на рисунке 3, представляют среднее число трансмигратированных нейтрофилов с барами ошибок, представляющими стандартное отклонение трех независимых скважин/условий. Количественные данные, изображенные на рисунке 3, согласуются с репрезентативными изображениями, отображаемыми на рисунке 1.
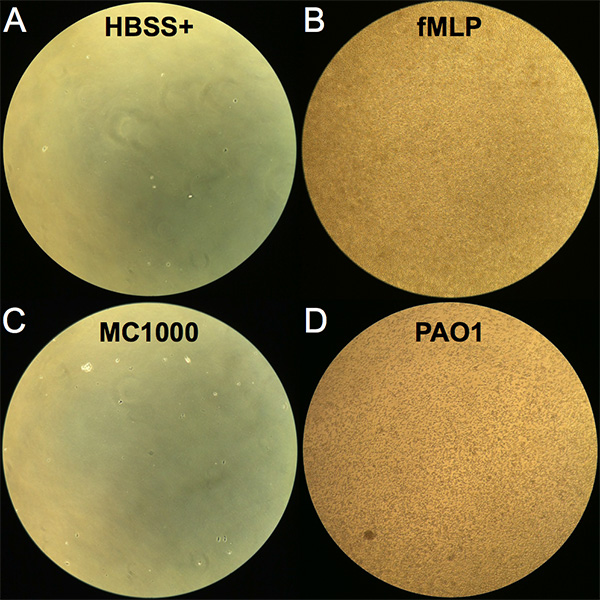
Рисунок 1. Изображение нейтрофилов после трансэпителиальной миграции. Изображения были просмотрены с перевернутым световым микроскопом при 10X увеличении нижней хорошо (апиальной камеры) 24-хорошо миграционной пластины после 2 часов инкубационного периода с нейтрофилов добавил к верхней хорошо (базолатеральная камера). (A)Отрицательный контроль HBSS. (B) Положительный контроль введен fMLP хемотаксического градиента. (C)Эпителиальные слои клеток, инфицированные непатогенной кишечной палочкой K12 (MC1000). (D)Эпителиальные слои клеток, инфицированные патогенными P. aeruginosa (PAO1). Нажмите здесь, чтобы просмотреть изображение большего размера.
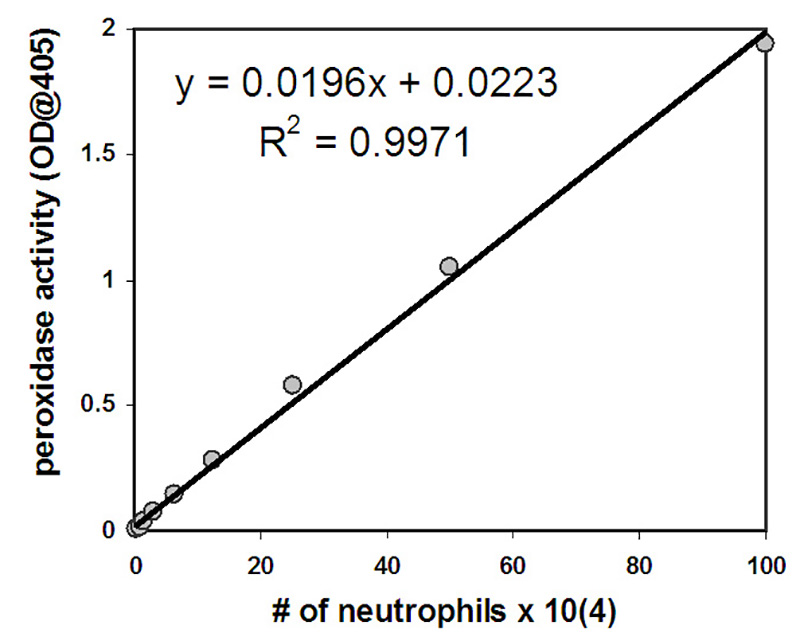
Рисунок 2. Нейтрофилов при стартовой концентрации 1 х 106 подверглись девяти 2-кратным разбавлениям. После лиза было определено количество пероксидазной активности и на хоси было на графике количество нейтрофилов с активностью пероксидазы. Изображенное уравнение может быть использовано для определения количества нейтрофилов, присутствующих в каждом из них после трансмиграции, на основе количества пероксидазы, измеряемой в каждой из них.
Нажмите здесь, чтобы просмотреть изображение большего размера.

Рисунок 3. Количественная оценка трансмигратных нейтрофилов. Количество трансмигратных нейтрофилов количественно измеряется относительной активностью миелопероксидазы до линейной стандартной кривой известных чисел нейтрофилов. Значительное количество трансмигратных нейтрофилов наблюдалось после эпителиальной клеточной инфекции с патогенной P. aeruginosa (PAO1) или создания апикала базолатерального градиента нейтрофилового химио-привлеченного фМЛП. Необнаруживаемое количество трансмигратных нейтрофилов наблюдалось после эпителиальной клеточной инфекции с непатогенной обработкой E. coli K12 (MC1000) или только отрицательным буфером контроля (HBSS). Нажмите здесь, чтобы просмотреть изображение большего размера.
Обсуждение
Миграция нейтрофилов через слизистые эпителиальные поверхности является общей чертой в патологии заболеваний после заражения бактериальными патогенами3. Методология, описанная в настоящем, предлагает быстрый, простой подход к экспериментальной изоляции этого дискретного события с помощью человеческой клетки, полученной в пробирке системы анализа, что модели особенность воспалительного процесса, вызванного бактериальными инфекциями. Эта система была первоначально разработана с использованием поляризованных кишечных эпителиальных клеток, инфицированных кишечных патогенов, включая salmonella typhimurium, Shigella flexneri, и различные патогенные кишечнойпалочки 8,19,24,27,28. Каждый из этих патогенных организмов способен управлять нейтрофилами через поляризованные кишечные эпителиальные монослойные, выращенные на перевернутых коллагеновых проницаемых трансвелл-фильтрах. Эта экспериментальная система была адаптирована с изменениями для изучения легких эпителиальных барьеров и патогена индуцированной нейтрофиловой трансэпителиальноймиграции 18,26. Несколько дыхательных путей эпителиальных клеточных линий, кроме H292 были использованы для этих исследований, включая обычно цитируется A549, BEAS-2B, и Calu-3 легких эпителиальных клеточныхлиний 22,26. P. aeruginosa провоцирует воспаление в легких, вызывая значительный ущерб, характеризующий такие заболевания, как острая пневмония имуковисцидоз 35,36. Как описано, легочный патоген P. aeruginosa легко вызывает нейтрофиловую трансэпителиальную миграцию при инфицировании легких эпителиальными клетками, что является заметной особенностью воспалительного процесса, наблюдаемого при пневмонии и муковисцидозе. Кроме того, несколько дополнительных штаммов P. aeruginosa в том числе клинических изолятов от муковисцидоза пациентов были проверены в качестве индукторов в этоманализе 25. Стрептококковая пневмония и Klebsiella pneumoniae, Грам-положительные и Грам-отрицательные бактериальные патогены, соответственно, обычно связаны с пневмонией и, как было показано, способны вызывать нейтрофиловую трансэпителиальную миграцию с помощью модели совместной культуры in vitro26,32. Таким образом, эта модельная система предлагает надежный подход in vitro с использованием клеток, полученных человеком, для изучения воспалительных процессов, инициированных слизистых патогенов.
Стандартные модели культуры тканей, часто используемые для изучения взаимодействий патогенов-хозяина, как правило, используют эпителиальные клетки, выращенные на плоских пластиковыхповерхностях 16. Анализ совместной культуры in vitro предлагает большую степень сложности, обеспечивая универсальность в экспериментальномдизайне 16,37,38. Поляризованные эпителиальные клетки, выращенные на нижней стороне проницаемых трансвелловых фильтров, создают апикал-отсек, который выходит на нижнюю камеру при размещении в 24-хорошой пластине и базолатерном отсеке, который выходит на внутреннюю верхнюючасть колодец трансвелла 14,17. Эта дискретная разобщенность и направленная ориентация позволяет проводить анализ физиологических базолатеральных к апической миграции нейтрофилов в ответ на навязанные или эпителиальные клеточные химиотатическиеградиенты 14,17,23. Система совместного развития in vitro позволяет изучат конкретные молекулярные механизмы, связанные с трансэпителиальной миграцией, которые могут быть трудно решить в сложной среде in vivo модели легочной инфекции1,15. Любой вывод, касающийся выявления ключевых факторов, участвующих в нейтрофиловой трансэпителиальной миграции с использованием модели совместной культуры in vitro, впоследствии может быть подтвержден на актуальность с использованием моделей in vivo острой пневмонии 15,22.
Анализом культуры in vitro можно манипулировать множеством способов для изучения целого ряда явлений. Исследования, ориентированные на бактериальные гены, способствующие набору нейтрофилов, могут быть проведены путем анализа имеющихся библиотек мутантовна конкретные патогенные микроорганизмы, представляющие интерес 25,39,40. Гены, выявленные в результате такого анализа, могут представлять собой новые факторы вирулентности и потенциальные терапевтические цели для противоинфекционых агентов. Нейтрофил также может представлять собой фокус анализа. Например, нейтрофилов используют несколько молекул адгезии поверхности клеток для облегчения трансэпителиальноймиграции 5,14,34,41,42. Ключевые взаимодействия от клетки к клетке могут варьироваться в зависимости от химио-притяганной движущей миграции и ткани, с которой нейтрофиловвзаимодействуют 34. Нейтрофилов можно предварительно обработать ингибиторами, антителами или антагонистами до оценки патогенной индуцированной трансэпителиальной миграции с целью выявления поверхностных молекул или сигнальных путей, которые имеют решающее значение дляэтого процесса 22,34. Эпителиальные клетки играют важную роль во время инфекции и воспаления, чувствуя сигналы и общаясь с иммунными клетками через растворимыепосредники 43. Сигнальные пути, поляризованная секреция химио-притягателей и эпителиальные молекулы адгезии поверхности, взаимодействующие с бактериями или нейтрофилами, которые влияют на патогенную индуцированную нейтрофиловую трансэпителиаловую миграцию, могут быть исследованы с помощью анализа культуры in vitro. Применение этой модели кокультуры показало важность ранее неотрещенного липидного эйкозаноидного химио-притязанного, известного как геоксилин А3,18,21. ГепоксилинА 3 вырабатывается как легкими, так и кишечными эпителиальными клетками в ответ на инфекцию конкретными патогенами и отвечает за вождение нейтрофилов через поляризованный эпителиальный монослой от базолатерального к инфицированной апическойстороне 3. Таким образом, анализ культуры in vitro служит надежным исследовательским инструментом с потенциалом для выявления критических механизмов, которые являются посредниками взаимодействия принимающей патогенов и организовать воспаление. Кроме того, эта модельная система может быть адаптирована в качестве подхода к скринингу с высокой пропускной способностью для оценки эффективности селективных противоинфекционых или противовоспалительных препаратов.
Суммируем, мы предоставляем подробный пошаговой протокол для изучения миграции нейтрофилов через монослой патоген-инфицированных слоев эпителиальных клеток легких, выращенных на проницаемых трансуэлльных фильтрах. Методы, описанные в этом документе, могут быть изменены для изучения миграции нейтрофилов через другие слизистые поверхности, где нейтрофилов проникают в состояния болезни, такие как желудочно-кишечный тракт или мочеполовой тракт. Кроме того, идеи, полученные с помощью системы анализа культуры in vitro, вероятно, имеют отношение к широкому спектру воспалительных заболеваний, не вызванных конкретными инфекционными агентами. Воспалительные заболевания слизистых поверхностей, которые имеют нейтрофилов пересечения защитного эпителиального барьера в патологической степени включают ХОБЛ, ОРДС, астма, и IBD5,10-12. Более глубокое понимание молекулярных механизмов, регулирующих трансэпителиаловую миграцию нейтрофила, скорее всего, будет информировать терапевтические стратегии, направленные на облегчение разрушительных воспалительных процессов, связанных с этими распространенными заболеваниями, предоставляя новые возможности для улучшения здоровья человека.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана финансово NIH (1 R01 AI095338-01A1).
Материалы
| Name | Company | Catalog Number | Comments |
| NCl-H292 cells | ATCC | CRL-1848 | |
| RPMI-1640 medium | ATCC | 30-2001 | |
| Pseudomonas aeruginosa PAO1 | ATCC | #47085 | |
| Escherichia coli MC1000 | ATCC | #39531 | |
| D-PBS (1x) liquid | Invitrogen | 14190-144 | without calcium and magnesium |
| Heat Inactivated Fetal bovine serum | Invitrogen | 10082-147 | 10% added to culture medium |
| Penicillin-Streptomycin | Invitrogen | 15140-122 | 100x: 10,000 units of penicillin and 10,000 µg of streptomycin per ml. |
| Trypsin-EDTA (0.05%) | Invitrogen | 25300-062 | 50 ml aliquots are stored frozen at -20 ºC. Aliquot in use can be stored at 4 ºC short-term. |
| Hank's Balanced Salt Solution - HBSS(-) | Invitrogen | 14175-079 | Sterile, without calcium and magnesium |
| Trypan Blue Solution | Invitrogen | 15250-061. | Stock = 0.4% |
| Collagen, Rat Tail | Invitrogen | A10483-01 | Can also be isolated in the laboratory directly from the tails of rats using standard protocols |
| Citric acid | Sigma-Aldrich | C1909-500G | Component of 1 M citrate buffer and acid citrate dextrose (ACD) solution |
| Sodium Citrate | Sigma-Aldrich | S4641-500G | Component of 1 M citrate buffer |
| Dextrose anhydrous | Sigma-Aldrich | D8066-250G | Component of acid citrate dextrose (ACD) solution |
| Ammonium Chloride | Sigma-Aldrich | 213330-500G | Component of red blood cell (RBC) lysis buffer |
| Sodium bicarbonate | Sigma-Aldrich | S6014-500G | Component of red blood cell (RBC) lysis buffer |
| EDTA | Sigma-Aldrich | ED-100G | Component of red blood cell (RBC) lysis buffer |
| HBSS(+) powder | Sigma-Aldrich | H1387-10L | Key component of HBSS+ |
| HEPES | Sigma-Aldrich | H3375-500G | Component of HBSS+ |
| Sigmacote | Sigma-Aldrich | SL2-25ML | Follow vendor instructions to coat glass pipette tips |
| Triton X-100 | Sigma-Aldrich | T-9284 | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) | Sigma-Aldrich | A9941-50TAB | Key component of ABTS substrate solution |
| 30% Hydrogen Peroxide Solution | Sigma-Aldrich | H1009-100ML | Component of ABTS substrate solution |
| N-Formyl-Met-Leu-Phe (fMLP or fMLF) | Sigma-Aldrich | F-3506 | A Stock solution of 10 mM in DMSO should be prepared and aliquots stored at -20 ºC. |
| Gelatin Type B | Fisher Scientific | M-12026 | |
| Pseudomonas isolation agar | Fisher Scientific | DF0927-17-1 | Follow manufacturer’s instructions to make PIA plates |
| Ficoll-Paque PLUS | Fisher Scientific | 45-001-749 | Optional, can improve neutrophil purity |
| Name of Material / Equipment | Company | Catalog Number | Comments |
| 24-well migration plate | Corning Incorporated | #3524 | |
| 24-well wash plate | Falcon | 35-1147 | Can be reused if soaked in 70% ethanol and washed thoroughly prior to reuse |
| 96-well plate | Fisher Scientific | #12565501 | |
| Transwell Permeable Supports | Corning Incorporated | #3415 | Polycarbonate; Diameter: 6.5 mm; Growth area: 0.33 cm2; Dish style: 24-well plate; Pore size: 3.0 µm |
| Petri dish | Falcon | 35-1013 | Each Petri dish holds 24 inverted 0.33 cm2 Transwells. |
| 500 ml 0.2 μm filter / flask | Fisher Scientific | 09-740-25A | To sterilize acid citrate dextrose (ACD) solution |
| 5-3/4 in glass Pasteur pipette | Fisher Scientific | 13-678-20A | Coat tips with Sigmacote prior to use |
| Hemostat | Fisher Scientific | 13-812-14 | Curved, Serrated |
| Invertoskop Inverted Microscope | Zeiss | #342222 | |
| Versa-Max Microplate Reader | Molecular Devices | #432789 |
Ссылки
- Burns, A. R., Smith, C. W., Walker, D. C. Unique structural features that influence neutrophil emigration into the lung. Physiol. Rev. 83, 309-336 (2003).
- Hurley, B. P., McCormick, B. A. Intestinal epithelial defense systems protect against bacterial threats. Curr. Gastroenterol. Rep. 6, 355-361 (2004).
- McCormick, B. A. Bacterial-induced hepoxilin A3 secretion as a pro-inflammatory mediator. FEBS J. 274, 3513-3518 (2007).
- Mumy, K. L., McCormick, B. A. The role of neutrophils in the event of intestinal inflammation. Curr. Opin. Pharmacol. 9, 697-701 (2009).
- Chin, A. C., Parkos, C. A. Pathobiology of neutrophil transepithelial migration: implications in mediating epithelial injury. Annu. Rev. Pathol. 2, 111-143 (2007).
- Segel, G. B., Halterman, M. W., Lichtman, M. A. The paradox of the neutrophil's role in tissue injury. J. Leukoc. Biol. 89, 359-372 (2011).
- Weiss, S. J. Tissue destruction by neutrophils. N. Engl. J. Med. 320, 365-376 (1989).
- Hurley, B. P., Thorpe, C. M., Acheson, D. W. Shiga toxin translocation across intestinal epithelial cells is enhanced by neutrophil transmigration. Infect. Immun. 69, 6148-6155 (2001).
- Kohler, H., et al. Salmonella enterica serovar Typhimurium regulates intercellular junction proteins and facilitates transepithelial neutrophil and bacterial passage. Am. J. Physiol. Gastrointest. Liver Physiol. 293, 178-187 (2007).
- Gane, J., Stockley, R. Mechanisms of neutrophil transmigration across the vascular endothelium in COPD. Thorax. 67, 553-561 (2012).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol. Med. 17, 293-307 (2011).
- Nakagome, K., Matsushita, S., Nagata, M. Neutrophilic inflammation in severe asthma. Int. Arch. Allergy Immunol.. 158 Suppl 1, 96-102 (2012).
- Choi, E. Y., Santoso, S., Chavakis, T. Mechanisms of neutrophil transendothelial migration. Front. Biosci. 14, 1596-1605 (2009).
- Louis, N. A., Campbell, E., Colgan, S. P. Model systems to investigate neutrophil adhesion and chemotaxis. Methods Mol. Biol. 412, 257-270 (2007).
- Craig, A., Mai, J., Cai, S., Jeyaseelan, S. Neutrophil recruitment to the lungs during bacterial pneumonia. Infect. Immun. 77, 568-575 (2009).
- Hurley, B. P., McCormick, B. A. Translating tissue culture results into animal models: the case of Salmonella typhimurium. Trends Microbiol. 11, 562-569 (2003).
- Lee, W. Y., Chin, A. C., Voss, S., Parkos, C. A. In vitro neutrophil transepithelial migration. Methods Mol. Biol. 341, 205-215 (2006).
- Hurley, B. P., Siccardi, D., Mrsny, R. J., McCormick, B. A. Polymorphonuclear cell transmigration induced by Pseudomonas aeruginosa requires the eicosanoid hepoxilin A3. J. Immunol. 173, 5712-5720 (2004).
- McCormick, B. A., Colgan, S. P., Delp-Archer, C., Miller, S. I., Madara, J. L. Salmonella typhimurium attachment to human intestinal epithelial monolayers: transcellular signalling to subepithelial neutrophils. J. Cell Biol. 123, 895-907 (1993).
- McCormick, B. A., et al. Surface attachment of Salmonella typhimurium to intestinal epithelia imprints the subepithelial matrix with gradients chemotactic for neutrophils. J. Cell Biol. 131, 1599-1608 (1995).
- Mrsny, R. J., et al. Identification of hepoxilin A3 in inflammatory events: a required role in neutrophil migration across intestinal epithelia. Proc. Natl. Acad. Sci. U.S.A. 101, 7421-7426 (2004).
- Tamang, D. L., et al. Hepoxilin A(3) facilitates neutrophilic breach of lipoxygenase-expressing airway epithelial barriers. J. Immunol. 189, 4960-4969 (2012).
- McCormick, B. A., Parkos, C. A., Colgan, S. P., Carnes, D. K., Madara, J. L. Apical secretion of a pathogen-elicited epithelial chemoattractant activity in response to surface colonization of intestinal epithelia by Salmonella typhimurium. J. Immunol. 160, 455-466 (1998).
- Boll, E. J., et al. Enteroaggregative Escherichia coli promotes transepithelial migration of neutrophils through a conserved 12-lipoxygenase pathway. Cell Microbiol. 14, 120-132 (2012).
- Hurley, B. P., et al. The two-component sensor response regulator RoxS/RoxR plays a role in Pseudomonas aeruginosa interactions with airway epithelial cells. Microbes Infect. 12, 190-198 (2010).
- Hurley, B. P., Williams, N. L., McCormick, B. A. Involvement of phospholipase A2 in Pseudomonas aeruginosa-mediated PMN transepithelial migration. Am. J. Physiol. Lung Cell Mol. Physiol. 290, L703-L709 (2006).
- McCormick, B. A., Siber, A. M., Maurelli, A. T. Requirement of the Shigella flexneri virulence plasmid in the ability to induce trafficking of neutrophils across polarized monolayers of the intestinal epithelium. Infect. Immun. 66, 4237-4243 (1998).
- Savkovic, S. D., Koutsouris, A., Hecht, G. Attachment of a noninvasive enteric pathogen, enteropathogenic Escherichia coli, to cultured human intestinal epithelial monolayers induces transmigration of neutrophils. Infect. Immun. 64, 4480-4487 (1996).
- Agbor, T. A., Demma, Z. C., Mumy, K. L., Bien, J. D., McCormick, B. A. The ERM protein, ezrin, regulates neutrophil transmigration by modulating the apical localization of MRP2 in response to the SipA effector protein during Salmonella typhimurium infection. Cell Microbiol. 13, 2007-2021 (2011).
- Pazos, M., et al. Multidrug resistance-associated transporter 2 regulates mucosal inflammation by facilitating the synthesis of hepoxilin A3. J. Immunol. 181, 8044-8052 (2008).
- Agace, W. W., Patarroyo, M., Svensson, M., Carlemalm, E., Svanborg, C. Escherichia coli induces transuroepithelial neutrophil migration by an intercellular adhesion molecule-1-dependent mechanism. Infect. Immun. 63, 4054-4062 (1995).
- Bhowmick, R., et al. Systemic Disease during Streptococcus pneumoniae Acute Lung Infection Requires 12-Lipoxygenase-Dependent Inflammation. J. Immunol. , (2013).
- Hurley, B. P., Pirzai, W., Mumy, K. L., Gronert, K., McCormick, B. A. Selective eicosanoid-generating capacity of cytoplasmic phospholipase A2 in Pseudomonas aeruginosa-infected epithelial cells. Am. J. Physiol. Lung Cell Mol. Physiol. 300, 286-294 (2011).
- Hurley, B. P., Sin, A., McCormick, B. A. Adhesion molecules involved in hepoxilin A3-mediated neutrophil transepithelial migration. Clin. Exp. Immunol. 151, 297-305 (2008).
- Frank, D. W. Research Topic on Pseudomonas aeruginosa, Biology, Genetics, and Host-Pathogen Interactions.. Front. Microbiol. 3, 20 (2012).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Lung infections associated with cystic fibrosis. Clin. Microbiol. Rev. 15, 194-222 (2002).
- Bucior, I., Mostov, K., Engel, J. N. Pseudomonas aeruginosa-mediated damage requires distinct receptors at the apical and basolateral surfaces of the polarized epithelium. Infect. Immun. 78, 939-953 (2010).
- Kierbel, A., et al. Pseudomonas aeruginosa exploits a PIP3-dependent pathway to transform apical into basolateral membrane. J. Cell Biol. 177, 21-27 (2007).
- Lee, C. A., et al. A secreted Salmonella protein induces a proinflammatory response in epithelial cells, which promotes neutrophil migration. Proc. Natl. Acad. Sci. U.S.A. 97, 12283-12288 (2000).
- Zurawski, D. V., Mumy, K. L., Faherty, C. S., McCormick, B. A., Maurelli, A. T. Shigella flexneri type III secretion system effectors OspB and OspF target the nucleus to downregulate the host inflammatory response via interactions with retinoblastoma protein. Mol. Microbiol. 71, 350-368 (2009).
- Brazil, J. C., et al. Neutrophil migration across intestinal epithelium: evidence for a role of CD44 in regulating detachment of migrating cells from the luminal surface. J. Immunol. 185, 7026-7036 (2010).
- Lawrence, D. W., et al. Antiadhesive role of apical decay-accelerating factor (CD55) in human neutrophil transmigration across mucosal epithelia. J. Exp. Med. 198, 999-1010 (2003).
- Hodges, K., Hecht, G. Interspecies communication in the gut, from bacterial delivery to host-cell response. J. Physiol. 590, 433-440 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены