Method Article
In vitro Ensayo de cocultivo para evaluar la migración transepitelial de neutrófilos inducida por patógenos
En este artículo
Resumen
La migración transepitelial del neutrófilo en respuesta a la infección bacteriana de la mucosa contribuye a lesión epitelial y a la enfermedad clínica. Se ha desarrollado un modelo in vitro que combina patógenos, neutrófilos humanos y capas polarizadas de células epiteliales humanas cultivadas en filtros transwell para facilitar las investigaciones hacia el desentrañamiento de los mecanismos moleculares que orquestan este fenómeno.
Resumen
Las superficies mucosas sirven como barreras protectoras contra organismos patógenos. Las respuestas inmunitarias innatas se activan al detectar patógenos que conducen a la infiltración de tejidos con células inflamatorias migratorias, principalmente neutrófilos. Este proceso tiene el potencial de ser destructivo para los tejidos si es excesivo o se mantiene en un estado no resuelto. Los modelos ines vitro cocultivos se pueden utilizar para estudiar los mecanismos moleculares únicos implicados en la migración transepitelial inducida por patógenos neutrófilos. Este tipo de modelo proporciona versatilidad en el diseño experimental con la oportunidad de manipulación controlada del patógeno, barrera epitelial o neutrófilo. La infección patógena de la superficie apical de monocapas epiteliales polarizadas crecidas en los filtros permeables del transwell instiga la migración basolateral a apical fisiológico relevante del transporte-epitelial de neutrófilos aplicados a la superficie basolateral. El modelo in vitro descrito en este documento demuestra los múltiples pasos necesarios para demostrar la migración de neutrófilos a través de una monocapa epitelial pulmonar polarizada que ha sido infectada con patógeno p. aeruginosa (PAO1). La siembra y el cultivo de transwells permeables con las células epiteliales derivadas humanas del pulmón se describen, junto con el aislamiento de neutrófilos de sangre humana entera y el cultivo de PAO1 y de K12 E. coli no patógeno (MC1000). El proceso de emigración y el análisis cuantitativo de los neutrófilos migrados con éxito que se han movilizado en respuesta a la infección patógena se muestran con datos representativos, incluidos controles positivos y negativos. Este sistema modelo in vitro puede ser manipulado y aplicado a otras superficies mucosas. Las respuestas inflamatorias que implican la infiltración excesiva del neutrófilo pueden ser destructivas a los tejidos del anfitrión y pueden ocurrir en la ausencia de infecciones patógenas. Una mejor comprensión de los mecanismos moleculares que promueven la migración transepitelial del neutrófilo con la manipulación experimental del sistema in vitro del análisis del cocultivo descrito adjunto tiene potencial significativo para identificar las blancos terapéuticas nuevas para una gama de enfermedades infecciosas de la mucosa así como inflamatorias.
Introducción
Las superficies mucosas sirven como barreras físicas e inmunológicas proporcionando protección contra las amenazas externas generalizadas en el medio ambiente1,2. Esta barrera epitelial protectora puede verse comprometida cuando los organismos patógenos invaden2. En el caso de un patógeno bacteriano, este encuentro a menudo instiga un proceso inflamatorio al activar el sistema inmune innato y desencadenar una rápida movilización de granulocitos de primer respondiente conocidos como neutrófilos2-4. Los agentes quimiotácticos que facilitan el reclutamiento de neutrófilos son producidos en parte por las células epiteliales de la mucosa que buscan librar al huésped del patógeno infractor2-4. La infiltración excesiva o no resuelta de neutrófilos en la superficie epitelial de la mucosa puede causar una patología significativa1,5. Esto es una consecuencia del daño tisular inespecífico causado por el arsenal de neutrófilosantibacterianos 5-7. En tales casos, la capacidad de la separación bacteriana de neutrófilos es eclipsada por la destrucción del tejido del anfitrión durante un insulto infeccioso. La interrupción de la función de barrera epitelial protectora puede conducir a una mayor exposición del tejido subyacente a microorganismos y/o toxinas, exacerbando aún más la patología de la enfermedad8,9. Estas consecuencias se pueden observar en múltiples sistemas de órganos, incluyendo el pulmón y el tracto digestivo1,5. Además, las condiciones inflamatorias no infecciosas tales como episodios severos de asma, enfermedad pulmonar obstructiva crónica (EPOC), síndrome de dificultad respiratoria aguda (SDRA) y enfermedad inflamatoria intestinal (EII) están marcadas por la ruptura patológica de la barrera epitelial de la mucosa por una respuesta neutrófila excesiva4,5,10-12.
El complejo proceso de reclutamiento de neutrófilos después de la infección de la mucosa implica varios pasos compartimentados1,5,13,14. En primer lugar, los neutrófilos deben salir de la circulación a través de una serie de interacciones célula a célula que faciliten la migración trans-endotelial1,13. Los neutrófilos navegan a continuación por el espacio intersticial existente que contiene la matriz extracelular1,14. Para alcanzar la luz de la mucosa infectada, los neutrófilos deben entonces migrar a través de la barrera epitelial1,4,5. Este intrincado fenómeno de varios pasos se investiga a menudo en conjunto utilizando modelos animales in vivo de infección15. Tales modelos son útiles para establecer la necesidad de factores específicos, tales como quimiocinas, moléculas de adhesión o vías de señalización que participan en el proceso general, pero son en gran medida inadecuados para resolver las contribuciones moleculares críticas para cada paso compartimentado distinto16. Los sistemas cocultivos in vitro que modelan la migración trans-endotelial, trans-matriz o transepitelial de neutrófilos han sido particularmente útiles en este sentido1,14,16,17.
Se ha desarrollado un robusto sistema de ensayo de cocultivo con el fin de descifrar los mecanismos responsables de la migración transepitelial de neutrófilos en respuesta a la infección patógena18-22. Este modelo consiste en infectar la superficie apical de las capas de células epiteliales humanas polarizadas con un patógeno bacteriano seguido de la aplicación de neutrófilos humanos recién aislados a la superficie basolateral18-22. Los neutrófilos migran a través de la barrera epitelial en respuesta a productos quimiotácticos derivados de la epitelial secretados después de una infección patógena18,21-23. Este sistema modelo se ha empleado utilizando cultivos epiteliales intestinales y pulmonares expuestos a patógenos bacterianos específicos del tejido apropiado y ha revelado nuevos mecanismos moleculares probablemente importantes para el proceso de reclutamiento de neutrófilos durante la infección de la mucosa3,8,19,24-28. La fuerza de este modelo de cocultivo in vitro es que un enfoque reduccionista permite al investigador manipular experimentalmente el patógeno, la barrera epitelial y / o neutrófilo en un sistema bien controlado, altamente reproducible y bastante barato. La información obtenida de este enfoque puede aprovecharse eficazmente para realizar análisis enfocados de eventos compartimentados durante el reclutamiento de neutrófilos utilizando modelos de infección in vivo 22,29,30.
Este artículo demuestra los pasos múltiples necesarios para el establecimiento acertado de este modelo reproducible para explorar la migración transporte-epitelial inducida patógeno del neutrófilo. Las barreras epiteliales del pulmón infectadas con el patógeno Pseudomonas aeruginosa se ofrecen en este artículo; sin embargo, otros epitelios y patógenos del tejido se pueden substituir con modificaciones de menor importancia. La siembra y el cultivo de capas polarizadas de células epiteliales pulmonares en filtros de transwell permeables recubiertos de colágeno invertido se detallan aquí, al igual que el crecimiento de P. aeruginosa patógeno y el aislamiento de neutrófilos de la sangre entera. Cómo estos componentes se combinan para observar la migración transepitelial inducida por patógenos neutrófilos se presenta junto con controles positivos y negativos apropiados para establecer un ensayo reproducible. La versatilidad de este acercamiento para examinar varios aspectos de la migración transporte-epitelial inducida patógeno del neutrófilo se discute referente a estudios específicos en la literatura.
Protocolo
Los pasos (1-3) deben realizarse en un ambiente estéril bajo una campana de flujo laminar.
1. Recubrimiento de colágeno Transwells
- Haga una solución de colágeno de 30 μg/ml. Diluir 3 mg/ml de colágeno 1:100 en etanol al 60% que ha pasado a través de una unidad de filtro de 0,2 μm.
- Vórtice diluido 30 μg/ml solución. Nota: No es necesario vortex la solución de 3 mg/ml de colágeno, ya que esta solución es bastante viscosa y se pueden introducir burbujas de aire, lo que potencialmente disminuye la precisión al pipetear.
- Retire los transwells de área de crecimientode 0,33 cm 2 con un tamaño de poro de 3 μm del exterior del embalaje y coloque la placa de 24 pozos que contiene 12 transwells boca abajo dentro de la campana.
- Levante la placa inferior y colótese a un lado. Nota: Transwells ahora estará boca abajo descansando sobre la tapa de la placa de 24 pozos
- Encienda el quemador Bunsen. Llama el hemóstato para la esterilidad y deja enfriar.
- Con el hemóstato estéril, transfiera los transwells a una placa de Petri de 150 mm x 25 mm, manteniéndolos en la posición invertida. Nota: Asegúrese de mantener la esterilidad de la placa vacía de 24 pozos más la tapa que se utilizará para albergar los transwells una vez que hayan sido sembrados con células epiteliales.
- Pipetear 70 μl de la solución de colágeno de 30 μg/ml sobre la membrana del filtro de cada trasteo invertido. Nota: La tensión superficial debe mantener este volumen de solución en su lugar, ya que no hay paredes alrededor de la membrana del filtro al acceder a la superficie de la parte inferior. Tenga cuidado de que la solución de colágeno no gotee por el lado del transwell y evite mover los transwells durante el procedimiento de recubrimiento.
- Deje la tapa de la placa de Petri fuera durante un mínimo de 4 horas para permitir que la solución de etanol se evapore. Para mantener la esterilidad durante este proceso, mantenga el ventilador de la campana y la luz ultravioleta encendida.
- Después de que los transwells se hayan secado, se pueden usar inmediatamente o almacenar a temperatura ambiente hasta por una semana, siempre que la cubierta de la placa de Petri esté en su lugar y se mantenga la esterilidad.
2. Matraz de paso de las células epiteliales para la siembra de transwells
(Este protocolo describe específicamente el manejo de la línea celular epitelial pulmonar H292 para la generación de barreras epiteliales cultivadas en transwells. Otras variedades de células epiteliales se pueden utilizar con modificaciones leves.)
- Prepare el medio de cultivo agregando un 10% de suero fetal bovino inactivado por calor (HI-FBS) y 1x penicilina/estreptomicina a RPMI 1640.
- Medios cálidos, tripsina-EDTA (T-EDTA), y D-PBS en baño de agua de 37 ºC.
- Retire del matraz T-75 que contiene células de la incubadora y evalúe la confluencia visualmente con microscopio invertido. Nota: Cuando se utilizan células H292, los frascos deben estar cerca o totalmente confluentes.
- Medios aspirados a partir del matraz. Reduzca el tiempo que las células están secas al tener la siguiente solución en la capucha con la tapa aflojada.
- Añadir 5 ml de D-PBS al matraz T-75 y remolino. Evite crear burbujas. Eliminar PBS por aspiración.
- Añadir 3 ml de T-EDTA al matraz T-75 y girar para cubrir la parte inferior.
- Retirar la mayor parte de T-EDTA, dejando aproximadamente 0,3 ml en matraz T-75.
- Distribuir el pequeño volumen restante de T-EDTA sobre la superficie de las células y colocarlo en una incubadora humidificada en condiciones de cultivo estándar (37 ºC, 5%co2).
- Después de un período de tiempo, retire el matraz de la incubadora. Nota: Las células deben desprenderse fácilmente de la superficie del matraz tocando suavemente el matraz de su lado. Las células ahora deben ser redondeadas y flotantes cuando se visualizan bajo el microscopio. El tiempo promedio que esto tomará para las células H292 es de 5-10 min.
- Añadir 10 ml de medios de cultivo al matraz para neutralizar las células T-EDTA y resuspend. Extraiga la solución celular en la punta de la pipeta y eyúcelo sobre la superficie del matraz que contiene células aproximadamente cinco veces para resuspensar todas las células.
- Transfiera las células resuspended a un tubo de 15 ml para sembrar los transwells. Nota: La concentración de células H292 resuspended preparadas de esta manera debe variar entre aproximadamente 1 x 106-1,8 x 106 cells/ml.
3. Siembra de transwells recubiertos de colágeno con células epiteliales
- Añadir 70 μl de solución de células resuspended del tubo de 15 ml a cada trasteo recubierto de colágeno invertido. Nota: Las soluciones celulares H292 con un rango de concentración entre 1 x10 6-1.8 x 106 células/ml producirán aproximadamente 70,000-120,000 células/transwell.
- Mezcle la suspensión celular invirtiendo suavemente el tubo periódicamente para evitar que las células se asienten en la parte inferior del tubo de 15 ml mientras siembra los transwells. Nota: No las células de vórtice y tenga cuidado de que la punta de la pipeta no entre en contacto directo con el filtro de membrana recubierto de colágeno.
- Una vez que todos los transwellos invertidos han sido sembrados con células epiteliales, reemplazar la cubierta de la placa de Petri y colocar cuidadosamente en la incubadora de cultivo de tejidos, humidificado, 37 ºC, 5% CO2. Tenga cuidado de no molestar la suspensión celular que se ha añadido a la membrana del filtro recubierta de colágeno.
- Mantener transwellos invertidos en la incubadora de cultivo de tejidos, humidificados, 37 ºC, 5% co2 durante la noche. Nota: La burbuja de células que contienen líquido debe permanecer asociada con la membrana filtrante permeable del transwell durante toda la incubación durante la noche. Si la membrana del filtro se seca debido a la evaporación del líquido o porque el líquido gotea por el lado de los transwells, las capas epiteliales pueden no crecer correctamente.
- Al día siguiente, agregue 1 ml de medio en la placa estéril original de 24 pozos y voltee cada trasteo invertido usando un hemóstato esterilizado en cada pozo que contenga 1 ml de medio.
- Añadir 0,2 ml de medios en la cámara superior de cada transwell y volver a la incubadora de cultivo de tejidos, humidificado, 37 ºC, 5%co2.
- Los transwells invertidos H292 se pueden utilizar desde 8 días hasta 1 mes después de la siembra. Nota: Sugerimos esperar un mínimo de 8 días después de la siembra de transwells para asegurarse de que las monocapas epiteliales se han formado completamente y exhiben una barrera funcional. Se puede probar la barrera epitelial H292 determinando si la monocapa es capaz de restringir el flujo transepitelial de la proteína caballo rábano peroxidasa (HRP) después de la adición a la superficie basolateral18.
4. Preparación de bacterias para la infección de capas epiteliales en transwells
- Un día antes del experimento, extraiga una colonia de P. aeruginosa PAO1 de una placa de agar aislamiento de Pseudomonas y una colonia de K12 E. coli MC1000 de una placa de agar Luria-Bertani (LB) y colóquela en tubos separados que contengan 3 ml de caldo LB. PRECAUCIÓN: P. aeruginosa es un patógeno humano, las medidas de seguridad estándar BSL2 se deben adoptar al manejar este organismo.
- Agitar durante la noche a 225 rpm en un entorno de 37 ºC.
- Al día siguiente, retire 1 ml de los cultivos bacterianos densos y colóquelos en tubos Eppendorf de 1,5 ml.
- Girar en microfugio a 15.800 x g durante 5 min y luego quitar el sobrenadante.
- Prepare la solución salina balanceada de Hanks con calcio y magnesio (HBSS+) con anticipación. Añadir 23,8 g de HEPES y 97,5 g de HBSS+ en polvo a 9,5 L de agua destilada. Añadir pequeñas cantidades de NaOH de 10 M a la solución, mientras se monitorea el pH hasta alcanzar un pH estable de 7,4. Llevar el volumen hasta 10 L y almacenar a 4 ºC.
- Resuspend cada pellet bacteriano con 1 ml hbss+. Vórtice para asegurarse de que se logra una suspensión bacteriana uniforme.
- Girar de nuevo a 15.800 x g durante 5 min y retirar el sobrenadante.
- Resuspend el pellet PAO1 con 0,6 ml HBSS+ y el pellet MC1000 con 0,5 ml HBSS+. Vórtice las suspensiones bacterianas.
- Diluya aún más los pellets resuspended PAO1 y MC1000 1:100 en HBSS+. Por ejemplo, añadir 50 μl del pellet resuspended de PAO1 de 0,6 ml a 5 ml de HBSS+. Nota: Utilizando mediciones de densidad óptica (OD) para determinar la densidad de cultivo, así como la metodología de dilución de la unidad de formación de colonias estándar (UFC), las soluciones PAO1 y MC1000 preparadas de esta manera producen consistentemente entre 3 x 107-6 x 107 UFC / ml. La densidad de un cultivo bacteriano se correlaciona positivamente con la medición OD del cultivo a 600 nm y esta correlación se puede utilizar para estimar la concentración celular bacteriana. Para confirmar la concentración celular bacteriana, el cultivo puede diluirse a una concentración estimada muy baja y plateado en una placa de agar tal que uno esperaría que entre 30-200 células bacterianas estén presentes en la placa. Las células se extienden a través de la placa y se incuban durante la noche a 37 ºC, de tal manera que cada célula forma una colonia individual de células que es lo suficientemente grande como para ser visible y las colonias se pueden contar.
5. Aislamiento de neutrófilos de la sangre entera
- La solución de dextrosa de citrato ácido (ACD) se utiliza como anticoagulante y se prepara agregando 6,9 g de ácido cítrico, 12,5 g de citrato de sodio y 10 g de dextrosa a 500 ml de agua destilada. Una vez que todos los componentes se disuelven, la solución de ACD se esteriliza pasando a través de una unidad de filtro de 0,2 μm. Conservar la solución de ACD a 4 ºC.
- Antes de extraer sangre, agregue 5 ml de ACD a la jeringa de 50 ml y coloque una aguja de mariposa de 21 x 3/4 G con 12 en la tubería.
- Aplique torniquete, limpie la vena con alcohol e inserte la aguja. Nota: Cualquier protocolo de investigación con seres humanos debe ser aprobado por una junta de revisión institucional y se debe proporcionar el consentimiento informado por escrito de cada donante de sangre. Por ejemplo, los experimentos realizados con este protocolo fueron aprobados por la Junta de Revisión Institucional del Hospital General de Massachusetts y se les asignó el protocolo #1999-P-007782.
- Extraiga lentamente 45 ml de sangre asegurando que la sangre se mezcle con ACD una vez en la jeringa.
- Cuando se hayan extraído 45 ml (50 ml de volumen total), desatar el torniquete antes de retirar la aguja. Aplique inmediatamente presión a la herida con gasa estéril cuando se retire la aguja.
- Transfiera sangre lentamente por el lado de un tubo de 50 ml durante aproximadamente 5-10 segundos.
- Gire en centrífuga a 1.000 x g con el freno desactivado durante 20 minutos a temperatura ambiente. Nota: Un paso adicional que implica la dilución de la sangre entera en PBS- y la superposición cuidadosa de la sangre diluida en Ficoll-Paque antes de la centrifugación se puede emplear para alcanzar un nivel levemente más alto de pureza del neutrófilo separando más eficientemente la capa buffy de los granulocytes8. Omitir este paso sirve para ahorrar tiempo sin afectar drásticamente el rendimiento o la pureza para los fines de este ensayo, y por lo tanto estamos a favor de no incluir la superposición de sangre en el paso de Ficoll-Paque.
- Mientras la sangre está girando, agregue muy lentamente 1 g de gelatina en 50 ml de solución sal equilibrada de Hanks calentada sin calcio y magnesio (HBSS (-)) para preparar una solución de gelatina al 2%. Mantener la solución a 37 ºC.
- Aspirar y desechar el plasma del tubo de 50 ml de sangre utilizando una punta de pipeta de vidrio que ha sido tratada con Sigmacote.
- Continúe aspirando con mucho cuidado para eliminar la capa buffy, que contiene glóbulos blancos, incluyendo linfocitos.
- A medida que la capa buffy se está eliminando lentamente, el material nublado amarillo blanquecino por encima de la capa de glóbulos rojos (RBC) desaparecerá. Cese la aspiración una vez que se elimina la capa buffy y la capa RBC se puede visualizar claramente cuando se ve desde arriba del tubo.
- Trate de no perturbar la capa de RBC ya que los granulocitos, en su mayoría neutrófilos, están cerca de la superficie de la capa de RBC, pero no son visibles.
- A un volumen de 15 ml de capa de RBC, añadir 30 ml de solución de gelatina caliente al 2% (2x volumen de la capa de RBC).
- Invierta el tubo suavemente para mezclar, teniendo cuidado de minimizar la formación de burbujas.
- Incubar a 37 ºC durante 25 min. Nota: Los glóbulos rojos deben agregarse y asentarse hasta el fondo. Como alternativa a la gelatina, se puede emplear dextrans de gran peso molecular para sedimentar glóbulosrojos 8.
- Después de la incubación, transfiera la solución rojiza clara de la capa superior que contiene granulocitos a un nuevo tubo de 50 ml con pipeta, teniendo cuidado de no perturbar la capa RBC oscura asentada durante la transferencia. Una vez separado, descarte la capa RBC oscura.
- Spin transferido solución rojída ligera que contiene granulocitos y algunos glóbulos rojos en centrífuga a 1.000 x g con freno activado durante 10 min a temperatura ambiente con el fin de pellets de células.
- Vierta o aspire el sobrenadante con cuidado, ya que el pellet de células rojáceas que se formará después de la centrifugación generalmente está suelto.
- Preparar el tampón de lisis RBC con antelación y conservar a 4 ºC añadiendo 8,29 g de cloruro de amonio (NH4Cl), 1 g de bicarbonato de sodio (NaHCO3),y 0,038 g de EDTA a 1 L de agua destilada en un castor. Almacenar el tampón de lisis RBC a 4 ºC.
- Resuspend y rompa el pellet de células rojiformes con un pequeño volumen de tampón de lisis RBC frío. Una vez que el pellet de la célula está en solución, llene el tubo a 50 ml con el almacenador intermediario de la lisis de RBC. Nota: En este punto y de cara al futuro, mantener las celdas en hielo o a 4 ºC.
- Girar en centrífuga a 300 x g durante 10 min a 4 ºC y luego verter o aspirar el sobrenadante. Nota: El sobrenadante será algo rojizo que contiene glóbulos rojos. El pellet debe ser de color blanco amarillento en este punto. Si quedan glóbulos rojos significativos en el pellet como lo indica un pellet rojizo, se puede repetir el paso 5.20-5.21. Los glóbulos rojos significativos permanecen en el pellet celular si el pellet rojizo del paso 5.20 no se divide lo suficiente.
- Resuspend y romper el pellet blanquecino con un pequeño volumen de HBSS(-) y luego llenar el tubo a 50 ml con HBSS(-). Nota: HBSS (-) y no HBSS + debe utilizarse para resuspend el pellet de células blanquecinas. Hbss (-) carece de calcio y magnesio.
- Girar de nuevo en centrífuga a 300 x g durante 10 min a 4 ºC.
- Vierta el sobrenadante y resuspend el pellet a un volumen final de 1 ml HBSS(-).
- Añadir 5 μl de la suspensión celular de 1 ml a 250 μl hbss(-) en un tubo Eppendorf de 1,5 ml y mezclar suavemente hacia arriba y hacia abajo por pipeta.
- Añadir 25 μl de suspensión de células diluidas a 25 μl al 0,4% de azul trypan.
- Añadir 12 μl de mezcla a cada lado de un hemocitómetro estándar.
- Cuente el número de células vivas que han excluido el tinte azul trypan y están presentes en el cuadrado medio de ambos lados del hemocitómetro.
- Para calcular la concentración celular, multiplique el promedio de los 2 cuadrados por 100 (factor de dilución) y luego multiplique por 104 para dar el número de celdas/ml.
- Ajuste la concentración final a 5 x 107 células/ml. Si es mayor que 5 x 107 células/ml, ajuste agregando HBSS(-). Si es menos, pellet las células y resuspend al volumen apropiado.
- Mantenga las células en el hielo hasta que estén listas para el ensayo de migración. Nota: Estas células representan la población de granulocitos de glóbulos blancos. La mayoría de los granulocitos aislados de la sangre humana entera son neutrófilos. Las células se mantienen en el hielo suspendido en HBSS (-) hasta la adición al ensayo de migración con el fin de mantener las células en un estado quieto.
6. Preparación de capas de células epiteliales para el ensayo de migración
(Estospasos no necesitan ser realizados dentro de una campana estéril.)
- Retire de la incubadora las capas epiteliales de soporte de placas de 24 pozos que se han cultivado en la parte inferior de las membranas del filtro transwell durante al menos ocho días.
- Agarre el borde de cada transwell con un hemóstato, levante la placa de 24 pozos e invierta el transwell sobre un cubo de basura para desechar los medios de cultivo de la cámara interna del transwell. Sumerja cada transwell en un lavabelte que contenga HBSS+ para llenar la cámara interna del transwell con HBSS+. Deseche el líquido de la cámara interior en un cubo de basura.
- Repita el paso 6.2 para un segundo lavado en HBSS+. Después de dos lavados, coloque los transwells en una nueva placa de 24 pozos que contenga 1 ml de HBSS+ en cada pozo. Nota: Todos los lavados deben realizarse con HBSS+ que se calienta a 37 ºC.
- Observe la cámara superior de cada transwell para evaluar la integridad de la capa de células epiteliales. Nota: HBSS+ no debe filtrarse y llenar la cámara superior del transwell cuando se coloca en el pocillo de una placa de 24 pocillos que contiene 1 ml de HBSS+.
- Después de observar cuidadosamente cada transwell, añadir 0,2 ml de HBSS+ en la cámara superior.
- Colocar en incubadora a 37 ºC, al 5% deCO2 en una cámara humidificada durante 30-60 min para equilibrar las capas de células epiteliales.
7. Ensayo de migración transepitelial de neutrófilos
- Retire de la incubadora la placa de 24 pozos de transwells lavados equilibrándose en HBSS+.
- Agarre cada transwell con un hemóstato y deseche el líquido en la parte superior bien en un cubo de basura.
- Coloque cada transwell boca abajo en una placa de Petri de 150 mm x 25 mm.
- A seis de los Transwells invertidos, agregue 25 μl de HBSS+. A tres de los trasmalgidos invertidos, infectar con 25 μl de P. aeruginosa (PAO1) diluido en HBSS+ preparado como se describe en el paso 4. Hasta los tres últimos trasteos invertidos, infectar con 25 μl de E. coli K12 (MC1000) diluidos en HBSS+ preparados como se describe en el paso 4. Esto es aproximadamente 0.8 x 106-1.5 x 106 CFL/capa epitelial para cada especie bacteriana ya que la concentración de las soluciones bacterianas preparadas en el paso 4 es de aproximadamente 3 x 107-6 x 107 UFC/ml.
- Incubar a 37 ºC, 5% deCO2 en una cámara humidificada durante 60 min.
- Preparar fMLP como control positivo para la migración de neutrófilos añadiendo 5 μl de 10 mM de fMLP a 5 ml hbss+ dando una solución de 10 μM.
- Lave los transwells agarrándose con un hemóstato y volteando hacia atrás en una placa de lavado de 24 pozos que contiene 1 ml de HBSS + en las cámaras inferiores. Añadir 0,2 ml de HBSS+ a las cámaras superiores.
- Agarre transwell con un hemóstato y retirar de la primera placa de lavado. Antes de colocar los transwells en una segunda placa de lavado de 24 pozos que contenga 1 ml de HBSS+, deseche el líquido de la cámara superior en un cubo de desecho. Añadir 0,2 ml de HBSS+ a la cámara superior.
- Repita los pasos 7.8 una vez más para un total de 3 lavados. Nota: Todos los transwells deben someterse al mismo régimen de manipulación y lavado, independientemente de que hayan sido infectados o no con bacterias, para garantizar que todos los transwells que se están ensayando hayan sido manipulados de la misma manera. Una infección de 60 min con PAO1 o MC1000 no reduce la viabilidad ni altera las propiedades de barrera de la monocapa H292 evaluadas por un ensayo toxicológico basado en lactato deshidrogenasa y el ensayo de flujo HRP, respectivamente18,22.
- Prepare la placa de migración de 24 pozos agregando 1 ml de HBSS+ en 12 pozos de la placa de 24 pozos. Nota: Esta placa se puede preparar con anticipación.
- Después del tercer lavado, deseche el líquido de las cámaras superiores de los transwells en un cubo de basura usando un hemóstato y coloque tres de los transwells no infectados en tres pozos de la placa de migración de 24 pozos que contiene 1 ml de HBSS+, que representa el control negativo.
- Pipetear 10 μl de una solución de 10 μM de fMLP en cada uno de los tres pozos de la placa de migración de 24 pozos que contiene 1 ml de HBSS+ (100 nM).
- Coloque tres de los transwells no infectados en tres pozos de la placa de migración de 24 pozos que contiene 100 nM fMLP, lo que representa un control positivo para la capacidad de los neutrófilos aislados para migrar.
- Coloque tres transwells infectados con PAO1 y tres transwells infectados con MC1000 en tres pozos cada uno respectivamente de la placa de migración de 24 pozos que contiene 1 ml hbss+. Añadir 0,1 ml de HBSS+ a la cámara superior de cada transwell.
- Además de los 0,1 ml de HBSS+ en cada transwell, añadir cuidadosamente 20 μl de la suspensión de neutrófilos (5 x 107 células/ml) preparada como se describe en el paso 5. Nota: Esto representa aproximadamente 1 x 106 neutrófilos/transwell.
- Incubar a 37 ºC, 5% deCO2 en una cámara humidificada durante 2 horas para permitir la migración transepitelial de neutrófilos.
- Prepare una curva estándar para determinar el número de neutrófilos que han migrado después de 2 horas. Añadir 40 μl de la suspensión de neutrófilos (5 x 107 células/ml) en 2 ml de HBSS(+) y transferir 1 ml a 1 ml de HBSS(+) y realizar diluciones seriales de 2 pliegues ocho veces adicionales para un total de 10 normas que van desde aproximadamente 2.000 células/ml hasta 1 x 106 células/ml. Incluir 1 ml de HBSS(+) para el espacio en blanco.
- Después de 2 horas de migración, levante los transwells agarrándose con un hemóstato y toque suavemente contra las paredes interiores de la placa de migración de 24 pozos. Deseche los transwells.
- Evaluar la migración de neutrófilos de forma grosera en los pocillos mediante la observación de los pocillos de la placa de migración de 24 pocillos bajo un microscopio invertido utilizando el objetivo 10X (consulte la Figura 1 para obtener imágenes de neutrófilos migrados en cada condición).
- Agregue 50 μl de tritón X-100 al 10% a cada pozo utilizado en la placa de migración de 24 pozos, cada estándar y el espacio en blanco.
- Gire la placa de migración de 24 pozos, los estándares y el espacio en blanco a baja velocidad durante 20 minutos a 4 ºC.
- Prepare el tampón de citrato de 1 M con anticipación. Añadir 52,5 g de ácido cítrico y 73,5 g de citrato de sodio a 400 ml de agua destilada en un casto. Lleve el pH a 4.2. Añadir agua destilada para solución final de 500 ml. Almacenar solución a 4 ºC.
- Prepare la solución de sustrato ABTS fresca ese día. Añadir 3 comprimidos ABTS (10 mg cada uno) y 5 ml de tampón de citrato 1 M a 45 ml de agua destilada. Deje que las tabletas se disuelvan completamente en solución. Retener la adición de 50 μl de peróxido de hidrógeno al 30% hasta que se necesite la solución de sustrato ABTS (véase el paso 7.27).
- Agregue 50 μl de tampón de citrato a cada pozo utilizado en la placa de migración de 24 pozos, cada estándar y el espacio en blanco.
- Transfiera 100 μl de cada pozo de muestra por duplicado a una placa de 96 pozos. Nota: Es muy importante mezclar a fondo el contenido de cada muestra antes de pasar a la placa de 96 pozos. Pipetee la solución hacia arriba y hacia abajo al menos cinco veces antes de la transferencia.
- Transferir 100 μl de cada estándar y el espacio en blanco a la placa de 96 pozos después de mezclar (en blanco por duplicado).
- Añadir 50 μl de peróxido de hidrógeno al 30% a la solución ABTS y al vórtice.
- Agregue 100 μl de solución de sustrato ABTS a cada muestra en la placa de 96 pozos.
- Deje que la placa se desarrolle durante 5-10 minutos en la oscuridad. Nota: Un color verde debe desarrollarse en ciertos pozos, correlacionando con el número de neutrófilos presentes en cada pozo.
- Leer a una longitud de onda de 405 nm utilizando un lector de microplacas.
- Calcular el número de neutrófilos que han migrado a través de la capa epitelial utilizando los estándares por los cuales existe una correlación positiva lineal entre el número conocido de neutrófilos preparados como estándares y la cantidad de actividad de la peroxidasa medida por la densidad óptica a 405 nm (ver figuras 2 y 3 para datos representativos). Nota: Este método de cuantificación de neutrófilos se aprovecha de la gran cantidad de actividad de la peroxidasa exhibida por los neutrófilos debido a la expresión de mieloperoxidasa. Se pueden considerar enfoques alternativos para cuantificar los neutrófilos, como los métodos que implican el preetiquetado de neutrófilos con radiactividad o compuestos de fluorescencia.
Resultados
Varios estudios han demostrado que las capas epiteliales infectadas por patógenos facilitan la migración transepitelial de neutrófilos3,8,19,24-28,31,32. Esto ocurre a través de una inducción específica del patógeno de un gradiente quimiotáctico de neutrófilos derivado de células epiteliales3,23. Por ejemplo, la patogenicidad de P. aeruginosa que interactúa con la superficie apical de las células epiteliales pulmonares hace que un número sustancial de neutrófilos migren a través de la capa epitelial18,22,25,26,33,34. Este sistema de ensayo clínicamente relevante se puede manipular de numerosas maneras para revelar los principales contribuyentes moleculares de patógenos y hospedadores cuando se combina con controles apropiados.
Los neutrófilos añadidos a las capas polarizadas de células epiteliales que no han sido preinfectadas no migran a través de un número apreciable. Sin embargo, el uso de un gradiente quimio-atrayente a través de una capa epitelial no infectada conducirá a números significativos de neutrófilos a través. Es importante incluir estos controles negativos y positivos respectivamente dentro de cada análisis al investigar la migración del neutrófilo a través de capas epiteliales infectadas patógeno. El control negativo establece el número de fondo de neutrófilos que cruzan la capa epitelial en ausencia de señal. Este número debe ser muy bajo cuando las células epiteliales cultivadas han establecido una barrera funcional. La alta migración de fondo complica la interpretación de los resultados alcanzados con el epitelio patógeno-infectado. El control positivo implica la aplicación de un gradiente de un quimio-atrayente neutrófilo como fMLP a través de la capa epitelial y sirve para confirmar que los neutrófilos aislados son funcionales. Además, en el caso de que las capas epiteliales se pretraten con ciertos reactivos para evaluar sus impactos en la migración transepitelial inducida por patógenos, el gradiente fMLP sirve para controlar cualquier efecto que el reactivo pueda tener en la capacidad de los neutrófilos para navegar por la capa epitelial independientemente de los efectos mediados por patógenos. Un control adicional empleado a menudo dentro de este sistema de ensayo implica la infección de capas epiteliales con bacterias no patógenas en paralelo con el patógeno. Este control se puede explotar para distinguir las respuestas epiteliales relevantes después de la interacción con las bacterias, así como ayudar con la identificación de los factores patógenos necesarios para estimular la migración transepitelial neutrófilo.
La migración transepitelial de neutrófilos se puede evaluar cualitativa y cuantitativamente. En la terminación de la incubación de 2 horas que sigue la adición de neutrófilos a la superficie basolateral, los transwells se quitan y los neutrófilos que han emigrado completamente a través de la capa epitelial a la cámara apical se pueden ver en el pozo inferior de la placa de la migración de 24 pozos. Una imagen representativa de cada condición se muestra en la Figura 1,visualizada utilizando un microscopio de luz invertido. Se observó que muy pocos neutrófilos migran a través de una capa epitelial no infectada sin un gradiente quimiotáctico impuesto (HBSS+) y representan los niveles de fondo en el ensayo (Figura 1A). Por el contrario, una abundancia de neutrófilos transmigrados fue evidente cuando se proporciona un gradiente fMLP (Figura 1B). La infección del epitelio con E. coli MC1000 no patógeno dio lugar a pocos neutrófilos transmigrados visibles, mientras que muchos neutrófilos transmigrados fueron observables cuando las capas epiteliales fueron infectadas con la patógena pulmonar P. aeruginosa (PAO1) (Figuras 1C y 1D).
Los neutrófilos que han migrado en el experimento se cuantifican midiendo su actividad mieloperoxidasa. Una curva estándar se utiliza para permitir una estimación del número de neutrófilos transmigrados. El número de neutrófilos se correlaciona positivamente con la cantidad de actividad de la peroxidasa medida después de la lisis de neutrófilos con valores que exhiben una relación lineal en el rango de números de neutrófilos seleccionados para la curva estándar (2 x10 3-1 x 106 células/ml) (Figura 2). Un número significativo de neutrófilos migran a través de las capas epiteliales en respuesta a un gradiente de fMLP proporcionado o en respuesta a una capa epitelial infectada con PAO1(Figura 3). El número de neutrófilos que migran en ausencia de estímulos (HBSS+) o después de la infección epitelial apical con E. coli MC1000 no patógena está por debajo del límite de detección para el ensayo (Figura 3). Los datos presentados en la Figura 3 representan el número promedio de neutrófilos transmigrados con barras de error que representan la desviación estándar de tres pozos independientes / condición. Los datos cuantitativos representados en la Figura 3 son consistentes con las imágenes representativas de pozos que se muestran en la Figura 1.
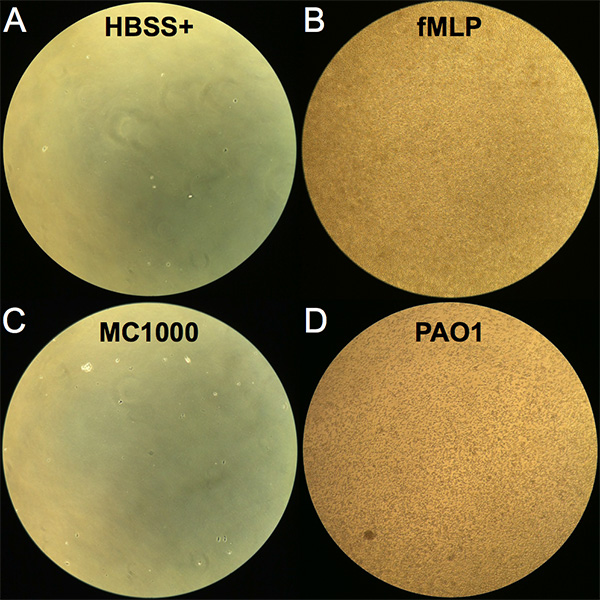
Figura 1. Imagen de neutrófilos después de la migración transepitelial. Las imágenes fueron vistas con un microscopio de luz invertido en la ampliación de 10X del pozo inferior (compartimiento apical) de la placa de la migración de 24 pozos que seguía el período de incubación de 2 horas con los neutrófilos agregados al pozo superior (compartimiento basolateral). (a) Control negativo HBSS+. (B)Control positivo impuesto fMLP gradiente quimiotáctico. (C)Capas de células epiteliales infectadas con E. coli K12 no patógena (MC1000). (D)Capas de células epiteliales infectadas con P. aeruginosa patógena (PAO1). Haga clic aquí para ver la imagen más grande.
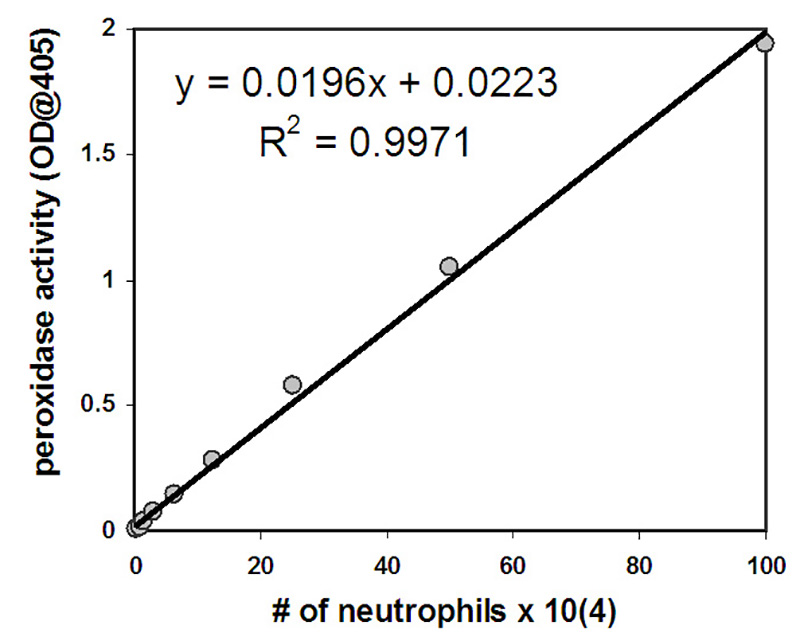
Figura 2. Los neutrófilos en una concentración inicial de 1 x 106 fueron sujetados a nueve diluciones de 2 dobleces. Después de lisis, la cantidad de actividad de la peroxidasa era determinada y el número de neutrófilos fue graficado en el eje de X con actividad de la peroxidasa en el y-eje. La ecuación representada se puede utilizar para determinar el número de neutrófilos presentes en cada pozo después de la transmigración en función de la cantidad de actividad de la peroxidasa medida en cada pozo.
Haga clic aquí para ver la imagen más grande.

Figura 3. Cuantificación de neutrófilos transmigrados. El número de neutrófilos transmigrados se cuantifica por la actividad relativa de la mieloperoxidasa a una curva estándar lineal de números conocidos de neutrófilos. Los números substanciales de neutrófilos transmigrated fueron observados después de la infección de la célula epitelial con el aeruginosa patógeno del P. (PAO1) o el establecimiento de un apical al gradiente basolateral del fMLP quimio-atrayente del neutrófilo. Los números imperceptibles de neutrófilos transmigrated fueron observados después de la infección de la célula epitelial con el tratamiento no patógeno de E. coli K12 (MC1000) o el almacenador intermediario negativo del control solamente (HBSS+). Haga clic aquí para ver la imagen más grande.
Discusión
La migración de neutrófilos a través de las superficies epiteliales de la mucosa es una característica común en la patología de la enfermedad después de la infección con patógenos bacterianos3. La metodología descrita en este documento ofrece un enfoque rápido y directo para aislar experimentalmente este evento discreto utilizando un sistema de ensayo de cocultivo in vitro derivado de células humanas que modela una característica del proceso inflamatorio desencadenado por infecciones bacterianas. Este sistema fue desarrollado originalmente utilizando células epiteliales intestinales polarizadas infectadas con patógenos entéricos incluyendo Salmonella typhimurium, Shigella flexneri,y varios patógenos de E. coli8,19,24,27,28. Cada uno de estos organismos patógenos es capaz de conducir neutrófilos a través de monocapas epiteliales intestinales polarizadas cultivadas en filtros de transpojo permeables recubiertos de colágeno invertido. Este sistema experimental ha sido adaptado con modificaciones para explorar las barreras epiteliales pulmonares y la migración transepitelial de neutrófilos inducida porpatógenos 18,26. Varias líneas celulares epiteliales de la vía aérea aparte de H292 se han utilizado para estos estudios incluyendo las variedades de células epiteliales del pulmón comúnmente citadas A549, BEAS-2B, y Calu-322,26. P. aeruginosa instiga la inflamación en el pulmón causando daños significativos caracterizando enfermedades como la neumonía aguda y la fibrosis quística35,36. Según lo descrito, el aeruginosa del P. del patógeno del pulmón induce fácilmente la migración transporte-epitelial del neutrófilo sobre la infección de las células epiteliales del pulmón, una característica notable del proceso inflamatorio observado en pulmonía y fibrosis enquistada. Además, varias cepas adicionales de P. aeruginosa, incluidos los aislamientos clínicos de pacientes con fibrosis quística, han sido validadas como inductores en este ensayo25. Streptococcus pneumoniae y Klebsiella pneumoniae,patógenos bacterianos Gram-positivos y Gram-negativos, respectivamente, se asocian comúnmente con neumonía y se ha demostrado que son capaces de inducir la migración transepitelial de neutrófilos utilizando el modelo de cocultivo in vitro 26,32. Por lo tanto, este sistema modelo ofrece un enfoque in vitro robusto utilizando células derivadas humanas para explorar los procesos inflamatorios instigados por patógenos de la mucosa.
Los modelos estándar basados en cultivos de tejidos a menudo utilizados para explorar las interacciones de los patógenos del huésped generalmente emplean células epiteliales cultivadas en superficies plásticas planas16. El ensayo de cocultivo in vitro ofrece un mayor grado de complejidad proporcionando versatilidad en el diseño experimental16,37,38. Las células epiteliales polarizadas cultivadas en la parte inferior de los filtros transwell permeables crean un compartimento apical que da a la cámara inferior cuando se coloca en una placa de 24 pozos y un compartimento basolateral que da al pozo superior interior del transwell14,17. Esta compartimentación discreta y orientación direccional permite el análisis de la migración basolateral fisiológica a apical de neutrófilos en respuesta a gradientes quimiotácticos impuestos o generados por células epiteliales14,17,23. El sistema de cocultivo in vitro permite la investigación de mecanismos moleculares específicos atribuibles a la migración transepitelial, que pueden ser difíciles de resolver en el entorno complejo de un modelo in vivo de infección pulmonar1,15. Cualquier hallazgo con respecto a la identificación de factores clave involucrados en la migración transepitelial de neutrófilos utilizando el modelo de cocultivo in vitro puede ser posteriormente validado para su relevancia utilizando modelos in vivo de neumonía aguda15,22.
El ensayo de cocultivo in vitro se puede manipular de numerosas maneras para estudiar una serie de fenómenos. Los estudios centrados en los genes bacterianos que contribuyen al reclutamiento de neutrófilos se pueden realizar ensayando las bibliotecas mutantes disponibles para patógenos específicos de interés25,39,40. Los genes revelados de tal análisis pueden representar factores nuevos de la virulencia y las blancos terapéuticas potenciales para los agentes antiinfecciosos. El neutrófilo también puede representar el foco de análisis. Por ejemplo, los neutrófilos emplean varias moléculas de adhesión a la superficie celular para facilitar la migración transepitelial5,14,34,41,42. Las interacciones clave de célula a célula pueden variar dependiendo de la migración que impulsa el quimio-atrayente y del tejido con el que interactúan los neutrófilos34. Los neutrófilos pueden ser pretratados con inhibidores, anticuerpos o antagonistas antes de evaluar la migración transepitelial inducida por patógenos con el fin de identificar moléculas superficiales o vías de señalización que son críticas para este proceso22,34. Las células epiteliales cumplen un papel crítico durante la infección y la inflamación mediante la detección de señales y la comunicación con las células inmunes a través de mediadores solubles43. Las vías de señalización, la secreción polarizada de quimio-atrayentes y las moléculas de adhesión a la superficie epitelial que interactúan con bacterias o neutrófilos que afectan la migración transepitelial de neutrófilos inducida por patógenos se pueden investigar utilizando el ensayo de cocultivo in vitro. La aplicación de este modelo de cocultivo reveló la importancia de un quimio-atrayente lipídico eicosanoide previamente no apreciado conocido como hepoxilina A33,18,21. La hepoxilina A3 es producida por células epiteliales pulmonares e intestinales en respuesta a la infección con patógenos específicos y es responsable de conducir neutrófilos a través de la monocapa epitelial polarizada desde el basolateral hasta el lado apical infectado3. Por lo tanto, el ensayo de cocultivo in vitro sirve como una herramienta exploratoria robusta con el potencial de identificar mecanismos críticos que median las interacciones huésped-patógeno y orquestan la inflamación. Además, este sistema modelo tiene el potencial de ser adaptado como un enfoque de detección de alto rendimiento para evaluar la eficacia de la terapéutica antiinfeccitiva o antiinflamatoria selectiva.
En suma, proporcionamos un protocolo detallado paso a paso para investigar la migración de neutrófilos a través de una monocapa de capas de células epiteliales pulmonares infectadas por patógenos cultivadas en filtros transwell permeables. Las técnicas descritas adjunto se pueden modificar para estudiar la migración del neutrófilo a través de otras superficies de la mucosa donde los neutrófilos infiltran en estados de la enfermedad tales como el aparato gastrointestinal o la zona genitourinaria. Además, los conocimientos adquiridos utilizando el sistema de ensayo de cocultivo in vitro probablemente sean relevantes para una amplia gama de enfermedades inflamatorias no impulsadas por agentes infecciosos específicos. Las enfermedades inflamatorias de las superficies de la mucosa que ofrecen a los neutrófilos que cruzan la barrera epitelial protectora a un grado patológico incluyen COPD, ARDS, asma, y IBD5,10-12. Una comprensión más profunda de los mecanismos moleculares que gobiernan la migración transepitelial de neutrófilos probablemente informará las estrategias terapéuticas orientadas a aliviar los procesos inflamatorios destructivos asociados con estas dolencias comunes, proporcionando nuevas vías para mejorar la salud humana.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Este trabajo fue apoyado financieramente por los NIH (1 R01 AI095338-01A1).
Materiales
| Name | Company | Catalog Number | Comments |
| NCl-H292 cells | ATCC | CRL-1848 | |
| RPMI-1640 medium | ATCC | 30-2001 | |
| Pseudomonas aeruginosa PAO1 | ATCC | #47085 | |
| Escherichia coli MC1000 | ATCC | #39531 | |
| D-PBS (1x) liquid | Invitrogen | 14190-144 | without calcium and magnesium |
| Heat Inactivated Fetal bovine serum | Invitrogen | 10082-147 | 10% added to culture medium |
| Penicillin-Streptomycin | Invitrogen | 15140-122 | 100x: 10,000 units of penicillin and 10,000 µg of streptomycin per ml. |
| Trypsin-EDTA (0.05%) | Invitrogen | 25300-062 | 50 ml aliquots are stored frozen at -20 ºC. Aliquot in use can be stored at 4 ºC short-term. |
| Hank's Balanced Salt Solution - HBSS(-) | Invitrogen | 14175-079 | Sterile, without calcium and magnesium |
| Trypan Blue Solution | Invitrogen | 15250-061. | Stock = 0.4% |
| Collagen, Rat Tail | Invitrogen | A10483-01 | Can also be isolated in the laboratory directly from the tails of rats using standard protocols |
| Citric acid | Sigma-Aldrich | C1909-500G | Component of 1 M citrate buffer and acid citrate dextrose (ACD) solution |
| Sodium Citrate | Sigma-Aldrich | S4641-500G | Component of 1 M citrate buffer |
| Dextrose anhydrous | Sigma-Aldrich | D8066-250G | Component of acid citrate dextrose (ACD) solution |
| Ammonium Chloride | Sigma-Aldrich | 213330-500G | Component of red blood cell (RBC) lysis buffer |
| Sodium bicarbonate | Sigma-Aldrich | S6014-500G | Component of red blood cell (RBC) lysis buffer |
| EDTA | Sigma-Aldrich | ED-100G | Component of red blood cell (RBC) lysis buffer |
| HBSS(+) powder | Sigma-Aldrich | H1387-10L | Key component of HBSS+ |
| HEPES | Sigma-Aldrich | H3375-500G | Component of HBSS+ |
| Sigmacote | Sigma-Aldrich | SL2-25ML | Follow vendor instructions to coat glass pipette tips |
| Triton X-100 | Sigma-Aldrich | T-9284 | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) | Sigma-Aldrich | A9941-50TAB | Key component of ABTS substrate solution |
| 30% Hydrogen Peroxide Solution | Sigma-Aldrich | H1009-100ML | Component of ABTS substrate solution |
| N-Formyl-Met-Leu-Phe (fMLP or fMLF) | Sigma-Aldrich | F-3506 | A Stock solution of 10 mM in DMSO should be prepared and aliquots stored at -20 ºC. |
| Gelatin Type B | Fisher Scientific | M-12026 | |
| Pseudomonas isolation agar | Fisher Scientific | DF0927-17-1 | Follow manufacturer’s instructions to make PIA plates |
| Ficoll-Paque PLUS | Fisher Scientific | 45-001-749 | Optional, can improve neutrophil purity |
| Name of Material / Equipment | Company | Catalog Number | Comments |
| 24-well migration plate | Corning Incorporated | #3524 | |
| 24-well wash plate | Falcon | 35-1147 | Can be reused if soaked in 70% ethanol and washed thoroughly prior to reuse |
| 96-well plate | Fisher Scientific | #12565501 | |
| Transwell Permeable Supports | Corning Incorporated | #3415 | Polycarbonate; Diameter: 6.5 mm; Growth area: 0.33 cm2; Dish style: 24-well plate; Pore size: 3.0 µm |
| Petri dish | Falcon | 35-1013 | Each Petri dish holds 24 inverted 0.33 cm2 Transwells. |
| 500 ml 0.2 μm filter / flask | Fisher Scientific | 09-740-25A | To sterilize acid citrate dextrose (ACD) solution |
| 5-3/4 in glass Pasteur pipette | Fisher Scientific | 13-678-20A | Coat tips with Sigmacote prior to use |
| Hemostat | Fisher Scientific | 13-812-14 | Curved, Serrated |
| Invertoskop Inverted Microscope | Zeiss | #342222 | |
| Versa-Max Microplate Reader | Molecular Devices | #432789 |
Referencias
- Burns, A. R., Smith, C. W., Walker, D. C. Unique structural features that influence neutrophil emigration into the lung. Physiol. Rev. 83, 309-336 (2003).
- Hurley, B. P., McCormick, B. A. Intestinal epithelial defense systems protect against bacterial threats. Curr. Gastroenterol. Rep. 6, 355-361 (2004).
- McCormick, B. A. Bacterial-induced hepoxilin A3 secretion as a pro-inflammatory mediator. FEBS J. 274, 3513-3518 (2007).
- Mumy, K. L., McCormick, B. A. The role of neutrophils in the event of intestinal inflammation. Curr. Opin. Pharmacol. 9, 697-701 (2009).
- Chin, A. C., Parkos, C. A. Pathobiology of neutrophil transepithelial migration: implications in mediating epithelial injury. Annu. Rev. Pathol. 2, 111-143 (2007).
- Segel, G. B., Halterman, M. W., Lichtman, M. A. The paradox of the neutrophil's role in tissue injury. J. Leukoc. Biol. 89, 359-372 (2011).
- Weiss, S. J. Tissue destruction by neutrophils. N. Engl. J. Med. 320, 365-376 (1989).
- Hurley, B. P., Thorpe, C. M., Acheson, D. W. Shiga toxin translocation across intestinal epithelial cells is enhanced by neutrophil transmigration. Infect. Immun. 69, 6148-6155 (2001).
- Kohler, H., et al. Salmonella enterica serovar Typhimurium regulates intercellular junction proteins and facilitates transepithelial neutrophil and bacterial passage. Am. J. Physiol. Gastrointest. Liver Physiol. 293, 178-187 (2007).
- Gane, J., Stockley, R. Mechanisms of neutrophil transmigration across the vascular endothelium in COPD. Thorax. 67, 553-561 (2012).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol. Med. 17, 293-307 (2011).
- Nakagome, K., Matsushita, S., Nagata, M. Neutrophilic inflammation in severe asthma. Int. Arch. Allergy Immunol.. 158 Suppl 1, 96-102 (2012).
- Choi, E. Y., Santoso, S., Chavakis, T. Mechanisms of neutrophil transendothelial migration. Front. Biosci. 14, 1596-1605 (2009).
- Louis, N. A., Campbell, E., Colgan, S. P. Model systems to investigate neutrophil adhesion and chemotaxis. Methods Mol. Biol. 412, 257-270 (2007).
- Craig, A., Mai, J., Cai, S., Jeyaseelan, S. Neutrophil recruitment to the lungs during bacterial pneumonia. Infect. Immun. 77, 568-575 (2009).
- Hurley, B. P., McCormick, B. A. Translating tissue culture results into animal models: the case of Salmonella typhimurium. Trends Microbiol. 11, 562-569 (2003).
- Lee, W. Y., Chin, A. C., Voss, S., Parkos, C. A. In vitro neutrophil transepithelial migration. Methods Mol. Biol. 341, 205-215 (2006).
- Hurley, B. P., Siccardi, D., Mrsny, R. J., McCormick, B. A. Polymorphonuclear cell transmigration induced by Pseudomonas aeruginosa requires the eicosanoid hepoxilin A3. J. Immunol. 173, 5712-5720 (2004).
- McCormick, B. A., Colgan, S. P., Delp-Archer, C., Miller, S. I., Madara, J. L. Salmonella typhimurium attachment to human intestinal epithelial monolayers: transcellular signalling to subepithelial neutrophils. J. Cell Biol. 123, 895-907 (1993).
- McCormick, B. A., et al. Surface attachment of Salmonella typhimurium to intestinal epithelia imprints the subepithelial matrix with gradients chemotactic for neutrophils. J. Cell Biol. 131, 1599-1608 (1995).
- Mrsny, R. J., et al. Identification of hepoxilin A3 in inflammatory events: a required role in neutrophil migration across intestinal epithelia. Proc. Natl. Acad. Sci. U.S.A. 101, 7421-7426 (2004).
- Tamang, D. L., et al. Hepoxilin A(3) facilitates neutrophilic breach of lipoxygenase-expressing airway epithelial barriers. J. Immunol. 189, 4960-4969 (2012).
- McCormick, B. A., Parkos, C. A., Colgan, S. P., Carnes, D. K., Madara, J. L. Apical secretion of a pathogen-elicited epithelial chemoattractant activity in response to surface colonization of intestinal epithelia by Salmonella typhimurium. J. Immunol. 160, 455-466 (1998).
- Boll, E. J., et al. Enteroaggregative Escherichia coli promotes transepithelial migration of neutrophils through a conserved 12-lipoxygenase pathway. Cell Microbiol. 14, 120-132 (2012).
- Hurley, B. P., et al. The two-component sensor response regulator RoxS/RoxR plays a role in Pseudomonas aeruginosa interactions with airway epithelial cells. Microbes Infect. 12, 190-198 (2010).
- Hurley, B. P., Williams, N. L., McCormick, B. A. Involvement of phospholipase A2 in Pseudomonas aeruginosa-mediated PMN transepithelial migration. Am. J. Physiol. Lung Cell Mol. Physiol. 290, L703-L709 (2006).
- McCormick, B. A., Siber, A. M., Maurelli, A. T. Requirement of the Shigella flexneri virulence plasmid in the ability to induce trafficking of neutrophils across polarized monolayers of the intestinal epithelium. Infect. Immun. 66, 4237-4243 (1998).
- Savkovic, S. D., Koutsouris, A., Hecht, G. Attachment of a noninvasive enteric pathogen, enteropathogenic Escherichia coli, to cultured human intestinal epithelial monolayers induces transmigration of neutrophils. Infect. Immun. 64, 4480-4487 (1996).
- Agbor, T. A., Demma, Z. C., Mumy, K. L., Bien, J. D., McCormick, B. A. The ERM protein, ezrin, regulates neutrophil transmigration by modulating the apical localization of MRP2 in response to the SipA effector protein during Salmonella typhimurium infection. Cell Microbiol. 13, 2007-2021 (2011).
- Pazos, M., et al. Multidrug resistance-associated transporter 2 regulates mucosal inflammation by facilitating the synthesis of hepoxilin A3. J. Immunol. 181, 8044-8052 (2008).
- Agace, W. W., Patarroyo, M., Svensson, M., Carlemalm, E., Svanborg, C. Escherichia coli induces transuroepithelial neutrophil migration by an intercellular adhesion molecule-1-dependent mechanism. Infect. Immun. 63, 4054-4062 (1995).
- Bhowmick, R., et al. Systemic Disease during Streptococcus pneumoniae Acute Lung Infection Requires 12-Lipoxygenase-Dependent Inflammation. J. Immunol. , (2013).
- Hurley, B. P., Pirzai, W., Mumy, K. L., Gronert, K., McCormick, B. A. Selective eicosanoid-generating capacity of cytoplasmic phospholipase A2 in Pseudomonas aeruginosa-infected epithelial cells. Am. J. Physiol. Lung Cell Mol. Physiol. 300, 286-294 (2011).
- Hurley, B. P., Sin, A., McCormick, B. A. Adhesion molecules involved in hepoxilin A3-mediated neutrophil transepithelial migration. Clin. Exp. Immunol. 151, 297-305 (2008).
- Frank, D. W. Research Topic on Pseudomonas aeruginosa, Biology, Genetics, and Host-Pathogen Interactions.. Front. Microbiol. 3, 20 (2012).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Lung infections associated with cystic fibrosis. Clin. Microbiol. Rev. 15, 194-222 (2002).
- Bucior, I., Mostov, K., Engel, J. N. Pseudomonas aeruginosa-mediated damage requires distinct receptors at the apical and basolateral surfaces of the polarized epithelium. Infect. Immun. 78, 939-953 (2010).
- Kierbel, A., et al. Pseudomonas aeruginosa exploits a PIP3-dependent pathway to transform apical into basolateral membrane. J. Cell Biol. 177, 21-27 (2007).
- Lee, C. A., et al. A secreted Salmonella protein induces a proinflammatory response in epithelial cells, which promotes neutrophil migration. Proc. Natl. Acad. Sci. U.S.A. 97, 12283-12288 (2000).
- Zurawski, D. V., Mumy, K. L., Faherty, C. S., McCormick, B. A., Maurelli, A. T. Shigella flexneri type III secretion system effectors OspB and OspF target the nucleus to downregulate the host inflammatory response via interactions with retinoblastoma protein. Mol. Microbiol. 71, 350-368 (2009).
- Brazil, J. C., et al. Neutrophil migration across intestinal epithelium: evidence for a role of CD44 in regulating detachment of migrating cells from the luminal surface. J. Immunol. 185, 7026-7036 (2010).
- Lawrence, D. W., et al. Antiadhesive role of apical decay-accelerating factor (CD55) in human neutrophil transmigration across mucosal epithelia. J. Exp. Med. 198, 999-1010 (2003).
- Hodges, K., Hecht, G. Interspecies communication in the gut, from bacterial delivery to host-cell response. J. Physiol. 590, 433-440 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados