Method Article
体外 共生分析评估病原体诱导中性粒细胞跨上皮迁移
摘要
中性粒细胞跨上皮迁移,以应对粘膜细菌感染,有助于上皮损伤和临床疾病。已经开发出一种 体外 模型,结合了病原体、人类嗜中性粒细胞和在转井过滤器上生长的极化人类上皮细胞层,以促进研究,以解开协调这一现象的分子机制。
摘要
粘性表面是预防致病生物的防护屏障。当感应病原体导致组织与迁移的炎症细胞(主要是嗜中性粒细胞)的渗透时,先天免疫反应被激活。如果过度或处于未解决状态,此过程可能会对组织造成破坏性破坏。 可利用 体外 培养模型研究病原体诱导中性粒细胞跨上皮迁移中涉及的独特分子机制。这种类型的模型在实验设计中提供了多功能性,为控制病原体、上皮屏障或中性粒细胞提供了机会。在透水转井过滤器上生长的极性上皮单层的气质表面的致病感染,在生理上与玄武岩相关,对应用于玄武岩表面的嗜中性嗜血杆菌进行肛盖跨上皮迁移。此处描述的 体外 模型演示了在极化肺上皮单层中演示中性粒细胞迁移所需的多个步骤,该单层已感染致病性 P. aeruginosa (PAO1)。描述了用人类衍生的肺上皮细胞对透水转井进行播种和培养,同时从整个人类血液中分离中性粒细胞,并培养PAO1和非致病性K12 大肠杆菌 (MC1000)。 移民过程和对成功迁移的嗜中性粒细胞的定量分析,已动员起来应对致病性感染,并显示具有代表性的数据,包括正对照和负对照。这种 体外 模型系统可以操纵并应用于其他粘性表面。涉及中性粒细胞过度渗透的炎症反应可能对宿主组织具有破坏性,并且可能发生在没有致病性感染的情况下。通过实验操纵本文所述的 体外 共生检测系统,更好地了解促进中性粒细胞跨上皮迁移的分子机制,对于确定一系列粘膜传染病和炎症性疾病的新治疗目标具有重大潜力。
引言
粘胶表面作为物理和免疫屏障,为防止外部威胁在环境中普遍存在提供保护。当致病生物入侵2时,这种保护性上皮屏障可能会受到损害。在细菌病原体的情况下,这种相遇往往通过激活先天免疫系统和触发被称为嗜中性粒细胞2-4的第一反应器颗粒细胞的快速动员煽动炎症过程。促进中性粒细胞招募的化学诱因剂部分由粘膜上皮细胞产生,试图摆脱宿主的违规病原体2-4。粘膜上皮表面过度或未解决的中性粒细胞渗透可引起重大病理学1,5。这是抗菌中性粒细胞库5-7造成的非特异性组织损伤的结果。在这种情况下,中性粒细胞的细菌清除能力因传染性侮辱期间宿主组织的破坏而黯然失色。 保护性上皮屏障功能的破坏可导致基础组织对微生物和/或毒素的进一步暴露,进一步加剧疾病病理学8,9。这些后果可以在多个器官系统中观察到,包括肺和消化道1,5。此外,非感染性炎症条件,如严重的哮喘发作,慢性阻塞性肺病(COPD),急性呼吸窘迫综合征(ARDS)和炎症性肠病(IBD)的特点是,通过过度的嗜中性反应4,5,10-12的粘膜上皮屏障的病理突破。
粘体感染后中性粒细胞招募的复杂过程涉及几个分门别化步骤1,5,13,14。首先,嗜中性粒细胞必须通过一系列细胞对细胞的相互作用来脱离循环,促进跨内皮迁移1,13。中性粒细胞接下来导航现有的间歇空间,其中包含细胞外基质1,14。要到达受感染的粘膜的流明,中性粒细胞必须迁移穿过上皮屏障1,4,5。这种复杂的多步骤现象往往被综合使用体内动物模型感染15。这些模型有助于确定特定因素的必要性,如化疗因子、粘附分子或参与整个过程的信号通路,但在很大程度上不足以解决对每个不同分门别析步骤16至关重要的分子贡献。培养体外系统建模跨内皮,转矩阵,或中性粒细胞的跨上皮迁移在这方面特别有用1,14,16,17。
已发展出一套强大的共生检测系统,以破译负责中性粒细胞跨上皮迁移的机制,以应对18-22年的致病性感染。该模型涉及用细菌病原体感染极化人类上皮细胞层的 apical 表面,然后将新分离的人类中微子应用到基底层表面 18-22。中性粒细胞迁移跨越上皮屏障,以响应18,21-23年致病性感染后分泌的上皮衍生化学产品。该系统采用肠道和肺上皮培养物,暴露于适当的组织特定细菌病原体,并揭示了新的分子机制可能重要的中性粒细胞招募过程中,粘膜感染3,8,19,24-28。这种 体外 共生模式的优点是,一种还原方法使研究者能够在控制良好、可重现、相当便宜的系统中实验性地操纵病原体、上皮屏障和/或中性粒细胞。从这种方法中收集的见解可以有效地利用在中性粒细胞招募期间使用 体内 感染模型22,29,30进行分门别析事件的集中分析。
本文演示了成功建立这种可重复模型以探索病原体诱发的中微子跨上皮迁移所需的多个步骤。本文介绍了感染病原体 伪多莫纳斯动脉鲁吉诺萨的 肺上皮屏障:然而,其他组织表皮和病原体可以替代与轻微的修改。在倒置胶原蛋白涂层透气透水过滤器上对极化肺上皮细胞层的播种和培养进行了详细的介绍,致病性 P.aeruginosa 的生长和中微粒细胞从全血中分离也详细介绍了这一点。这些组件如何结合观察病原体诱发的中微子跨上皮迁移,并结合适当的正负对照组进行,以建立可重复的检测。本文结合文献中的具体研究,探讨了这种方法研究病原体诱导中性粒细胞跨上皮迁移各个方面的多功能性。
研究方案
步骤 (1-3) 应在层压流罩下的无菌环境中执行。
1. 胶原蛋白涂层透水井
- 制作 30μg/ml 胶原蛋白溶液。稀释 3 毫克/毫升胶原蛋白库存 1:100 在 60% 乙醇,已通过 0.2 μm 过滤器单元。
- 漩涡稀释了 30μg/ml 溶液。注意:没有必要涡流3毫克/毫升胶原蛋白库存溶液,因为这个解决方案是相当粘稠的,气泡可能会引入,可能会降低管道时的准确性。
- 从外部包装中取出 0.33 厘米2 生长面积的孔径为 3 μm 的透水井,并将包含 12 个跨井的 24 井板倒置在发动机罩内。
- 从底部板上抬起来,放在一边。注意: 特兰斯韦尔斯现在将倒置休息在 24 井板的盖子上
- 打开本森燃烧器。火焰恒河不育,让冷却。
- 使用无菌血肿,将转井转移到 150 mm x 25 mm 的培养皿中,使其处于倒置位置。注意:一定要保持空的24井板加盖子的不育性,一旦它们被播种上皮细胞,用于容纳转井。
- 将 30μg/ml 胶原蛋白溶液的 70 μl 输送到每个倒置转井的滤膜上。注意:表面张力应保持此溶液体积到位,因为在访问下部表面时,滤膜周围没有墙壁。小心胶原蛋白溶液不会滴落到透水井的一侧,避免在涂层过程中移动转井。
- 将培养皿的盖子关闭至少 4 小时,以便乙醇溶液蒸发。在此过程中保持不育,请保持发动机罩风扇和紫外线亮起。
- 转井干燥后,只要培养皿盖到位并保持不育,它们可以立即使用或在室温下储存长达一周。
2. 种子转井的上皮细胞的通道烧瓶
(本协议特别描述了处理肺上皮细胞系H292,用于生成在输血井上生长的上皮屏障。其他上皮细胞系可以稍作修改使用。
- 通过在RPMI 1640中加入10%的热灭活胎儿牛血清(HI-FBS)和1x青霉素/链霉素来准备培养介质。
- 温暖的介质,特普辛-EDTA(T-EDTA)和D-PBS在37°C水浴。
- 从孵化器中取出含有细胞的T-75烧瓶,用倒显微镜直观地评估汇合。注意:使用 H292 细胞时,烧瓶应接近或完全汇合。
- 从烧瓶吸气介质。通过在盖上松开盖层的下一个溶液来缩短细胞干燥的时间长度。
- 将 5 毫升 D-PBS 添加到 T-75 烧瓶和漩涡中。避免产生气泡。按愿望删除 PBS。
- 将 3 毫升 T-EDTA 添加到 T-75 烧瓶中,然后旋转以覆盖底部。
- 取出大部分 T-EDTA,在 T-75 烧瓶中留下约 0.3 毫升。
- 在细胞表面区域分布少量T-EDTA,并在标准培养条件下(37 oC,5%CO2)放置在加湿的孵化器中。
- 一段时间后,从孵化器中取出烧瓶。注意:细胞应通过轻轻敲击烧瓶侧面的烧瓶,轻松脱离烧瓶表面。现在,当显微镜下可视化时,细胞应该四舍五入并浮动。H292细胞的平均时间为5-10分钟。
- 在烧瓶中加入 10 毫升培养介质,以中和 T-EDTA 并重新添加细胞。将细胞溶液绘制成移液器尖端,并弹出到含有细胞的烧瓶表面约五次,以补充所有细胞。
- 将再吸收的细胞转移到15毫升的管子上,用于播种转井。注意:以这种方式准备的再悬念 H292 细胞的浓度应介于大约 1 x 106 -1.8x 106 细胞/毫升之间。
3. 播种胶原蛋白涂层透水井与上皮细胞
- 将 15 毫升管中的 70μl 再喷出的细胞溶液添加到每个倒置胶原蛋白涂层转井中。注意:H292细胞解决方案的浓度范围在 1 x 106-1.8 x 106 细胞/毫升之间,将产生大约 70,000-120,000 个细胞/转井。
- 通过定期轻轻倒置管混合细胞悬架,以防止细胞在播种转井时沉降到 15 毫升管的底部。注意:不要涡流细胞,并小心移液器尖端不直接接触胶原蛋白涂层膜过滤器。
- 一旦所有倒置的转井都播种了上皮细胞,更换培养皿盖,并小心地放置在组织培养孵化器中,加湿,37°C,5%CO2。小心避免干扰已添加到胶原蛋白涂层滤膜中的细胞悬浮。
- 在组织培养孵化器中保持倒置的转井,加湿,37°C,5%CO2 过夜。注意:在整个夜间孵化过程中,含有细胞的液体气泡应与透水滤膜保持相关。如果滤膜因液体蒸发或液体滴到转井侧而变干,上皮层可能无法正常生长。
- 第二天,将1毫升介质加入原始无菌24井板中,然后使用消毒的血量母翻转每个倒置的转井,放入每口含有1毫升介质的油井中。
- 将 0.2 毫升介质添加到每个转井的顶室中,并返回组织培养孵化器,加湿、37 oC、5% CO2。
- H292倒置转井可用于播种后8天至1个月。注意:我们建议在播种后至少等待8天,以确保上皮单层已完全形成并表现出功能屏障。人们可以通过确定单层是否能够限制蛋白马萝卜过氧化酶(HRP)的跨上皮通量来测试H292上皮屏障。
4. 为跨井上上皮层感染细菌的准备
- 实验前一天,从伪多莫纳斯隔离阿加板中提取一个 P.aeruginosa PAO1菌落,从Luria-Bertani(LB)Agar板中提取一个K12 大肠杆菌 MC1000菌落,放入含有3毫升LB汤的单独管中。注意 :Aeruginosa 是人类的病原体,在处理这种生物体时应采取标准的BSL2安全措施。
- 在 37 oC 环境中以 225 rpm 的速成一夜摇动。
- 第二天,从密集的细菌培养物中取出1毫升,放入1.5毫升埃彭多夫管中。
- 在微浮子中旋转15,800 x g 5分钟,然后去除超自然。
- 提前用钙和镁(HBSS+)准备汉克斯平衡盐溶液。将 23.8 克 HEPES 和 97.5 克 HBSS® 粉末加入 9.5 升蒸馏水中。向解决方案添加少量的 10 M NaOH,同时监控 pH,直到达到 7.4 的稳定 pH。将音量调高至10升,并存储在4°C。
- 用1毫升HBSS+来补充每个细菌颗粒。漩涡,以确保实现均匀的细菌悬浮。
- 在 15,800 x g 下再次旋转 5 分钟,并去除超自然。
- 用 0.6 毫升 HBSS® 和 MC1000 颗粒(0.5 毫升 HBSS®)来补充 PAO1 颗粒。漩涡细菌悬浮。
- 进一步稀释 PAO1 和 MC1000 在 HBSS® 中 1:100 重新喷出的颗粒。例如,将 0.6 毫升 PAO1 再喷出颗粒中的 50 μl 添加到 5 毫升 HBSS® 中。注意:使用光学密度 (OD) 测量来确定培养密度以及标准菌落形成单元 (CFU) 稀释电镀方法,以这种方式编写的 PAO1 和 MC1000 解决方案始终在 3 x 107-6 x 107 CFU/ml 之间产生。细菌培养的密度与 600 nm 的培养的 OD 测量呈正相关,此相关性可用于估计细菌细胞浓度。为了确认细菌细胞的浓度,这种培养可以稀释到非常低的估计浓度,并镀在一个阿加板上,这样人们就会期望在板上存在30-200个细菌细胞。细胞分布在板块中,在37°C下在一夜之间孵化,这样每个细胞形成一个足够大、可见的细胞群,然后就可以计算出殖民地。
5. 将嗜中性粒细胞从全血中分离
- 酸柠檬酸葡萄糖溶液 (ACD) 用作抗凝血剂,通过添加 6.9 克柠檬酸、12.5 克柠檬酸钠和 10 克葡萄糖到 500 毫升蒸馏水来制备。一旦所有组件溶解,ACD 解决方案将通过 0.2 μm 滤光单元进行灭菌。将 ACD 解决方案存储在 4 oC。
- 在抽血之前,将 5 毫升 ACD 添加到 50 毫升注射器中,并在管中附上 21 x 3/4 G 蝴蝶针和 12 根蝴蝶针。
- 涂抹静脉,用酒精擦拭静脉,并插入针头。注:任何涉及人类主体的研究协议都必须经机构审查委员会批准,并且必须获得每个献血者的书面知情同意。例如,使用此协议进行的实验得到了马萨诸塞州总医院机构审查委员会的批准,并分配了协议#1999-P-007782。
- 慢慢抽取 45 毫升血液,确保注射器中一次血液与 ACD 混合。
- 绘制 45 毫升(总体积为 50 毫升)时,在取出针头之前解开旅游服。取出针头时,立即用无菌纱布对伤口施加压力。
- 在大约 5-10 秒内将血液缓慢地输送到 50 毫升管的侧面。
- 在离心机中旋转1,000 x g,在室温下刹车停用20分钟。注意:在PBS中稀释全血的额外步骤-和在离心前小心地将稀释的血液叠加到Ficoll-Paque上,通过更有效地将浅色外衣与颗粒8分离,达到略高的中性粒细胞纯度水平。省略此步骤有助于节省时间,而不会为此测定的目的大幅影响产量或纯度,因此我们赞成不将血液覆盖到 Ficoll-Paque 步骤上。
- 当血液旋转时,非常缓慢地将1克明胶加入50毫升加热的汉克斯平衡盐溶液中,不含钙和镁(HBSS(-),以准备2%明胶溶液。将解决方案保持在 37 oC。
- 使用用西格玛科特处理的玻璃移液器尖端吸气并丢弃 50 毫升血液管中的血浆。
- 继续非常小心地吸气,去除含有白血球(包括淋巴细胞)的浅黄色外套。
- 随着浅黄色外衣慢慢被移除,红血球 (RBC) 层上方的白色黄色多云物质将消失。一旦脱下浅黄色外套,RBC 层就可以在从管子上方查看时清晰可视化。
- 尽量不要打扰 RBC 层,因为颗粒细胞(大部分是嗜中性粒细胞)靠近 RBC 层表面,但不可见。
- 在 15 毫升 RBC 层的体积中,添加 30 毫升加热 2% 明胶溶液(RBC 层的 2 倍体积)。
- 倒管轻轻混合,注意尽量减少气泡的形成。
- 在 37 oC 孵化 25 分钟。 注意: Rbcs 应聚合并稳定到底部。作为明胶的替代品,大分子量脱氧核桃体可用于沉积物RBC8。
- 孵化后,将含有颗粒细胞的顶层浅红色溶液转移到带移液器的新的 50 毫升管中,在移植过程中小心不要打扰已固定的暗 RBC 层。分离后,丢弃黑暗的 RBC 层。
- 旋转转移含有颗粒细胞和离心机中一些 RBC 的浅红色溶液,在 1,000 x g 下,在室温下启动制动器 10 分钟,以颗粒细胞。
- 小心地倒掉或吸气超自然,因为离心后形成的红色细胞颗粒通常松动。
- 提前准备 RBC 裂解缓冲器,在烧瓶中加入 8.29 克氯化铵 (NH4Cl)、1 克碳酸氢钠 (NaHCO3)和 0.038 克 EDTA 至 1 升蒸馏水,储存在 4 oC 中。将RBC裂解缓冲区存储在4°C。
- 用少量的冷RBC裂解缓冲器重新喷出并分解红细胞颗粒。一旦细胞颗粒在溶液中,用RBC裂解缓冲器填充管到50毫升。注意:此时和前进方向,将细胞保持在冰上或 4 oC。
- 在离心机中旋转300 x g,在4°C下旋转10分钟 ,然后倒掉或吸气超自然人。注意:超自然人将有点红,含有解体RBC。此时,弹丸应该是黄色的白色。如果大量 RBC 仍如红丸所示留在颗粒中,则可以重复步骤 5.20-5.21。如果步骤 5.20 中的红粒没有充分分解,则细胞颗粒中仍保留着重要的 RBC。
- 用少量的 HBSS(-) 重新填充并分解白颗粒,然后用 HBSS (-) 将管子填充到 50 毫升。注意:HBSS(-)而不是HBSS®应该用于补充白细胞颗粒。HBSS(-)缺乏钙和镁。
- 在离心机中以300 x g再次旋转,在4°C下旋转10分钟 。
- 倒掉超自然物,将颗粒重新注入到 1 毫升 HBSS (-) 的最终体积。
- 在 1.5 毫升 Eppendorf 管中将 1 毫升细胞悬架的 5μl 添加到 250 μl HBSS(-) 中,然后通过移液器轻轻上下混合。
- 将 25μl 稀释细胞悬架添加到 25 μl 0.4% 特里潘蓝色。
- 在标准测高仪的每一侧加入 12μl 的混合物。
- 计算排除Trypan蓝色染料并存在于血细胞仪两侧中间方块的活细胞数量。
- 要计算细胞浓度,将 2 平方的平均值乘以 100(稀释因子),然后乘以 104, 以给出细胞/毫升的数量。
- 将最终浓度调整为 5 x 107 细胞/毫升。如果大于 5 x 107 细胞/毫升,则通过添加 HBSS(-)进行调整。如果更少,颗粒细胞和恢复到适当的体积。
- 将细胞保存在冰上,直到准备好进行迁移检测。注意:这些细胞代表白血球的粒细胞群。从整个人类血液中分离出的大多数颗粒细胞是嗜中性粒细胞。细胞被保存在冰上暂停在HBSS(-),直到除了迁移检测,以保持细胞在静止状态。
6. 为迁移测定准备上皮细胞层
(这些步骤不需要在无菌罩内执行。
- 从孵化器 24 井板支撑上皮层中取出,这些上皮层已在跨井滤膜的底面培养了至少 8 天。
- 用血量管抓住每个转井的边缘,从 24 井板中抬起来,将转井倒置在废桶上,从转井的内室丢弃培养介质。将每个转井浸入含有 HBSS® 的洗涤烧嘴中,用 HBSS® 填充转井的内室。将内室的液体丢弃到废桶中。
- 在 HBSS+中重复第二次洗涤的步骤 6.2。洗完两次后,将转井放入一个新的 24 井板中,每口井中含有 1 毫升 HBSS® 。注意:所有洗涤应使用加热至 37 oC 的 HBSS® 进行。
- 观察每个转井的顶室,以评估上皮细胞层的完整性。注意:HBSS® 放置在包含 1 毫升 HBSS®的 24 井板的井中时,不应泄漏并填充透水井的顶室。
- 仔细观察每个转井后,将 0.2 毫升 HBSS® 添加到顶室中。
- 将孵化器置于 37°C,5%CO2 放在加湿室中30-60分钟,以平衡上皮细胞层。
7. 中性粒细胞跨上皮迁移测定
- 从孵化器中取出 24 井板,在 HBSS+ 中等于洗净的转井。
- 用血量管抓住每个转井,将顶部的液体丢弃到废桶中。
- 将每个横井倒置在 150 mm x 25 mm 培养皿中。
- 在六个倒置的跨井中,添加 25μl 的 HBSS® 。对三个倒置的转井,感染25μl P. aeruginosa (PAO1) 稀释在HBSS®准备如第4步所述。到最后三个倒置的转井,感染25μl 大肠杆菌 K12(MC1000)稀释在HBSS®准备在第4步。这是大约 0.8 x 106-1.5 x 106 CFU/上皮层为每个细菌物种,因为第 4 步准备的细菌溶液的浓度约为 3 x 107-6 x 107 CFU/ml。
- 在 37°C孵化,5%CO2 在加湿室中孵化60分钟。
- 通过将 5 μl 的 10 mM fMLP 库存添加到 5 毫升 HBSS® 中,为中性粒细胞迁移提供 10μM 解决方案,为中性粒细胞迁移准备 fMLP 作为正控制。
- 用血肿抓住并翻转回底部室中含有 1 毫升 HBSS® 的 24 井洗盘,洗净横流井。将 0.2 毫升 HBSS® 添加到顶部腔室中。
- 用血肿抓住转井,从第一个洗盘中取出。在将转井放入第二个包含 1 毫升 HBSS® 的 24 井洗涤板之前,将顶部腔室中的液体丢弃到废桶中。将 0.2 毫升 HBSS® 添加到顶室中。
- 重复步骤 7.8 一次,共洗 3 次。注意:所有输水井都应接受相同的处理和清洗方案,无论他们是否感染了细菌,以确保所有被检测的跨井都以同样的方式纵。60分钟感染PAO1或MC1000不会降低生存能力或改变H292单层的屏障特性,分别由乳酸脱氢酶毒理学检测和HRP通量检测评估,分别为18,22。
- 通过在 24 井板的 12 口井中加入 1 毫升 HBSS® 来准备 24 井迁移板。注意:此盘可以提前准备。
- 第三次洗涤后,使用血量母将来自横井顶部的液体丢弃到废桶中,并将三个未受感染的转井放入包含 1 毫升 HBSS® 的 24 井迁移板的三口井中,表示负控制。
- 将 10μM 溶液的 10μl 放入 24 井迁移板的三口井中,每口井包含 1 毫升 HBSS® (100 nM)。
- 将三口未受感染的转井放入含有 100 nM fMLP 的 24 井迁移板的三口井中,这对孤立嗜中性粒细胞的迁移能力具有正控制。
- 将感染 PAO1 的三口输油井和三口感染 MC1000 的跨井分别放入包含 1 毫升 HBSS®的 24 井迁移板的三口井中。将 0.1 毫升 HBSS® 添加到每个横流井的顶室。
- 在每个转井的 0.1 毫升 HBSS® 之上,仔细添加步骤 5 中性粒细胞悬架 (5 x 107 细胞/毫升) 的 20 μl。注意:这表示大约 1 x 106 嗜中性粒细胞/转井。
- 在37°C的孵化,5%的二氧化碳在 加湿室2小时,使中性粒细胞的跨上皮迁移。
- 准备一个标准曲线,以确定 2 小时后迁移的嗜中性粒细胞的数量。将 40μl 的中性粒细胞悬架(5 x 107 细胞/毫升)添加到 2 毫升 HBSS (+) 中,将 1 毫升转移到 1 毫升 HBSS (+) 中,并执行连续 2 倍稀释 8 次,总共 10 个标准,从大约 2,000 个细胞/毫升到 1 x 106 个细胞/毫升不等。包括 1 毫升 HBSS (+) 用于空白。
- 迁移 2 小时后,用血压器抓住横井,轻轻敲击 24 井迁移板的内壁。丢弃转井。
- 使用 10X 目标在倒置显微镜下查看 24 井迁移板下的中性粒细胞在井中的迁移情况(参见 图 1, 了解每个条件下迁移的嗜中性粒细胞的图像)。
- 在 24 井迁移板、每个标准和空白中使用的每口井中加入 50μl 的 10% 三吨 X-100。
- 在 4 oC 时以低速旋转 24 井迁移板、标准和空白 20 分钟。
- 提前准备1M柠檬酸盐缓冲区。在烧瓶中加入 52.5 克柠檬酸和 73.5 克柠檬酸钠至 400 毫升蒸馏水。将pH到4.2。加入蒸馏水,最终溶液为500毫升。将解决方案存储在4°C。
- 当天准备 ABTS 基板解决方案。将 3 片 ABTS 片剂(每片 10 毫克)和 5 毫升 1 M 柠檬酸盐缓冲器添加到 45 毫升蒸馏水中。允许平板电脑完全溶解在溶液中。在需要 ABTS 基板溶液之前,暂不添加 50μl 的 30% 过氧化氢(参见步骤 7.27)。
- 在 24 井迁移板、每个标准和空白中使用的每口井中添加 50 μl 的柠檬酸盐缓冲器。
- 将每个样品的 100 μl 重复转移到 96 井板中。注意:在移动到 96 井板之前,将每个样品中的内容彻底混合非常重要。在转移前至少上下五次将解决方案上上下下。
- 混合后将每个标准的 100 μl 和空白转移到 96 井板(重复中的空白)。
- 在 ABTS 溶液和涡流中加入 50μl 的 30% 过氧化氢。
- 在 96 井板上的每个样品中加入 100μl 的 ABTS 基板溶液。
- 允许板在黑暗中发展5-10分钟。注意:某些油井中应出现绿色,与每口井中中性粒细胞的数量相关。
- 使用微板读取器以 405 nm 的波长阅读。
- 使用以下标准计算在上皮层迁移的嗜中性粒细胞数量,根据该标准,作为标准编制的已知中微子数量与光学密度在 405 nm 测量的过氧化酶活性量之间存在线性正相关关系(参见 图 2 和3, 了解代表性数据)。注意:这种中性粒细胞定量方法利用了中性粒细胞由于骨髓酶表达而表现出的大量过氧化酶活性。可以考虑量化嗜中性粒细胞的替代方法,例如用放射性或荧光化合物对嗜中性粒细胞进行预贴标签的方法。
结果
多项研究表明,病原体感染的上皮层促进中微子跨上皮迁移3,8,19,24-28,31,32。这发生在一个上皮细胞衍生的中性粒细胞化学梯度3,23的病原体特异性诱导。例如,致病 性P.aeruginosa 与肺上皮细胞的顶层相互作用,导致大量嗜中性粒细胞在上皮层18,22,25,26,33,34迁移。这种临床相关的检测系统可以以多种方式进行操作,在与适当的控制配对时,揭开关键病原体和宿主分子贡献者的面纱。
添加到极化上皮细胞层的中性粒细胞层,这些细胞层尚未得到证实,但无法以明显数量迁移。然而,在未受感染的上皮层中应用化疗吸引梯度将推动大量嗜中性粒细胞跨越。在调查中性粒细胞在病原体感染上皮层的迁移时,在每个检测中分别包括这些负对照和正对照组非常重要。负控器在没有信号的情况下确定穿过上皮层的嗜中性粒细胞的背景数。当培养的上皮细胞建立功能屏障时,这个数字应该很低。高背景迁移使对病原体感染上皮所取得结果的解释复杂化。正控制涉及在上皮层上应用中性粒细胞化疗吸引剂(如 fMLP)的梯度,并用于确认分离的嗜中性粒细胞是有效的。此外,如果上皮层使用某些试剂进行预处理,以评估其对病原体诱导的跨上皮迁移的影响,fMLP 梯度可用于控制试剂可能对嗜中性粒细胞在上皮层中导航的能力的任何影响,而不管病原体介导效应如何。此检测系统中常采用的另一种控制涉及与病原体并行感染非致病细菌的上皮层。这种控制可以用来区分与细菌相互作用后的相关上皮反应,并协助识别刺激中性粒细胞跨上皮迁移所需的致病因素。
中微子跨上皮迁移可以定性和定量地评估。在将嗜中性粒细胞加入玄武岩表面后,在完成2小时的孵育后,将去除转井,在24井迁移板底部的井中可以看到完全穿过上皮层迁移到顶层的嗜中性粒细胞。每个情况的代表性图像显示在图1中,使用倒置光显微镜可视化。很少观察到嗜中性粒细胞在没有强加化学梯度(HBSS+)的情况下在未受感染的上皮层中迁移,并在测定中表示背景水平(图1A)。相比之下,当提供fMLP梯度时,大量移位的嗜中性粒细胞是显而易见的(图1B)。上皮感染非致病性大肠杆菌MC1000导致很少可见的移位嗜中性粒细胞,而许多移位的嗜中性粒细胞在上皮层感染肺致病性P.aeruginosa(PAO1)(图1C和1D)时是可观察到的。
在实验中迁移的嗜中性粒细胞通过测量它们的骨髓酶活性来量化。使用标准曲线来估计移位的嗜中性粒细胞的数量。嗜中性粒细胞的数量与中性粒细胞裂解后测量的过氧化酶活性量呈正相关,其值在标准曲线选择的中微子数范围内表现出线性关系(2 x 103-1 x 106细胞/毫升)(图 2)。大量的嗜中性粒细胞在上皮层之间迁移,以响应提供的 fMLP 梯度或响应感染 PAO1 的上皮层(图 3)。在没有刺激(HBSS+)或非致病性大肠杆菌MC1000的上皮感染后迁移的嗜中性粒细胞数量低于检测限值(图3)。图3中提供的数据表示平均移位中性粒细胞数量,误差条表示三个独立井的标准偏差/状况。图3中描述的定量数据与图1中显示的代表性井图像一致。
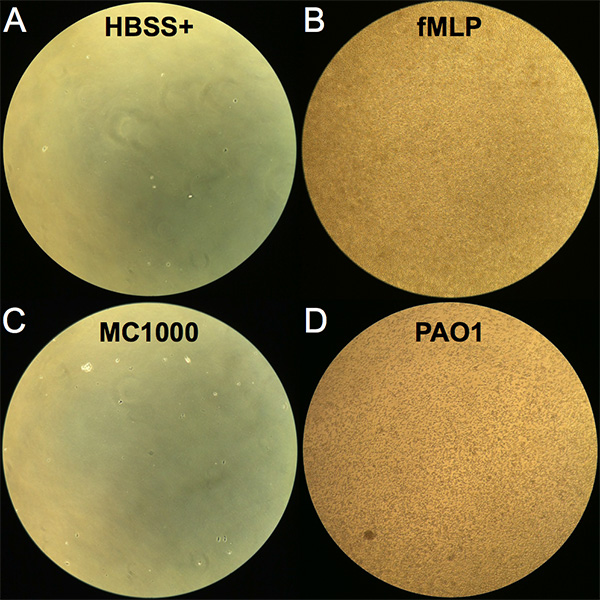
图1。跨上皮迁移后嗜中性粒细胞的图像。 在2小时潜伏期后,用倒置光显微镜在24井迁移板底部井(杏室)放大10倍处观看图像,将嗜中性粒细胞添加到顶井(玄武岩室)。(A) 负控制 HBSS+.(B) 积极控制施加 fMLP 化学梯度。(C) 感染非致病性 大肠杆菌 K12 (MC1000) 的上皮细胞层。(D) 感染致病性 气 管的上皮细胞层 (PAO1)。 单击此处查看更大的图像。
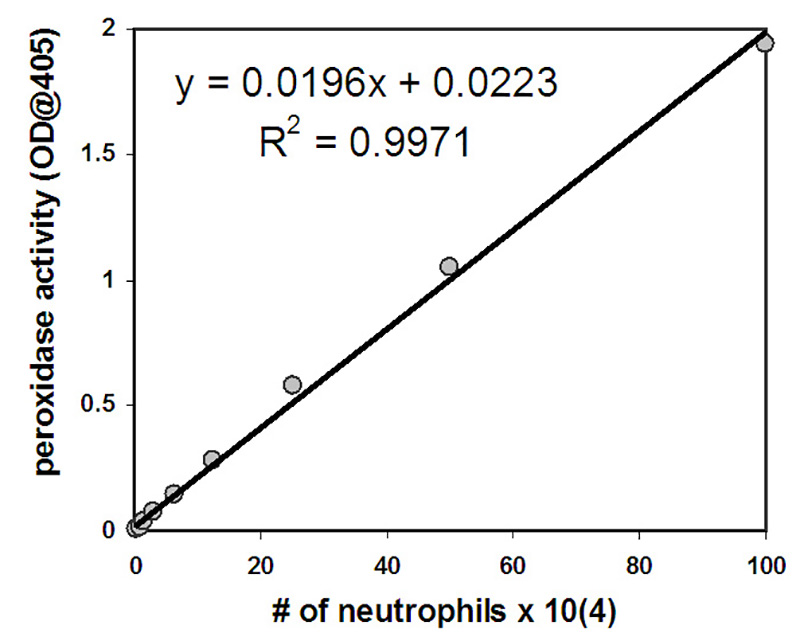
图2。开始浓度为1×106 的嗜中性粒细胞受到9次2倍稀释。 裂解后,确定过氧化酶活性量,并在 x 轴上绘制中性粒细胞的数量,在 y 轴上绘制过氧化酶活性图。所描绘的方程可用于根据每口油井中测量的过氧化酶活性量,确定移位后每口井中存在的嗜中性粒细胞的数量。
单击此处查看更大的图像。

图3。移位中性粒细胞的量化。 移位中性粒细胞的数量通过相对骨髓酶活性与已知中微子数量的线性标准曲线进行量化。在上皮细胞感染致病性 P.aeruginosa(PAO1) 或建立中微子化学吸引剂fMLP的腹膜到基底梯度后,观察到大量移位的嗜中性粒细胞。在上皮细胞感染后,仅通过非致病性大 肠杆菌 K12 (MC1000) 治疗或负控制缓冲 (HBSS+) 观察到无法检测的转基因嗜中性粒细胞数量。 单击此处查看更大的图像。
讨论
中微霉素在粘膜上皮表面的迁移是感染细菌病原体后疾病病理学的一个常见特征。本文描述的方法提供了一种快速、直接的方法,利用人类细胞衍生的体外人工造影检测系统,对细菌感染引发的炎症过程的一个特征进行实验隔离。该系统最初是利用极化肠道上皮细胞开发的,该细胞感染了肠道病原体,包括沙门氏菌、西盖拉弹性内膜和各种致病性大肠杆菌8,19,24,27,28。这些致病生物中的每一个都能够驱动嗜中性粒细胞穿越极化肠道上皮单层生长在倒胶原蛋白涂层透水透水透水过滤器上。该实验系统经过改造,探索肺上皮屏障和病原体诱发的中性粒细胞跨上皮迁移18,26。除了H292之外,其他几个气道上皮细胞系也用于这些研究,包括通常引用的A549、BEAS-2B和Calu-3肺上皮细胞系22,26。P. aeruginosa在肺部引发炎症,造成重大损害,包括急性肺炎和囊性纤维化等疾病。如前所述,肺病原体P.aeruginosa容易诱发中性粒细胞在感染肺上皮细胞时转上皮迁移,这是肺炎和囊性纤维化观察到的炎症过程的一个显著特征。此外,在本分析25中,包括囊性纤维化患者的临床分离物在内的几种额外的P.aeruginosa菌株已被确认为诱导剂。肺炎链球菌和肺炎克勒布西拉、葛兰素阳性和革兰氏阴性细菌病原体通常与肺炎有关,并已证明能够利用体外共生模型26,32诱导中性粒细胞跨上皮迁移。因此,这个模型系统提供了一个强大的体外方法,利用人类衍生的细胞来探索由粘性病原体引起的炎症过程。
标准组织培养模型常用于探索宿主病原体相互作用,通常采用生长在平坦塑料表面的上皮细胞16。体外共生测定提供了更大的复杂性,在实验设计16,37,38提供多功能性。生长在透水透水透水器下侧的极性上皮细胞在放置在24井板和面向透水井14,17内顶井的底层时,会形成一个面向底部腔室的顶棚。这种离散的分隔和方向允许分析生理玄武岩到中性粒细胞的apical迁移,以响应强加或上皮细胞产生的化学梯度14,17,23。体外共生系统能够研究可归因于跨上皮迁移的特定分子机制,在肺感染1,15体内模型的复杂环境中,这种机制可能难以解决。有关使用体外共生模型识别中性粒细胞跨上皮迁移所涉及的关键因素的任何发现,可随后使用急性肺炎15,22的体内模型进行相关性验证。
体外共生检测可以以多种方式进行操作,以研究一系列现象。以细菌基因为重点的研究有助于中性粒细胞的招募,可以通过对25,39,40种感兴趣的特定病原体进行分析。从这种分析中揭示的基因可能代表新的毒性因素和抗感染剂的潜在治疗目标。中性粒细胞也可以代表分析的重点。例如,嗜中性粒细胞使用几个细胞表面粘附分子,以促进跨上皮迁移5,14,34,41,42。关键的细胞对细胞相互作用可能因化疗吸引驱动迁移和嗜中性粒细胞相互作用的组织而异。在评估病原体诱导的跨上皮迁移之前,中性粒细胞可以用抑制剂、抗体或拮抗剂进行预处理,以识别对这个过程至关重要的表面分子或信号通路。通过感应信号和通过可溶性介质43与免疫细胞通信,上皮细胞在感染和炎症中起着至关重要的作用。信号通路、化疗吸引剂的极化分泌以及与细菌或嗜中性粒细胞相互作用的上皮表面粘附分子,都会通过体外辅音检测来研究病原体诱导的中性粒细胞转上皮迁移。这种共养模型的应用揭示了以前不被欣赏的脂质 eicosanoid 化疗吸引剂的重要性,称为赫波西林 A3 3,18,21。Hepoxilin A3由肺和肠道上皮细胞产生,以应对特定病原体的感染,并负责将嗜中性粒细胞从基底层穿过极性上皮单层到受感染的 apical 侧3。因此,体外共生检测是一个强大的探索工具,具有识别介导宿主-病原体相互作用和协调炎症的关键机制的潜力。此外,该系统有可能被调整为高吞吐量筛查方法,以评估选择性抗感染或抗炎治疗的有效性。
总之,我们提供了详细的分步协议,用于调查中微子在渗透性透水过滤器上生长的单层病原体感染肺上皮细胞层的迁移。本文描述的技术可以修改,以研究中性粒细胞在中性粒细胞渗透到疾病状态(如胃肠道或生殖器)的其他粘膜表面的迁移。此外,使用 体外 共生检测系统获得的见解可能与并非由特定传染性药物驱动的各种炎症性疾病有关。具有中性粒细胞穿越保护性上皮屏障到病理程度的粘膜表面的炎症性疾病包括慢性阻塞性肺病、ARDS、哮喘和IBD5,10-12。更深入地了解控制中微子跨上皮迁移的分子机制,可能会为旨在缓解与这些常见疾病相关的破坏性炎症过程的治疗策略提供参考,为改善人类健康提供新的途径。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
这项工作得到了NIH(1 R01 AI095338-01A1)的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| NCl-H292 cells | ATCC | CRL-1848 | |
| RPMI-1640 medium | ATCC | 30-2001 | |
| Pseudomonas aeruginosa PAO1 | ATCC | #47085 | |
| Escherichia coli MC1000 | ATCC | #39531 | |
| D-PBS (1x) liquid | Invitrogen | 14190-144 | without calcium and magnesium |
| Heat Inactivated Fetal bovine serum | Invitrogen | 10082-147 | 10% added to culture medium |
| Penicillin-Streptomycin | Invitrogen | 15140-122 | 100x: 10,000 units of penicillin and 10,000 µg of streptomycin per ml. |
| Trypsin-EDTA (0.05%) | Invitrogen | 25300-062 | 50 ml aliquots are stored frozen at -20 ºC. Aliquot in use can be stored at 4 ºC short-term. |
| Hank's Balanced Salt Solution - HBSS(-) | Invitrogen | 14175-079 | Sterile, without calcium and magnesium |
| Trypan Blue Solution | Invitrogen | 15250-061. | Stock = 0.4% |
| Collagen, Rat Tail | Invitrogen | A10483-01 | Can also be isolated in the laboratory directly from the tails of rats using standard protocols |
| Citric acid | Sigma-Aldrich | C1909-500G | Component of 1 M citrate buffer and acid citrate dextrose (ACD) solution |
| Sodium Citrate | Sigma-Aldrich | S4641-500G | Component of 1 M citrate buffer |
| Dextrose anhydrous | Sigma-Aldrich | D8066-250G | Component of acid citrate dextrose (ACD) solution |
| Ammonium Chloride | Sigma-Aldrich | 213330-500G | Component of red blood cell (RBC) lysis buffer |
| Sodium bicarbonate | Sigma-Aldrich | S6014-500G | Component of red blood cell (RBC) lysis buffer |
| EDTA | Sigma-Aldrich | ED-100G | Component of red blood cell (RBC) lysis buffer |
| HBSS(+) powder | Sigma-Aldrich | H1387-10L | Key component of HBSS+ |
| HEPES | Sigma-Aldrich | H3375-500G | Component of HBSS+ |
| Sigmacote | Sigma-Aldrich | SL2-25ML | Follow vendor instructions to coat glass pipette tips |
| Triton X-100 | Sigma-Aldrich | T-9284 | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) | Sigma-Aldrich | A9941-50TAB | Key component of ABTS substrate solution |
| 30% Hydrogen Peroxide Solution | Sigma-Aldrich | H1009-100ML | Component of ABTS substrate solution |
| N-Formyl-Met-Leu-Phe (fMLP or fMLF) | Sigma-Aldrich | F-3506 | A Stock solution of 10 mM in DMSO should be prepared and aliquots stored at -20 ºC. |
| Gelatin Type B | Fisher Scientific | M-12026 | |
| Pseudomonas isolation agar | Fisher Scientific | DF0927-17-1 | Follow manufacturer’s instructions to make PIA plates |
| Ficoll-Paque PLUS | Fisher Scientific | 45-001-749 | Optional, can improve neutrophil purity |
| Name of Material / Equipment | Company | Catalog Number | Comments |
| 24-well migration plate | Corning Incorporated | #3524 | |
| 24-well wash plate | Falcon | 35-1147 | Can be reused if soaked in 70% ethanol and washed thoroughly prior to reuse |
| 96-well plate | Fisher Scientific | #12565501 | |
| Transwell Permeable Supports | Corning Incorporated | #3415 | Polycarbonate; Diameter: 6.5 mm; Growth area: 0.33 cm2; Dish style: 24-well plate; Pore size: 3.0 µm |
| Petri dish | Falcon | 35-1013 | Each Petri dish holds 24 inverted 0.33 cm2 Transwells. |
| 500 ml 0.2 μm filter / flask | Fisher Scientific | 09-740-25A | To sterilize acid citrate dextrose (ACD) solution |
| 5-3/4 in glass Pasteur pipette | Fisher Scientific | 13-678-20A | Coat tips with Sigmacote prior to use |
| Hemostat | Fisher Scientific | 13-812-14 | Curved, Serrated |
| Invertoskop Inverted Microscope | Zeiss | #342222 | |
| Versa-Max Microplate Reader | Molecular Devices | #432789 |
参考文献
- Burns, A. R., Smith, C. W., Walker, D. C. Unique structural features that influence neutrophil emigration into the lung. Physiol. Rev. 83, 309-336 (2003).
- Hurley, B. P., McCormick, B. A. Intestinal epithelial defense systems protect against bacterial threats. Curr. Gastroenterol. Rep. 6, 355-361 (2004).
- McCormick, B. A. Bacterial-induced hepoxilin A3 secretion as a pro-inflammatory mediator. FEBS J. 274, 3513-3518 (2007).
- Mumy, K. L., McCormick, B. A. The role of neutrophils in the event of intestinal inflammation. Curr. Opin. Pharmacol. 9, 697-701 (2009).
- Chin, A. C., Parkos, C. A. Pathobiology of neutrophil transepithelial migration: implications in mediating epithelial injury. Annu. Rev. Pathol. 2, 111-143 (2007).
- Segel, G. B., Halterman, M. W., Lichtman, M. A. The paradox of the neutrophil's role in tissue injury. J. Leukoc. Biol. 89, 359-372 (2011).
- Weiss, S. J. Tissue destruction by neutrophils. N. Engl. J. Med. 320, 365-376 (1989).
- Hurley, B. P., Thorpe, C. M., Acheson, D. W. Shiga toxin translocation across intestinal epithelial cells is enhanced by neutrophil transmigration. Infect. Immun. 69, 6148-6155 (2001).
- Kohler, H., et al. Salmonella enterica serovar Typhimurium regulates intercellular junction proteins and facilitates transepithelial neutrophil and bacterial passage. Am. J. Physiol. Gastrointest. Liver Physiol. 293, 178-187 (2007).
- Gane, J., Stockley, R. Mechanisms of neutrophil transmigration across the vascular endothelium in COPD. Thorax. 67, 553-561 (2012).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol. Med. 17, 293-307 (2011).
- Nakagome, K., Matsushita, S., Nagata, M. Neutrophilic inflammation in severe asthma. Int. Arch. Allergy Immunol.. 158 Suppl 1, 96-102 (2012).
- Choi, E. Y., Santoso, S., Chavakis, T. Mechanisms of neutrophil transendothelial migration. Front. Biosci. 14, 1596-1605 (2009).
- Louis, N. A., Campbell, E., Colgan, S. P. Model systems to investigate neutrophil adhesion and chemotaxis. Methods Mol. Biol. 412, 257-270 (2007).
- Craig, A., Mai, J., Cai, S., Jeyaseelan, S. Neutrophil recruitment to the lungs during bacterial pneumonia. Infect. Immun. 77, 568-575 (2009).
- Hurley, B. P., McCormick, B. A. Translating tissue culture results into animal models: the case of Salmonella typhimurium. Trends Microbiol. 11, 562-569 (2003).
- Lee, W. Y., Chin, A. C., Voss, S., Parkos, C. A. In vitro neutrophil transepithelial migration. Methods Mol. Biol. 341, 205-215 (2006).
- Hurley, B. P., Siccardi, D., Mrsny, R. J., McCormick, B. A. Polymorphonuclear cell transmigration induced by Pseudomonas aeruginosa requires the eicosanoid hepoxilin A3. J. Immunol. 173, 5712-5720 (2004).
- McCormick, B. A., Colgan, S. P., Delp-Archer, C., Miller, S. I., Madara, J. L. Salmonella typhimurium attachment to human intestinal epithelial monolayers: transcellular signalling to subepithelial neutrophils. J. Cell Biol. 123, 895-907 (1993).
- McCormick, B. A., et al. Surface attachment of Salmonella typhimurium to intestinal epithelia imprints the subepithelial matrix with gradients chemotactic for neutrophils. J. Cell Biol. 131, 1599-1608 (1995).
- Mrsny, R. J., et al. Identification of hepoxilin A3 in inflammatory events: a required role in neutrophil migration across intestinal epithelia. Proc. Natl. Acad. Sci. U.S.A. 101, 7421-7426 (2004).
- Tamang, D. L., et al. Hepoxilin A(3) facilitates neutrophilic breach of lipoxygenase-expressing airway epithelial barriers. J. Immunol. 189, 4960-4969 (2012).
- McCormick, B. A., Parkos, C. A., Colgan, S. P., Carnes, D. K., Madara, J. L. Apical secretion of a pathogen-elicited epithelial chemoattractant activity in response to surface colonization of intestinal epithelia by Salmonella typhimurium. J. Immunol. 160, 455-466 (1998).
- Boll, E. J., et al. Enteroaggregative Escherichia coli promotes transepithelial migration of neutrophils through a conserved 12-lipoxygenase pathway. Cell Microbiol. 14, 120-132 (2012).
- Hurley, B. P., et al. The two-component sensor response regulator RoxS/RoxR plays a role in Pseudomonas aeruginosa interactions with airway epithelial cells. Microbes Infect. 12, 190-198 (2010).
- Hurley, B. P., Williams, N. L., McCormick, B. A. Involvement of phospholipase A2 in Pseudomonas aeruginosa-mediated PMN transepithelial migration. Am. J. Physiol. Lung Cell Mol. Physiol. 290, L703-L709 (2006).
- McCormick, B. A., Siber, A. M., Maurelli, A. T. Requirement of the Shigella flexneri virulence plasmid in the ability to induce trafficking of neutrophils across polarized monolayers of the intestinal epithelium. Infect. Immun. 66, 4237-4243 (1998).
- Savkovic, S. D., Koutsouris, A., Hecht, G. Attachment of a noninvasive enteric pathogen, enteropathogenic Escherichia coli, to cultured human intestinal epithelial monolayers induces transmigration of neutrophils. Infect. Immun. 64, 4480-4487 (1996).
- Agbor, T. A., Demma, Z. C., Mumy, K. L., Bien, J. D., McCormick, B. A. The ERM protein, ezrin, regulates neutrophil transmigration by modulating the apical localization of MRP2 in response to the SipA effector protein during Salmonella typhimurium infection. Cell Microbiol. 13, 2007-2021 (2011).
- Pazos, M., et al. Multidrug resistance-associated transporter 2 regulates mucosal inflammation by facilitating the synthesis of hepoxilin A3. J. Immunol. 181, 8044-8052 (2008).
- Agace, W. W., Patarroyo, M., Svensson, M., Carlemalm, E., Svanborg, C. Escherichia coli induces transuroepithelial neutrophil migration by an intercellular adhesion molecule-1-dependent mechanism. Infect. Immun. 63, 4054-4062 (1995).
- Bhowmick, R., et al. Systemic Disease during Streptococcus pneumoniae Acute Lung Infection Requires 12-Lipoxygenase-Dependent Inflammation. J. Immunol. , (2013).
- Hurley, B. P., Pirzai, W., Mumy, K. L., Gronert, K., McCormick, B. A. Selective eicosanoid-generating capacity of cytoplasmic phospholipase A2 in Pseudomonas aeruginosa-infected epithelial cells. Am. J. Physiol. Lung Cell Mol. Physiol. 300, 286-294 (2011).
- Hurley, B. P., Sin, A., McCormick, B. A. Adhesion molecules involved in hepoxilin A3-mediated neutrophil transepithelial migration. Clin. Exp. Immunol. 151, 297-305 (2008).
- Frank, D. W. Research Topic on Pseudomonas aeruginosa, Biology, Genetics, and Host-Pathogen Interactions.. Front. Microbiol. 3, 20 (2012).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Lung infections associated with cystic fibrosis. Clin. Microbiol. Rev. 15, 194-222 (2002).
- Bucior, I., Mostov, K., Engel, J. N. Pseudomonas aeruginosa-mediated damage requires distinct receptors at the apical and basolateral surfaces of the polarized epithelium. Infect. Immun. 78, 939-953 (2010).
- Kierbel, A., et al. Pseudomonas aeruginosa exploits a PIP3-dependent pathway to transform apical into basolateral membrane. J. Cell Biol. 177, 21-27 (2007).
- Lee, C. A., et al. A secreted Salmonella protein induces a proinflammatory response in epithelial cells, which promotes neutrophil migration. Proc. Natl. Acad. Sci. U.S.A. 97, 12283-12288 (2000).
- Zurawski, D. V., Mumy, K. L., Faherty, C. S., McCormick, B. A., Maurelli, A. T. Shigella flexneri type III secretion system effectors OspB and OspF target the nucleus to downregulate the host inflammatory response via interactions with retinoblastoma protein. Mol. Microbiol. 71, 350-368 (2009).
- Brazil, J. C., et al. Neutrophil migration across intestinal epithelium: evidence for a role of CD44 in regulating detachment of migrating cells from the luminal surface. J. Immunol. 185, 7026-7036 (2010).
- Lawrence, D. W., et al. Antiadhesive role of apical decay-accelerating factor (CD55) in human neutrophil transmigration across mucosal epithelia. J. Exp. Med. 198, 999-1010 (2003).
- Hodges, K., Hecht, G. Interspecies communication in the gut, from bacterial delivery to host-cell response. J. Physiol. 590, 433-440 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。