Method Article
In vitro Ensaio de cocultura para avaliar migração trans epitelial de neutrófilo induzida por patógenos
Neste Artigo
Resumo
A migração trans-epitelial de neutrófilos em resposta à infecção bacteriana mucosa contribui para lesão epitelial e doença clínica. Foi desenvolvido um modelo in vitro que combina patógenos, neutrófilos humanos e camadas de células epiteliais humanas polarizadas cultivadas em filtros transwell para facilitar investigações para desvendar os mecanismos moleculares que orquestram esse fenômeno.
Resumo
As superfícies mucosas servem como barreiras protetoras contra organismos patogênicos. As respostas imunes inatas são ativadas ao detectar patógenos que levam à infiltração de tecidos com células inflamatórias migratórias, principalmente neutrófilos. Esse processo tem o potencial de ser destrutivo para os tecidos se excessivo ou mantido em um estado não resolvido. Modelos in vitro coculturizados podem ser utilizados para estudar os mecanismos moleculares únicos envolvidos na migração trans-epitelial induzida pelo patógeno. Este tipo de modelo fornece versatilidade no design experimental com oportunidade de manipulação controlada do patógeno, barreira epitelial ou neutrófilo. A infecção patogênica da superfície apical de monocamadas epiteliais polarizadas cultivadas em filtros transwell permeáveis instiga a migração basolateral fisiologicamente relevante para a migração trans-epitelial apical de neutrófilos aplicados à superfície basolateral. O modelo in vitro descrito aqui demonstra os múltiplos passos necessários para demonstrar a migração de neutrófilos através de uma monocamada epitelial pulmonar polarizada que foi infectada com P. aeruginosa patogênica (PAO1). A semeadura e a colheita de transwells permeáveis com células epiteliais pulmonares derivadas humanas é descrita, juntamente com o isolamento de neutrófilos de sangue humano inteiro e cultivo de PAO1 e não-patogênico K12 E. coli (MC1000). O processo de emigração e a análise quantitativa de neutrófilos migrados com sucesso que foram mobilizados em resposta à infecção patogênica são mostrados com dados representativos, incluindo controles positivos e negativos. Este sistema de modelo in vitro pode ser manipulado e aplicado a outras superfícies mucosas. Respostas inflamatórias que envolvem infiltração excessiva de neutrófilos podem ser destrutivas para os tecidos hospedeiros e podem ocorrer na ausência de infecções patogênicas. Uma melhor compreensão dos mecanismos moleculares que promovem a migração trans-epitelial de neutrófilos através da manipulação experimental do sistema de ensaio de cocultura in vitro descrito aqui tem um potencial significativo para identificar novos alvos terapêuticos para uma gama de doenças infecciosas mucosas, bem como inflamatórias.
Introdução
As superfícies mucosas servem como barreiras físicas e imunológicas que proporcionam proteção contra ameaças externas generalizadas no meio ambiente1,2. Esta barreira epitelial protetora pode ser comprometida quando organismos patogênicos invadem2. No caso de um patógeno bacteriano, esse encontro muitas vezes instiga um processo inflamatório ativando o sistema imunológico inato e desencadeando uma rápida mobilização de granulócitos de primeiros socorros conhecidos como neutrófilos2-4. Agentes chemotactic facilitando o recrutamento de neutrófilos são produzidos em parte pelas células epiteliais mucosas que buscam livrar o hospedeiro do patógenoofensivo 2-4. Infiltração de neutrófilo excessivo ou não resolvida da superfície epitelial mucosa pode causar patologia significativa1,5. Isso é consequência de danos teciduais não específicos causados pelo arsenal antibacteriano de neutrófilo5-7. Nesses casos, a capacidade de liberação bacteriana de neutrófilos é ofuscada pela destruição do tecido hospedeiro durante um insulto infeccioso. A interrupção da função de barreira epitelial protetora pode levar a uma maior exposição do tecido subjacente a microrganismos e/ou toxinas, exacerbando ainda mais a patologia da doença8,9. Essas consequências podem ser observadas em múltiplos sistemas de órgãos, incluindo o pulmão e o trato digestivo1,5. Além disso, condições inflamatórias não infecciosas, como crises graves de asma, doença pulmonar obstrutiva crônica (DPOC), síndrome do desconforto respiratório agudo (ARDS) e doença inflamatória intestinal (DII) são marcadas pela ruptura patológica da barreira epitelial mucosa por uma resposta neutrófila excessiva4,5,10-12.
O complexo processo de recrutamento de neutrófilos após infecção mucosa envolve várias etapas compartimentadas1,5,13,14. Primeiro, os neutrófilos devem sair de circulação através de uma série de interações célula-celular que facilitam a migração trans-endotelial1,13. Os neutrófilos navegam em seguida no espaço intersticial existente contendo matriz extracelular1,14. Para alcançar o lúmen da mucosa infectada, os neutrófilos devem migrar através da barreira epitelial1,4,5. Este intrincado fenômeno multistep é frequentemente investigado em agregado usando modelos in vivo animais de infecção15. Tais modelos são úteis para estabelecer a necessidade de fatores específicos, como quimiocinas, moléculas de adesão ou caminhos de sinalização que participam do processo global, mas são em grande parte inadequados para a resolução de contribuições moleculares críticas para cada etapa compartimentalizada distinta16. Sistemas in vitro coculturados modelando migração trans-endotelial, trans matricial ou trans-epitelial de neutrófilos têm sido particularmente úteis a este respeito1,14,16,17.
Um robusto sistema de ensaio de cocultura foi desenvolvido com o objetivo de decifrar mecanismos responsáveis pela migração trans-epitelial de neutrófilos em resposta à infecção patogênica18-22. Este modelo envolve infectar a superfície apical de camadas de células epiteliais humanas polarizadas com um patógeno bacteriano seguido pela aplicação de neutrófilos humanos recém-isolados na superfície basolateral18-22. Os neutrófilos migram através da barreira epitelial em resposta a produtos quimiolíticos derivados da epitelial secretados após infecção patogênica18,21-23. Este sistema modelo tem sido empregado usando culturas epiteliais intestinais e pulmonares expostas a patógenos bacterianos específicos do tecido apropriado e revelou novos mecanismos moleculares provavelmente importantes para o processo de recrutamento de neutrófilos durante a infecção mucosa3,8,19,24-28. A força deste modelo de cocultura in vitro é que uma abordagem reducionista permite ao pesquisador manipular experimentalmente o patógeno, a barreira epitelial e/ou o neutrófilo em um sistema bem controlado, altamente reprodutível e bastante barato. Os insights obtidos a partir dessa abordagem podem ser efetivamente aproveitados para realizar análises focadas de eventos compartimentados durante o recrutamento de neutrófilos usando modelos de infecção in vivo 22,29,30.
Este artigo demonstra os múltiplos passos necessários para o estabelecimento bem-sucedido deste modelo reprodutível para explorar a migração trans-epitelial induzida pelo patógeno. As barreiras epiteliais pulmonares infectadas com o patógeno Pseudomonas aeruginosa são destaque neste artigo; no entanto, outras epitélios teciduais e patógenos podem ser substituídos por pequenas modificações. A semeadura e a colheita de camadas de células epiteliais pulmonares polarizadas em filtros transwell permeáveis revestidos de colágeno invertidos são detalhados aqui, assim como o crescimento da P. aeruginosa patogênica e o isolamento de neutrófilos de sangue inteiro. Como esses componentes são combinados para observar a migração trans-epitelial induzida pelo patógeno é apresentada juntamente com controles positivos e negativos apropriados para estabelecer um ensaio reprodutível. A versatilidade dessa abordagem para examinar vários aspectos da migração trans-epitelial induzida pelo patógeno é discutida com referência a estudos específicos na literatura.
Protocolo
As etapas (1-3) devem ser realizadas em um ambiente estéril sob um capô de fluxo laminar.
1. Transwells de revestimento de colágeno
- Faça uma solução de colágeno de 30 μg/ml. Diluir 3 mg/ml de colágeno 1:100 em 60% de etanol que foi passado por uma unidade de filtro de 0,2 μm.
- Vortex diluído solução de 30 μg/ml. Nota: Não é necessário vórtice a solução de estoque de colágeno de 3 mg/ml, pois esta solução é bastante viscosa e bolhas de ar podem ser introduzidas, potencialmente diminuindo a precisão ao pipetar.
- Remova transwells de área de crescimento de0,33 cm 2 com um tamanho de poros de 3 μm da embalagem externa e coloque a placa de 24 poços contendo 12 transwells de cabeça para baixo dentro do capô.
- Retire a placa inferior e coloque de lado. Nota: Transwells agora estará de cabeça para baixo descansando em cima da tampa da placa de 24 poços
- Ligue o bico de Bunsen. Hemostat de chama para esterilidade e deixe esfriar.
- Com hemostat estéril, transfira transwells para uma placa de Petri de 150 mm x 25 mm, mantendo-as na posição invertida. Nota: Certifique-se de manter a esterilidade da placa vazia de 24 poços mais tampa para ser usada para abrigar transwells uma vez que tenham sido semeadas com células epiteliais.
- Pipeta 70 μl da solução de colágeno de 30 μg/ml sobre a membrana do filtro de cada transwell invertida. Nota: A tensão superficial deve manter este volume de solução no lugar, pois não há paredes ao redor da membrana do filtro ao acessar a superfície da parte inferior. Tenha cuidado para que a solução de colágeno não escorresse pelo lado do transwell e evite mover transwells durante o procedimento de revestimento.
- Deixe a tampa da placa de Petri desligada por um mínimo de 4 horas para permitir que a solução de etanol evapore. Para manter a esterilidade durante este processo mantenha o ventilador do capô e a luz ultravioleta acesas.
- Depois que as transwells secarem, elas podem ser usadas imediatamente ou armazenadas à temperatura ambiente por até uma semana, desde que a tampa da placa de Petri esteja no lugar e a esterilidade seja mantida.
2. Frasco de passagem de células epiteliais para transwells de semeadura
(Este protocolo descreve especificamente o manuseio da linha de células epiteliais pulmonares H292 para a geração de barreiras epiteliais cultivadas em transwells. Outras linhas de células epiteliais podem ser usadas com pequenas modificações.)
- Prepare o meio de cultura adicionando 10% de soro bovino fetal inativado por calor (HI-FBS) e 1x Penicilina/Estreptomicina ao RPMI 1640.
- Mídia quente, trypsin-EDTA (T-EDTA) e D-PBS em banho de água de 37 ºC.
- Remova o frasco T-75 contendo células da incubadora e avalie a confluência visualmente com microscópio invertido. Nota: Ao usar células H292, os frascos devem ser próximos ou totalmente confluentes.
- Aspirar mídia de frasco. Reduza o tempo de secagem das células, tendo a próxima solução no capô com a tampa solta.
- Adicione 5 ml D-PBS ao frasco T-75 e redemoinho. Evite criar bolhas. Remova o PBS por aspiração.
- Adicione 3 ml T-EDTA ao frasco T-75 e gire para cobrir o fundo.
- Remova a maior parte do T-EDTA, deixando aproximadamente 0,3 ml em frasco T-75.
- Distribua o pequeno volume restante de T-EDTA sobre a superfície das células e coloque em uma incubadora umidificada em condições de cultura padrão (37 ºC, 5% CO2).
- Após um período de tempo, remova o frasco da incubadora. Nota: As células devem prontamente se desprender da superfície do frasco tocando suavemente o frasco de lado. As células devem agora ser arredondadas e flutuando quando visualizadas sob o microscópio. O tempo médio que isso levará para as células H292 é de 5 a 10 minutos.
- Adicione 10 ml de mídia de cultura ao frasco para neutralizar as células T-EDTA e resuspend. Desenhe a solução celular na ponta da pipeta e ejete na superfície do frasco contendo células aproximadamente cinco vezes para resuspendar todas as células.
- Transesse células resuspendadas para um tubo de 15 ml para semeadura de transwells. Nota: A concentração de células H292 resuspended preparadas desta forma deve variar entre aproximadamente 1 x 106-1,8 x 106 células/ml.
3. Mudas Revestidas de Colágeno com Células Epiteliais
- Adicione 70 μl de solução celular resuspended do tubo de 15 ml a cada transwell revestido de colágeno invertido. Nota: As soluções celulares H292 com intervalo de concentração entre 1 x 106-1,8 x 106 células/ml produzirão aproximadamente 70.000-120.000 células/transwell.
- Misture a suspensão celular invertendo suavemente o tubo periodicamente para evitar que as células se instalem no fundo do tubo de 15 ml enquanto semeam os transwells. Nota: Não faça células de vórtice e tenha cuidado para que a ponta da pipeta não entre em contato direto com o filtro de membrana revestido de colágeno.
- Uma vez que todas as transwells invertidas tenham sido semeadas com células epiteliais, substitua a cobertura da placa de Petri e coloque cuidadosamente na incubadora de cultura tecidual, umidificada, 37 ºC, 5% CO2. Tome cuidado para evitar perturbar a suspensão celular que foi adicionada à membrana do filtro revestida de colágeno.
- Manter transwells invertidas na incubadora de cultura tecidual, umidificadas, 37 ºC, 5% DE CO2 durante a noite. Nota: A bolha de células contendo líquidos deve permanecer associada à membrana de filtro permeável da transwell durante toda a incubação durante a noite. Se a membrana do filtro ficar seca devido à evaporação do líquido ou porque o líquido escorre pelo lado das transwells, as camadas epiteliais podem não crescer adequadamente.
- No dia seguinte, adicione 1 ml de mídia na placa original estéril de 24 poços e gire cada transwell invertida usando um hemosta esterilizado em cada poço contendo 1 ml de mídia.
- Adicione 0,2 ml de mídia na câmara superior de cada transwell e retorne à incubadora de cultura tecidual, umidificada, 37 ºC, 5% CO2.
- As transwells invertidas H292 podem ser usadas de 8 dias até 1 mês após a semeadura. Nota: Sugerimos esperar um mínimo de 8 dias após a semeadura de transwells para garantir que as monocamadas epiteliais tenham se formado totalmente e exame uma barreira funcional. Pode-se testar a barreira epitelial H292 determinando se a monocamada é capaz de restringir o fluxo trans-epitelial do rabanete peroxidase de rabanete proteico (HRP) após a adição à superfície basolateral18.
4. Preparação de bactérias para infecção de camadas epiteliais em transwells
- Um dia antes do experimento, extraia uma colônia de P. aeruginosa PAO1 de uma placa de Ágar de Isolamento pseudomonas e uma colônia de K12 E. coli MC1000 de uma placa de Ágar Luria-Bertani (LB) e coloque em tubos separados contendo 3 ml de caldo LB. ATENÇÃO: P. aeruginosa é um patógeno humano, medidas padrão de segurança BSL2 devem ser adotadas ao manusear este organismo.
- Agite durante a noite a 225 rpm em um ambiente de 37 ºC.
- No dia seguinte, remova 1 ml das densas culturas bacterianas e coloque em tubos Eppendorf de 1,5 ml.
- Gire em microfuça a 15.800 x g por 5 min e, em seguida, remova o supernascer.
- Prepare a Solução de Sal Balanceado da Hanks com cálcio e magnésio (HBSS+) com antecedência. Adicione 23,8 g DE HEPES e 97,5 g de pó HBSS+ a 9,5 L de água destilada. Adicione pequenas quantidades de 10 M NaOH à solução, enquanto monitora o pH até que um pH estável de 7,4 seja atingido. Leve o volume até 10 L e armazene a 4 ºC.
- Resuspend cada pelota bacteriana com 1 ml HBSS+. Vórtice para ter certeza de que uma suspensão bacteriana uniforme é alcançada.
- Gire novamente a 15.800 x g por 5 min e remova o supernaspe.
- Resuspene a pelota PAO1 com 0,6 ml HBSS+ e a pelota MC1000 com 0,5 ml HBSS+. Vórtice as suspensões bacterianas.
- Diluir ainda mais as pelotas PAO1 e MC1000 resuspended 1:100 no HBSS+. Por exemplo, adicione 50 μl da pelota resuspended PAO1 de 0,6 ml a 5 ml HBSS+. Nota: Utilizando medidas de densidade óptica (OD) para determinar a densidade da cultura, bem como a metodologia de diluição da unidade de formação de colônias padrão (CFU), as soluções PAO1 e MC1000 preparadas desta forma produzem consistentemente entre 3 x 107-6 x 107 CFU/ml. A densidade de uma cultura bacteriana está positivamente correlacionada com a medição de OD da cultura a 600 nm e essa correlação pode ser usada para estimar a concentração celular bacteriana. Para confirmar a concentração celular bacteriana, a cultura pode ser diluída a uma concentração muito baixa estimada e banhada em uma placa de ágar de tal forma que se esperaria que entre 30-200 células bacterianas riam presentes na placa. As células são espalhadas pela placa e incubadas durante a noite a 37 ºC de tal formação de uma colônia individual de células que é grande o suficiente para serem visíveis e colônias podem então ser contadas.
5. Isolamento de neutrófilos de sangue inteiro
- A solução de dextrose citrato ácido (ACD) é usada como anticoagulante e preparada adicionando ácido cítrico de 6,9 g, citrato de sódio de 12,5 g e 10 g dextrose a 500 ml de água destilada. Uma vez que todos os componentes são dissolvidos, a solução ACD é esterilizada através de uma unidade de filtro de 0,2 μm. Armazene a solução ACD a 4 ºC.
- Antes de tirar sangue, adicione 5 ml de ACD à seringa de 50 ml e conecte agulha borboleta de 21 x 3/4 G com 12 em tubulação.
- Aplique torniquete, limpe a veia com álcool e insira agulha. Nota: Qualquer protocolo de pesquisa envolvendo sujeitos humanos deve ser aprovado por um conselho de revisão institucional e o consentimento informado por escrito deve ser fornecido de cada doador de sangue. Por exemplo, os experimentos realizados usando este protocolo foram aprovados pelo Massachusetts General Hospital Institutional Review Board e designados protocolo #1999-P-007782.
- Desenhe lentamente 45 ml de sangue garantindo que o sangue se misture com ACD uma vez na seringa.
- Quando 45 ml tiver sido desenhado (50 ml de volume total), desamarre o torniquete antes de remover a agulha. Aplique imediatamente pressão na ferida com gaze estéril quando a agulha for removida.
- Transfira sangue lentamente para baixo do lado de um tubo de 50 ml ao longo de aproximadamente 5-10 segundos.
- Gire em centrífuga a 1.000 x g com o freio desativado por 20 minutos à temperatura ambiente. Nota: Um passo adicional envolvendo a diluição de sangue inteiro na PBS e uma sobreposição cuidadosa de sangue diluído em Ficoll-Paque antes da centrifugação pode ser empregado para alcançar um nível ligeiramente maior de pureza neutrófila, separando de forma mais eficiente o casaco buffy dos granulocitos8. Omitir esta etapa serve para economizar tempo sem impactar drasticamente o rendimento ou a pureza para os propósitos deste ensaio, e, portanto, favorecemos não incluir a sobreposição de sangue na etapa Ficoll-Paque.
- Enquanto o sangue está girando, muito lentamente adicione 1 g de gelatina em 50 ml aquecida Hanks's Balanced Salt Solution sem cálcio e magnésio (HBSS(-)) para preparar 2% de solução de gelatina. Mantenha a solução a 37 ºC.
- Aspire e descarte plasma do tubo de 50 ml de sangue usando uma ponta de pipeta de vidro que foi tratada com Sigmacote.
- Continue aspirando com muito cuidado para remover a camada buffy, que contém glóbulos brancos, incluindo linfócitos.
- À medida que a camada de buffy está sendo lentamente removida, o material nublado amarelo esbranquiçado acima da camada de glóbulos vermelhos (RBC) desaparecerá. Cessar a aspiração uma vez que o casaco buffy é removido e a camada RBC pode ser claramente visualizada ao visualizar de cima do tubo.
- Tente não perturbar a camada RBC, pois os granulócitos, principalmente neutrófilos, estão perto da superfície da camada RBC, mas não são visíveis.
- Para um volume de camada RBC de 15 ml, adicione 30 ml de solução de gelatina quente de 2% (2x de volume da camada RBC).
- Inverter o tubo suavemente para misturar, tomando o cuidado de minimizar a formação de bolhas.
- Incubar a 37 ºC por 25 min. Nota: Os RBCs devem agregar e se fixar na parte inferior. Como alternativa à gelatina, grandes dextrans de peso molecular podem ser empregados para sedimentar RBCs8.
- Após a incubação, transfira a solução avermelhada de camada superior que contenha granulócitos em um novo tubo de 50 ml com pipeta, tomando cuidado para não perturbar a camada RBC escura durante a transferência. Uma vez separado, descarte a camada RBC escura.
- Spin transferiu solução avermelhada leve contendo granulócitos e alguns RBCs em centrífuga a 1.000 x g com freio ativado por 10 minutos à temperatura ambiente, a fim de pelotas de células.
- Despeje ou aspire o supernatante cuidadosamente, pois a pelota de célula avermelhada que se formará após a centrifugação é geralmente solta.
- Prepare o tampão de lise RBC com antecedência e armazene a 4 ºC adicionando 8,29 g de cloreto de amônio (NH4Cl), 1 g de bicarbonato de sódio (NaHCO3)e 0,038 g EDTA a 1 L destilado em um béquer. Armazene o buffer de lise RBC a 4 ºC.
- Resuspend e quebrar pelotas de célula avermelhada com um pequeno volume de tampão de lise RBC frio. Uma vez que a pelota de célula esteja em solução, encha o tubo de 50 ml com tampão de lise RBC. Nota: Neste ponto e indo em frente, mantenha as células no gelo ou a 4 ºC.
- Gire em centrífuga a 300 x g por 10 min a 4 ºC e depois despeje ou aspire o supernasce. Nota: O supernatante será um pouco avermelhado contendo RBCs lysed. A pelota deve ser amarelada branca neste momento. Se os RBCs significativos permanecerem na pelota, como indicado por uma pelota avermelhada, a etapa 5.20-5.21 pode ser repetida. RBCs significativos permanecem na pelota celular se a pelota avermelhada da etapa 5.20 não for quebrada o suficiente.
- Resuspend e break up pellet esbranquiçado com um pequeno volume de HBSS(-) e, em seguida, encher tubo para 50 ml com HBSS(-). Nota: O HBSS(-) e não o HBSS+ devem ser usados para resuspensar a pelota de célula esbranquiçada. O HBSS(-) não tem cálcio e magnésio.
- Gire novamente em centrífuga a 300 x g por 10 min a 4 ºC.
- Despeje o supernatante e resuspense a pelota para um volume final de 1 ml HBSS(-).
- Adicione 5 μl da suspensão celular de 1 ml a 250 μl HBSS(-) em um tubo Eppendorf de 1,5 ml e misture suavemente para cima e para baixo por pipeta.
- Adicione 25 μl de suspensão celular diluída a 25 μl 0,4% azul Trypan.
- Adicione 12 μl de mistura a cada lado de um hemótmetro padrão.
- Conte o número de células vivas que excluíram o corante azul Trypan e estão presentes no quadrado médio de ambos os lados do hemótmetro.
- Para calcular a concentração celular, multiplique a média dos 2 quadrados por 100 (fator diluição) e multiplique por 104 para dar o número de células/ml.
- Ajuste a concentração final para 5 x 107 células/ml. Se for maior que 5 x 107 células/ml, ajuste adicionando HBSS(-). Se menos, pelota as células e resuspend para volume apropriado.
- Mantenha as células no gelo até que estejam prontas para o ensaio de migração. Nota: Essas células representam a população de granulócitos de glóbulos brancos. A maioria dos granulócitos isolados de sangue humano inteiro são neutrófilos. As células são mantidas no gelo suspensas no HBSS(-) até a adição ao ensaio migratório, a fim de manter as células em um estado quiescente.
6. Preparação de camadas de células epiteliais para ensaio migratório
(Estas etapas não precisam ser realizadas dentro de um capô estéril.)
- Remova da incubadora placa de 24 poços que suportam camadas epiteliais que foram cultivadas na parte inferior das membranas do filtro transwell por pelo menos oito dias.
- Agarre a borda de cada transwell com um hemostat, levante da placa de 24 poços e inverta a transwell sobre um balde de lixo para descartar a mídia cultural da câmara interna do transwell. Mergulhe cada transwell em um béquer de lavagem contendo HBSS+ para encher a câmara interna do transwell com HBSS+. Descarte o fluido da câmara interna em um balde de lixo.
- Repita o passo 6.2 para uma segunda lavagem no HBSS+. Depois de duas lavagens, coloque transwells em uma nova placa de 24 poços contendo 1 ml HBSS+ em cada poço. Nota: Todas as lavagens devem ser realizadas com HBSS+ que é aquecido a 37 ºC.
- Observe a câmara superior de cada transwell para avaliar a integridade da camada celular epitelial. Nota: O HBSS+ não deve vazar e encher a câmara superior do transwell quando colocado no poço de uma placa de 24 poços contendo 1 ml de HBSS+.
- Depois de observar cuidadosamente cada transwell, adicione 0,2 ml de HBSS+ na câmara superior.
- Coloque na incubadora a 37 ºC, 5% DE CO2 em uma câmara umidificada por 30-60 min para equilibrar camadas de células epiteliais.
7. Ensaio de Migração Trans epitelial de neutrófilos
- Remova da incubadora placa de 24 poços de transwells lavadas equilibrando-se no HBSS+.
- Segure cada transwell com um hemostat e descarte fluido no topo bem em um balde de lixo.
- Coloque cada transwell de cabeça para baixo em uma placa de Petri de 150 mm x 25 mm.
- A seis das Transwells invertidas, adicione 25 μl de HBSS+. Para três dos transwells invertidos, infecte com 25 μl P. aeruginosa (PAO1) diluído no HBSS+ preparado conforme descrito na etapa 4. Para as últimas três transwells invertidas, infecte com 25 μl E. coli K12 (MC1000) diluído no HBSS+ preparado como descrito na etapa 4. Trata-se de aproximadamente 0,8 x 106-1,5 x 106 CFUs/camada epitelial para cada espécie bacteriana, uma vez que a concentração das soluções bacterianas preparadas na etapa 4 é de aproximadamente 3 x 107-6 x 107 CFU/ml.
- Incubar a 37 ºC, 5% de CO2 em uma câmara umidificada por 60 min.
- Prepare o fMLP como um controle positivo para a migração de neutrófilos adicionando 5 μl de 10 mM fMLP a 5 ml HBSS+ dando uma solução de 10 μM.
- Lave transwells agarrando-se com um hemostat e voltando para uma placa de lavagem de 24 poços que contém 1 ml HBSS+ nas câmaras inferiores. Adicione 0,2 ml de HBSS+ às câmaras superiores.
- Segure transwell com um hemostat e remova da primeira placa de lavagem. Antes de colocar transwells em uma segunda placa de lavagem de 24 poços contendo 1 ml HBSS+, descarte o fluido da câmara superior em um balde de lixo. Adicione 0,2 ml de HBSS+ à câmara superior.
- Repita as etapas 7.8 mais uma vez para um total de 3 lavagens. Nota: Todas as transwells devem ser submetidas ao mesmo regime de manuseio e lavagem, sejam ou não infectadas por bactérias, para garantir que todas as transwells que estão sendo avaliadas tenham sido manipuladas da mesma forma. Uma infecção de 60 min com pao1 ou MC1000 não reduz a viabilidade ou altera as propriedades de barreira da monocamada H292, conforme avaliado por um ensaio toxicológico à base de lactato dehidroase e pelo ensaio de fluxo HRP,respectivamente 18,22.
- Prepare a placa de migração de 24 poços adicionando 1 ml HBSS+ em 12 poços da placa de 24 poços. Nota: Esta placa pode ser preparada com antecedência.
- Após a terceira lavagem, descarte o fluido das câmaras superiores de transwells em um balde de lixo usando um hemostat e coloque três dos transwells não infectados em três poços da placa de migração de 24 poços contendo 1 ml HBSS+, o que representa o controle negativo.
- Pipeta 10 μl de uma solução de 10 μM de fMLP em cada um dos três poços da placa de migração de 24 poços contendo 1 ml HBSS+ (100 nM).
- Coloque três dos transwells não infectados em três poços da placa de migração de 24 poços contendo 100 nM fMLP, o que representa um controle positivo para a capacidade de migração de neutrófilos isolados.
- Coloque três transwells infectadas com PAO1 e três transwells infectadas com MC1000 em três poços cada, respectivamente, da placa de migração de 24 poços contendo 1 ml HBSS+. Adicione 0,1 ml de HBSS+ à câmara superior de cada transwell.
- Além do HBSS+ de 0,1 ml em cada transwell, adicione cuidadosamente 20 μl da suspensão de neutrófilo (5 x 107 células/ml) preparada como descrito na etapa 5. Nota: Isso representa aproximadamente 1 x 106 neutrófilos/transwell.
- Incubar a 37 ºC, 5% de CO2 em uma câmara umidificada por 2 horas para permitir a migração trans-epitelial de neutrófilos.
- Prepare uma curva padrão para determinar o número de neutrófilos que migraram após 2 horas. Adicione 40 μl da suspensão de neutrófilo (5 x 107 células/ml) em 2 ml de HBSS(+) e transfira 1 ml para 1 ml HBSS(+) e realize diluições de 2 vezes adicionais em 2 vezes para um total de 10 padrões que variam de aproximadamente 2.000 células/ml a 1 x 106 células/ml. Inclua 1 ml HBSS(+) para em branco.
- Após 2 horas de migração, levante as transwells agarrando-se com um hemostat e toque suavemente contra as paredes internas da placa de migração de 24 poços. Descarte transwells.
- Avalie a migração de neutrófilos grosseiramente nos poços visualizando poços da placa de migração de 24 poços sob um microscópio invertido usando o objetivo 10X (Ver Figura 1 para imagens de neutrófilos migrados em cada condição).
- Adicione 50 μl de 10% triton X-100 a cada bem utilizado na placa de migração de 24 poços, cada padrão, e o em branco.
- Gire a placa de migração de 24 poços, padrões e em branco em baixa velocidade por 20 min a 4 ºC.
- Prepare o tampão de citrato de 1 M com antecedência. Adicione 52,5 g de ácido cítrico e 73,5 g de citrato de sódio a 400 ml de água destilada em um béquer. Leve o pH para 4.2. Adicione água destilada para solução final de 500 ml. Solução de loja a 4 ºC.
- Prepare a solução de substrato ABTS fresca naquele dia. Adicione 3 comprimidos ABTS (10 mg cada) e 5 ml de tampão citrato de 1 M a 45 ml de água destilada. Permitir que os comprimidos se dissolvam totalmente na solução. Reter adição de 50 μl de peróxido de hidrogênio de 30% até que a solução de substrato ABTS seja necessária (ver passo 7.27).
- Adicione 50 μl de tampão de citrato a cada poço utilizado na placa de migração de 24 poços, cada padrão e em branco.
- Transfira 100 μl de cada amostra bem em duplicata para uma placa de 96 poços. Nota: É muito importante misturar bem o conteúdo em cada amostra antes de passar para a placa de 96 poços. Pipeta a solução para cima e para baixo pelo menos cinco vezes antes da transferência.
- Transfira 100 μl de cada padrão e o em branco para a placa de 96 poços após a mistura (em branco em duplicata).
- Adicione 50 μl de peróxido de hidrogênio de 30% à solução ABTS e vórtice.
- Adicione 100 μl de solução de substrato ABTS a cada amostra na placa de 96 poços.
- Deixe a placa se desenvolver por 5-10 minutos no escuro. Nota: Uma cor verde deve desenvolver-se em certos poços, correlacionando-se com o número de neutrófilos presentes em cada poço.
- Leia no comprimento de onda de 405 nm usando um leitor de microplaca.
- Calcule o número de neutrófilos que migraram através da camada epitelial usando os padrões pelos quais existe uma correlação positiva linear entre os números conhecidos de neutrófilos preparados como padrões e a quantidade de atividade peroxidase medida pela densidade óptica em 405 nm (Ver Figuras 2 e 3 para dados representativos). Nota: Este método de quantificação de neutrófilos aproveita a grande quantidade de atividade peroxidase exibida por neutrófilos devido à expressão mieloperoxidase. Abordagens alternativas para quantificar neutrófilos podem ser consideradas, como métodos envolvendo neutrófilos pré-rotulados com radioatividade ou compostos de fluorescência.
Resultados
Vários estudos demonstraram que as camadas epiteliais infectadas por patógenos facilitam a migração trans-epitelial de neutrófilos3,8,19,24-28,31,32. Isso ocorre por meio de uma indução específica de patógeno de um gradiente químico quimiofilo quimiofilo derivado de células epiteliais3,23. Por exemplo, p. aeruginosa patogênica interagindo com a superfície apical das células epiteliais pulmonares faz com que um número substancial de neutrófilos migrem através da camada epitelial18,22,25,26,33,34. Este sistema de ensaio clinicamente relevante pode ser manipulado de várias maneiras para desvendar patógenos-chave e host molecular contribuintes quando emparelhados com controles apropriados.
Os neutrófilos adicionados às camadas de células epiteliais polarizadas que não foram pré-infectadas não migram em números apreciáveis. No entanto, a aplicação de um gradiente de quimio-atrainte através de uma camada epitelial não infectada irá impulsionar um número significativo de neutrófilos através. É importante incluir esses controles negativos e positivos, respectivamente, dentro de cada ensaio ao investigar a migração de neutrófilos através de camadas epiteliais infectadas por patógenos. O controle negativo estabelece o número de fundo de neutrófilos que cruzam a camada epitelial na ausência de sinal. Esse número deve ser muito baixo quando células epiteliais cultivadas estabeleceram uma barreira funcional. A migração de fundo elevado complica a interpretação dos resultados obtidos com o epitélio infectado pelo patógeno. O controle positivo envolve a aplicação de um gradiente de um quimio-atrativo neutrófilo, como o FPM na camada epitelial e serve para confirmar que os neutrófilos isolados são funcionais. Além disso, no caso de as camadas epiteliais serem pré-tratadas com certos reagentes para avaliar seus impactos sobre a migração trans-epitelial induzida pelo patógeno, o gradiente fMLP serve para controlar quaisquer efeitos que o reagente possa ter sobre a capacidade dos neutrófilos de navegar na camada epitelial, independentemente dos efeitos mediados por patógenos. Um controle adicional frequentemente empregado dentro deste sistema de ensaio envolve a infecção de camadas epiteliais com bactérias não patogênicas em paralelo com o patógeno. Esse controle pode ser explorado para distinguir respostas epiteliais relevantes após a interação com bactérias, bem como auxiliar na identificação de fatores patogênicos necessários para estimular a migração trans-epitelial de neutrófilos.
A migração trans-epitelial de neutrófilos pode ser avaliada de forma qualitativa e quantitativa. Ao término da incubação de 2 horas após a adição de neutrófilos à superfície basolateral, transwells são removidas e neutrófilos que migraram totalmente através da camada epitelial para a câmara apical podem ser vistos no poço inferior da placa de migração de 24 poços. Uma imagem representativa de cada condição é exibida na Figura 1,visualizada usando um microscópio de luz invertida. Pouquíssimos neutrófilos foram observados para migrar através de uma camada epitelial não infectada sem um gradiente quimotactico imposto (HBSS+) e representar níveis de fundo no ensaio(Figura 1A). Em contraste, uma abundância de neutrófilos transmigrados eram aparentes quando um gradiente de FMLP é fornecido(Figura 1B). A infecção do epitélio com E. coli MC1000 não patogênico resultou em poucos neutrófilos transmigrados visíveis, enquanto muitos neutrófilos transmigrados eram observáveis quando as camadas epiteliais foram infectadas com o P. aeruginosa patogênico pulmonar (PAO1) (Figuras 1C e 1D).
Os neutrófilos que migraram no experimento são quantificados medindo sua atividade de mieloperoxidase. Uma curva padrão é utilizada para permitir uma estimativa do número de neutrófilos transmigrados. O número de neutrófilos correlaciona-se positivamente com a quantidade de atividade peroxidase medida após a lise de neutrófilos com valores que apresentam uma relação linear na faixa de números de neutrófilos selecionados para a curva padrão (2 x 103-1 x 106 células/ml)(Figura 2). Um número significativo de neutrófilos migram através de camadas epiteliais em resposta a um gradiente fMLP fornecido ou em resposta a uma camada epitelial infectada com PAO1 (Figura 3). O número de neutrófilos que migram na ausência de estímulos (HBSS+) ou após infecção epitelial apical com E. coli MC1000 não patopogênico está abaixo do limite de detecção para o ensaio(Figura 3). Os dados apresentados na Figura 3 representam o número médio de neutrófilos transmigrados com barras de erro representando desvio padrão de três poços/condições independentes. Os dados quantitativos retratados na Figura 3 são consistentes com as imagens representativas de poços exibidas na Figura 1.
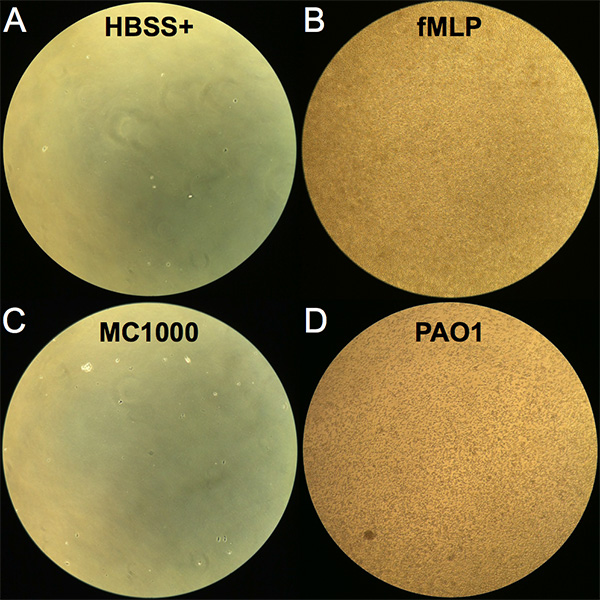
Figura 1. Imagem de neutrófilos após migração trans-epitelial. As imagens foram vistas com um microscópio de luz invertido na ampliação de 10X do poço inferior (câmara apical) da placa de migração de 24 poços após o período de incubação de 2 horas com neutrófilos adicionados ao poço superior (câmara basolateral). (A) Controle negativo HBSS+. (B) Controle positivo imposto fMLP gradiente chemotactic. (C) Camadas de células epiteliais infectadas com E. coli K12 não patogênicos (MC1000). (D) Camadas de células epiteliais infectadas com P. aeruginosa patogênica (PAO1). Clique aqui para ver imagem maior.
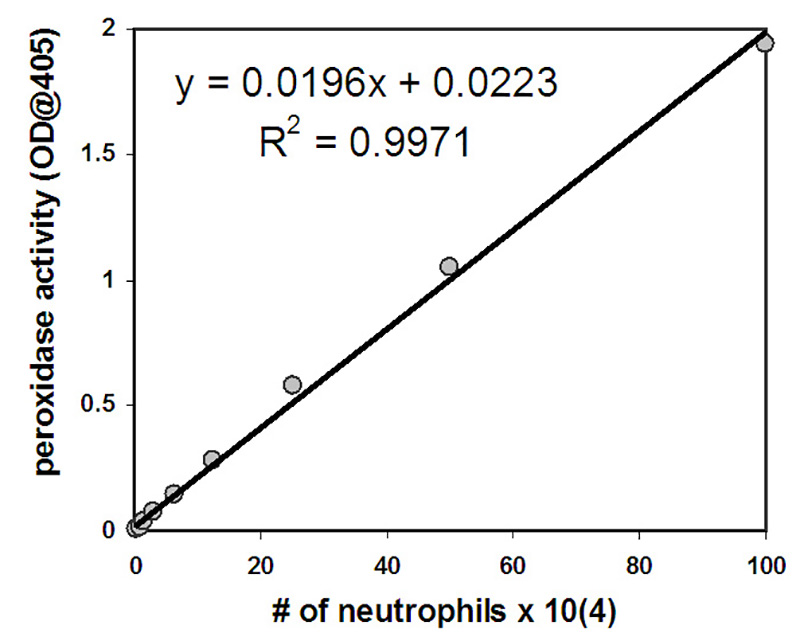
Figura 2. Os neutrófilos com concentração inicial de 1 x 106 foram submetidos a nove diluições de 2 vezes. Após a lise, a quantidade de atividade peroxidase foi determinada e o número de neutrófilos foi grafado no eixo x com atividade peroxidase no eixo y. A equação retratada pode ser usada para determinar o número de neutrófilos presentes em cada poço após a transmigração com base na quantidade de atividade peroxidase medida em cada poço.
Clique aqui para ver imagem maior.

Figura 3. Quantificação de neutrófilos transmigrados. O número de neutrófilos transmigrados é quantificado pela atividade relativa de mieloperoxidase para uma curva padrão linear de números conhecidos de neutrófilos. Números substanciais de neutrófilos transmigrados foram observados após infecção celular epitelial com P. aeruginosa patogênica (PAO1) ou estabelecimento de um gradiente apical para basolateral de quimio-atrainte de neutrófilo fMLP. Números indetectáveis de neutrófilos transmigrados foram observados após infecção celular epitelial com tratamento não-patogênico E. coli K12 (MC1000) ou tampão de controle negativo (HBSS+). Clique aqui para ver imagem maior.
Discussão
A migração de neutrófilos através das superfícies epiteliais mucosas é uma característica comum na patologia da doença após a infecção com patógenos bacterianos3. A metodologia descrita aqui oferece uma abordagem rápida e direta para isolar experimentalmente este evento discreto usando um sistema de ensaio de cocultura in vitro derivado de células humanas que modela uma característica do processo inflamatório desencadeado por infecções bacterianas. Este sistema foi originalmente desenvolvido usando células epiteliais intestinais polarizadas infectadas com patógenos entéricos, incluindo Salmonella typhimurium, Shigella flexneri, e vários E. colipatogênicos 8,19,24,27,28. Cada um desses organismos patogênicos é capaz de conduzir neutrófilos através de monocamadas epiteliais intestinais polarizadas cultivadas em filtros transwell revestidos de colágeno invertidos. Este sistema experimental foi adaptado com modificações para explorar barreiras epiteliais pulmonares e migração trans-epitelial induzida por patêgêno18,26. Várias linhas de células epiteliais das vias aéreas além de H292 têm sido utilizadas para esses estudos, incluindo as linhas de células epiteliais pulmonares comumente citadas A549, BEAS-2B e Calu-3 linhas de células epiteliaispulmonares 22,26. P. aeruginosa instiga inflamação no pulmão causando danos significativos caracterizando doenças como pneumonia aguda e fibrose cística35,36. Como descrito, o patógeno pulmonar P. aeruginosa induz prontamente a migração trans-epitelial de neutrófilos após a infecção de células epiteliais pulmonares, característica notável do processo inflamatório observado em pneumonia e fibrose cística. Além disso, várias cepas adicionais de P. aeruginosa, incluindo isolados clínicos de pacientes com fibrose cística, foram validadas como indutores neste ensaio25. Os patógenos bacterianos Streptococcus pneumoniae e Klebsiella,gram-positivos e gram-negativos, respectivamente, são comumente associados à pneumonia e têm se mostrado capazes de induzir a migração trans-epitelial de neutrófilos usando o modelo de cocultura in vitro 26,32. Assim, este sistema modelo oferece uma abordagem in vitro robusta usando células derivadas humanas para explorar processos inflamatórios instigados por patógenos mucosas.
Modelos baseados em cultura tecidual padrão frequentemente usados para explorar interações de patógenos hospedeiros geralmente empregam células epiteliais cultivadas em superfícies de plástico plana16. O ensaio de cocultura in vitro oferece um maior grau de complexidade proporcionando versatilidade no design experimental16,37,38. Células epiteliais polarizadas cultivadas na parte inferior de filtros transwell permeáveis criam um compartimento apical que fica de frente para a câmara inferior quando colocado em uma placa de 24 poços e um compartimento basolateral que enfrenta o poço superior interno do transwell14,17. Esta discreta compartimentação e orientação direcional permite a análise da migração fisiológica basolateral para apical de neutrófilos em resposta aos gradientes quimotacticos gerados por células impostas ou epiteliais14,17,23. O sistema de cocultura in vitro permite a investigação de mecanismos moleculares específicos atribuíveis à migração trans-epitelial, que podem ser difíceis de resolver no ambiente complexo de um modelo in vivo de infecção pulmonar1,15. Qualquer achado sobre a identificação de fatores-chave envolvidos na migração trans-epitelial de neutrófilos utilizando o modelo de cocultura in vitro pode posteriormente ser validado para relevância utilizando modelos in vivo de pneumonia aguda15,22.
O ensaio de cocultura in vitro pode ser manipulado de várias maneiras para estudar uma série de fenômenos. Estudos focados em genes bacterianos que contribuem para o recrutamento de neutrófilos podem ser realizados avaliando bibliotecas mutantes disponíveis para patógenos específicos de interesse25,39,40. Genes revelados a partir de tal análise podem representar novos fatores de virulência e potenciais alvos terapêuticos para agentes anti-infecciosos. O neutrófilo também pode representar o foco da análise. Por exemplo, os neutrófilos empregam várias moléculas de adesão da superfície celular para facilitar a migração trans-epitelial5,14,34,41,42. As principais interações célula-célula podem variar dependendo da migração de condução quimio-atraída e do tecido com o qual os neutrófilos estão interagindo34. Os neutrófilos podem ser pré-tratados com inibidores, anticorpos ou antagonistas antes de avaliar a migração trans-epitelial induzida pelo patógeno, a fim de identificar moléculas superficiais ou caminhos de sinalização que são críticos para este processo22,34. As células epiteliais cumprem um papel crítico durante a infecção e inflamação, detectando sinais e se comunicando com células imunes através de mediadores solúveis43. Caminhos de sinalização, secreção polarizada de quimio-atrativos e moléculas de adesão epitelial da superfície interagindo com bactérias ou neutrófilos que impactam a migração trans-epitelial induzida por patófilos pode ser investigada usando o ensaio de cocultura in vitro. A aplicação deste modelo de cocultura revelou a importância de um quimio-atrativo lipídicos eicosanoide anteriormente não apreciado conhecido como hepoxilina A33,18,21. A hepoxilina A3 é produzida por células epiteliais pulmonares e intestinais em resposta à infecção com patógenos específicos e é responsável por conduzir neutrófilos através da monocamada epitelial polarizada do basolateral ao lado apical infectado3. Assim, o ensaio de cocultura in vitro serve como uma ferramenta exploratória robusta com potencial para identificar mecanismos críticos que mediam interações hospedeiro-patógeno e orquestram inflamação. Além disso, este sistema modelo tem o potencial de ser adaptado como uma abordagem de triagem de alto rendimento para avaliar a eficácia de terapêuticas anti-infecciosas seletivas ou anti-inflamatórias.
Resumindo, fornecemos um protocolo passo a passo detalhado para investigar a migração de neutrófilos através de uma monocamada de camadas de células epiteliais pulmonares infectadas por patógenos cultivadas em filtros transwell permeáveis. Técnicas descritas aqui podem ser modificadas para estudar a migração de neutrófilos através de outras superfícies mucosas onde os neutrófilos se infiltram em estados de doenças como o trato gastrointestinal ou o trato genitourinary. Além disso, os insights obtidos usando o sistema de ensaio de cocultura in vitro são provavelmente relevantes para uma ampla gama de doenças inflamatórias não impulsionadas por agentes infecciosos específicos. As doenças inflamatórias das superfícies mucosas que apresentam neutrófilos que atravessam a barreira epitelial protetora a um grau patológico incluem DPOC, ARDS, asma e IBD5,10-12. Uma compreensão mais profunda dos mecanismos moleculares que regem a migração trans-epitelial de neutrófilos provavelmente informará estratégias terapêuticas voltadas para aliviar processos inflamatórios destrutivos associados a essas doenças comuns, fornecendo novos caminhos para melhorar a saúde humana.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado financeiramente pelo NIH (1 R01 AI095338-01A1).
Materiais
| Name | Company | Catalog Number | Comments |
| NCl-H292 cells | ATCC | CRL-1848 | |
| RPMI-1640 medium | ATCC | 30-2001 | |
| Pseudomonas aeruginosa PAO1 | ATCC | #47085 | |
| Escherichia coli MC1000 | ATCC | #39531 | |
| D-PBS (1x) liquid | Invitrogen | 14190-144 | without calcium and magnesium |
| Heat Inactivated Fetal bovine serum | Invitrogen | 10082-147 | 10% added to culture medium |
| Penicillin-Streptomycin | Invitrogen | 15140-122 | 100x: 10,000 units of penicillin and 10,000 µg of streptomycin per ml. |
| Trypsin-EDTA (0.05%) | Invitrogen | 25300-062 | 50 ml aliquots are stored frozen at -20 ºC. Aliquot in use can be stored at 4 ºC short-term. |
| Hank's Balanced Salt Solution - HBSS(-) | Invitrogen | 14175-079 | Sterile, without calcium and magnesium |
| Trypan Blue Solution | Invitrogen | 15250-061. | Stock = 0.4% |
| Collagen, Rat Tail | Invitrogen | A10483-01 | Can also be isolated in the laboratory directly from the tails of rats using standard protocols |
| Citric acid | Sigma-Aldrich | C1909-500G | Component of 1 M citrate buffer and acid citrate dextrose (ACD) solution |
| Sodium Citrate | Sigma-Aldrich | S4641-500G | Component of 1 M citrate buffer |
| Dextrose anhydrous | Sigma-Aldrich | D8066-250G | Component of acid citrate dextrose (ACD) solution |
| Ammonium Chloride | Sigma-Aldrich | 213330-500G | Component of red blood cell (RBC) lysis buffer |
| Sodium bicarbonate | Sigma-Aldrich | S6014-500G | Component of red blood cell (RBC) lysis buffer |
| EDTA | Sigma-Aldrich | ED-100G | Component of red blood cell (RBC) lysis buffer |
| HBSS(+) powder | Sigma-Aldrich | H1387-10L | Key component of HBSS+ |
| HEPES | Sigma-Aldrich | H3375-500G | Component of HBSS+ |
| Sigmacote | Sigma-Aldrich | SL2-25ML | Follow vendor instructions to coat glass pipette tips |
| Triton X-100 | Sigma-Aldrich | T-9284 | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) | Sigma-Aldrich | A9941-50TAB | Key component of ABTS substrate solution |
| 30% Hydrogen Peroxide Solution | Sigma-Aldrich | H1009-100ML | Component of ABTS substrate solution |
| N-Formyl-Met-Leu-Phe (fMLP or fMLF) | Sigma-Aldrich | F-3506 | A Stock solution of 10 mM in DMSO should be prepared and aliquots stored at -20 ºC. |
| Gelatin Type B | Fisher Scientific | M-12026 | |
| Pseudomonas isolation agar | Fisher Scientific | DF0927-17-1 | Follow manufacturer’s instructions to make PIA plates |
| Ficoll-Paque PLUS | Fisher Scientific | 45-001-749 | Optional, can improve neutrophil purity |
| Name of Material / Equipment | Company | Catalog Number | Comments |
| 24-well migration plate | Corning Incorporated | #3524 | |
| 24-well wash plate | Falcon | 35-1147 | Can be reused if soaked in 70% ethanol and washed thoroughly prior to reuse |
| 96-well plate | Fisher Scientific | #12565501 | |
| Transwell Permeable Supports | Corning Incorporated | #3415 | Polycarbonate; Diameter: 6.5 mm; Growth area: 0.33 cm2; Dish style: 24-well plate; Pore size: 3.0 µm |
| Petri dish | Falcon | 35-1013 | Each Petri dish holds 24 inverted 0.33 cm2 Transwells. |
| 500 ml 0.2 μm filter / flask | Fisher Scientific | 09-740-25A | To sterilize acid citrate dextrose (ACD) solution |
| 5-3/4 in glass Pasteur pipette | Fisher Scientific | 13-678-20A | Coat tips with Sigmacote prior to use |
| Hemostat | Fisher Scientific | 13-812-14 | Curved, Serrated |
| Invertoskop Inverted Microscope | Zeiss | #342222 | |
| Versa-Max Microplate Reader | Molecular Devices | #432789 |
Referências
- Burns, A. R., Smith, C. W., Walker, D. C. Unique structural features that influence neutrophil emigration into the lung. Physiol. Rev. 83, 309-336 (2003).
- Hurley, B. P., McCormick, B. A. Intestinal epithelial defense systems protect against bacterial threats. Curr. Gastroenterol. Rep. 6, 355-361 (2004).
- McCormick, B. A. Bacterial-induced hepoxilin A3 secretion as a pro-inflammatory mediator. FEBS J. 274, 3513-3518 (2007).
- Mumy, K. L., McCormick, B. A. The role of neutrophils in the event of intestinal inflammation. Curr. Opin. Pharmacol. 9, 697-701 (2009).
- Chin, A. C., Parkos, C. A. Pathobiology of neutrophil transepithelial migration: implications in mediating epithelial injury. Annu. Rev. Pathol. 2, 111-143 (2007).
- Segel, G. B., Halterman, M. W., Lichtman, M. A. The paradox of the neutrophil's role in tissue injury. J. Leukoc. Biol. 89, 359-372 (2011).
- Weiss, S. J. Tissue destruction by neutrophils. N. Engl. J. Med. 320, 365-376 (1989).
- Hurley, B. P., Thorpe, C. M., Acheson, D. W. Shiga toxin translocation across intestinal epithelial cells is enhanced by neutrophil transmigration. Infect. Immun. 69, 6148-6155 (2001).
- Kohler, H., et al. Salmonella enterica serovar Typhimurium regulates intercellular junction proteins and facilitates transepithelial neutrophil and bacterial passage. Am. J. Physiol. Gastrointest. Liver Physiol. 293, 178-187 (2007).
- Gane, J., Stockley, R. Mechanisms of neutrophil transmigration across the vascular endothelium in COPD. Thorax. 67, 553-561 (2012).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol. Med. 17, 293-307 (2011).
- Nakagome, K., Matsushita, S., Nagata, M. Neutrophilic inflammation in severe asthma. Int. Arch. Allergy Immunol.. 158 Suppl 1, 96-102 (2012).
- Choi, E. Y., Santoso, S., Chavakis, T. Mechanisms of neutrophil transendothelial migration. Front. Biosci. 14, 1596-1605 (2009).
- Louis, N. A., Campbell, E., Colgan, S. P. Model systems to investigate neutrophil adhesion and chemotaxis. Methods Mol. Biol. 412, 257-270 (2007).
- Craig, A., Mai, J., Cai, S., Jeyaseelan, S. Neutrophil recruitment to the lungs during bacterial pneumonia. Infect. Immun. 77, 568-575 (2009).
- Hurley, B. P., McCormick, B. A. Translating tissue culture results into animal models: the case of Salmonella typhimurium. Trends Microbiol. 11, 562-569 (2003).
- Lee, W. Y., Chin, A. C., Voss, S., Parkos, C. A. In vitro neutrophil transepithelial migration. Methods Mol. Biol. 341, 205-215 (2006).
- Hurley, B. P., Siccardi, D., Mrsny, R. J., McCormick, B. A. Polymorphonuclear cell transmigration induced by Pseudomonas aeruginosa requires the eicosanoid hepoxilin A3. J. Immunol. 173, 5712-5720 (2004).
- McCormick, B. A., Colgan, S. P., Delp-Archer, C., Miller, S. I., Madara, J. L. Salmonella typhimurium attachment to human intestinal epithelial monolayers: transcellular signalling to subepithelial neutrophils. J. Cell Biol. 123, 895-907 (1993).
- McCormick, B. A., et al. Surface attachment of Salmonella typhimurium to intestinal epithelia imprints the subepithelial matrix with gradients chemotactic for neutrophils. J. Cell Biol. 131, 1599-1608 (1995).
- Mrsny, R. J., et al. Identification of hepoxilin A3 in inflammatory events: a required role in neutrophil migration across intestinal epithelia. Proc. Natl. Acad. Sci. U.S.A. 101, 7421-7426 (2004).
- Tamang, D. L., et al. Hepoxilin A(3) facilitates neutrophilic breach of lipoxygenase-expressing airway epithelial barriers. J. Immunol. 189, 4960-4969 (2012).
- McCormick, B. A., Parkos, C. A., Colgan, S. P., Carnes, D. K., Madara, J. L. Apical secretion of a pathogen-elicited epithelial chemoattractant activity in response to surface colonization of intestinal epithelia by Salmonella typhimurium. J. Immunol. 160, 455-466 (1998).
- Boll, E. J., et al. Enteroaggregative Escherichia coli promotes transepithelial migration of neutrophils through a conserved 12-lipoxygenase pathway. Cell Microbiol. 14, 120-132 (2012).
- Hurley, B. P., et al. The two-component sensor response regulator RoxS/RoxR plays a role in Pseudomonas aeruginosa interactions with airway epithelial cells. Microbes Infect. 12, 190-198 (2010).
- Hurley, B. P., Williams, N. L., McCormick, B. A. Involvement of phospholipase A2 in Pseudomonas aeruginosa-mediated PMN transepithelial migration. Am. J. Physiol. Lung Cell Mol. Physiol. 290, L703-L709 (2006).
- McCormick, B. A., Siber, A. M., Maurelli, A. T. Requirement of the Shigella flexneri virulence plasmid in the ability to induce trafficking of neutrophils across polarized monolayers of the intestinal epithelium. Infect. Immun. 66, 4237-4243 (1998).
- Savkovic, S. D., Koutsouris, A., Hecht, G. Attachment of a noninvasive enteric pathogen, enteropathogenic Escherichia coli, to cultured human intestinal epithelial monolayers induces transmigration of neutrophils. Infect. Immun. 64, 4480-4487 (1996).
- Agbor, T. A., Demma, Z. C., Mumy, K. L., Bien, J. D., McCormick, B. A. The ERM protein, ezrin, regulates neutrophil transmigration by modulating the apical localization of MRP2 in response to the SipA effector protein during Salmonella typhimurium infection. Cell Microbiol. 13, 2007-2021 (2011).
- Pazos, M., et al. Multidrug resistance-associated transporter 2 regulates mucosal inflammation by facilitating the synthesis of hepoxilin A3. J. Immunol. 181, 8044-8052 (2008).
- Agace, W. W., Patarroyo, M., Svensson, M., Carlemalm, E., Svanborg, C. Escherichia coli induces transuroepithelial neutrophil migration by an intercellular adhesion molecule-1-dependent mechanism. Infect. Immun. 63, 4054-4062 (1995).
- Bhowmick, R., et al. Systemic Disease during Streptococcus pneumoniae Acute Lung Infection Requires 12-Lipoxygenase-Dependent Inflammation. J. Immunol. , (2013).
- Hurley, B. P., Pirzai, W., Mumy, K. L., Gronert, K., McCormick, B. A. Selective eicosanoid-generating capacity of cytoplasmic phospholipase A2 in Pseudomonas aeruginosa-infected epithelial cells. Am. J. Physiol. Lung Cell Mol. Physiol. 300, 286-294 (2011).
- Hurley, B. P., Sin, A., McCormick, B. A. Adhesion molecules involved in hepoxilin A3-mediated neutrophil transepithelial migration. Clin. Exp. Immunol. 151, 297-305 (2008).
- Frank, D. W. Research Topic on Pseudomonas aeruginosa, Biology, Genetics, and Host-Pathogen Interactions.. Front. Microbiol. 3, 20 (2012).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Lung infections associated with cystic fibrosis. Clin. Microbiol. Rev. 15, 194-222 (2002).
- Bucior, I., Mostov, K., Engel, J. N. Pseudomonas aeruginosa-mediated damage requires distinct receptors at the apical and basolateral surfaces of the polarized epithelium. Infect. Immun. 78, 939-953 (2010).
- Kierbel, A., et al. Pseudomonas aeruginosa exploits a PIP3-dependent pathway to transform apical into basolateral membrane. J. Cell Biol. 177, 21-27 (2007).
- Lee, C. A., et al. A secreted Salmonella protein induces a proinflammatory response in epithelial cells, which promotes neutrophil migration. Proc. Natl. Acad. Sci. U.S.A. 97, 12283-12288 (2000).
- Zurawski, D. V., Mumy, K. L., Faherty, C. S., McCormick, B. A., Maurelli, A. T. Shigella flexneri type III secretion system effectors OspB and OspF target the nucleus to downregulate the host inflammatory response via interactions with retinoblastoma protein. Mol. Microbiol. 71, 350-368 (2009).
- Brazil, J. C., et al. Neutrophil migration across intestinal epithelium: evidence for a role of CD44 in regulating detachment of migrating cells from the luminal surface. J. Immunol. 185, 7026-7036 (2010).
- Lawrence, D. W., et al. Antiadhesive role of apical decay-accelerating factor (CD55) in human neutrophil transmigration across mucosal epithelia. J. Exp. Med. 198, 999-1010 (2003).
- Hodges, K., Hecht, G. Interspecies communication in the gut, from bacterial delivery to host-cell response. J. Physiol. 590, 433-440 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados