Method Article
В естественных условиях измерения мышь легочных эндотелиальных поверхностного слоя
В этой статье
Резюме
Эндотелиальных гликокаликса / эндотелиальных поверхностного слоя идеально изучены с помощью прижизненной микроскопии. Прижизненная микроскопия является технически сложной задачей в движущемся органа, такие как легкое. Мы показываем, как одновременный светлое и флуоресцентной микроскопии может быть использована для оценки эндотелиальной толщину поверхностного слоя в свободно движущихся В естественных условиях Мышь легких.
Аннотация
Эндотелиальных гликокаликса представляет собой слой протеогликанов и гликозаминогликанов, связанных выстилающих просвет сосудов. В естественных условиях, гликокаликса очень увлажненной, формирование существенных эндотелия поверхностного слоя (ESL), что способствует поддержанию функции эндотелия. Как эндотелиальных гликокаликса часто аберрантной в пробирке и теряется при стандартных методов фиксации тканей, изучение ESL требует использования прижизненной микроскопии. Чтобы максимально приближают комплекса физиологии альвеолярного микрососудов, легочной прижизненных изображений идеально выполнены на свободно движущихся легких. Эти препараты, однако, как правило, страдают от обширного артефактов движения. Мы показываем, как закрытые груди прижизненной микроскопии свободно движущихся мышей легких может быть использован для измерения гликокаликса целостности через ESL исключения флуоресцентно-меченных декстранов высоким молекулярным весом от эндотелиальной поверхности. Это без рекуперации хирургическая техника, которая требуетодновременное светлое и флуоресцентных изображений мыши легких, позволяет продольные наблюдения субплеврально микрососудов без признаков вызывая смешанные повреждения легких.
Введение
Эндотелиальных гликокаликса является внеклеточный слой протеогликанов и гликозаминогликанов, связанных выстилающих сосудистую интиму. В естественных условиях, гликокаликса сильно увлажненной, формирование существенных эндотелия поверхностного слоя (ESL), который регулирует различные эндотелиальной функции, включая жидкости проницаемости 1, нейтрофилов-эндотелиальной адгезия 2, а механотрансдукции жидкости сдвига 3 стрессом.
Исторически сложилось, что гликокаликса был недооцененным из-за его отклонение от нормы в культуре клеточные препараты 4, 5 и его деградации во время стандартной фиксации тканей и обработки 6. Увеличение использования 7 прижизненной микроскопии (в естественных условиях микроскопии, IVM) совпал с повышенным научный интерес к важности ESL на сосудистую функцию при здоровьем и болезнью. ESL является невидимым для световой микроскопии и не могут быть легко помечать вестественных условиях, учитывая склонность люминесцентных гликокаликса-связывающие лектины вызывают РБК агглютинации 8 и фатальной легочной эмболии (неопубликованные данные). Некоторые косвенные подходы Поэтому были разработаны вывести ESL толщины (и, как следствие, гликокаликса целостности) в неподвижных сосудистого русла, такие как cremasteric и брыжеечных microcirculations. Эти методы включают в себя измерение различий в скорости циркулирующих микрочастиц как функция расстояния от эндотелиальной мембраны (микрочастицы Измерение скорости Изображения 9), а также измерение исключения громоздких, флуоресцентно-меченных сосудистых маркеров (например, декстраны) от поверхности эндотелиальных (декстран исключения техники 10, 11). Из этих методов, только декстрана исключения способны оценить ESL толщиной от измерений в одной точке во времени. По одновременного измерения ширины сосудистого использованием светлого микроскопии (ширина винклюзивного из "невидимых" ESL) и флуоресцентной микроскопии сосудистой трассирующими исключены из ESL, ESL Толщина может быть рассчитана как половина разницы между сосудистыми шириной 2.
Использование мгновенного мера толщины ESL хорошо подходит для исследования легочной гликокаликса. Прижизненные микроскопии легких является сложной задачей, учитывая значительный легочной и сердечной движения артефакт. Хотя последние достижения позволяют для иммобилизации мыши легких в 12 естественных, 13, существует обеспокоенность относительно физиологического воздействия легких застой. Легкое неподвижности связано со снижением эндотелиальной окиси азота сигнализации, 14 сигнального пути, что влияет как на адгезию нейтрофилов 15 и повреждения легких 16. Кроме того, иммобилизация области легких подвергает окружающих альвеолы для мобильных вредные поперечных сил (так называемый "atelectrauma"), в соответствии с классическими физиологическими понятиямиальвеолярной взаимозависимости 17.
В 2008 году Арата Tabuchi, Вольфганг Kuebler и его коллеги разработали хирургическая техника позволяет прижизненной микроскопии свободно движущихся мышей легких 18. Респираторные артефактов, связанных с этой техникой может быть сведено на нет использование высокоскоростной обработки изображений, в том числе одновременное измерение светлое и люминесцентной микроскопии. В этом отчете мы подробно описывается как мгновенное исключение декстрана визуализации может быть использован для измерения толщины ESL в субплеврально микроциркуляцию свободно двигаться, в естественных условиях мышь легких. Этот метод может быть легко изменена, чтобы определить гликокаликса функции-в частности, способностью нетронутой ESL, чтобы исключить элементы из циркулирующих эндотелиальных поверхности. Мы недавно эти методы использовались для определения важности легочной целостности ESL в развитии острого повреждения легких при системных воспалительных заболеваний, таких как сепсис 2.
протокол
1. Подготовка хирургической трубки, сосудистые катетеры, Window грудной стенки
- Прижизненные этапе микроскопии. Мы специально сделали оргстекла этап, на котором лежит под наркозом мыши во время микроскопии. Этот этап совмещает в 15 см на 10 см гибкой пластиковой разделочной доске (на которой лежит мышь во время вводного наркоза, трахеостомия размещения, и венозная катетеризация), а также аналогичным размером нагревательного элемента (расположен под разделочной доске).
- Мышь дренирование плевральной полости трубки подготовки (рис. 1). 10 см длины трубы PE 50 (Intramedic, внутренний диаметр 0,58 мм, наружным диаметром 0,965 мм) вырезать. Один конец прикреплен к тупым концом изогнутой иглой 23 калибра, эта игла будет использоваться, чтобы передать трубку, через грудной стенки (внутри → пределами) до закрытия грудной окна.
Дистальный конец трубки (1,5 см в длину, напротив прилагаемой 23 калибраигла) несколько раз проткнуть иглой 30, создавая "сторону портов" в целях содействия эффективному стремление внутригрудных воздуха.
Это окончатые часть отделяется от остальной части трубки на несколько окружных петли 4:00 шов шелк; эти петли будут служить в качестве "пробка", в конечном счете крепления 1,5 см окончатые часть в грудной полости. - Jugular венозных катетеров. Две 15 см длины трубы PE 10 (Intramedic, внутренний диаметр 0,28 мм, внешний диаметр 0,61 мм) вырезаются. Скальпель используется для конических концов трубки, тем самым повышая удобство вены. Трубы очищается с помощью 1 мл шприц, содержащий 6% декстрана 150 кДа решения (в PBS), подключенных к не-скошенный конец трубки.
- Грудь стену окна препарата (рис. 2). Прозрачная мембрана поливинилиденфторида (Нью-Куре Wrap, Kuresha, Токио) разрезают на овальную форму (большая ось 6 см, малая ось 4 см). Круговые 5 мм № 1 покровное (Bellcо) прикрепляется к мембране использованием α-цианоакрилат клея (Pattex flüssig, Henkel, Дюссельдорф).
- . Труба для пневмоторакса индукции ("удар трубки") 10 см, длина трубки (внутренний диаметр 3 мм, внешний диаметр 5 мм) крепится к 5 мл шприц, в противоположном конце будет использован для введения воздуха в грудной клетке животного до груди приживления окна стене.
- Шприц для погружения в воду объективной. 23 игла прикреплена к 30 мл шприц с дистиллированной водой. Кончик иглы притупляются (с использованием металла файл) в целях предотвращения повреждения цели.
2. Мышь анестезии
- Мышь находится под наркозом смесью кетамина (10 мг / мл) и ксилазина (2 мг / мл) вводили внутрибрюшинно в дозе 8 мкл на грамм массы тела мыши. Торможение происходит в течение 3 - 6 мин и не должны препятствовать спонтанного дыхания.
- Использование электрической бритвы, бритьегорло, грудь, живот и правую сторону мыши.
- Используя ленту, обеспечить мыши, чтобы тонкая доска пластика. Глава мышь должна указывать в сторону оператора (рис. 3). Нежные напряженности предоставляемых петли шва проходящий под верхними зубами служит для поддержания головы расширения. Разделочной доске делается на грелку, сохраняя мыши euthermia во время трахеостомии и размещение венозного катетера.
- Мокрая бритая области со 100% этанола.
- Подтвердите адекватного обезболивания с хвостом / лапы крайнем случае. Приступить в случае минимальный ответ, обеспечивают дополнительную болюса кетамина / ксилазина, если должным образом не под наркозом.
3. Трахеостомические
- 1 см надрез на горле. Базовая соединительная ткань разрезали, и слюнных желез разделяют и отражается в сторону. Грудинно-подъязычный мышцы сразу кпереди от трахеи резекции.
- Петля 4:00 шов продвинулись в гоэлектронной трахеи (рис. 4). Цикл затем разрезают, создавая два отдельных нитей шва, лежащие в основе трахеи. Хвостового шов будет использоваться для обеспечения трахеостомической трубки; черепной шов будет использоваться для обеспечения напряженности на трахею во время размещения трахеостомии.
- С помощью двух пальцев, верхний шов схватил и нежно напряжение подается на трахее. Горизонтального надрез в трахее между верхней и нижней нити. Этот разрез должны пересекаться примерно две трети трахеи окружности. Фланцевое трахеостомической трубки (Harvard Apparatus, 1,22 мм наружный диаметр) вставляется в дистальных трахеи и закреплен на месте с помощью хвостового трахеи шва.
- Трахеостомия связано с управлением по объему небольшой вентилятор животных (Inspira, Harvard Apparatus), и мышь вентилируемые с 40% вдыхаемого кислорода и 9 мл / кг дыхательный объем (настройки оптимизированы для поддержания адекватной оксигенации / вентиляции в нашей лаборатории). PosiTIVE давление в конце выдоха (PEEP) не начали в этой точке. Следует отметить, что вентилятор параметры должны быть оптимизированы для уникальных условий в рамках отдельных лабораторий. Различные длины избыточных трубки (вставляется между вентилятором трубки Y-разъем и трахеостомия) может быть использован для регулировки мертвого пространства, обеспечение стабильного альвеолярной вентиляции для любого выбранного дыхательного объема.
4. Венозной катетеризации
- Стыке внутренней и наружной яремной вены могут быть идентифицированы путем отслеживания дистальные ветви венозных проксимально. Наружной яремной находится под отражение слюнных желез, что может быть прослежена проксимально, чтобы найти внешнего внутренней яремной перехода.
- Используйте нежные тупой диссекции отделить яремной перехода от окружающей соединительной ткани.
- Использование 4:00 швов, галстук с наружной яремной и внутренней яремной вены дистальных (краниально) в яремную перехода.
- Сделайте небольшой надрез в килемиз яремной соединения; кровотечение должно быть минимальным.
- Два катетера может быть постепенно продвинулся через разрез и в яремную ствола. После нежного стремление обеспечить возврат крови, катетеры закреплены в вены с использованием 4:00 швов.
- Лента венозных катетеров на разделочную доску, чтобы предотвратить случайное смещение.
5. Прижизненные мышь легких микроскопии хирургии (адаптировано из Tabuchi и соавт. 18)
- Разделочная доска (содержащие сдержанный, анестезию мыши, а также выявляются венозные катетеры) является переход к прижизненной микроскопии этап, где остальные хирургические вмешательства будут выполнены. Ректального датчика температуры находится, это интерфейсы с адаптивной системой отопления (расположен под разделочную доску), что позволяет поддержание мыши euthermia.
- Один яремной венозного катетера прикреплен к шприцевой насос, который обеспечивает кетамина (10 мг / мл)-ксилазина (2 мг / мл)смеси на 200 мл в час. Адекватная анестезия раз подтвердил использованием хвост / лапы крайнем случае.
- Срединный разрез распространяется от шеи до xyphoid процессом, то, исходя сбоку с правой стороны (рис. 5).
- Использование электрокоагуляции, грудь мускулатуру удаляются, обнажая грудной клетки. Принимаются меры для обеспечения полного гемостаза.
- Крест правой задней ноги мыши на левую сторону и лентой вниз. В результате брюшной кручения вращается грудной клетки немного, повышение удобства операции.
- Поместите сцену в 45 градусов (рис. 6); это позиционирование позволяет легких отпадать от стенки грудной клетки один раз пневмоторакс индуцирован.
- 1-го ребра (самый низкий ребра) захватывают пинцетом и вырос; изогнутых щипцов откровенно толкнул под ребро. Это отделяет париетальной плевры от грудной стенки. Плевры должна оставаться unpunctured.
- Использование трубы удар ишприц, воздух принудительно введены против париетальной плевры. Это приводит к разрыву плевральной поверхности и пневмоторакс, не повреждая основной легких. Основной легких отпадут от грудной стенки, что позволяет введение электрокоагуляции щипцы без повреждения легких. Снижение вентилятор дыхательный объем, как правило, не требуется на этом этапе.
- Использование электрокоагуляции щипцы, рассекают стенку грудной клетки мускулатуры и пересекают 5-го и 6-го ребра / париетальной плевры, что делает ~ 8 мм круглое отверстие в стенке грудной клетки. Важно, чтобы полный гемостаз быть сохранен, так как наличие кровотечения скроет микроскопии (рис. 7).
- С помощью иглы водитель, дренирование плевральной полости вставить трубку в отверстие в стене грудь. Игла должна прокол грудной стенки и выхода из грудной полости ниже и латеральнее к грудной окне (рис. 7). Будьте осторожны, чтобы избежать прокола мембраны.трубка затем аккуратно вытащил из стенки грудной клетки, пока она сопротивление происходит от шва "пробка", расположенный на краю окончатые часть трубы.
- Поместите этапе квартире.
- Добавить 3 см H 2 O PEEP к вентилятору для помощи легкого переразложения.
- Клей (Pattex гель, Henkel) находится по окружности груди окне. Мембрана крепится с скольжения стеклянной крышкой, стоящих перед внешней по отношению к грудной полости. Осторожно (и окружности) приближенные мембраны для клея с помощью ватного аппликатора.
- При выполнении маневра легкого набора (3 дыхательного объема в течение которых порт PEEP вентилятор препятствия), -3 мм рт всасывающий применяется к груди трубку. Легких следует постоянно приближенных мембраны при свободном перемещении во время приливной вентиляции (рис. 8).
- Правой передней лапой на мышь перешел на левую сторону, в результате чего левое боковое положение пролежни мыши.Губки клинья могут быть использованы правильно позиционировать мышь так, грудь окна совмещена с целью погружения воды микроскопии.
- Дистиллированная вода помещается на обложку скольжения до микроскопии, позволяющий для визуализации легких с использованием объектива погружения в воду. Воды нужно будет периодически пополняться по всему изображений.
6. Измерение легочных эндотелиальных толщины поверхностного слоя
- Сразу же после закрытия грудной стенки, 500 мкл FITC-меченого декстрана 150 кДа (6% раствор в PBS) вводят через второй (без наркоза) яремных венозных катетеров. Этот болюс служит объем реанимации, а также сосудистого трассирующими для ESL измерения. Декстрана болюсным не влияет на адгезию нейтрофилов или отек легких формирования 2.
- Целью погружения в воду по центру над покровным стеклом. Выбор цели необходимо, чтобы визуализировать небольшие различия в толщине ESL, высокие численныекал диафрагмы необходима (> 0,8) при сохранении 2 - 3 мм, рабочее расстояние (с учетом проникновения через окно легких и плевральной поверхности). Мы используем Nikon CFI 75 LWD 16x (NA 0,8) и CFI 75 LWD 25x (NA 1,1) цели для этой цели.
- Для точного измерения толщины ESL в движущемся органе, очень важно, чтобы светлое и флуоресцентные сосудистой ширины выполняются одновременно. Это может быть осуществлено с использованием изображений сплиттер (Dual View, Фотометрия), что позволяет для одновременного захвата отраженного света интерференционного контраста дифференциал (DIC, светлое) и FITC изображения (рис. 9).
- Во время паузы в 5 секунд вдоха, непрерывная визуализация выступал и записывался. Позже, эти изображения могут быть пересмотрены, чтобы определить в фокусе кадров.
- Использование в фокусе кадра, субплеврально микрососудов (<20 мкм в диаметре) определены, по крайней мере, 3 микрососудов которые обычно находятся на одном кадре. После завершения эксперимента, DICи FITC-декстрана сосудистой ширина измеряется (по ослепил наблюдателя) путем усреднения длин трех перпендикулярных перехватывает за микрососудов. Предполагая, равной толщине ESL на обоих краев сосуда, размер ESL может быть определена на половину разницы между ДВС и FITC-декстрана сосудистой ширины, как описано в разделе представителя результаты.
- Как правило, прижизненной микроскопии может быть выполнена в течение> 90 минут без каких-либо признаков повреждения легких или гипотонией 2. Предварительные эксперименты должны быть выполнены, чтобы подтвердить стабильность мыши (артериальное давление, насыщение крови кислородом, вентиляции, повреждение легкого) в течение периода наблюдения. Экспериментальные препараты могут быть введены через вторую (не анестетик) яремной катетер в любой момент во время процедуры.
7. Альтернативное измерение легочных эндотелиальных целостности поверхностного слоя
Нетронутым эндотелиальной функции поверхностного слоя (частично), чтобы исключить циркулирующихния элементов из эндотелиальных 2 поверхности. ESL целостность может быть измерено по способности циркулирующих элементов (например, флуоресцентные микросферы) для доступа и взаимодействия с клеточной поверхности молекул адгезии (таких как ICAM-1).
- Anti-ICAM-1 помечены флуоресцентным микросферы готовы до операции. Стрептавидин покрытием 0,97 мкм флуоресцентные микросферы инкубировали с биотинилированным анти-ICAM-1 (YN1/1.7.4 клон, 1:50, eBioscience) антител или изотипа контроля в течение 30 мин при комнатной температуре. Микросферы трижды промывают и суспендируют в PBS на 1 х 10 9 Микросферы на мл.
- Во время прижизненной микроскопии, микросферы подвески (100 мкл) вводят в яремную венозный катетер. Через 15 мин обращения, флуоресцентные изображения будут захвачены в течение 5 минут. Микросферы неподвижно> 5 мин считается приверженцем и количественно, используя программное обеспечение для обработки изображений.
8. Эвтаназия
<р = класса "jove_content"> После завершения процедуры под наркозом мышей эвтаназии путем обескровливания через прямой пункции сердца. Эвтаназия подтверждается с помощью двустороннего пневмоторакса, после чего легкие собирают и оснастки замороженные для последующего анализа.Результаты
Экспериментальный подход, описанный в шагах 1-6 позволит захват нескольких кадров одновременно DIC (светлое) и флуоресцентные изображения. Для определения толщины ESL, записанного изображения рассматриваются ослепил наблюдателей после завершения экспериментального протокола. Использование в фокусе кадра, субплеврально микрососудов (<20 мкм в диаметре) определены, по крайней мере, 3 микрососудов которые обычно находятся на одном кадре (рис. 10). Использование программного обеспечения для анализа изображений (NIS Elements, Nikon), сосудистые ширина измеряется (по ослепил наблюдателя) путем усреднения длин трех перпендикулярных перехватывает за микрососудов. Как ESL является невидимым для DIC изображений, DIC сосудистого эндотелия шириной охватывают мембраны эндотелиальных мембран и, следовательно, с учетом ESL толщиной 9, 10. В отличие от FITC-декстрана (150 кДа) исключены из ESL. Следовательно, FITC сосудистой шириной не включают ESL толщины. Предполагая, равный ESL толстыхность на обоих краев сосуда, размер ESL поэтому может быть определена на половину разницы между ДВС и FITC-декстрана сосудистой ширины.
Несколько потенциальных технических ловушек может влиять на интерпретацию экспериментальных результатов. Наличие кровотечения в области микроскопии скроет как DIC и FITC визуализации микрососудов субплеврально, поэтому необходимо соблюдать осторожность, чтобы получить гемостаза (с помощью электрокоагуляции) во время расположения окон (5,9). Кроме того, легкие, возможно, не reapproximate грудной окно после набора маневра (5,14), это обычно указывает на неполное окружной адгезии мембраны вокруг грудной окна. Обычно это может быть исправлена путем повторного применения клея вокруг грудной окно, за которым следует набор маневр легких повторить. Наконец, необходимо соблюдать осторожность, чтобы избежать случайного введения внутривенных воздуха в мышь. Воздух эмболия, даже если не смертельным, будет preferenti союзника поездки в nondependent легких, предотвращая FITC-декстрана перфузии визуализированы (nondependent) субплеврально микрососудов.
Измерение ширины ESL требует использования изображений разветвитель (одновременное предоставление DIC и флуоресцентной томографии), а также специализированных целей микроскопии. Эти требования оборудования можно избежать с некоторыми изменениями в нашем протоколе. Гликокаликса целостности может быть косвенно измеряется путем определения ESL исключения циркулирующий микросфер с судна поверхность. Наличие деградации ESL, следовательно, указывает повышенная субплеврально микрососудистых захвата микросферы, направленные против поверхности эндотелиальных молекул адгезии (таких как ICAM-1) (рис. 11).

Рисунок 1.
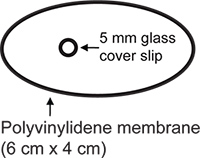
Рисунок 2.

Рисунок 3.

Рисунок 4.

Рисунок 5.

Рисунок 6.
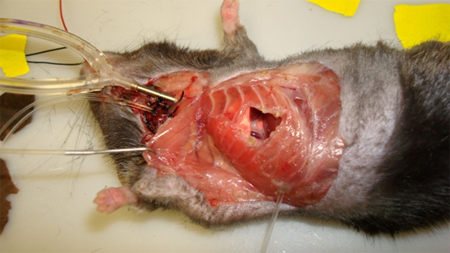
Рисунок 7.

Рисунок 8.

Рисунок 9.
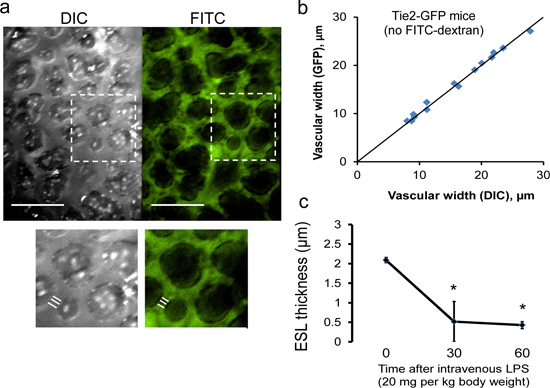
Рисунок 10. Измерение толщины мыши легочной ESL. (А) представитель одновременно захваченных DIC и флуоресцентные изображения мышью субплеврально микрососудов (линейка, 50 мкм). Микрососудов ширина измеряется с помощью средней из трех перпендикулярных линейных перехватывает. ESL толщина может быть определена на половину разницы между DIC (в том числе ESL) и флуоресцентные (без учета ESL)микрососудов ширины. (б) ДВС измерений точно определить границы субплеврально стенки сосуда, как показали почти идентичные DIC и GFP судно шириной измерений, выполненных в эндотелиальных-флуоресцентный Tie2-GFP мышей (Jackson Labs). Сплошная линия представляет линию идентичности. (С) субплеврально микрососудов можно проследить в продольном направлении, о чем свидетельствует прогрессирующая потеря толщины ESL, происходящие после внутривенного введения ЛПС (LPS). П = 3 мышей. * Р <0,05 в сравнении с временем = 0 мин ANOVA.
Фильм 1. Гликокаликса целостности могут быть определены на основе оценки анти-ICAM-1 микросфер соблюдение в субплеврально микрососудов. Высокоскоростной конфокальной микроскопии (Nikon A1R) демонстрирует приверженца флуоресцентные микросферы 45 мин после внутривенного введения ЛПС (20 мг на кг массы тела). Обратите внимание, что циркулирующий микросферы могут быть occasionallУ видел, проходящей через микроциркуляции. Для улучшения визуализации (зеленый флуоресцентный) микросферы локализации, в шаге 6,1 мышей предварительно с сосудистыми трассирующими TRITC-декстрана (150 кДа, 6%) вместо FITC-декстрана. Щелкните здесь для просмотра фильмов .
Обсуждение
Одновременно с расширением использования в естественных условиях микроскопии, растет понимание как для существенного размера ESL, а также его большой вклад в сосудистую функцию. Эти новые данные, однако, в основном получены в результате исследований системной сосудистой системы. Действительно, использование в естественных условиях микроскопии в легких является технически сложной задачей, учитывая значительный легочной и сердечной движения артефакт.
Несколько последних технических достижений позволило стабилизации движущихся легких мышей, предоставляя лучшее применение методов прижизненной в легочную микроциркуляцию 12, 13. Эти подходы, однако, возможно, путают физиологические последствия легкого неподвижности. В качестве легкого телеологически орган предназначен для непрерывного движения, легких застой будет интуитивно изменять легочной физиологии. Действительно, легких застой связан с изменениями в эндотелиальных пitric оксида сигнализации, пути вниз по течению с многочисленными последствиями, как в здоровых и поврежденных легких 14, 16. Кроме того, иммобилизация одной области легких предметов окружающих альвеолы, чтобы вредные силы сдвига, в соответствии с "atelectrauma" характеристика вентилятора вызывать повреждение легких 19. Эти и другие пока-к-быть-определены последствия легких застой, вероятно, смешал интерпретации прижизненного наблюдения легочных капилляров (пато) физиология.
Учитывая эти проблемы, мы стремились разработать метод, с помощью которого легочной ESL могут быть изучены в свободно движущейся, в естественных условиях мышь легких. Мы решили адаптировать технику Tabuchi и Kuebler, подход, который позволяет продольной визуализации свободно движущихся мышей легкие, не вызывая повреждения легких 18. Важно отметить, что наш подход состоит из нескольких тонких изменений от оригинального протокола Tabuchi автора, эти Alteraных превратилась из необходимости размещения уникальных условиях в нашей лаборатории. Кроме того, принятие нашей модели ESL измерения в других местах потребуется аналогичный оптимизации, чтобы обеспечить стабильность мыши гемодинамики, оксигенации, вентиляции и отсутствия повреждения легких.
Мы решили использовать декстран исключения в качестве основного подхода к ESL измерения. Этот метод хорошо подходит для нашей модели, как ESL измерения могут быть сделаны из одного момента времени, отрицая легочной и сердечной движения артефакт. В то время как предыдущие исследования системной микрососудов предполагают, что декстран исключением является точным только в мелких сосудах (<15 мкм 6), мы отметили, согласованные изменения в ESL судов длиной до 30 мкм в диаметре. Эти расхождения может быть связано с оптическими характеристиками, характерные для плевральной поверхности.
В движущейся сосудистого русла, очень важно, чтобы светлое и флуоресцентных изображений Occurs одновременно, так как даже небольшая задержка в Image Acquisition (например, закрытие затвора между последовательных изображений) будет фатально путать измерения толщины ESL. Во время паузы вентиляции может уменьшить это смешанные, вдоха паузы не будет полностью предотвратить сердечные артефакты движения или дыхательной артефакт из газа перераспределение в гетерогенно-завышен, потерпевшей легких ("pendelluft") 20. Мы решили использовать изображения сплиттер одновременно отправить светлое и флуоресцентных изображений на одной ПЗС-камеры. Альтернативные подходы потенциально может включать в себя использование дихроичные зеркала для одновременного захвата отраженного света и флуоресцентных изображений при конфокальной микроскопии.
Дополнительный спрос критической нашей модели является использование специализированных воды погружения цели. Эти цели должны иметь достаточно большой числовой апертурой, чтобы разрешение небольшие различия в ширине судна в то же время СОХРАНЯЯг адекватное рабочее расстояние проникать как в грудном окна и плевральной поверхности. Эти цели, в то время как доступные, очень дорого. Использование отраженного света дифференциального интерференционного контраста (DIC) микроскопии, светлое технику, которая подчеркивает безупречную края ткани, дополнительно желательно, так как DIC улучшает точность измерений сосудистой ширину.
Альтернативные методы существуют для определения легочной ширина ESL. В то время как микросферы велосиметрии не может быть точно выполнены на движущийся сосудистого русла, микросферы адгезии могут быть использованы для косвенного проверить целостность легочной гликокаликса. Ранее мы показали, что неповрежденная функции ESL, чтобы исключить циркулирующих микросферы из эндотелиальных молекул адгезии поверхности 2. Наличие анти-ICAM-1 микросфер адгезией к поверхности эндотелиальных Поэтому свидетельствует о потере гликокаликса / ESL целостности. Этот метод не требует одновременного brightfield / флуоресцентных изображений, ни высокие численные цели диафрагмы необходимо. Тем не менее, одна важная оговорка существует: для увеличения анти-ICAM-1 микросфер сцепления, чтобы указать гликокаликса потери, должны быть похожи клетки ICAM-1 поверхность выражение между контрольной и экспериментальной групп. В то время как ICAM-1 эндотелиальными выражения поверхность оставалась стабильной ранней (<45 мин) при сепсисе вызванных повреждением легких 2, поверхностное выражение в конечном итоге увеличение NF-зависимым способом 21. Использование микросфер адгезии в качестве маркера целостности гликокаликса, следовательно, может иметь силу только в начале воспаления.
Следует отметить, что в то время как наши хирургические и микроскопии не вызывать повреждение легких 2, неясно, как развиваются экспериментальные повреждения легких (например, травмы индуцированных интратрахеального закапывания кислоты) влияет на измерения толщины ESL. Развивающийся отек легких потенциально может посрамить DIC измерения ширины суднаи / или проницаемости влиянием декстрана. Эта неопределенность может быть уменьшен путем дополнительного использования нескольких методов (например, декстран исключения, микросферы адгезии, а также подтверждающие гистологической оценке судна гликозаминогликана содержание 2) для подтверждения наблюдаемыми изменениями в легочной ESL.
Таким образом, за счет расширения хирургического подхода первоначально сообщалось Tabuchi и Kuebler, мы разработали экспериментальную модель, которая позволяет для детального наблюдения легочной ESL. Использование этой модели должна обеспечить более глубокое понимание важности эндотелиального гликокаликса в легочной сосудистой физиологии в здоровье и болезни.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим доктора. Арата Tabuchi и Вольфганг Kuebler (Университет Торонто) для обучения по прижизненной микроскопии. Мы благодарим Эндрю Кэхилл (Nikon Instruments) за помощь в разработке и осуществлении микроскопии. Эта работа финансировалась NIH / NHLBI гранты P30 HL101295 и K08 HL105538 (для EPS).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | |||
| FITC-декстрана (150 кДа) | Сигма | FD150S | |
| TRITC-декстрана (150 кДа) | Сигма | T1287 | |
| Покрытых стрептавидином флуоресцентные микросферы | Челка лабораторий | CP01F/10428 | Дракон зеленую флуоресценцию (по аналогии с FITC) |
| Кетамин | Мур Медицинский | ||
| Ксилазин | Мур Медицинский | ||
| Anti-ICAM-1 биотинилированные антитела | eBioscience | Клонирование YN1/1.7.4 | Разведение 1:50 |
| Изотип биотинилированных антител | eBioscience | IgG2b eB149/10H5 | Разведение 1:50 |
| ОБОРУДОВАНИЕ | |||
| Механический вентилятор | Harvard Apparatus | Inspira | |
| Трахеостомические катетер | Harvard Apparatus | 730028 | |
| Electrocautery аппарата | DRE Медицинский | Valleylab Ю-2L | |
| Биполярные щипцы прижигания | Olsen Медицинский | 10-1200I | 9.9cm McPherson |
| Температура противоречивыел системой | Инструменты Всемирной Precision | ATC1000 | |
| Шприц насос | Harvard Apparatus | Насос 11 Elite | |
| Микроскоп (широкопольных) | Nikon | LV-150 | |
| Микроскоп (конфокальной) | Nikon | A1R | |
| Изображение сплиттер | Фотометрия | DV2 | |
| ПЗС-камеры | Фотометрия | CoolSNAP HQ2 | |
| Программное обеспечение для обработки изображений | Nikon | NIS Elements | |
| Polyvinylidene мембраны | Kure WrAP | ||
| Циркуляр покровным | Bellco | 5CIR-1-BEL | 5 мм, толщина № 1 |
| Клей (покровного стекла, чтобы мембрана) | Pattex | Flussig (жидкость) | Для нанесения покровного стекла для мембраны |
| Клей (покрытие скольжения для мыши) | Pattex | Гель | Для крепления мембраны для мыши |
| Хирургическое труб | Intramedic | PE50, PE10 | |
| Шов | Рыбак | 4:00 шелка | |
| Электробритва | Остер | 78997 | |
| Изогнутые хирургических щипцов | Roboz | ||
| Прямо хирургических щипцов | Roboz | ||
| Хирургические ножницы | Roboz | ||
| Хирургическое microscissors | Roboz | ||
| Хирургические иглы водитель | Roboz | ||
| Хирургическая лента | Рыбак | ||
| Губки кухонные (разрезать на дольки) | различный |
Ссылки
- Negrini, D., Tenstad, O., Passi, A., Wiig, H. Differential degradation of matrix proteoglycans and edema development in rabbit lung. AJP - Lung Cellular and Molecular Physiology. 290, L470-L477 (2006).
- Schmidt, E. P., et al. The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis. Nat. Med. 18, 1217-1223 (2012).
- Florian, J. A., et al. Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ. Res. 93, e136-e142 (2003).
- Chappell, D., et al. The Glycocalyx of the Human Umbilical Vein Endothelial Cell: An Impressive Structure Ex Vivo but Not in Culture. Circulation Research. 104, 1313-1317 (2009).
- Potter, D. R., Damiano, E. R. The hydrodynamically relevant endothelial cell glycocalyx observed in vivo is absent in vitro. Circ. Res. 102, 770-776 (2008).
- Weinbaum, S., Tarbell, J. M., Damiano, E. R. The Structure and Function of the Endothelial Glycocalyx Layer. Annual Review of Biomedical Engineering. 9, 121-167 (2007).
- Pittet, M., Weissleder, R. Intravital Imaging. Cell. 147, 983-991 (2011).
- Kilpatrick, D. C., Graham, C., Urbaniak, S. J., Jeffree, C. E., Allen, A. K. A comparison of tomato (Lycopersicon esculentum) lectin with its deglycosylated derivative. Biochem. J. 220, 843-847 (1984).
- Smith, M. L., Long, D. S., Damiano, E. R., Ley, K. Near-wall micro-PIV reveals a hydrodynamically relevant endothelial surface layer in venules in vivo. Biophys. J. 85, 637-645 (2003).
- Vink, H., Duling, B. R. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circ. Res. 79, 581-589 (1996).
- Marechal, X., et al. Endothelial glycocalyx damage during endotoxemia coincides with microcirculatory dysfunction and vascular oxidative stress. Shock. 29, 572-576 (2008).
- Presson, R. G. Jr, et al. Two-Photon Imaging within the Murine Thorax without Respiratory and Cardiac Motion Artifact. The American Journal of Pathology. 179, 75-82 (2011).
- Looney, M. R., et al. Stabilized imaging of immune surveillance in the mouse lung. Nat. Meth. 8, 91-96 (2011).
- Pearse, D. B., Wagner, E. M., Permutt, S. Effect of ventilation on vascular permeability and cyclic nucleotide concentrations in ischemic sheep lungs. J. Appl. Physiol. 86, 123-132 (1999).
- Hossain, M., Qadri, S., Liu, L. Inhibition of nitric oxide synthesis enhances leukocyte rolling and adhesion in human microvasculature. Journal of Inflammation. 9, 28(2012).
- Schmidt, E. P., et al. Soluble guanylyl cyclase contributes to ventilator-induced lung injury in mice. AJP - Lung Cellular and Molecular Physiology. 295, L1056-L1065 (2008).
- Mead, J., Takishima, T., Leith, D. Stress distribution in lungs: a model of pulmonary elasticity. J. Appl. Physiol. 28, 596-608 (1970).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104, 338-346 (2008).
- Gattinoni, L., Protti, A., Caironi, P., Carlesso, E. Ventilator-induced lung injury: the anatomical and physiological framework. Crit. Care Med. 38, 539-548 (2010).
- Tabuchi, A., Kim, M., Semple, J. W., Kuebler, W. M. Acute Lung Injury Causes Pendelluft Between Adjacent Alveoli In Vivo. Am. J. Respir. Crit. Care Med. 183, A2490(2011).
- Roebuck, K. A., Finnegan, A. Regulation of intercellular adhesion molecule-1 (CD54) gene expression. J. Leukoc. Biol. 66, 876-888 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены