Method Article
Nella misura in vivo della superficie polmonare strato endoteliale mouse
In questo articolo
Riepilogo
Il glicocalice endoteliale / endoteliale strato superficiale è perfettamente studiata usando la microscopia intravitale. Microscopia intravitale è tecnicamente difficile in un organo in movimento come il polmone. Si dimostra come brightfield simultanea e microscopia a fluorescenza possono essere utilizzate per stimare endoteliale spessore dello strato di superficie in un movimento liberamente In vivo Polmonare mouse.
Abstract
Il glicocalice endoteliale è uno strato di proteoglicani e glicosaminoglicani associati rivestono il lume vascolare. In vivo, il glicocalice è altamente idratata, formando uno strato consistente superficie endoteliale (ESL) che contribuisce al mantenimento della funzione endoteliale. Come il glicocalice endoteliale è spesso aberrante in vitro e si perde durante tecniche standard di fissazione dei tessuti, studio della ESL richiede l'uso di microscopia intravitale. Per meglio approssimare la fisiologia complesso del microcircolo alveolare polmonare immagini intravitale è idealmente eseguita su un polmone liberamente mobile. Tali preparazioni, tuttavia, tipicamente soffrono di artefatti da movimento ampio. Si dimostra come chiuso petto microscopia intravitale di un polmone topo liberamente mobile può essere utilizzato per misurare l'integrità glicocalice con esclusione ESL di fluorescenza destrani marcati ad alto peso molecolare dalla superficie endoteliale. Il mancato recupero tecnica chirurgica, che richiedebrightfield simultanea e imaging fluorescente del polmone mouse, consente l'osservazione longitudinale del microcircolo subpleurica senza evidenza di indurre lesioni confondimento polmonare.
Introduzione
Il glicocalice endoteliale è uno strato extracellulare di proteoglicani e glicosaminoglicani associati costeggiano il vascolare intimale. In vivo, il glicocalice è altamente idratata, formando uno strato consistente superficie endoteliale (ESL) che regola una varietà di funzioni endoteliali compreso permeabilità di un fluido 1, neutrofili-endoteliale adesione 2, e l'meccanotrasduzione di fluido 3 shear stress.
Storicamente, il glicocalice è stata sottovalutata a causa della sua aberrance in preparazioni di cellule in coltura 4, 5 e la sua degradazione durante il fissaggio del tessuto standard e di elaborazione 6. L'uso sempre più 7 di microscopia intravitale (microscopia in vivo, IVM) ha coinciso con elevato interesse scientifico per l'importanza della ESL di funzione vascolare durante la salute e la malattia. L'ESL è invisibile per microscopia ottica e non può essere facilmente etichettato invivo, data la propensione di fluorescenti glicocalice leganti lectine di provocare agglutinazione RBC 8 e fatale embolia polmonare (osservazioni non pubblicate). Diversi approcci indiretti sono quindi stati sviluppati per dedurre spessore ESL (e, per estensione, l'integrità glicocalice) nei letti vascolari non-movimento, come l'microcirculations cremastere e mesenterici. Queste tecniche comprendono la misurazione delle differenze in circolazione microparticella velocità in funzione della distanza dalla membrana endoteliale (immagine microparticella velocimetria 9) così come la misurazione della esclusione di ingombranti, fluorescenza etichettati marcatori vascolari (ad esempio destrani) dalla superficie endoteliale (tecnica esclusione destrano 10, 11). Di queste tecniche, solo esclusione destrano è in grado di stimare spessore ESL da misurazioni effettuate in un singolo punto nel tempo. Da misurare simultaneamente larghezze vascolari mediante microscopia brightfield (larghezza inclusive del "invisibile" ESL) e microscopia a fluorescenza di un tracciante vascolare escluso dal ESL, spessore ESL può essere calcolato come metà della differenza tra due larghezze vascolari.
L'uso di una misura istantanea di spessore ESL è adatto per lo studio del glicocalice polmonare. Microscopia intravitale del polmone è impegnativo, dato significativo artefatti da movimento polmonare e cardiaca. Mentre recenti progressi permettono di immobilizzazione polmoni topo in vivo 12, 13, esistono preoccupazioni riguardo l'impatto fisiologico di stasi polmonare. Immobilità polmonare è associato con una diminuzione di ossido nitrico endoteliale segnalazione 14, una via di segnalazione che ha un impatto sia l'adesione dei neutrofili 15 e danno polmonare 16. Inoltre, immobilizzazione di una zona di polmone espone circostante alveoli mobili pregiudizievoli per forze di taglio (cosiddetti "atelectrauma"), secondo i concetti classici fisiologicheinterdipendenza alveolare 17.
Nel 2008, Arata Tabuchi, Wolfgang Kuebler e colleghi hanno sviluppato una tecnica chirurgica che consente per la microscopia intravitale di un polmone del mouse liberamente in movimento 18. Artefatto respiratorio derivanti da questa tecnica può essere negata con l'uso di imaging ad alta velocità, compresa la misurazione simultanea di chiaro e microscopia a fluorescenza. In questo rapporto, dettaglio come istantanea di imaging esclusione destrano può essere impiegato per misurare lo spessore ESL nel microcircolo subpleurica di muoversi liberamente, in vivo polmone mouse. Questa tecnica può essere facilmente modificato per determinare glicocalice funzione-specifico, la capacità di un intatto ESL escludere circolanti elementi dalla superficie endoteliale. Abbiamo recentemente usato queste tecniche per determinare l'importanza di integrità polmonare ESL allo sviluppo di danno polmonare acuto in malattie infiammatorie sistemiche come sepsi 2.
Protocollo
1. Preparazione dei tubi chirurgici, cateteri vascolari, Muro Finestra Busto
- Fase di microscopia intravitale. Abbiamo misura una fase in plexiglass su cui si trova il mouse anestetizzato durante la microscopia. Questo stadio ospita sia di 15 cm per 10 scheda di plastica flessibile di taglio cm (su cui il mouse si trova durante l'induzione dell'anestesia, il posizionamento tracheostomia, e cateterismo venoso), così come un elemento riscaldante di dimensioni analoghe (che si trova sotto il tagliere).
- Mouse toracostomia preparazione tubo (Figura 1). A 10 cm di lunghezza del tubo PE 50 (Intramedic, diametro interno 0,58 millimetri, diametro esterno 0,965 millimetri), è tagliato. Un'estremità è fissata all'estremità di una curva smussata 23 gauge, questo ago verrà utilizzato per passare il tubo attraverso la parete toracica (interno → esterno) prima della chiusura della finestra toracica.
L'estremità distale del tubo (1,5 cm di lunghezza, di fronte agli annessi 23 gaugeago) viene ripetutamente perforato con un ago calibro 30, la creazione di "porte laterali" per facilitare l'aspirazione efficace di aria intratoracica.
Questa porzione fenestrata viene poi separato dal resto del tubo da diversi anelli circonferenziali di sutura di seta 04:00; queste anse servirà come un "tappo", infine ancorando i 1,5 centimetri fenestrated porzione all'interno della cavità toracica. - Cateteri venosi giugulare. Due lunghezze di 15 cm di tubi PE 10 (Intramedic, diametro interno 0.28 mm, diametro esterno 0,61 millimetri), sono tagliati. Un bisturi viene utilizzato per smussare le estremità del tubo, aumentando così la facilità di venipuntura. Il tubo viene lavata con una siringa da 1 ml contenente 6% soluzione di 150 kDa destrano (in PBS) attaccato al non smussato estremità della tubazione.
- Busto preparazione finestra, parete, (Figura 2). Trasparente membrana di polivinilidene (New Kure Wrap, Kuresha, Tokyo) viene tagliato in una forma ovale (asse maggiore 6 cm, minori asse 4 cm). Una circolare 5 # 1 coprioggetto (Bellco) è fissato alla membrana con α-cianoacrilato colla (Pattex flüssig, Henkel, Düsseldorf).
- . Tubo per induzione pneumotorace ("blow tube") A 10 cm di lunghezza di tubo (diametro interno 3 mm, diametro esterno 5 mm) è attaccato ad una siringa da 5 ml, all'estremità opposta sarà utilizzato per introdurre aria nella gabbia toracica animale prima di attecchimento finestra parete toracica.
- Siringa per immersione in acqua di obiettivo. A 23 gauge è collegato a una siringa di 30 ml contenente acqua distillata. La punta dell'ago è smussata (utilizzando un file di metallo) per evitare di danneggiare l'obiettivo.
2. Anestesia mouse
- Un topo è anestetizzato con una miscela di ketamina (10 mg / ml) e xilazina (2 mg / ml), intraperitoneale somministrato alla dose di 8 microlitri per grammo di peso corporeo del mouse. Sedazione avviene entro 3 - 6 minuti e non dovrebbe ostacolare la respirazione spontanea.
- L'utilizzo di un rasoio elettrico, la barbala gola, torace, addome, e la parte destra del mouse.
- Con del nastro, fissare il mouse per una scheda di taglio di plastica sottile. La testa del mouse deve essere rivolto verso l'operatore (Figura 3). Leggera tensione fornita da un anello di sutura passa sotto i denti superiori serve a mantenere l'estensione testa. Il tagliere è posto su di una piastra elettrica, mantenendo euthermia mouse durante tracheostomia e il posizionamento del catetere venoso.
- Wet zone rasate con il 100% di etanolo.
- Confermare l'anestesia adeguata con una coda / zampa pizzico. Procedere se risposta minima, fornire un bolo extra di ketamina / xilazina se non adeguatamente anestetizzato.
3. Tracheostomia
- A 1 centimetro incisione è fatta sulla gola. Sottostante tessuto connettivo è sezionato, e le ghiandole salivari sono separati e riflessi lateralmente. Il muscolo sterno-ioideo immediatamente anteriore alla trachea viene asportato.
- Un ciclo di sutura 04:00 è avanzata in the trachea (Figura 4). Il ciclo viene poi tagliato, creando due filoni separati di sutura sottostanti la trachea. La sutura caudale sarà utilizzato per fissare la cannula, la sutura cranica sarà utilizzato per fornire la tensione sulla trachea durante il posizionamento tracheostomia.
- Usando due dita, la sutura superiore è afferrata e leggera tensione viene applicata alla trachea. Una incisione orizzontale è realizzata nella trachea tra superiore e inferiore suture. Questa incisione dovrebbe attraversare circa due terzi della circonferenza tracheale. Una cannula flangiato (Harvard Apparatus, 1,22 mm di diametro esterno) viene inserito nella trachea distale e fissato in posizione utilizzando la sutura caudale tracheale.
- La tracheostomia è collegato ad un volume controllato ventilatore piccolo animale (Inspira, Harvard Apparatus), e il topo è ventilato con 40% di ossigeno inspirato e 9 ml / kg volumi correnti (impostazioni ottimizzate per mantenere un'adeguata ossigenazione / aerazione nel nostro laboratorio). Posizione pressione di fine espirazione (PEEP) non è iniziata a questo punto. Da notare che le impostazioni del ventilatore dovrebbe essere ottimizzato per condizioni uniche in singoli laboratori. Diverse lunghezze dei tubi ridondanti (interposto tra il tubo del ventilatore connettore a Y e tracheostomia) possono essere utilizzati per regolare lo spazio morto, assicurando stabile ventilazione alveolare per qualsiasi volume scelto marea.
4. Cateterismo venoso
- La giunzione della vena giugulare interna ed esterna può essere identificato da inseguimento rami venosi distali prossimalmente. La giugulare esterna si trova sotto le ghiandole salivari riflettono, che può essere fatta prossimalmente per trovare l'esterna-interna di giunzione giugulare.
- Utilizzare dolce smussa per separare il bivio giugulare dal circostante tessuto connettivo.
- Utilizzando suture 04:00, legare le vene giugulari esterne e interne giugulari distali (craniale) fino al bivio giugulare.
- Fai una piccola incisione nella carenadella giunzione giugulare, sanguinamento dovrebbe essere minimo.
- Due cateteri possono essere gradualmente avanzare attraverso l'incisione e nel tronco giugulare. Dopo l'aspirazione delicata per assicurare il ritorno del sangue, cateteri sono fissati all'interno della vena con suture 04:00.
- Tape cateteri venosi al tagliere per evitare contro dislocazione accidentale.
5. Intravitale mouse Microscopia chirurgia polmonare (adattato da Tabuchi et al. 18)
- La scheda di taglio (che contiene il contenuto, il mouse anestetizzato e cateteri venosi registrate) è transizione alla fase di microscopia intravitale, dove gli interventi chirurgici rimanenti verrà eseguita. Una sonda di temperatura rettale è posto; questa interfaccia con un sistema di riscaldamento adattativo (che si trova sotto il tagliere), che permette la manutenzione di euthermia mouse.
- Un catetere venoso giugulare è collegato a una pompa a siringa che fornisce un ketamina (10 mg / ml)-xilazina (2 mg / ml)miscela a 200 pl per ora. Anestesia adeguata è ancora una volta confermata con coda / zampa pizzico.
- L'incisione mediana si estende dal collo al processo xifoideo, procedendo poi lateralmente a destra (Figura 5).
- Utilizzando elettrocauterizzazione, la muscolatura del torace viene rimosso, esponendo la gabbia toracica. La cura è presa per garantire l'emostasi completa.
- Attraversare gamba posteriore destro del mouse sul lato sinistro e il nastro verso il basso. La torsione risultante addominale ruota il torace leggermente, migliorando la facilità della chirurgia.
- Luogo la fase ad un angolo di 45 gradi (figura 6); questo posizionamento permette il polmone ad allontanarsi dalla parete toracica volta il pneumotorace è indotta.
- Il 1 ° costola (costola più inferiore) si afferra con una pinza e cresciuto, una pinza curva è senza mezzi termini spinto sotto la costola. Questo separa pleura parietale dalla parete toracica. La pleura deve restare unpunctured.
- Utilizzando il tubo di colpo euna siringa, l'aria viene forzatamente introdotta contro la pleura parietale. Questo porta alla rottura della superficie pleurica pneumotorace e senza danneggiare il polmone sottostante. Il polmone sottostante cadere dalla parete toracica, che consentiva l'introduzione di una pinza elettrocauterizzazione senza danneggiare il polmone. Una diminuzione del volume corrente ventilatore non è tipicamente richiesto durante questa fase.
- Utilizzando pinze elettrocauterizzazione, sezionare la muscolatura della parete toracica e tagliare attraverso il 5 ° e 6 ° / nervature pleura parietale, facendo da 8 mm ~ foro circolare nella parete toracica. È essenziale che completa emostasi essere mantenuta, come la presenza di sanguinamento oscurerà microscopia (Figura 7).
- Utilizzando un driver ago, inserire il tubo nel foro toracostomia parete toracica. L'ago deve forare la parete toracica e uscire dalla cavità toracica inferiore e laterale della finestra toracica (Figura 7). Fare attenzione a non pungere la membrana. Iltubo viene quindi delicatamente tirato fuori dalla parete toracica finché non si verifica una resistenza da "tappo" sutura situato sul bordo della porzione fenestrata del tubo.
- Posizionare la fase piatta.
- Aggiungere 3 cm H 2 O PEEP al ventilatore per aiutare assistere riespansione del polmone.
- Colla (Pattex gel, Henkel) è posto attorno alla circonferenza della finestra torace. La membrana è collegato, con il vetrino coprioggetti vetro rivolta verso l'esterno alla cavità toracica. Attenzione (e circonferenzialmente) circa la membrana alla colla usando un applicatore di cotone.
- Durante l'esecuzione di una manovra di reclutamento polmonare (3 volumi correnti durante il quale la porta è ostruita ventilatore PEEP), -3 mmHg aspirazione viene applicato al tubo toracico. Il polmone deve costantemente approssimativa della membrana, mentre liberi di muoversi durante la ventilazione di marea (Figura 8).
- La zampa anteriore destra del mouse è passati al lato sinistro, con un conseguente decubito laterale sinistro del mouse.Cunei spugna può essere utilizzata per posizionare correttamente il mouse così la finestra torace è allineato con l'obiettivo ad immersione microscopia acqua.
- Acqua distillata è posto sul vetrino prima microscopia, permettendo la visualizzazione del polmone utilizzando un obiettivo ad immersione in acqua. Acqua dovrà essere rifornito intermittente durante l'imaging.
6. Misura dello spessore polmonare endoteliale strato superficiale
- Immediatamente dopo la chiusura della parete toracica, 500 pl FITC-destrano marcato 150 kDa (6% in soluzione di PBS) è somministrato attraverso il secondo (non anestesia) catetere venoso giugulare. Questo serve come bolo rianimazione volume e il tracciante vascolare per ESL misurazione. Il bolo destrano non influenza l'adesione dei neutrofili o edema polmonare formazione 2.
- L'obiettivo immersione in acqua è centrato sul vetrino. La scelta di un obiettivo essenziale-per visualizzare piccole differenze di spessore ESL, un alto Numerical diaframma è necessaria (> 0,8) pur mantenendo un 2-3 mm di distanza di lavoro (che consente la penetrazione attraverso la finestra polmone e superficie pleurica). Usiamo il Tribunale di primo grado 75 Nikon LWD 16x (NA 0,8) e Tribunale di primo grado 75 LWD 25x (NA 1.1) gli obiettivi per questo scopo.
- Per misurare con precisione lo spessore ESL in un organo in movimento, è essenziale che chiaro e fluorescenti larghezze vascolari sono eseguite simultaneamente. Ciò può essere realizzato utilizzando una immagine splitter (Dual View, fotometrici) che consente la cattura simultanea di luce riflessa contrasto di interferenza differenziale (DIC, campo chiaro) e le immagini FITC (Figura 9).
- Durante una pausa 5 sec inspiratoria, imaging continuo viene eseguito e registrato. Più tardi, queste immagini possono essere riviste per individuare in-frame di messa a fuoco.
- L'utilizzo di un telaio di messa a fuoco, subpleurica microvasi (<20 micron di diametro) sono identificati; almeno 3 microvasi si trovano tipicamente in un unico telaio. Dopo il completamento dell'esperimento, DICe FITC-destrano larghezze vascolari sono misurate (da un osservatore cieco) facendo la media delle lunghezze di tre intercettazioni perpendicolari al microvascolare. Supponendo uguale spessore ESL su entrambi i bordi della nave, la dimensione ESL può essere definita da una metà della differenza tra DIC e FITC-destrano larghezze vascolari, come descritto nella sezione rappresentativa Risultati.
- In genere, la microscopia intravitale può essere eseguita per> 90 min senza alcuna prova di danno polmonare o ipotensione 2. Esperimenti preliminari vanno eseguite per confermare la stabilità del mouse (pressione sanguigna, ossigenazione, ventilazione, danno polmonare) durante il periodo di osservazione. Farmaci sperimentali può essere introdotto attraverso il secondo (non-anestetico) giugulare catetere in qualsiasi momento durante la procedura.
7. Misura alternativa della integrità endoteliale polmonare strato superficiale
Le intatte endoteliali funzioni di strato di superficie (in parte) per escludere cirelementi zione del 2 di superficie endoteliale. Integrità ESL può quindi essere misurata la capacità di un elemento circolare (ad esempio una microsfera fluorescente) per accedere e interagire con molecole di adesione sulla superficie cellulare (come ICAM-1).
- Anti-ICAM-1 etichetta microsfere fluorescenti sono preparato prima dell'intervento chirurgico. Streptavidina rivestite 0,97 micron microsfere fluorescenti sono incubati con controllo biotinilato anti-ICAM-1 (YN1/1.7.4 clone, 01:50, eBioscience) isotipo dell'anticorpo o per 30 min a temperatura ambiente. Le microsfere vengono lavate tre volte in PBS e sospese a 1 x 10 9 microsfere per ml.
- Durante microscopia intravitale, la sospensione di microsfere (100 microlitri) viene iniettato nel catetere venoso giugulare. Dopo 15 min di circolazione, immagini fluorescenti vengono catturate oltre 5 min. Immobile per> 5 min Microsfere sono considerati aderenti e quantificate utilizzando un software di elaborazione delle immagini.
8. Eutanasia
"jove_content" Dopo completamento della procedura, topi anestetizzati sono eutanasia da dissanguamento via diretta puntura cardiaca. L'eutanasia è confermato tramite pneumotorace bilaterale, dopo di che vengono raccolti i polmoni e lo snap-congelati per una successiva analisi.
Risultati
L'approccio sperimentale descritto in fasi 1-6 consentirà cattura di fotogrammi di DIC simultanea (campo chiaro) e immagini fluorescenti. Per determinare lo spessore ESL, le immagini registrate vengono esaminati da un osservatore cieco dopo il completamento del protocollo sperimentale. Utilizzando un telaio a fuoco, subpleurica microvasi (<20 micron di diametro) sono identificati; almeno 3 microvasi trovano tipicamente in un unico telaio (Figura 10). Utilizzando software di analisi di immagine (NIS Elements, Nikon), vascolari larghezze sono misurate (da un osservatore cieco) la media della lunghezza di tre intercettazioni perpendicolari al microvasi. Come ESL è invisibile DIC imaging, DIC larghezze membrana endoteliale vascolare estendersi alla membrana endoteliale e sono quindi comprensivi di spessore ESL 9, 10. In contrasto, FITC-destrano (150 kDa) è esclusa dal ESL. Di conseguenza, le larghezze FITC vascolari non incorporano spessore ESL. Assumendo pari ESL spessoreness su entrambi i bordi della nave, la dimensione ESL può quindi essere definito da una metà della differenza tra DIC e FITC-destrano larghezze vascolari.
Diversi potenziali insidie tecniche possono interferire con l'interpretazione dei risultati sperimentali. La presenza di sanguinamento nel campo microscopia oscurerà sia visualizzazione DIC e FITC del microcircolo subpleurica, pertanto occorre prestare attenzione per ottenere l'emostasi (utilizzando elettrocauterizzazione) durante il posizionamento della finestra (5.9). Inoltre, il polmone potrebbe non reapproximate finestra toracica dopo la manovra di reclutamento (5.14), il che di solito indica incompleta adesione circonferenziale della membrana intorno alla finestra toracica. Questo può essere corretta riapplicazione di colla intorno alla finestra toracica, seguita da una manovra di reclutamento ripetizione polmonare. Infine, la cura deve essere presa per evitare l'iniezione accidentale di aria per via endovenosa nel mouse. Emboli d'aria, anche se non mortali, sarà preferenti alleato viaggio al polmone nondependent, impedendo FITC-destrano perfusione del visualizzata (nondependent) microcircolo subpleurica.
Misurazione della larghezza ESL richiede l'uso di un divisore di immagine (offra simultanea di imaging DIC e fluorescenza) nonché obiettivi microscopia specializzati. Queste richieste apparecchiature possono essere evitati con alcune modifiche al nostro protocollo. Integrità glicocalice può essere indirettamente misurata determinando l'esclusione di ESL circolante microsfere dalla superficie vaso. La presenza di degrado ESL, pertanto, è indicato da un aumento della cattura subpleurica microvascolare di microsfere mirate contro molecole di adesione endoteliali superficiali (come ICAM-1) (Figura 11).

Figura 1.
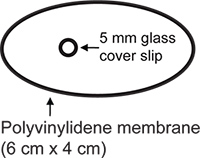
Figura 2.

Figura 3.

Figura 4.

Figura 5.

Figura 6.
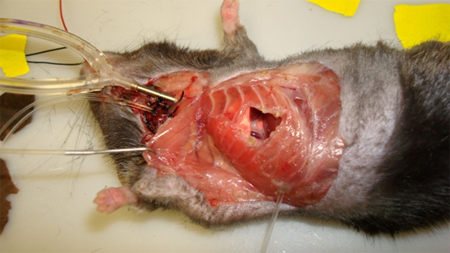
Figura 7.

Figura 8.

Figura 9.
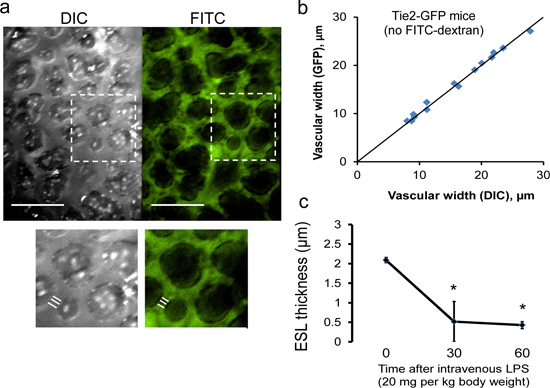
Figura 10. La misurazione dello spessore del mouse polmonare ESL. (A) rappresentante simultaneamente le immagini catturate DIC e fluorescenza del microcircolo del mouse subpleurica (barra della scala, 50 micron). Larghezza microvasi è misurata utilizzando la media di tre intercetta perpendicolari lineari. ESL spessore può essere determinato da una metà della differenza tra DIC (comprensivo della ESL) e fluorescente (esclusiva della ESL)larghezze microvasi. (b) misurazioni DIC identificare con precisione i confini subpleuriche parete dei vasi, come dimostrato da quasi DIC-identici e GFP misure di larghezza nave condotta endoteliale-fluorescenti Tie2-GFP topi Labs (Jackson). Linea continua rappresenta linea di identità. (C) Il microcircolo subpleurica può essere seguita longitudinalmente, come dimostra la progressiva perdita di spessore che si verificano dopo ESL endovenosa lipopolisaccaride (LPS). N = 3 topi. * P <0,05 rispetto al tempo = 0 min mediante ANOVA.
Film 1. Glicocalice integrità può essere determinato valutando per anti-ICAM-1 aderenza microsfere all'interno del microcircolo subpleurica. Ad alta velocità microscopia confocale (Nikon A1R) dimostra aderente microsfere fluorescenti 45 minuti dopo LPS per via endovenosa (20 mg per kg di peso corporeo). Notare che circola microsfere possono essere occasionally visto passare attraverso il microcircolo. Per migliorare la visualizzazione della (verde fluorescente) microsfere localizzazione, nel passaggio 6,1 topi sono stati pretrattati con il tracciante vascolare TRITC-destrano (150 kDa, 6%) al posto di FITC-destrano. Clicca qui per visualizzare filmati .
Discussione
Coincidente con il diffondersi di microscopia in vivo, vi è crescente apprezzamento sia per la notevole entità delle ESL così come i suoi numerosi contributi alla funzione vascolare. Questi dati emergenti, tuttavia, derivano principalmente da studi del sistema vascolare sistemica. In effetti, l'uso di microscopia in vivo nel polmone è tecnicamente impegnativo, dato artefatto significativo movimento polmonare e cardiaca.
Diversi recenti progressi tecnici hanno consentito la stabilizzazione del polmone movimento del mouse, offrendo una migliore applicazione delle tecniche intravitale la microcircolazione polmonare 12, 13. Questi approcci, tuttavia, sono potenzialmente confusi da ramificazioni fisiologiche di immobilità polmonare. Poiché il polmone è teleologicamente un organo destinato a moto continuo, stasi polmonare intuitivamente altera la fisiologia polmonare. Infatti, stasi polmonare è associata ad alterazioni endoteliale nitric ossido di segnalazione, un percorso con numerose conseguenze a valle sia nel polmone sano e feriti 14, 16. Inoltre, immobilizzazione di una zona dei soggetti circostanti alveoli polmonari a forze di taglio pregiudizievoli, coerente con la caratteristica "atelectrauma" del ventilatore induce danno polmonare 19. Questi ed altri ancora-a-essere-identificati conseguenze di stasi polmonare possono confondere l'interpretazione di osservazioni intravitale di microvascolare polmonare (pato) fisiologia.
Dati questi problemi, si è cercato di sviluppare un metodo con cui la ESL polmonare potrebbe essere studiato in un movimento liberamente, in vivo polmone mouse. Abbiamo scelto di adattare la tecnica di Tabuchi e Kuebler, un approccio che permette la visualizzazione longitudinale di un polmone del mouse liberamente in movimento senza l'istigazione lesioni polmonari 18. È importante sottolineare che il nostro approccio contiene diverse alterazioni sottili dal protocollo originale di Tabuchi; queste alterazionizioni si sono evoluti dalla necessità di ospitare particolari condizioni all'interno del nostro laboratorio. Analogamente, l'adozione del modello di misurazione ESL altrove richiederà ottimizzazione simile a garantire la stabilità emodinamica del mouse, ossigenazione, ventilazione, e l'assenza di danno polmonare.
Abbiamo scelto di utilizzare l'esclusione di destrano come il nostro approccio primario al ESL misura. Questa tecnica è particolarmente adatto per il nostro modello, in quanto le misure ESL può essere fatto da un singolo momento nel tempo, negando artefatti da movimento polmonare e cardiaca. Mentre gli studi precedenti del microcircolo sistemico hanno suggerito che l'esclusione destrano è precisa soltanto nei piccoli vasi (<15 micron 6), abbiamo notato cambiamenti concordanti ESL a navi fino a 30 micron di diametro. Queste discrepanze possono essere dovuti a caratteristiche ottiche specifiche alla superficie pleurica.
In un letto mobile vascolare, è essenziale che chiaro e di imaging fluorescente occurs contemporaneamente, come anche un breve ritardo di acquisizione delle immagini (ad esempio, la chiusura di scatto tra le immagini in sequenza) avrebbe fatalmente confondere misurazioni dello spessore ESL. Durante la pausa di ventilazione può diminuire questa confusione, una pausa inspiratoria non previene completamente artefatto cardiaco o un artefatto di movimento respiratorio dalla redistribuzione del gas in modo eterogeneo-gonfiati, polmoni feriti ("pendelluft") 20. Abbiamo scelto di utilizzare un divisore dell'immagine da inviare contemporaneamente chiaro e le immagini fluorescenti per una singola telecamera CCD. Approcci alternativi potrebbero includere l'uso di specchi dicroici per catturare contemporaneamente riflettono luce e immagini fluorescenti durante microscopia confocale.
Un aumento della domanda fondamentale del nostro modello è l'uso di speciali immersione in acqua obiettivi. Questi obiettivi devono avere un'apertura sufficientemente grande per consentire la risoluzione numerica delle piccole differenze nella larghezza dei vasi pur MANUTENZIOg una distanza adeguata al lavoro per penetrare sia nella finestra del torace e superficie pleurica. Tali obiettivi, pur disponibili, sono molto costosi. L'uso di luce riflessa contrasto interferenziale differenziale (DIC) microscopia, una tecnica campo chiaro che evidenzia i bordi del tessuto non marcate, è inoltre desiderabile, come DIC migliora la precisione delle misure di larghezza vascolari.
Tecniche alternative esistono per la determinazione della larghezza ESL polmonare. Mentre velocimetry microsfere non può essere accuratamente eseguita su un letto mobile vascolare, adesione microsfere possono essere impiegati per testare l'integrità indirettamente polmonare glicocalice. Abbiamo precedentemente dimostrato che le funzioni intatte ESL escludere circolanti microsfere da molecole di adesione endoteliali di superficie 2. La presenza di anticorpi anti-ICAM-1 microsfere adesione alla superficie endoteliale indica quindi una perdita di glicocalice / ESL integrità. Questa tecnica non richiede brightf simultaneaield / fluorescente di imaging, né sono alti obiettivi apertura numerica necessaria. Tuttavia, esiste un avvertimento importante: per una maggiore aderenza anti-ICAM-1 microsfere per indicare perdita glicocalice, ci deve essere simile cella espressione ICAM-1 superficie tra gruppi di controllo e sperimentali. Mentre la espressione ICAM-1 superficie endoteliale rimasto stabile precoce (<45 min) a sepsi danno polmonare indotto 2, superficie espressione fine aumenterà in modo NF-kB dipendente 21. Uso di adesione microsfere come marker di integrità glicocalice, pertanto, può essere valida solo durante l'infiammazione precoce.
Da notare che, mentre le nostre tecniche chirurgiche e la microscopia non provocare il danno polmonare 2, non è certo quanto in continua evoluzione danno polmonare sperimentale (ad esempio, lesioni indotte da acido instillazione endotracheale) influenza misurazioni dello spessore ESL. Evoluzione edema polmonare potrebbe confondere le misure DIC di larghezza navee / o influenza permeabilità destrano. Questa incertezza può essere mitigato attraverso l'uso complementare di molteplici tecniche (ad esempio, l'esclusione destrano, l'adesione microsfere, e conferma le valutazioni istologiche di contenuti nave glicosaminoglicano 2) per confermare le modifiche osservate nel polmonare ESL.
In sintesi, espandendo l'approccio chirurgico inizialmente riportato da Tabuchi e Kuebler, abbiamo sviluppato un modello sperimentale che consente l'osservazione dettagliata della ESL polmonare. L'uso di questo modello dovrebbe consentire una maggiore comprensione dell'importanza del glicocalice endoteliale di fisiologia vascolare polmonare in salute e malattia.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo Drs. Arata Tabuchi e Wolfgang Kuebler (Università di Toronto) per l'istruzione per quanto riguarda la microscopia intravitale. Ringraziamo Andrew Cahill (Nikon Instruments) per l'assistenza nella progettazione e realizzazione di microscopia. Questo lavoro è stato finanziato dal NIH / NHLBI concede P30 HL101295 e K08 HL105538 (per EPS).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | |||
| FITC-destrano (150 kDa) | Sigma | FD150S | |
| TRITC-destrano (150 kDa) | Sigma | T1287 | |
| Streptavidina rivestite microsfere fluorescenti | Bangs Laboratories | CP01F/10428 | Drago Verde fluorescenza (simile a FITC) |
| Ketamina | Moore Medical | ||
| Xylazina | Moore Medical | ||
| Anti-ICAM-1 biotinilato | eBioscience | Clone YN1/1.7.4 | Diluizione 1:50 |
| Isotipo anticorpo biotinilato | eBioscience | IgG2b eB149/10H5 | Diluizione 1:50 |
| ATTREZZATURE | |||
| Ventilatore meccanico | Harvard Apparatus | Inspira | |
| Tracheostomia catetere | Harvard Apparatus | 730028 | |
| Apparecchi Elettrocauterizzazione | DRE Medical | Valleylab SSE-2L | |
| Cauterizzazione bipolare pinza | Olsen Medical | 10-1200i | 9,9 centimetri McPherson |
| Temperatura Control Sistema | Mondo Strumenti di precisione | ATC1000 | |
| Pompa a siringa | Harvard Apparatus | Pompa 11 Elite | |
| Microscopio (widefield) | Nikon | LV-150 | |
| Microscopio (confocale) | Nikon | A1R | |
| Image Splitter | Fotometrici | DV2 | |
| Telecamera CCD | Fotometrici | CoolSNAP HQ2 | |
| Immagine software di elaborazione | Nikon | NIS Elements | |
| Membrana di polivinilidene | Kure Wrap | ||
| Fodera circolare | Bellco | 5CIR-1-BEL | 5 mm, uno spessore # |
| Colla (fodera a membrana) | Pattex | Flüssig (liquido) | Per l'apposizione vetrino alla membrana |
| Colla (coperchio a scorrimento del mouse) | Pattex | Gel | Per il fissaggio della membrana per il mouse |
| Tubo chirurgico | Intramedic | PE50, PE10 | |
| Suturare | Pescatore | Seta 04:00 | |
| Rasoio elettrico | Oster | 78997 | |
| Curve pinze chirurgiche | Roboz | ||
| Dritti pinza chirurgica | Roboz | ||
| Forbici chirurgiche | Roboz | ||
| Microforbici chirurgici | Roboz | ||
| Ago chirurgico conducente | Roboz | ||
| Nastro chirurgico | Pescatore | ||
| Spugne da cucina (tagliati a spicchi) | vario |
Riferimenti
- Negrini, D., Tenstad, O., Passi, A., Wiig, H. Differential degradation of matrix proteoglycans and edema development in rabbit lung. AJP - Lung Cellular and Molecular Physiology. 290, L470-L477 (2006).
- Schmidt, E. P., et al. The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis. Nat. Med. 18, 1217-1223 (2012).
- Florian, J. A., et al. Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ. Res. 93, e136-e142 (2003).
- Chappell, D., et al. The Glycocalyx of the Human Umbilical Vein Endothelial Cell: An Impressive Structure Ex Vivo but Not in Culture. Circulation Research. 104, 1313-1317 (2009).
- Potter, D. R., Damiano, E. R. The hydrodynamically relevant endothelial cell glycocalyx observed in vivo is absent in vitro. Circ. Res. 102, 770-776 (2008).
- Weinbaum, S., Tarbell, J. M., Damiano, E. R. The Structure and Function of the Endothelial Glycocalyx Layer. Annual Review of Biomedical Engineering. 9, 121-167 (2007).
- Pittet, M., Weissleder, R. Intravital Imaging. Cell. 147, 983-991 (2011).
- Kilpatrick, D. C., Graham, C., Urbaniak, S. J., Jeffree, C. E., Allen, A. K. A comparison of tomato (Lycopersicon esculentum) lectin with its deglycosylated derivative. Biochem. J. 220, 843-847 (1984).
- Smith, M. L., Long, D. S., Damiano, E. R., Ley, K. Near-wall micro-PIV reveals a hydrodynamically relevant endothelial surface layer in venules in vivo. Biophys. J. 85, 637-645 (2003).
- Vink, H., Duling, B. R. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circ. Res. 79, 581-589 (1996).
- Marechal, X., et al. Endothelial glycocalyx damage during endotoxemia coincides with microcirculatory dysfunction and vascular oxidative stress. Shock. 29, 572-576 (2008).
- Presson, R. G. Jr, et al. Two-Photon Imaging within the Murine Thorax without Respiratory and Cardiac Motion Artifact. The American Journal of Pathology. 179, 75-82 (2011).
- Looney, M. R., et al. Stabilized imaging of immune surveillance in the mouse lung. Nat. Meth. 8, 91-96 (2011).
- Pearse, D. B., Wagner, E. M., Permutt, S. Effect of ventilation on vascular permeability and cyclic nucleotide concentrations in ischemic sheep lungs. J. Appl. Physiol. 86, 123-132 (1999).
- Hossain, M., Qadri, S., Liu, L. Inhibition of nitric oxide synthesis enhances leukocyte rolling and adhesion in human microvasculature. Journal of Inflammation. 9, 28(2012).
- Schmidt, E. P., et al. Soluble guanylyl cyclase contributes to ventilator-induced lung injury in mice. AJP - Lung Cellular and Molecular Physiology. 295, L1056-L1065 (2008).
- Mead, J., Takishima, T., Leith, D. Stress distribution in lungs: a model of pulmonary elasticity. J. Appl. Physiol. 28, 596-608 (1970).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104, 338-346 (2008).
- Gattinoni, L., Protti, A., Caironi, P., Carlesso, E. Ventilator-induced lung injury: the anatomical and physiological framework. Crit. Care Med. 38, 539-548 (2010).
- Tabuchi, A., Kim, M., Semple, J. W., Kuebler, W. M. Acute Lung Injury Causes Pendelluft Between Adjacent Alveoli In Vivo. Am. J. Respir. Crit. Care Med. 183, A2490(2011).
- Roebuck, K. A., Finnegan, A. Regulation of intercellular adhesion molecule-1 (CD54) gene expression. J. Leukoc. Biol. 66, 876-888 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon