Method Article
Na medição in vivo da camada superficial do rato pulmonar endotelial
Neste Artigo
Resumo
A camada de superfície endotelial glicocálice / endotelial está idealmente estudada por microscopia intravital. Microscopia intravital é tecnicamente desafiante em um órgão em movimento, tais como o pulmão. Demonstramos como brightfield simultânea e microscopia de fluorescência pode ser utilizado para estimar a espessura da camada endotelial da superfície em um movimento livremente In vivo Pulmão do rato.
Resumo
O glycocalyx é uma camada endotelial de proteoglicanos e glicosaminoglicanos associados que revestem o lúmen vascular. In vivo, o glycocalyx é altamente hidratada, formando uma camada superficial substancial endotelial (ESL), que contribui para a manutenção da função endotelial. À medida que o glicocálice endotelial é muitas vezes aberrante in vitro e é perdida durante as técnicas de fixação de tecidos normais, o estudo do ESL requer o uso de microscopia intravital. Para melhor a fisiologia do complexo aproximado da microvasculatura alveolar, imagens intravital pulmonar está idealmente realizada em um pulmão livremente movimento. Estas preparações, no entanto, geralmente sofrem de artefacto de movimento extensivo. Demonstramos como de tórax fechado de microscopia intravital de um pulmão de rato livremente móvel pode ser usado para medir a integridade glicocálice via ESL exclusão de fluorescentemente marcadas com dextranos de elevado peso molecular a partir da superfície endotelial. Esta técnica não-recuperação cirúrgica, que requerbrightfield simultânea e de imagem de fluorescência do pulmão do rato, permite a observação longitudinal da microvasculatura subpleural sem evidência de induzir lesão pulmonar confusão.
Introdução
O glycocalyx é uma camada endotelial extracelular de proteoglicanos e glicosaminoglicanos associados que revestem a íntima vascular. In vivo, o glycocalyx é altamente hidratada, formando uma camada superficial substancial endotelial (ESL) que regula várias funções endoteliais incluindo a permeabilidade do fluido 1, neutrófilos endotelial adesão 2, e a tensão de 3 mecanotransdução fluido de cisalhamento.
Historicamente, tem sido o glicocálice underappreciated devido à sua aberrance em preparações de células de cultura 4, 5 e a sua degradação durante a fixação do tecido normal e de processamento 6. O uso crescente de 7 microscopia intravital (em microscopia vivo, IVM) coincidiu com elevado interesse científico na importância do ESL para a função vascular durante a saúde e na doença. O ESL é invisível para microscopia de luz e não pode ser facilmente rotulado devivo, dada a propensão do glicocálice fluorescentes de ligação de lectinas para provocar a aglutinação de glóbulos vermelhos 8 e embolia pulmonar fatal (observações não publicadas). Várias abordagens indiretas, por isso, foi desenvolvido para deduzir ESL espessura (e, por extensão, a integridade glicocálice), não-móveis leitos vasculares, como os microcirculations cremastérico e mesentérica. Estas técnicas incluem a medição de diferenças de velocidade de circulação de micropartículas como uma função da distância a partir da membrana endotelial (velocimetria de micropartículas imagem 9), bem como a medição da exclusão de volumosos, fluorescentemente marcadas com marcadores vasculares (por exemplo, dextranos), a partir da superfície endotelial (técnica de exclusão de dextrano 10, 11). Destas técnicas, apenas a exclusão de dextrano é capaz de estimar a espessura ESL partir de medições feitas em um único ponto no tempo. Ao medir simultaneamente larguras vasculares utilizando microscopia de campo claro (a largura emclusive do "invisível" ESL) e microscopia de fluorescência de um marcador vascular excluídos do ESL, ESL espessura pode ser calculada como a metade da diferença entre as larguras vasculares 2.
O uso de uma medida instantânea de espessura ESL é bem adequado para o estudo do glicocálice pulmonar. Microscopia intravital do pulmão é um desafio, dado artefato movimento significativo pulmonar e cardíaca. Embora os avanços recentes permitem a imobilização dos pulmões do rato, in vivo 12, 13, existam preocupações quanto ao impacto fisiológico do pulmão estase. Imobilidade pulmonar está associado com o óxido nítrico endotelial diminuiu de sinalização 14, uma via de sinalização que afeta tanto a adesão de neutrófilos e lesão pulmonar 15 16. Além disso, a imobilização de uma área de pulmão expõe circundante alvéolos móveis prejudiciais forças de cisalhamento (o chamado "atelectrauma"), de acordo com os conceitos clássicos fisiológicosinterdependência alveolar 17.
Em 2008, Arata Tabuchi, Wolfgang Kuebler e seus colegas desenvolveram uma técnica cirúrgica que permite microscopia intravital de um pulmão de rato livremente em movimento 18. Artefato respiratória decorrente desta técnica pode ser negada pela utilização de imagens em alta velocidade, incluindo a medição simultânea de campo claro e microscopia de fluorescência. Neste relatório, como pormenor, a exclusão de imagem instantânea de dextrano pode ser utilizado para medir a espessura ESL na microcirculação subpleural do pulmão do rato livremente movendo, in vivo. Esta técnica pode ser facilmente modificado para determinar a função glicocálice, especificamente, a capacidade de um intacto ESL para excluir circulante elementos a partir da superfície endotelial. Recentemente temos usado essas técnicas para determinar a importância da integridade ESL pulmonar para o desenvolvimento de lesão pulmonar aguda durante as doenças inflamatórias sistémicas tais como sépsis 2.
Protocolo
1. Preparação de tubo cirúrgico, cateteres vasculares, Janela parede torácica
- Fase microscopia intravital. Nós custom-made um estágio plexiglass em que o rato anestesiado reside durante microscopia. Esta fase acomoda ambos de 15 cm por 10 centímetros placa de corte de plástico flexível (sobre a qual o rato se encontra durante a indução da anestesia, a colocação de traqueostomia, e cateterização venosa), bem como um elemento de aquecimento de tamanho semelhante (localizado por baixo da placa de corte).
- Rato preparação tubo de toracostomia (Figura 1). Um comprimento de 10 cm de tubagem de PE 50 (Intramedic, diâmetro interno 0,58 milímetros, o diâmetro exterior 0,965 milímetros) é cortado. Uma das extremidades é ligada à extremidade romba de uma agulha de calibre 23 curvo; esta agulha vai ser usado para passar o tubo através da parede torácica (dentro → exterior) antes do fecho da janela torácica.
A extremidade distal do tubo (1,5 cm de comprimento, em frente ao calibre 23 em anexoagulha) é repetidamente perfurado por uma agulha de calibre 30, a criação de "portas laterais" para facilitar a aspiração de ar eficaz intratorácica.
Esta porção fenestrada é então separado do resto do tubo por várias voltas circunferenciais de sutura de seda 04:00; estes loops servirá como uma "rolha", em última análise, a ancoragem dos 1,5 centímetros fenestrado porção no interior da cavidade torácica. - Cateter venoso jugular. Dois 15 cm de comprimento de tubos PE 10 (Intramedic, diâmetro interno 0,28 milímetros, diâmetro externo 0,61 milímetros) são cortadas. Um bisturi é usado para chanfrar as extremidades do tubo, aumentando assim a facilidade de punção venosa. O tubo é descarregado através de uma seringa de 1 ml contendo 6% de solução de dextrano de 150 kDa (em PBS) ligado à extremidade não-chanfrada do tubo.
- Chest preparação parede janela (Figura 2). Membrana transparente de polivinilideno (New Kure Wrap, Kuresha, Tokyo) é cortada em forma oval (eixo maior a 6 cm, de menor importância do eixo 4 cm). A 5 mm circular n º 1 lamela (Bellco) é fixada à membrana usando α-cianoacrilato cola (Pattex flüssig, Henkel, Dusseldorf).
- . Tubo para a indução de pneumotórax ("tubo de sopro") Um comprimento de tubo de 10 cm (diâmetro interno de 3 mm, diâmetro externo de 5 mm) é ligada a uma seringa de 5 ml, a extremidade oposta vai ser utilizado para introduzir o ar para dentro da gaiola de animais torácica antes de peito enxerto janela parede.
- Seringa para imersão em água do objectivo. Uma agulha de calibre 23 é ligada a uma seringa de 30 ml com água destilada. A ponta da agulha é embotada (usando um arquivo de metal), a fim de evitar danos para o objectivo.
2. Anestesia Rato
- Um rato é anestesiado com uma mistura de cetamina (10 mg / ml) e xilazina (2 mg / ml), administrada por via intraperitoneal na dose de 8 ul por grama de peso corporal do rato. A sedação ocorre dentro de 3 - 6 min e não deve impedir a respiração espontânea.
- Usando um barbeador elétrico, fazer a barbada garganta, tórax, abdômen, e do lado direito do rato.
- Usando a fita, prenda o mouse para uma placa fina de plástico de corte. A cabeça do rato deve apontar para o operador (Figura 3). Tensão suave proporcionada por um laço de sutura que passa por baixo dos dentes superiores serve para manter a extensão da cabeça. A placa de corte é colocada sobre uma almofada de aquecimento, mantendo euthermia mouse durante traqueostomia e colocação de cateter venoso.
- Áreas molhadas raspadas com 100% de etanol.
- Confirme anestesia adequada com uma pitada de cauda / pata. Proceder se resposta mínima, fornecer um bolus extra de cetamina / xilazina se não forem adequadamente anestesiado.
3. Traqueostomia
- Uma incisão de 1 cm é feita ao longo da garganta. Tecido conjuntivo subjacente é dissecado, e as glândulas salivares são separados e reflete lateralmente. O músculo esterno imediatamente anterior à traquéia é ressecado.
- Um laço de sutura 04:00 é avançado em poe traqueia (Figura 4). O ciclo é então cortada, criando duas cadeias separadas de sutura subjacentes à traqueia. A sutura de caudal irá ser utilizado para fixar o tubo de traqueostomia; sutura craniana vai ser usado para fornecer a tensão na traqueia, durante a colocação de traqueostomia.
- Usando dois dedos, a sutura superior é agarrada e a tensão é aplicada uma ligeira à traqueia. Uma incisão é feita na horizontal da traqueia superior entre as suturas e inferiores. Esta incisão deve atravessar aproximadamente dois terços da circunferência traqueal. Um tubo de traqueostomia de arrastamento (Harvard Apparatus, 1,22 mm de diâmetro exterior) é inserido na traqueia distal e fixada no lugar através do fio de sutura caudal traqueal.
- A traqueostomia é ligado a um ventilador de animais controlada a volume pequeno (Inspira, Harvard Apparatus), e que o mouse é ventilado com 40% de oxigênio inspirado e 9 ml / kg de volume corrente (configurações otimizadas para manter a oxigenação adequada / ventilação em nosso laboratório). PosiA pressão expiratória final positiva (PEEP) não é iniciada neste ponto. De nota, o ventilador deve ser otimizada para condições únicas dentro dos laboratórios individuais. Diferentes comprimentos de tubagem redundante (interposta entre o tubo do ventilador conector Y e traqueostomia) pode ser usada para ajustar o espaço morto, garantindo ventilação alveolar estável para qualquer volume escolhido de maré.
4. Cateterismo Venoso
- A junção da veia jugular interna e externa podem ser identificadas através de rastreamento ramos venosos distais proximalmente. A jugular externa é encontrado debaixo das glândulas salivares refletidas, o que pode ser rastreada proximalmente para encontrar a junção externo-interno jugular.
- Use dissecção romba suave para separar a junção jugular do tecido circundante conjuntivo.
- Com suturas 04:00, amarrar as jugular externa e interna das veias jugulares distais (cranial) para a junção jugular.
- Faça uma incisão pequena no carinada junção jugular; sangramento deve ser mínima.
- Dois cateteres podem ser incrementalmente avançado através da incisão e para dentro do tronco jugular. Após a aspiração suave para garantir o retorno do sangue, cateteres são assegurada na veia com suturas 04:00.
- Fita cateteres venosos para a placa de corte para prevenir contra o deslocamento acidental.
5. Intravital Rato Cirurgia Microscopia Lung (adaptado de Tabuchi et al. 18)
- A placa de corte (contendo o rato anestesiado contido bem como cateteres venosos gravadas) é transferida para o estágio de microscopia intravital, em que as intervenções cirúrgicas restantes será executada. Uma sonda de temperatura retal é colocado; esta interface com um sistema de aquecimento adaptativo (localizado sob a placa de corte), permitindo a manutenção de euthermia mouse.
- Um cateter venoso jugular está ligado a uma bomba de seringa, que proporciona uma mistura de cetamina (10 mg / ml), xilazina (2 mg / ml)mistura à temperatura de 200 ul por hora. Anestesia adequada é novamente confirmado usando a cauda / pata pitada.
- A incisão é estendida a partir do pescoço ao processo xifóide, em seguida, proceder-se lateralmente para o lado direito (Figura 5).
- Usando a electrocauterização, a musculatura do peito é removida, expondo a caixa torácica. Toma-se cuidado para garantir a hemostase completa.
- Atravesse garupa direito do rato sobre o lado esquerdo e fita para baixo. A torção, resultante do tórax abdominal gira ligeiramente, melhorando a facilidade da operação.
- Coloque a fase em um ângulo de 45 graus (Figura 6), o que permite o posicionamento do pulmão para cair para fora da parede do peito quando o pneumotórax é induzida.
- A 1 ª costela (costela mais inferior) é apreendido com pinça e levantou; uma pinça curva é bruscamente empurrado por baixo da costela. Isto separa pleura parietal da parede torácica. A pleura deve permanecer unpunctured.
- Usando o tubo de sopro euma seringa, o ar é introduzido à força contra a pleura parietal. Isto leva a ruptura da superfície pleural e pneumotórax, sem danificar o pulmão subjacente. O pulmão subjacente cair fora da parede torácica, o que permite a introdução de uma pinça de eletrocautério sem danificar o pulmão. Uma diminuição no volume tidal ventilador não é normalmente necessário durante este passo.
- Utilizando uma pinça eletrocautério, dissecar o peito musculatura da parede e corte pelas 5 ª e 6 ª costelas / pleura parietal, fazendo um buraco ~ 8 milímetros circular na parede torácica. É essencial que a hemostase completa seja mantida, tal como a presença de hemorragia irá obscurecer microscopia (Figura 7).
- Utilizando um controlador de agulha, inserir o tubo de toracostomia no orifício da parede torácica. A agulha deve perfurar a parede do peito e sair da cavidade torácica inferior e lateral para a janela torácica (Figura 7). Tome cuidado para evitar a perfuração do diafragma. Otubo é então delicadamente puxado para fora da parede da caixa, até que a resistência ocorre a partir do fio de sutura "rolha", localizado na extremidade da porção do tubo fenestrado.
- Coloque a fase plana.
- Adicione 3 cm H 2 O PEEP ao ventilador para ajudar a ajudar reexpansão pulmonar.
- Cola (Pattex gel, Henkel) é colocada circunferencialmente em torno da janela de peito. A membrana é ligada, com a lamela de vidro voltado para o exterior da cavidade torácica. Cuidadosamente (e circunferencialmente) aproximada da membrana para a cola usando um aplicador de algodão.
- Durante a realização de uma manobra de recrutamento do pulmão (3 volumes correntes durante a qual a porta é obstruída ventilador PEEP), -3 mm Hg sucção é aplicada ao tubo de peito. O pulmão deve persistentemente aproximada da membrana, enquanto movendo-se livremente, durante a ventilação de ar corrente (Figura 8).
- A pata dianteira direita do rato é cruzado para o lado esquerdo, o que resulta numa posição de decúbito lateral esquerdo do rato.Cunhas de esponja pode ser utilizado para posicionar devidamente o rato para a janela do peito está alinhado com a objectiva de imersão em água a microscopia.
- A água destilada é colocada sobre a lâmina de cobertura antes de microscopia, permitindo a visualização do pulmão utilizando uma objectiva de imersão em água. Água terá de ser reabastecido intermitentemente ao longo da imagem latente.
6. Medição da Espessura da camada endotelial da superfície pulmonar
- Imediatamente após o fechamento da parede torácica, 500 ul de FITC-dextrano 150 kDa marcado (solução a 6% em PBS) é administrada através do cateter venoso segunda (não-anestesia) jugular. Isto serve como bolus ressuscitação de volume, bem como o marcador vascular para ESL medição. O bolus dextrano não influencia a adesão de neutrófilos ou a formação de edema pulmonar 2.
- O objetivo imersão em água está centrada sobre a lamínula. A escolha do objetivo é essencial para visualizar pequenas diferenças na espessura ESL, um elevado numerical abertura é necessário (> 0,8) e ainda manter um 2-3 mm de distância de trabalho (que permite a penetração através da janela de pulmão e superfície pleural). Usamos a Nikon CFI 75 LWD 16x (NA 0,8) e CFI 75 LWD 25x (NA 1.1) objetivos para esta finalidade.
- Para medir com precisão o AEP espessura em um órgão móvel, é essencial que as larguras de campo claro e fluorescentes vasculares são realizadas simultaneamente. Isto pode ser conseguido utilizando um divisor de imagem (Dual View, Photometrics), que permite a captação simultânea de luz reflectida de contraste de interferência diferencial (DIC, campo claro) e imagens de FITC (Figura 9).
- Durante a 5 seg pausa inspiratória, imagem contínua é realizada e gravada. Mais tarde, estas imagens podem ser revistos para identificar em foco quadros.
- Usando um em foco-frame, microvasos subpleural (<20 um de diâmetro) são identificados, pelo menos três microvasos são normalmente encontrados em um único frame. Depois de terminada a experiência, DICe larguras de FITC-dextrano vasculares são medidos (por um observador cego) calculando a média dos comprimentos das três intercepta perpendiculares por microvascular. Assumindo espessura ESL igual em ambas as extremidades do navio, o tamanho ESL pode ser definida por um-metade da diferença entre as larguras de DIC e FITC-dextrano vasculares, tal como descrito na secção de resultados representativos.
- Tipicamente, microscopia intravital pode ser realizada por> 90 min, sem qualquer evidência de lesão pulmonar ou hipotensão 2. Experiências preliminares devem ser realizados para confirmar a estabilidade do rato (pressão arterial, a oxigenação, a ventilação, a lesão pulmonar), durante o período de observação. Drogas experimentais, pode ser introduzido através do segundo cateter (não-anestésico) jugular em qualquer momento durante o procedimento.
7. Medição alternativa da integridade da camada endotelial superfície pulmonar
As funções da camada endoteliais intactas de superfície (em parte) para excluir ciring elementos do 2 superfície endotelial. Integridade ESL pode, portanto, ser medida pela capacidade de um elemento circular (por exemplo, uma microesfera fluorescente), para aceder e interagir com as moléculas de adesão da superfície celular (por exemplo, ICAM-1).
- Anti-ICAM-1 marcado microesferas fluorescentes são preparados antes da cirurgia. Revestidas com estreptavidina 0,97 uM microesferas fluorescentes são incubados com anticorpo biotinilado de controlo de isotipo ou anti-ICAM-1 (clone YN1/1.7.4, 1:50, eBioscience) durante 30 min à temperatura ambiente. As microesferas são lavadas por três vezes e suspensas em PBS a 1 x 10 9 microesferas por ml.
- Durante a microscopia intravital, a suspensão de microsferas (100 uL) é injectado para dentro do cateter da veia jugular. Após 15 minutos de circulação, as imagens fluorescentes foram capturadas ao longo de 5 min. Microesferas imóvel por> 5 minutos são considerados aderentes e quantificadas usando o software de processamento de imagem.
8. Eutanásia
Após a conclusão do procedimento, os ratos anestesiados são sacrificados por exsanguinação por punção cardíaca directa. A eutanásia é confirmado através de pneumotórax bilateral, após o que os pulmões são colhidas e snap-congelado para posterior análise.Resultados
A abordagem experimental descrito nos passos 1-6 permite a captura de quadros múltiplos de DIC simultânea (campo claro) e as imagens fluorescentes. Para determinar a espessura da ESL, imagens gravadas são analisadas por um observador cego, após conclusão do protocolo experimental. Usando uma moldura de focagem, microvasos subpleural (<20 um de diâmetro) são identificados; pelo menos 3 microvasos são normalmente encontrados numa estrutura única (Figura 10). Usando o software de análise de imagem (NIS Elements, Nikon), larguras vasculares são medidos (por um observador cego) calculando a média dos comprimentos das três intercepta perpendiculares por microvascular. À medida que a ESL é invisível a imagem DIC, DIC larguras vasculares abrangem a membrana endotelial da membrana endotelial e são, portanto, incluindo o AEP espessura 9, 10. Em contraste, a FITC-dextrano (150 kDa) está excluído do AEP. Consequentemente, as larguras FITC vasculares não incorporam espessura ESL. Assumindo igual ESL grossodade em ambas as extremidades do navio, o tamanho ESL pode portanto ser definida pela metade da diferença entre as larguras de DIC e FITC-dextrano vasculares.
Vários potenciais armadilhas técnicas podem interferir com a interpretação de resultados experimentais. A presença de sangramento na microscopia de campo irão obscurecer tanto visualização DIC e FITC da microvasculatura subpleural e, portanto, deve ser tomado cuidado para se obter a hemostasia (usando electrocauterização) durante a colocação da janela (5.9). Além disso, o pulmão não pôde janela do reapproximate torácica após a manobra de recrutamento (5,14), o que normalmente indica aderência circunferencial incompleta da membrana em torno da janela torácica. Isto pode geralmente ser corrigida pela reaplicação de cola em torno da janela torácica, seguido por uma repetição da manobra de recrutamento do pulmão. Finalmente, os cuidados devem ser tomados para evitar a injeção intravenosa acidental de ar para o mouse. Êmbolos ar, mesmo se não for fatal, vai preferenti viagens aliado para o pulmão não dependente, impedindo a FITC-dextran perfusão da microvasculatura (não dependente) visualizado subpleural.
Medição de larguras de ESL requer o uso de um divisor de imagem (imagem latente proporcionando DIC e fluorescentes simultânea), bem como os objectivos de microscopia especializados. Essas demandas equipamentos podem ser evitados com algumas modificações para o nosso protocolo. Integridade glicocálice pode ser indirectamente medida através da determinação ESL exclusão de circulação microesferas a partir da superfície do vaso. A presença de degradação ESL, portanto, é indicada pela captura subpleural microvascular aumentada de microesferas dirigidos contra moléculas de superfície de adesão endoteliais (tais como a ICAM-1) (Figura 11).

Figura 1.
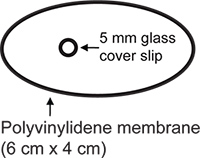
Figura 2.

Figura 3.

Figura 4.

Figura 5.

Figura 6.
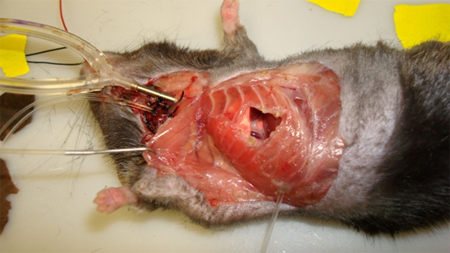
Figura 7.

Figura 8.

Figura 9.
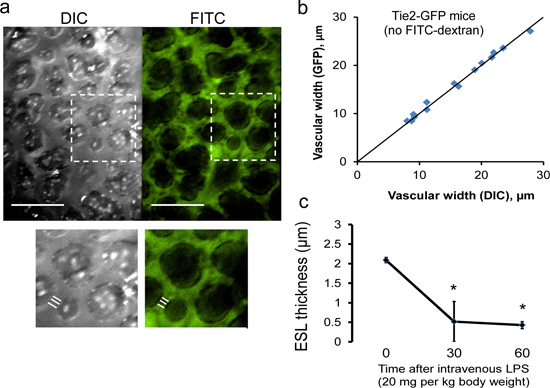
Figura 10. Medição da espessura do rato ESL pulmonar. (Um) Representante simultaneamente, capturou imagens DIC e fluorescentes da microvasculatura do mouse subpleural (barra de escala, 50 m). Largura de microvasos é medido utilizando a média das três intercepta perpendiculares lineares. ESL espessura pode ser determinada por uma-metade da diferença entre DIC (incluindo o AEP) e fluorescentes (exclusivo do ESL)microvasos. larguras (b) medições DIC identificar com precisão as fronteiras da parede dos vasos subpleurais, como demonstrado por DIC quase idênticas e as medições da largura dos vasos GFP realizados no endotélio fluorescentes Tie2-GFP ratinhos (Jackson Labs). Linha sólida representa linha de identidade. (C) A microvasculatura subpleural podem ser seguidos longitudinalmente, tal como evidenciado pela perda progressiva da espessura ESL ocorrendo após intravenosa de lipopolissacarídeo (LPS). N = 3 ratos. * P <0,05 em comparação com o tempo = 0 min por ANOVA.
Filme 1. Glicocálix integridade pode ser determinada através da avaliação de anti-ICAM-1 de adesão no interior da microesfera microvasculatura subpleural. De alta velocidade de microscopia confocal (Nikon A1R) demonstra aderente microesferas fluorescentes de 45 min após a LPS por via intravenosa (20 mg por kg de peso corporal). Note-se que circula microesferas podem ser occasionally visto que passa através da microcirculação. Para melhorar a visualização da localização microesfera (verde fluorescente), no passo 6,1 ratinhos foram pré-tratados com o marcador vascular TRITC-dextrano (150 kDa, 6%), em vez de FITC-dextrano. clique aqui para ver filme .
Discussão
Coincidente com a crescente utilização de microscopia em vivo, não há reconhecimento crescente de tanto o tamanho substancial do ESL, bem como as suas numerosas contribuições para a função vascular. Estes dados emergentes, no entanto, são principalmente derivados de estudos do sistema vascular sistémica. Na verdade, o uso de em microscopia vivo no pulmão é tecnicamente desafiador, dado artefato movimento significativo pulmonar e cardíaca.
Vários últimos avanços técnicos para a estabilização do pulmão do rato em movimento, proporcionando uma melhor aplicação das técnicas intravital para a microcirculação pulmonar 12, 13. Estas abordagens, no entanto, são potencialmente confundidos por ramificações fisiológicas de imobilidade do pulmão. À medida que o pulmão é teleologicamente um órgão destinado a um movimento contínuo, de pulmão estase intuitivamente alterar a fisiologia pulmonar. Com efeito, a estase pulmonar está associado a alterações no n endotelialitric óxido de sinalização, uma via com numerosas consequências a jusante, tanto o pulmão saudável e ferido 14, 16. Além disso, a imobilização de uma área dos sujeitos alvéolos pulmonares circundantes às forças de cisalhamento prejudiciais, de acordo com o "atelectrauma" característica do ventilador induzir lesão pulmonar 19. Estes e outros ainda a ser identificados conseqüências de pulmão estase são susceptíveis de interpretação de observações confundir intravital de microvascular pulmonar (pato) fisiologia.
Dadas estas preocupações, buscou-se desenvolver um método pelo qual o ESL pulmonar poderia ser estudada de se movimentar livremente de pulmão de rato, in vivo. Optamos por adaptar a técnica de Tabuchi e Kuebler, uma abordagem que permite a visualização longitudinal de um pulmão de rato livremente em movimento sem incitar lesão pulmonar 18. É importante ressaltar que nossa abordagem contém várias alterações sutis de protocolo original de Tabuchi, estes alteções evoluíram a partir da necessidade de acomodar condições únicas no nosso laboratório. Do mesmo modo, a adopção do nosso modelo de ESL medição em outro lugar exigirá optimização semelhante para garantir a estabilidade da hemodinâmica do rato, a oxigenação, ventilação, e a ausência de lesão pulmonar.
Nós escolhemos usar a exclusão dextrano como nosso enfoque principal para ESL medição. Esta técnica é bem adequado para o nosso modelo, como as medições de ESL pode ser feita a partir de um único momento no tempo, negando artefactos cardíaca e pulmonar. Enquanto estudos anteriores da microvasculatura sistêmica têm sugerido que a exclusão dextrano só é preciso em vasos pequenos (<15 mM 6), observamos mudanças concordantes ESL em navios de até 30 mm de diâmetro. Estas discrepâncias podem ser devido a características ópticas específicas para a superfície pleural.
Num leito móvel vascular, é essencial que o campo brilhante e fluorescência imagiologia occurs simultaneamente, como até mesmo uma breve demora na aquisição de imagem (por exemplo, o fechamento do obturador entre as imagens seqüenciais) fatalmente confundir a medida da espessura da ESL. Durante a pausa de ventilação pode diminuir esta confusão, uma pausa inspiratória não impedir completamente artefato de movimento cardíaca ou respiratória artefato da redistribuição de gás em forma heterogênea-inflados, pulmões lesionados ("pendelluft") 20. Nós eleito para usar um divisor de imagem para enviar simultaneamente claro e imagens fluorescentes a uma câmera CCD único. Abordagens alternativas poderiam incluir o uso de espelhos dicróicos para simultaneamente capturar imagens reflectidas luz fluorescente durante e microscopia confocal.
Uma demanda adicional crítica de nosso modelo é o uso de água de imersão-especializados objetivos. Estes objectivos devem ter uma abertura suficientemente grande para permitir a resolução numérica de pequenas diferenças na largura dos vasos, enquanto ainda maintaining de uma distância suficiente para penetrar a trabalhar tanto na janela do tórax e superfície pleural. Estes objectivos, enquanto disponíveis, são muito caros. O uso de interferência diferencial reflectida microscopia óptica de contraste (DIC), uma técnica de campo claro, que destaca as bordas do tecido não corados, é adicionalmente desejável, tal como DIC melhora a precisão das medições de largura vasculares.
Técnicas alternativas existem para a determinação da largura ESL pulmonar. Enquanto velocimetria microesfera não pode ser rigorosamente executada em um leito móvel vascular, a adesão de microesferas pode ser utilizado para testar a integridade de glicocálice indirectamente pulmonar. Temos anteriormente demonstrado que as funções intactas ESL para excluir circulante microesferas a partir de moléculas de adesão endoteliais de superfície 2. A presença de anticorpos anti-ICAM-1 de adesão de microesferas à superfície endotelial, por conseguinte, indica uma perda de glicocálice / ESL integridade. Esta técnica não requer brightf simultâneaield / fluorescente de imagens, nem são altos objetivos de abertura numérica necessário. No entanto, existe uma limitação importante: por aderência anti-ICAM-1 de microesferas aumentado para indicar a perda de glicocálice, deve ser semelhante a expressão de ICAM-1 na superfície celular entre o controlo e os grupos experimentais. Enquanto a expressão de ICAM-1 de superfície endotelial permaneceu estável precoce (<45 min) na sépsia lesão pulmonar induzida por 2, a expressão de superfície irá, eventualmente, aumentar de uma forma dependente de NF-kB 21. A utilização de microesferas de adesão, como um marcador da integridade glicocálice, portanto, só pode ser válido, durante a inflamação precoce.
De nota, enquanto nossas técnicas cirúrgicas e de microscopia de não provocar lesão pulmonar 2, é incerto como evolui a lesão pulmonar experimental (por exemplo, lesão induzida por instilação intratraqueal de ácido) influencia a medida da espessura da ESL. Evoluindo edema pulmonar potencialmente poderiam confundir medidas DIC de largura navioe / ou permeabilidade influência dextrano. Esta incerteza pode ser atenuado pela utilização de múltiplas técnicas complementares (por exemplo, a exclusão dextrano, a adesão de micro, bem como as avaliações de confirmação histológica de conteúdo navio glicosaminoglicanos 2) para confirmar as mudanças observadas na ESL pulmonar.
Em resumo, expandindo a abordagem cirúrgica descrita inicialmente por Tabuchi e Kuebler, desenvolvemos um modelo experimental que permite a observação detalhada do ESL pulmonar. A utilização deste modelo deverá permitir uma maior compreensão da importância do glicocálice endotelial vascular para a fisiologia pulmonar na saúde e na doença.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos os drs. Arata Tabuchi e Wolfgang Kuebler (Universidade de Toronto) para a instrução sobre microscopia intravital. Agradecemos Andrew Cahill (Nikon Instruments) para obter ajuda na concepção e implementação de microscopia. Este trabalho foi financiado pelo NIH / NHLBI concede P30 HL101295 e K08 HL105538 (para EPS).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | |||
| FITC-dextrano (150 kDa) | Sigma | FD150S | |
| TRITC-dextrano (150 kDa) | Sigma | T1287 | |
| Estreptavidina revestida microesferas fluorescentes | Bangs Laboratories | CP01F/10428 | Dragão Verde fluorescência (semelhante a FITC) |
| Cetamina | Moore Médica | ||
| Xilazina | Moore Médica | ||
| Anti-ICAM-1 anticorpo biotinilado | eBioscience | Clonar YN1/1.7.4 | Diluição 1:50 |
| Isotipo de anticorpo biotinilado | eBioscience | IgG2b eB149/10H5 | Diluição 1:50 |
| EQUIPAMENTOS | |||
| Ventilador mecânico | Harvard Apparatus | Inspira | |
| Cateter traqueostomia | Harvard Apparatus | 730028 | |
| Aparelho de eletrocautério | DRE Médica | Valleylab SSE-2L | |
| Cautério bipolar fórceps | Olsen Medical | 10-1200I | 9,9 centímetros McPherson |
| Temperatura control sistema | Instrumentos de Precisão mundo | ATC1000 | |
| Bomba de seringa | Harvard Apparatus | Elite bomba 11 | |
| Microscópio (campo amplo) | Nikon | LV-150 | |
| Microscópio (confocal) | Nikon | A1R | |
| Image Splitter | Fotometria | DV2 | |
| Câmera CCD | Fotometria | CoolSNAP HQ2 | |
| Software de processamento de imagem | Nikon | Elementos NIS | |
| Membrana de polivinilideno | Kure Wrap | ||
| Lamela circular | Bélico | 5CIR-1-BEL | 5 mm, # 1 espessura |
| Cola (tampa de deslizamento de membrana) | Pattex | Flussig (líquido) | Para a aposição lamínula à membrana |
| Cola (tampa de deslizamento de mouse) | Pattex | Gel | Para a fixação da membrana de rato |
| Tubo cirúrgico | Intramedic | PE50, PE10 | |
| Suture | Pescador | 04:00 seda | |
| Barbeador elétrico | Oster | 78997 | |
| Curvas pinça cirúrgica | Roboz | ||
| Retas pinça cirúrgica | Roboz | ||
| Tesouras cirúrgicas | Roboz | ||
| Microtesoura cirúrgicos | Roboz | ||
| Motorista agulha cirúrgica | Roboz | ||
| Fita cirúrgica | Pescador | ||
| Esponjas de cozinha (cortadas em fatias) | vário |
Referências
- Negrini, D., Tenstad, O., Passi, A., Wiig, H. Differential degradation of matrix proteoglycans and edema development in rabbit lung. AJP - Lung Cellular and Molecular Physiology. 290, L470-L477 (2006).
- Schmidt, E. P., et al. The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis. Nat. Med. 18, 1217-1223 (2012).
- Florian, J. A., et al. Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ. Res. 93, e136-e142 (2003).
- Chappell, D., et al. The Glycocalyx of the Human Umbilical Vein Endothelial Cell: An Impressive Structure Ex Vivo but Not in Culture. Circulation Research. 104, 1313-1317 (2009).
- Potter, D. R., Damiano, E. R. The hydrodynamically relevant endothelial cell glycocalyx observed in vivo is absent in vitro. Circ. Res. 102, 770-776 (2008).
- Weinbaum, S., Tarbell, J. M., Damiano, E. R. The Structure and Function of the Endothelial Glycocalyx Layer. Annual Review of Biomedical Engineering. 9, 121-167 (2007).
- Pittet, M., Weissleder, R. Intravital Imaging. Cell. 147, 983-991 (2011).
- Kilpatrick, D. C., Graham, C., Urbaniak, S. J., Jeffree, C. E., Allen, A. K. A comparison of tomato (Lycopersicon esculentum) lectin with its deglycosylated derivative. Biochem. J. 220, 843-847 (1984).
- Smith, M. L., Long, D. S., Damiano, E. R., Ley, K. Near-wall micro-PIV reveals a hydrodynamically relevant endothelial surface layer in venules in vivo. Biophys. J. 85, 637-645 (2003).
- Vink, H., Duling, B. R. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circ. Res. 79, 581-589 (1996).
- Marechal, X., et al. Endothelial glycocalyx damage during endotoxemia coincides with microcirculatory dysfunction and vascular oxidative stress. Shock. 29, 572-576 (2008).
- Presson, R. G., et al. Two-Photon Imaging within the Murine Thorax without Respiratory and Cardiac Motion Artifact. The American Journal of Pathology. 179, 75-82 (2011).
- Looney, M. R., et al. Stabilized imaging of immune surveillance in the mouse lung. Nat. Meth. 8, 91-96 (2011).
- Pearse, D. B., Wagner, E. M., Permutt, S. Effect of ventilation on vascular permeability and cyclic nucleotide concentrations in ischemic sheep lungs. J. Appl. Physiol. 86, 123-132 (1999).
- Hossain, M., Qadri, S., Liu, L. Inhibition of nitric oxide synthesis enhances leukocyte rolling and adhesion in human microvasculature. Journal of Inflammation. 9, 28 (2012).
- Schmidt, E. P., et al. Soluble guanylyl cyclase contributes to ventilator-induced lung injury in mice. AJP - Lung Cellular and Molecular Physiology. 295, L1056-L1065 (2008).
- Mead, J., Takishima, T., Leith, D. Stress distribution in lungs: a model of pulmonary elasticity. J. Appl. Physiol. 28, 596-608 (1970).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104, 338-346 (2008).
- Gattinoni, L., Protti, A., Caironi, P., Carlesso, E. Ventilator-induced lung injury: the anatomical and physiological framework. Crit. Care Med. 38, 539-548 (2010).
- Tabuchi, A., Kim, M., Semple, J. W., Kuebler, W. M. Acute Lung Injury Causes Pendelluft Between Adjacent Alveoli In Vivo. Am. J. Respir. Crit. Care Med. 183, A2490 (2011).
- Roebuck, K. A., Finnegan, A. Regulation of intercellular adhesion molecule-1 (CD54) gene expression. J. Leukoc. Biol. 66, 876-888 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados