Method Article
Запись электрической активности нейронов Выявленные в интактном мозге трансгенных рыб
В этой статье
Резюме
В этом видео мы покажем, как для записи электрической активности отдельных нейронов определены в целом подготовка мозга, который сохраняет сложные нейронные цепи. Мы используем трансгенных рыб, в котором гонадотропин-рилизинг-гормона (ГнРГ) нейронов генетически помечены флуоресцентным белком для идентификации в неповрежденной подготовки мозга.
Аннотация
Понимание физиологии клеток нейронных цепей, которые регулируют сложные поведения значительно повышается при использовании модели системы, в которых эта работа может быть выполнена в интактной подготовка мозга, где нервной системы ЦНС остается неизменным. Мы используем трансгенных рыб, в котором гонадотропин-рилизинг-гормона (ГнРГ) нейронов генетически помечены зеленым флуоресцентным белком для идентификации в неповрежденном мозге. Рыбы имеют несколько популяций ГнРГ нейронов, и их функции зависят от их расположения в мозге и ГнРГ ген, который они выражают 1. Мы сосредоточили наши демонстрации на GnRH3 нейронов, расположенных в терминале нервов (TN), связанные с использованием обонятельных луковиц интактном мозге трансгенных рыб оризии (рис. 1В и С). Исследования показывают, что оризии TN-GnRH3 нейроны нейромодуляторных, действующего в качестве передатчика информации из внешней среды в центральной нервной системе; тЭй, не играют непосредственную роль в регуляции гипофизарно-половая функция, как это делают известные нейронов гипоталамуса GnRH1 2, 3. тоником модель спонтанной стрельбы потенциал действия TN-GnRH3 нейронов является внутренним свойством 4-6, частота которой модулируется визуальные сигналы от сородичей 2 и нейропептид kisspeptin 1 5. В этом видео, мы используем устойчивую линию трансгенных оризии в которых TN-GnRH3 нейроны экспрессируют трансген, содержащий промотор области Gnrh3 связана с расширенной зеленого флуоресцентного белка 7, чтобы показать вам, как определить нейроны и следить за их электрической активности всего головного мозга подготовка 6.
протокол
1. Рассечение Головной мозг взрослого Оризии
- Обезболить взрослого мужчины или женщины (рис. 1А) путем погружения в 5 мл MS-222 (150 мг / л, рН 7,4), подождать пару минут после жабры движения перестали перед обезглавить. Все процедуры были одобрены Институциональные уходу и использованию животных комитета Калифорнийского университета в Лос-Анджелесе.
- Обезглавить рыба в рыбе солевого раствора при хвостового конца жаберной крышки с ножницами в 60-мм чашку Петри диаметром.
- Передача голова рыбы к 35-мм чашку Петри диаметром, наполовину заполненный рыбой солевые и выстроились с Sylgard, которая имеет углубление в его положение и закрепите головку для мозга рассечение. Положение и закрепите головы спинной стороной вверх с насекомых булавками.
- Аккуратно вырежьте спинной части черепа по его периметру с тонкими ножницами и осторожно удалить с помощью пинцета, выставляя спинной части мозга в том числе полностью переднюю часть спинного мозга.
- Поднимите спинного мозга осторожно тонким кончиком пинцета и отделят двусторонних соединительных нервов с острым концом ножниц: черепно-мозговых нервов, спинномозговых нервов и зрительных нервов на брюшной стороне мозга и обонятельных нервов в передней части мозг.
- Поместите полностью расчлененный мозга в свежем чашку Петри с рыбой солевого раствора и тщательно проверить под микроскопом, чтобы обеспечить весь мозг цели (в том числе гипофиза) без каких-либо сокращений или проколов. Повреждение мозга не используются для экспериментов.
2. Монтаж мозг в записи камеры
- Поместите небольшую каплю цианоакрилат или другие быстродействующие клей с помощью иглы в центр записи камеры и распространение клей около 1 см 2.
- Быстрый перенос мозга и приклейте ее вниз в вентральной стороной вверх положении.
- Добавить 1 мл солевого рыбу так, чтобы она заполнила записи камеры и охватывает мозг. Постоянно заливатьмозга с газировкой солевой рыбу со скоростью не менее 200 мкл / мин.
- Использование тонким кончиком осторожно удалить пинцетом мозговые оболочки по поверхности области записи головного мозга.
3. Электрофизиологии
- Свободные записи патча действия стрельбе потенциальную
- Стекло микроэлектродах (6-10 МОм) строятся из боросиликатного стекла пипетки (1B150F-4, инструменты Всемирного Precision) с использованием электрода съемник (например Саттер Р-87), и обратно заполненные свободную патч записи решения на полпути электрода.
- Использование вертикального флуоресцентный микроскоп с охлаждением прибора с зарядовой связью (ПЗС) камеры, найти GFP-экспрессирующих TN-GnRH3 нейронов через 10x (рис. 1В), то погружение в воду 40x цели (рис. 1в). Они расположены на или вблизи вентральной поверхности обонятельных луковиц, просто впереди конечного мозга.
- Переключитесь на видеомонитор, который предоставляетизображений в реальном времени с микроскопом, чтобы найти TN-GnRH3 нейрон кластер (рис. 1в).
- Поместите микроэлектрода в ванну так, чтобы кончик электрода выше целевого нейрона. Применение постоянного небольшое положительное давление в микроэлектрода так, что она не засоряются и осторожно подходить к целевой нейрона с кончиком электрода.
- Проверять и контролировать сопротивление электрода в фиксации потенциала режиме с помощью программного обеспечения и усилителем AxoGraph Axoclamp 200B Axograph с программным обеспечением (Axon Instruments). Когда вы можете видеть на мониторе, что кончик электрода на поверхности нейронов и от AxoGraph дисплей, что сопротивление изменяется незначительно, отпустите положительным давлением и нанесите небольшое отрицательное давление, если это необходимо, чтобы сделать низкое сопротивление уплотнения на нейрона (<100 МОм).
- Переключить на текущий зажим режиме и записывать напряжение мембраны непрерывно без тока, настройка масштабанапряжения и скорости записи, если это необходимо. Данные, собранные и проанализированные Powerlab программное обеспечение (ADInstruments Inc.)
- Запись базовой электрической активности в нормальном солевом растворе рыбы в течение примерно 5 мин до процедуры (рис. 2А). Ванна перфузии наркотиков, гормонов, пептидов и др. добавлены рыбы солевой продолжается со скоростью 200 мкл / мин с последующим периодом выведения в нормальном солевом рыбы 5, 6, 11.
- Запись всего клетки мембранного потенциала
Целой клетки патч зажим электрофизиологии процедура та же, что и внеклеточный свободную патч записи процедуру, описанную выше, на этапах 3.1.1 - 3.1.4. Тогда процедур отклоняются соответственно:- Проверять и контролировать сопротивление электрода в фиксации потенциала режиме. Когда вы можете видеть на мониторе, что кончик электрода на поверхности нейронов и от осциллографа, что сопротивление изменяется незначительно, отпустите положительнымдавлением и нанесите немного отрицательным давлением, чтобы сделать высокое сопротивление уплотнения на нейрон (~ 3 гига Ω). Нежный всасывания ртом к разрыву мембраны исправленная, вы увидите, внезапное падение сопротивление примерно до 120-250 МОм.
- Переключить на текущий зажим режиме и записывать напряжение мембраны непрерывно без тока, регулируя масштаб напряжения и скорости записи, если это необходимо.
- Запись базовой электрической активности в нормальном солевом растворе рыбы в течение примерно 5 мин до процедуры, как описано выше в 3.1.7 (фиг. 2В).
Результаты
Пример двустороннего кластеров GFP-меченых TN-GnRH3 нейронов из вырезали мозг рыбы оризии показаны на фиг.1В и 1С. Каждый кластер содержит около 8-10 ГнРГ нейронов. Спонтанной нейронной деятельности целевой TN-GnRH3 были зарегистрированы в текущем режиме зажим (I = 0) с типичной теплотехнической 0,5-6 Гц. Характер действий стрельбы потенциал, как правило, тоником или избиение узором, с достаточно регулярным интервалом межспайковые. Пример следов показаны на рисунке 2 (2А: свободный патч; 2B: цельноклеточная).
Этот экспериментальный подход также успешно записи с GFP-меченых GnRH нейронов, расположенных в переднем мозге взрослых данио рерио (фиг.3А и 3В). Нейрон электрической активности в вырезают, интактном мозге был записан аналогичным образом, как описано выше в оризии рыхлыми-патч (рис. 3C) и целых клеток записи ( Рисунок 3D). В отличие от TN-оризии ГнРГ нейронов, картина спонтанного стрельбы потенциал действия данио ГнРГ нейронов в преоптической области, вентральный конечный мозг и гипоталамус часто нерегулярно.
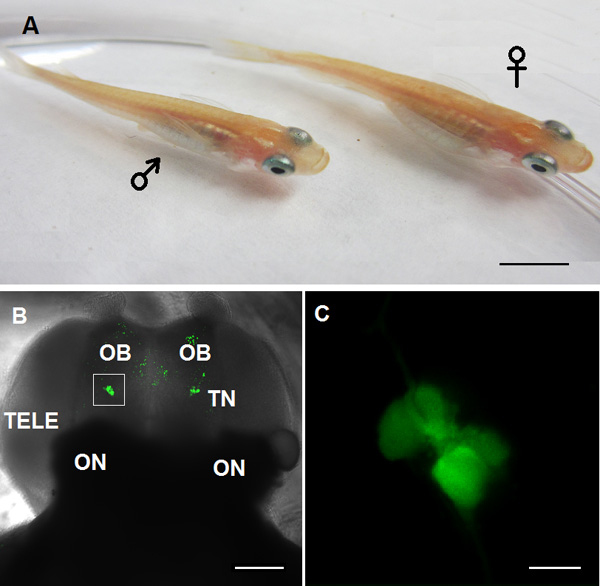
Рисунок 1. Животное модели, используемой для TN-GnRH3 нейрона исследования в этом видео: Взрослый оризии GnRH3: GFP трансгенных рыб, левое: мужчины; право:.. Женский B: конфокальной образ вентральной переднего мозга. О.Б.: обонятельная луковица; TN: нервных окончаний GnRH3 нейронов; TELE: конечный мозг, по:. Зрительного нерва C: Высокое увеличение TN-GnRH3 нейронов показано на белую коробку из панели B. (масштаб: A: 5 мм; B: 100 мкм, С: 20 мкм).
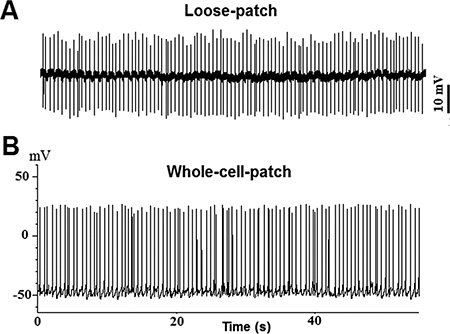
Рисунок 2. Spontaneous потенциалы действия записанные с TN-GnRH3 нейронов в текущем режиме зажим (I = 0): Пример след от свободно-патч записи; B:. Пример след от цельноклеточная записи.

Рисунок 3. Запись GnRH3: EMD (изумруд зеленый флуоресцентный белок) нейронной активности из интактных подготовки мозге взрослых трансгенных данио 9 с использованием тех же экспериментальный подход, как описано для получения мозг оризии:. GnRH3: EMD нейронов, расположенных в вентральном конечном мозге (VT) и преоптической . площадь (ПД) в переднем мозге взрослых данио B: GnRH3: EMD нейронов, расположенных в гипоталамусе (гипо). Масштабные линейки: 100 мкм C:. Пример следов свободную патча записи с GnRH3: EMD нейронаVT D:. Пример следов цельноклеточная патча записи с VT.
Обсуждение
ГнРГ 3: GFP трансгенные рыбы обеспечивают уникальные модели для изучения нейрофизиологических механизмов, лежащих в основе нейронных интеграции и регулирования в центральный контроль поведения, которые прямо или косвенно участвуют в 3 воспроизводства, 8-10. Одним из существенных преимуществ этой модели является то, что система много GnRH3 нейроны, экспрессирующие GFP близки к вентральной поверхности мозга, что позволяет относительно легкий доступ к нейронам для электрофизиологические записи без нарушения нейронных цепей 6, 9, 11, 12 (рис. 1В и 1С; фиг.3А и 3В). В этом видео, мы показали, как в случае свободного и патч-цельноклеточная записей с TN-GnRH3 нейронов в интактном мозге взрослой рыбы оризии. Не TN-GnRH3 нейроны обладают тонизирующим или избиение модели спонтанного потенциала действия стрельбе с частотой 0,5-6Hz.There были никакие обнаруженные половые различия в спонтанной стрельбыСкорость 5, но были драматические изменения в развитии нейронов GnRH3 электромонтажных работ во время эмбриогенеза 9. Свободные и патч-цельноклеточная электрофизиологии имеют различные методологические преимущества и недостатки. Свободные патч-технически проще, чем цельноклеточная записи, но только показана схема нейрона и частотой. С другой стороны, цельноклеточной записи может обеспечить гораздо больше информации: мембранный потенциал покоя, выпустив модель и частоту потенциала действия анализа, мембранные емкости и сопротивления. Потому что свободный патч записи не нарушает клеточную мембрану и нарушают внутриклеточный ион и второй концентраций посланника, он идеально подходит для длительной записи нейронной активности. Всего клетка записи разрыва клеточных мембран и в конечном итоге привести к диализу внутриклеточных молекул, тем самым потенциально изменения нейронов свойства при более длительном записей. Из-за преимущества и недостатки обоих электрофизическихгическим методам, это может быть важно исследовать нейрон свойства, используя оба метода. Поскольку оба рН и осмолярности очень важны для выживания нейронов и функции, все решения в использовании должны быть отрегулированы.
Чтобы подтвердить идентичность записанных нейронов, отрицательное давление после завершения записи, а затем флуоресценции на кончике электрода подтверждена с помощью микроскопического флуоресценции. Малый молекулярный красителей или зондов (например, Alexa Fluor 568 краситель или biocytin) могут быть включены в внутриклеточных решение для цельноклеточной записи, чтобы отметить записаны нейрон для дальнейшего морфологического анализа.
Чтобы успешно завершить запись от нейронов-мишеней в неповрежденном мозге, глубина расположения нейронов имеет решающее значение - тем глубже нейронов, тяжело прийти к согласию (как свободную патч и целых клеток). Как правило, возможно глубины для успешного исправления около 5-6 слоев клеток с поверхности. MedTN-ака GnRH3 нейронов, как правило, на вентральной поверхности мозга, в то время как у рыбок данио нейронов гипоталамуса GnRH3 может быть до 6 слоев клеток с поверхности. Положительное давление может быть очень полезным для предотвращения записи электрода от засорения при приближении к клеткам. Этот тип экспериментальный подход может быть использован для любого нейрона, генетически метили флуоресцентным белком. Для изучения активности нейронов ГнРГ во взрослом мозге, мы обычно используем оризии рыб и рыбок данио 4-6 месячного возраста. Молодая рыба с меньшим мозгом и старше рыба с более кальцинированная черепов, сделают вскрытие более сложным. TN: GnRH3 нейронов легко доступны для электрофизиологии от мозга взрослого оризии, но это не так для взрослых данио, в которых TN: GnRH3 нейронов заключены в жесткую соединительную оболочку. С другой стороны, GnRH3 нейронов в ПД, VT, а гипоталамус более доступны для электрофизиологии в головном мозге взрослых данио чем от оризии. Там нет сексаразличия, основанные на трудности вскрытие и электрофизиологии записи любого вида.
Хотя это не в естественных условиях экспериментального подхода, запись с относительно нетронутыми нейронных цепей с минимальным ущербом является привлекательным способом исследовать физиологические функции и регуляции нейронной системы интересов. Нетронутыми подготовки мозга длится в течение нескольких часов, и хорошее качество записи может длиться больше часа 6. Этот протокол подходит для исследователей, которые уже имеют базовые знания и опыт работы с методами электрофизиологии 13, и, а также специализированного оборудования, необходимых для выполнения работы.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим доктора Мэн-Чин Лин и г-жа Юань Дун за техническую помощь. Эта работа была поддержана грантом Национального института здоровья HD053767 (предоставление субконтрактов NLW), а также за счет средств кафедры физиологии и канцелярии вице-канцлера по научной работе Калифорнийского университета в Лос-Анджелесе (NLW).
Материалы
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | Comments |
| Microscope | Olympus | BX50W (Upright) | |
| Amplifier | Axon Instruments | Axoclamp 200B | |
| A-D converter | Computer Interference Corp. | Digidata ITC-18 | |
| Cooled CCD camera | PCO Computer Optics | Sensicam | |
| Xenon lamp | Sutter Instruments Co. | ||
| GFP filter set | Chroma Technologies | ||
| Imaging Software | Intelligent Imaging Innovations | Slidebook software | |
| Electrophysiology Data Acquisition Software | Axon Instruments | Axograph software | |
| Electrophysiology Data Acquisition Software | AD Instruments Inc. | PowerLab | |
| Headstage for electrophysiology | Axon Instruments | CV 203BU | |
| Micromanipulator | Sutter Instrument Co | MP-285 | |
| Recording Chamber Platform | Warner Instrument Corp. | P1 | |
| Recording Chamber | Warner Instrument Corp. | RC-26G | |
| Electrode Puller | Sutter instruments | P87 | |
| Filament for electrode puller | Sutter Instruments | FB330B | 3.0 mm wide trough filament |
| 1.5 mm glass capillaries | World Precision Instruments | 1B150-4 | Microelectrode for recording |
| Syringe | Becton Dickinson | 309586 | 3 ml |
| MS-222 | Sigma | E10521-10G | Ethyl 3-aminobenzoate methanesulfonate salt |
| Fish saline | mM: 134 NaCl; 2.9 KCl; 2.1 CaCl2; 1.2 MgCl2; 10 HEPES | ||
| Electrode solution (loose-patch) | mM: 150 NaCl; 3.5 KCl; 2.5 CaCl2; 1.3 MgCl2; 10 HEPES; 10 glucose | ||
| Electrode solution (whole-cell patch) | mM: 112.5 K-gluconate; NaCl; 17.5 KCl; 0.5 CaCl2; 1 MgCl2; 5 MgATP; 1 EGTA; 10 HEPES; 1 GTP; 0.1 leupeptin;10 phospho-creatine |
Ссылки
- Kah, O., Lethimonier, C., Lareyre, J. J. Gonadotrophin-releasing hormone (GnRH) in the animal kingdom. J. Soc. Biol. 198 (1), 53-60 (2004).
- Ramakrishnan, S., Wayne, N. L. Social cues from conspecifics alter electrical activity of gonadotropin-releasing hormone neurons in the terminal nerve via visual signals. Am. J. Physiol. Regul. Integr. Comp. Physiol. 297 (1), R135-R141 (2009).
- Abe, H., Oka, Y. Mechanisms of neuromodulation by a nonhypophysiotropic GnRH system controlling motivation of reproductive behavior in the teleost. 57 (6), 665-674 (2011).
- Oka, Y. Tetrodotoxin-resistant persistent Na+ current underlying pacemaker potentials of fish gonadotrophin-releasing hormone neurones. J. Physiol. 482 (Pt. 1), 1-6 (1995).
- Zhao, Y., Wayne, N. L. Effects of Kisspeptin1 on Electrical Activity of an Extrahypothalamic Population of Gonadotropin-Releasing Hormone Neurons in Medaka. PLoS One. 7 (5), e37909 (2012).
- Wayne, N. L., et al. Whole-cell electrophysiology of gonadotropin-releasing hormone neurons that express green fluorescent protein in the terminal nerve of transgenic medaka (Oryzias latipes). Biol. Reprod. 73 (6), 1228-1234 (2005).
- Okubo, K., et al. Forebrain gonadotropin-releasing hormone neuronal development: insights from transgenic medaka and the relevance to X-linked Kallmann syndrome. Endocrinology. 147 (3), 1076-1084 (2006).
- Okubo, K., et al. A novel form of gonadotropin-releasing hormone in the medaka, Oryzias latipes. Biochem. Biophys. Res. Commun. 276 (1), 298-303 (2000).
- Ramakrishnan, S., et al. Acquisition of spontaneous electrical activity during embryonic development of gonadotropin-releasing hormone-3 neurons located in the terminal nerve of transgenic zebrafish (Danio rerio). Gen. Comp. Endocrinol. 168 (3), 401-407 (2010).
- Abraham, E., et al. Targeted gonadotropin-releasing hormone-3 neuron ablation in zebrafish: effects on neurogenesis, neuronal migration, and reproduction. Endocrinology. 151 (1), 332-340 (2010).
- Wayne, N. L., Kuwahara, K. Beta-endorphin alters electrical activity of gonadotropin releasing hormone neurons located in the terminal nerve of the teleost medaka (Oryzias latipes. Gen. Comp. Endocrinol. 150 (1), 41-47 (2007).
- Oka, Y. Three types of gonadotrophin-releasing hormone neurones and steroid-sensitive sexually dimorphic kisspeptin neurones in teleosts. J. Neuroendocrinol. 21 (4), 334-338 (2009).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены