Method Article
הקלטת פעילות חשמלי מתא העצב מזוהה במוח שלם של דג מהונדס
In This Article
Summary
בסרטון הזה, נדגים כיצד להקליט פעילות חשמלית מתא עצב בודד שזוהה בכל הכנת מוח, השומרת על מעגלים עצביים מורכבים. אנו משתמשים בדג מהונדס שבי גונדוטרופין משחרר הורמון (GnRH) נוירונים מתויגים גנטי בחלבון פלואורסצנטי לזיהוי בהכנת המוח השלמה.
Abstract
הבנת הפיסיולוגיה של התא של מעגלים עצביים המווסתים את ההתנהגויות מורכבות היא מאוד משופרת באמצעות מערכות מודל שבו ניתן לבצע את העבודה הזאת בהכנת מוח שלמה שבו המעגלים העצביים של מערכת העצבים המרכזית נשארים שלמים. אנו משתמשים בדג מהונדס שבי גונדוטרופין משחרר הורמון (GnRH) נוירונים מתויגים גנטי עם חלבון פלואורסצנטי ירוק לזיהוי במוח שלם. יש דגי אוכלוסיות מרובות של נוירונים GnRH, והפונקציות שלהם הן תלויות במיקומם במוח ובגן GnRH שהם מביעים 1. יש לנו התמקדנו בהפגנה שלנו GnRH3 נוירונים הממוקמים בעצבי המסוף (TN) בקשר לנורות חוש הריח באמצעות המוח שלם של דגי medaka מהונדס (איור 1B ו-C). מחקרים מראים שנוירונים TN-GnRH3 Medaka הם neuromodulatory, מתנהגים כמו משדר של מידע מהסביבה החיצונית למערכת העצבים המרכזית; לאהיי לא משחק תפקיד ישיר בויסות תפקודי יותרת המוח, האשכים, כפי שעושה נוירונים ההיפותלמוס GnRH1 הידועים 2, 3. דפוס טוניק של ירי פוטנציאל פעולה הספונטני של תאי עצב TN-GnRH3 הוא מאפיין מהותי 4-6, התדירות מתוכם הוא מווסת על ידי רמזים חזותיים מקונספציפים 2 ו kisspeptin 1 5 נוירופפטידים. בסרטון הזה, אנו משתמשים בקו יציב של מהונדס medaka בי נוירונים TN-GnRH3 להביע transgene המכיל את האזור המקדם של Gnrh3 קשור לחלבון פלואורסצנטי ירוק משופר 7 להראות לך איך לזהות ולעקוב אחר פעילות נוירונים החשמלית שלהם במוח כולו הכנת 6.
Protocol
1. נתיחה של מוח מהמבוגרים Medaka
- הרדימי מבוגר זכר או נקבה (איור 1 א) על ידי טבילה ב5 מיליליטר MS-222 (150 מ"ג / ל ', pH 7.4); לחכות כמה דקות אחרי תנועות זימים הפסיקו לפני עריפת הראש. כל ההליכים אושרו על ידי הטיפול בבעלי החיים המוסדיים ועדת שימוש של אוניברסיטת קליפורניה בלוס אנג'לס.
- לערוף את הדגים במלח דגים בסוף הזנב של operculum עם מספריים בצלחת פטרי בקוטר של 60 מ"מ.
- העברת ראש דג לצלחת פטרי בקוטר 35 מ"מ, חצי מלא בדגים מלוחים ומרופד בSylgard שיש לו דיכאון בזה כדי למקם ולאבטח את הראש לנתיחה המוח. עמדה ולאבטח את הגב בצד הראש עם סיכות חרקים.
- לחתוך בזהירות את החלק הגבי של הגולגולת מסביב שלה עם מספריים עדינים ובעדינות להסיר אותו עם מלקחיים, חושף חלק הגבי של המוח כולל את החלק הקדמי של חוט השדרה לחלוטין.
- הרם את חוט השדרה בעדינות עם מלקחיים עדין קצה ולנתק את עצבי חיבור בין שתי המדינות במספריים קנס שקצהו: עצבים גולגולת, עצבים בעמוד השדרה, ואת עצבים ראייה בצד הגחוני של המוח, ואת עצבי חוש הריח בחלק הקדמי של המוח.
- מניחים את המוח גזור באופן מלא בצלחת פטרי טרי מלאה מלוח דגים, ולבדוק בזהירות מתחת למיקרוסקופ כדי להבטיח את המוח כולו הוא ללא פגע (כולל בלוטת יותרת המוח), ללא חתכים או נקבים. מוח שנפגע אינם משמש לניסויים.
2. ההרכבה המוח בתא הקלטה
- מקום טיפה קטנה של cyanoacrylate או דבק מהיר משחק אחר עם מחט לתוך מרכז חדר ההקלטה ולהפיץ את הדבק על 1 ס"מ 2.
- מהר להעביר את המוח ואותו הדבק בעמדה עד הגחון בצד.
- הוסף 1 מ"ל של תמיסת מלח דגים, כך שהוא ממלא את חדר ההקלטה ומכסה את המוח. ברציפות perfuseהמוח עם מי מלח דגי מוגזים בשיעור של לפחות 200 μl / דקה.
- באמצעות קצה מלקחיים עדין להסיר את קרומי המוח בזהירות מעל פני השטח של אזור ההקלטה של המוח.
3. Electrophysiology
- הקלטת תיקון רופפת של ירי פוטנציאל פעולה
- microelectrodes הזכוכית (6-10 MΩ) בנויים מpipettes זכוכית ורוסיליקט (1B150F-4, מכשירי עולם Precision) באמצעות חולץ אלקטרודה (למשל סאטר P-87), ומילא חזרה עם פתרון ההקלטה רופף-התיקון בחץ הדרך למעלה האלקטרודה.
- באמצעות מיקרוסקופ פלואורסצנטי זקוף עם מכשיר תשלום מצמיד מקורר (CCD) מצלמה, למצוא את ה-GFP-לבטא TN-GnRH3 הנוירונים באמצעות 10x (איור 1), ולאחר מכן מטרות טבילה במים 40X (איור 1 ג). הם ממוקמים ליד או על פני השטח הגחון של נורות חוש הריח, רק הקדמיים לtelencephalon.
- לעבור לצג וידאו שמספקתמונות בזמן אמת ממיקרוסקופ כדי לאתר את TN-GnRH3 נוירון האשכול (איור 1 ג').
- מקם את microelectrode לאמבטיה, כך שהקצה של האלקטרודה הוא מעל ליעד נוירון. להפעיל לחץ חיובי קל מתמיד microelectrode כך שזה לא ייסתם, ומתקרב בעדינות נוירון היעד עם הקצה של האלקטרודה.
- לבדוק ולפקח על התנגדות האלקטרודה במצב מתח מהדק באמצעות תוכנת AxoGraph ומגבר Axoclamp 200B עם תוכנת Axograph (אקסון מכשירים). כאשר אתה יכול לראות מהצג וידאו שהקצה של האלקטרודה הוא על פני השטח של תא העצב ומתצוגת AxoGraph שההתנגדות משתנה במקצת, שחרר את הלחץ החיובי ולהפעיל לחץ שלילי קל אם יש צורך לעשות חותם על התנגדות נמוכה נוירון (<100 MΩ).
- מעבר למצב נוכחי, מהדק, ולהקליט את מתח הקרום ברציפות ללא כל קלט נוכחי, כדי להתאים את קנה המידהשל מתח וקצב ההקלטה במידת צורך. הנתונים שנאספו ונותחו על ידי תוכנת Powerlab (ADInstruments Inc).
- פעילות שיא הבסיס חשמלית בתמיסת מלח דגים רגיל לכ -5 דקות לפני כל טיפול (איור 2 א). זלוף אמבט של תרופות, הורמונים, פפטידים, וכו '. הוסיף מלח לדגים ממשיך בשיעור של 200 μl / דקות, ואחרי תקופה בכישלון רגיל דגים מלוחים 5, 6, 11.
- הקלטת תא שלמה של פוטנציאל הממברנה
ההליך כולו מהדק תיקון תא electrophysiology הוא זהה לזה של הליך ההקלטה רופף-תיקון תאי שתואר לעיל, משלבים 3.1.1 - 3.1.4. ואז את ההליכים לסטות בהתאם:- לבדוק ולפקח על התנגדות האלקטרודה במצב מתח מהדק. כאשר אתה יכול לראות מהצג וידאו שהקצה של האלקטרודה הוא על פני השטח של תא העצב ומאוסצילוסקופ כי שינויי ההתנגדות מעט, שחררו את חיובייםלחץ ולהחיל לחץ שלילי קטן כדי להפוך את חותם עמידות גבוהה בנוירון (~ 3 גיגה Ω). החל שאיבה עדינה דרך פה לקרע קרום הטלאים, אתה תראה ירידה פתאומית של ההתנגדות לכ 120-250 MΩ.
- מעבר למצב נוכחי, מהדק, ולהקליט את מתח הקרום ברציפות ללא כל קלט נוכחי, כדי להתאים את קנה המידה של מתח וקצב ההקלטה במידת צורך.
- פעילות חשמלית בסיסית בשיא מלוח דגים רגילים לכ -5 דקות לפני כל טיפול, כפי שתוארה לעיל ב3.1.7 (איור 2).
תוצאות
דוגמה של אשכולות בין שתי המדינות של ה-GFP שכותרתו GnRH3-TN נוירונים מהמוח של דגים נכרת medaka מוצגת ב1B 1C ודמויות. כל אשכול מכיל כ 8-10 נוירונים GnRH. את הפעילות העצבית הספונטנית של יעד TN-GnRH3 נרשמה במצב נוכחי מהדק (אני = 0) עם שיעורי ירי טיפוסיים של 0.5-6 הרץ. הדפוס של ירי פוטנציאל פעולה הוא בדרך כלל דפוס טוניק או להכות, עם מרווח interspike קבוע למדי. עקבות לדוגמה מוצגות באיור 2 (2 א: רופף-תיקון; 2B: כל התא).
גישה ניסויית זה היא גם הצליח בהקלטה מ-GFP שכותרתו נוירונים GnRH הממוקמים במוח הקדמי של דג הזברה מבוגר (איורים 3 א ו 3 ב). פעילות חשמלית בתא עצב, המוח שלם נכרת נרשמה באופן דומה כפי שתוארה לעיל בmedaka ידי רופף תיקון (איור 3 ג) והקלטה כל התא ( איור 3D). שלא כמו עם הנוירונים TN-GnRH Medaka, הדפוס של ירי פוטנציאל פעולה הספונטני של נוירונים GnRH דג הזברה באזור preoptic, telencephalon הגחון, וההיפותלמוס הוא לעתים קרובות לא סדיר.
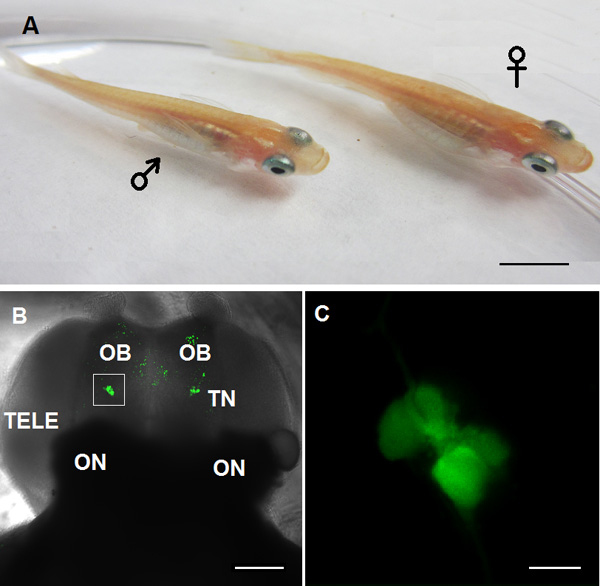
איור 1. מודל חיה המשמש למחקר TN-GnRH3 נוירון בסרט הזה: מבוגר medaka GnRH3: דג מהונדס GFP, שמאל: זכר; ימין:.. נשי ב ': תמונת confocal של תצוגת הגחון של המוח הקדמי. OB: הנורה חוש הריח; TN: עצב מסוף GnRH3 נוירונים; TELE: telencephalon; ON:. עצב הראייה C: הגדלה גבוהה של נוירונים TN-GnRH3 מוצגים בקופסה לבנה של הפנל ב '(בר סולם:: 5 מ"מ; ב': 100 מיקרומטר, C: 20 מיקרומטר).
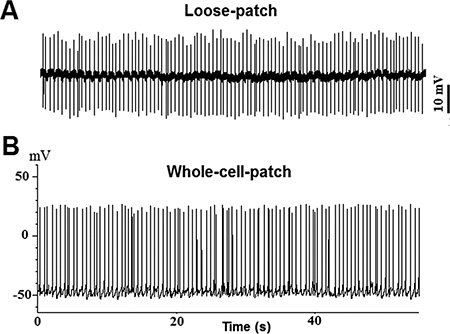
איור 2. Spoפוטנציאל פעולת ntaneous נרשם מ- TN GnRH3 הנוירונים במצב נוכחי מהדק (אני = 0): עקבות דוגמה מהקלטה רופפת-תיקון; ב ': דוגמה. עקבות מהקלטה כל התא.

איור 3. הקלטה של GnRH3: EMD (חלבון פלואורסצנטי הירוק אזמרגד) פעילות הנוירון מהמוח השלמה של הכנה למבוגרים דג הזברה מהונדס 9 תוך שימוש באותה הגישה ניסויית כפי שתואר להכנת מוח medaka:. GnRH3: נוירונים EMD ממוקמים בtelencephalon הגחון (VT) וpreoptic . האזור (POA) במוח הקדמי של דג הזברה מבוגר ב ': GnRH3: נוירונים EMD הממוקמים ביפותלמוס (היפו). סולם ברים: 100 מיקרומטר C:. קורט לדוגמה של הקלטה רופף-תיקון מGnRH3: EMD נוירון בVT D:. עקבות לדוגמה של הקלטת תיקון כל התא מVT.
Discussion
GnRH 3: דגים מהונדסים GFP לספק מודלים ייחודיים כדי לחקור את המנגנונים שבבסיס neurophysiological אינטגרציה ורגולציה בשליטה מרכזית של התנהגויות שהן גם ישירות ובעקיפין מעורבות ב3 רבייה, 8-10 עצביים. אחד היתרונות המשמעותיים של מערכת מודל זה הוא שהרבה GnRH3 נוירונים להביע GFP קרובים אל פני השטח הגחון של המוח, המאפשרים גישה קלה יחסית לתאי העצב להקלטת אלקטרו מבלי לשבש מעגלים עצביים 6, 9, 11, 12 (איורים 1B ו1C; 3A ו 3 דמויות). בסרטון הזה, שהראינו את שני הקלטות רופפות תיקון וכל תא מ- TN GnRH3 תאי עצב במוח הבוגר בשלמות של דגי medaka. נוירונים TN-GnRH3 תערוכת טוניק או תבנית פועמת של פוטנציאל פעולה ספונטני ירי בתדירות של 0.5-6Hz.There היו הבדלי מין גילוי בירי ספונטנישיעור 5, אבל היו שינויים התפתחותיים דרמטיים בGnRH3 פעילות חשמלית נוירון במהלך embryogenesis 9. Loose-תיקון וelectrophysiology כל התא יש יתרונות וחסרונות מתודולוגיות שונים. Loose-תיקון הוא קל יותר מבחינה טכנית מאשר הקלטה כל התא, אלא רק מראה את דפוס ירי נוירון ותדירות. מצד השני, הקלטה כל התא יכולה לספק מידע רב יותר: פוטנציאל הממברנה במנוחה, דפוס ותדירות ירי, ניתוח פוטנציאל פעולה, קיבול הממברנה והתנגדות. בגלל הקלטה רופפת-תיקון לא לשבור את קרום התא ולשבש את יון תאי וריכוזי שליח שני, הוא אידיאלי להקלטה ארוכת טווח של פעילות עצבית. קרע הקלטות תא כולו קרום התא וסופו של דבר להוביל לדיאליזה של מולקולות תאיות, ובכך עלולים לשנות את מאפייני נוירון עם הקלטות יותר ממושכות. בשל היתרונות והחסרונות של שניהם electrophysiשיטות ological, זה יכול להיות חשוב ללמוד מאפייני נוירון באמצעות שתי הטכניקות. מכיוון שגם ה-pH וosmolarity הם מאוד חשובים להישרדות ותפקוד תא עצב, את כל פתרונות בשימוש צריכים להיות מותאמים כראוי.
כדי לאשר את זהותו של תא העצב המוקלט, לחץ שלילי מיושם לאחר סיום ההקלטה, ולאחר מכן הקרינה בקצה של האלקטרודה הוא אישר שימוש בדימות פלואורסצנטי מיקרוסקופית. צבעים מולקולריים קטנים או בדיקות (כגון Alexa פלואוריד 568 צבע או biocytin) עשויים להיכלל בפתרון תאי להקלטה כל התא כדי לסמן את תא העצב שנרשם לניתוח צורני נוסף.
כדי להקליט בהצלחה מהנוירונים היעד במוח שלם, העומק של מיקומם של הנוירונים הוא חיוני - עמוק יותר את הנוירונים, כך קשה יותר לתיקון (שניהם רופפי תיקון וכל תא). באופן כללי, את העומק ריאלי עבור תיקון מוצלח הוא כ 5-6 שכבות תאים מפני השטח. מדנוירונים aka TN-GnRH3 הם בדרך כלל על פני השטח הגחון של המוח, ואילו נוירונים דג הזברה ההיפותלמוס GnRH3 יכולים להיות עד 6 שכבות תאים מפני השטח. לחץ חיובי מאוד עוזר כדי למנוע את האלקטרודה ההקלטה מהסתימה בעת שהתקרב לתאים. סוג זה של גישה ניסויית יכול לשמש לכל נוירון שכותרתו גנטית עם חלבון פלואורסצנטי. ללמוד פעילות הנוירון GnRH במוח הבוגר, אנו משתמשים באופן שגרתי דגי medaka ודג זברה של 4-6 חודשים של גיל. הדגים הצעירים עם מוח קטן יותר או דגים גדולים עם גולגולות מסוידים יותר, יגרמו לנתיחה יותר מאתגר. TN: GnRH3 נוירונים נגישים בקלות לelectrophysiology ממוח medaka המבוגר, אבל זה לא המקרה של דג הזברה מבוגר שבTN: GnRH3 נוירונים נארזים בנדן חיבור קשה. מצד השני, GnRH3 הנוירונים בPOA, VT, וההיפותלמוס הם יותר נגישים לelectrophysiology במוח של דג הזברה מבוגר יותר מmedaka. אין סקסהבדלים המבוססים על הקשיים של נתיחה והקלטה של electrophysiology או מינים.
אמנם זה לא בגישה ניסויית vivo, הקלטה מהמעגלים העצביים השלמים יחסית עם נזק מינימאלי היא דרך אטרקטיבית כדי לחקור את התפקוד והרגולציה של המערכת העצבית של עניין הפיזיולוגי. הכנת המוח השלמה נמשכת שעות, והקלטה טובה יכולה להימשך יותר משעה 6. פרוטוקול זה מתאים לחוקרים שכבר יש ידע בסיסי ובניסיון עם טכניקות electrophysiology 13, וכן ציוד מיוחד נדרש לעשות את העבודה.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים לד"ר מנג-צ'ין לין וגב 'דונג יואן לקבלת סיוע טכני. עבודה זו נתמכה על ידי מענק מהמכון הלאומי לבריאות HD053767 (קבלנות משנה לNLW), ועל ידי קרנות מהמחלקה לפיסיולוגיה ומשרד המשנה לנגיד למחקר, אוניברסיטת קליפורניה בלוס אנג'לס (NLW).
Materials
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | Comments |
| Microscope | Olympus | BX50W (Upright) | |
| Amplifier | Axon Instruments | Axoclamp 200B | |
| A-D converter | Computer Interference Corp. | Digidata ITC-18 | |
| Cooled CCD camera | PCO Computer Optics | Sensicam | |
| Xenon lamp | Sutter Instruments Co. | ||
| GFP filter set | Chroma Technologies | ||
| Imaging Software | Intelligent Imaging Innovations | Slidebook software | |
| Electrophysiology Data Acquisition Software | Axon Instruments | Axograph software | |
| Electrophysiology Data Acquisition Software | AD Instruments Inc. | PowerLab | |
| Headstage for electrophysiology | Axon Instruments | CV 203BU | |
| Micromanipulator | Sutter Instrument Co | MP-285 | |
| Recording Chamber Platform | Warner Instrument Corp. | P1 | |
| Recording Chamber | Warner Instrument Corp. | RC-26G | |
| Electrode Puller | Sutter instruments | P87 | |
| Filament for electrode puller | Sutter Instruments | FB330B | 3.0 mm wide trough filament |
| 1.5 mm glass capillaries | World Precision Instruments | 1B150-4 | Microelectrode for recording |
| Syringe | Becton Dickinson | 309586 | 3 ml |
| MS-222 | Sigma | E10521-10G | Ethyl 3-aminobenzoate methanesulfonate salt |
| Fish saline | mM: 134 NaCl; 2.9 KCl; 2.1 CaCl2; 1.2 MgCl2; 10 HEPES | ||
| Electrode solution (loose-patch) | mM: 150 NaCl; 3.5 KCl; 2.5 CaCl2; 1.3 MgCl2; 10 HEPES; 10 glucose | ||
| Electrode solution (whole-cell patch) | mM: 112.5 K-gluconate; NaCl; 17.5 KCl; 0.5 CaCl2; 1 MgCl2; 5 MgATP; 1 EGTA; 10 HEPES; 1 GTP; 0.1 leupeptin;10 phospho-creatine |
References
- Kah, O., Lethimonier, C., Lareyre, J. J. Gonadotrophin-releasing hormone (GnRH) in the animal kingdom. J. Soc. Biol. 198 (1), 53-60 (2004).
- Ramakrishnan, S., Wayne, N. L. Social cues from conspecifics alter electrical activity of gonadotropin-releasing hormone neurons in the terminal nerve via visual signals. Am. J. Physiol. Regul. Integr. Comp. Physiol. 297 (1), R135-R141 (2009).
- Abe, H., Oka, Y. Mechanisms of neuromodulation by a nonhypophysiotropic GnRH system controlling motivation of reproductive behavior in the teleost. 57 (6), 665-674 (2011).
- Oka, Y. Tetrodotoxin-resistant persistent Na+ current underlying pacemaker potentials of fish gonadotrophin-releasing hormone neurones. J. Physiol. 482 (Pt. 1), 1-6 (1995).
- Zhao, Y., Wayne, N. L. Effects of Kisspeptin1 on Electrical Activity of an Extrahypothalamic Population of Gonadotropin-Releasing Hormone Neurons in Medaka. PLoS One. 7 (5), e37909 (2012).
- Wayne, N. L., et al. Whole-cell electrophysiology of gonadotropin-releasing hormone neurons that express green fluorescent protein in the terminal nerve of transgenic medaka (Oryzias latipes). Biol. Reprod. 73 (6), 1228-1234 (2005).
- Okubo, K., et al. Forebrain gonadotropin-releasing hormone neuronal development: insights from transgenic medaka and the relevance to X-linked Kallmann syndrome. Endocrinology. 147 (3), 1076-1084 (2006).
- Okubo, K., et al. A novel form of gonadotropin-releasing hormone in the medaka, Oryzias latipes. Biochem. Biophys. Res. Commun. 276 (1), 298-303 (2000).
- Ramakrishnan, S., et al. Acquisition of spontaneous electrical activity during embryonic development of gonadotropin-releasing hormone-3 neurons located in the terminal nerve of transgenic zebrafish (Danio rerio). Gen. Comp. Endocrinol. 168 (3), 401-407 (2010).
- Abraham, E., et al. Targeted gonadotropin-releasing hormone-3 neuron ablation in zebrafish: effects on neurogenesis, neuronal migration, and reproduction. Endocrinology. 151 (1), 332-340 (2010).
- Wayne, N. L., Kuwahara, K. Beta-endorphin alters electrical activity of gonadotropin releasing hormone neurons located in the terminal nerve of the teleost medaka (Oryzias latipes. Gen. Comp. Endocrinol. 150 (1), 41-47 (2007).
- Oka, Y. Three types of gonadotrophin-releasing hormone neurones and steroid-sensitive sexually dimorphic kisspeptin neurones in teleosts. J. Neuroendocrinol. 21 (4), 334-338 (2009).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved