Method Article
تسجيل النشاط الكهربائي من الخلايا العصبية التي تم تحديدها في الدماغ سليمة من الأسماك المعدلة وراثيا
In This Article
Summary
في هذا الفيديو، ونحن سوف تظهر كيفية تسجيل النشاط الكهربائي من الخلايا العصبية التي تم تحديدها واحد في إعداد الدماغ كله، الذي يحافظ على الدارات العصبية المعقدة. نحن نستخدم الأسماك المعدلة وراثيا التي يتم تمييزها موجهة الغدد التناسلية لإفراز هرمون (هرمون GnRH) الخلايا العصبية وراثيا مع بروتين فلوري لتحديد الهوية في إعداد الدماغ سليمة.
Abstract
فهم الفيزيولوجيا الخلية من الدوائر العصبية التي تنظم السلوك المعقد هو تتعزز بشكل كبير عن طريق استخدام نظم نموذج التي يمكن من خلالها تنفيذ هذا العمل في إعداد الدماغ سليمة حيث لا يزال الدوائر العصبية في الجهاز العصبي المركزي سليمة. نحن نستخدم الأسماك المعدلة وراثيا التي يتم تمييزها موجهة الغدد التناسلية لإفراز هرمون (هرمون GnRH) الخلايا العصبية وراثيا مع بروتين الفلورية الخضراء لتحديد الهوية في الدماغ سليمة. وتحتوي الأسماك السكان متعددة من الخلايا العصبية هرمون GnRH، ووظائفها تعتمد على موقعها في المخ والجينات هرمون GnRH التي يبدونها 1. فقد ركزنا على مظاهرة لدينا GnRH3 الخلايا العصبية الموجودة في الأعصاب الطرفية (TN) المرتبطة بصيلات الشم باستخدام الدماغ سليمة من الأسماك المعدلة وراثيا الميداكا (الشكل 1B و C). تشير الدراسات إلى أن الخلايا العصبية الميداكا TN-GnRH3 هي neuromodulatory، بوصفها جهاز إرسال المعلومات من البيئة الخارجية إلى الجهاز العصبي المركزي؛ رمهلا لا تلعب دورا مباشرا في تنظيم وظائف الغدد التناسلية النخامية، كما يفعل المعروفة طائي GnRH1 الخلايا العصبية 2، 3. نمط منشط من إمكانات العمل العفوي إطلاق الخلايا العصبية TN-GnRH3 هو خاصية ذاتية 4-6، وتواتر الذي هو عن طريق التضمين الإشارات البصرية من conspecifics 2 وkisspeptin نيوروبيبتيدي 1 5. في هذا الفيديو، ونحن نستخدم خط مستقر من الميداكا المعدلة وراثيا في الخلايا العصبية التي TN-GnRH3 تعبر عن التحوير الذي يحتوي على منطقة المروج من Gnrh3 مرتبطة تعزيز البروتين الفلوري الأخضر 7 لتظهر لك كيفية التعرف على الخلايا العصبية ورصد نشاطهم الكهربائية في الدماغ كله إعداد 6.
Protocol
1. تشريح أدمغة من الكبار الميداكا
- تخدير الكبار من الذكور أو الإناث (الشكل 1A) من تخبط في 5 مل MS-222 (150 ملغ / لتر، ودرجة الحموضة 7.4)؛ الانتظار بضع دقائق بعد توقف الحركات الخياشيم قبل قطع الرقاب. وقد وافق جميع الإجراءات المتبعة في رعاية الحيوان واللجنة المؤسسية الاستخدام من جامعة كاليفورنيا في لوس انجليس.
- قطع رأس السمكة في المياه المالحة الأسماك في نهاية الذيلية للالوصاد مع مقص في قطر 60 ملم طبق بيتري.
- نقل رئيس الأسماك ليبلغ قطرها 35 ملم طبق بيتري، وشغل نصف مع الأسماك المالحة واصطف مع Sylgard أن لديه الاكتئاب في ذلك لوضع وتأمين الرأس لتشريح الدماغ. موقف وتأمين رأس يصل الجانب الظهري مع دبابيس الحشرات.
- قطع بعناية الجزء الظهري للجمجمة حول محيطه مع مقص غرامة وإزالة برفق مع ملقط، ويعرض الجزء الظهري من الدماغ بما في ذلك تماما الجزء الأمامي من الحبل الشوكي. <لى> ارفع الحبل الشوكي بلطف مع ملقط غرامة طرف وقطع الأعصاب الضام الثنائية مع مقص غرامة ذات الرؤوس: الأعصاب القحفية والأعصاب في العمود الفقري، والأعصاب البصرية على الجانب البطني من الدماغ، والأعصاب الشمية في الجزء الأمامي لل الدماغ.
- وضع الدماغ تشريح كاملة في طبق بيتري جديدة مليئة المالحة الأسماك، والتحقق بعناية تحت المجهر للتأكد من الدماغ كله غير سليمة (بما في ذلك الغدة النخامية) دون أي جروح أو ثقوب. لا تستخدم العقول التالفة للتجريب.
2. تركيب الدماغ في غرفة تسجيل
- وضع قطرة صغيرة من فورية الغراء أو بعض الغراء سريع المفعول أخرى مع إبرة في وسط غرفة تسجيل ونشر الغراء حوالي 1 سم 2.
- نقل بسرعة الدماغ والغراء عليه في موقف ما يصل الجانب البطني.
- إضافة 1 مل من المياه المالحة الأسماك بحيث يملأ غرفة تسجيل، ويغطي الدماغ. يروي باستمرارالدماغ مع الغازي المالحة الأسماك بمعدل لا يقل عن 200 ميكرولتر / دقيقة.
- باستخدام ملقط غرامة غيض إزالة بعناية السحايا على سطح منطقة تسجيل من الدماغ.
3. الكهربية
- فضفاض تسجيل التصحيح من عمل اطلاق النار المحتملة
- هي التي شيدت microelectrodes الزجاج (6-10 MΩ) من الماصات الزجاج البورسليكات (1B150F-4، الآلات الدقيقة الدولي) باستخدام مجتذب الكهربائي (مثل سوتر P-87)، وتملأ مرة أخرى مع تسجيل حل فضفاضة التصحيح في منتصف الطريق حتى القطب.
- باستخدام مجهر الفلورسنت تستقيم مع تبريد الجهاز المسؤول عن جانب (CCD) وكاميرا، والعثور على GFP، معربا عن TN-GnRH3 الخلايا العصبية من خلال 10X (1B الشكل)، ثم الأهداف مياه الغمر 40X (الشكل 1C). فهي تقع في أو بالقرب من السطح البطني للبصيلات الشم، الأمامي فقط إلى الدماغ الانتهائي.
- التبديل إلى جهاز الفيديو التي يتم توفيرالصور في الوقت الحقيقي من المجهر لتحديد موقع الخلايا العصبية كتلة TN-GnRH3 (الشكل 1C).
- ضع مسرى مكروي في الحمام بحيث غيض من القطب هو فوق الهدف الخلايا العصبية. تطبيق الضغط الايجابي المستمر طفيف على مسرى مكروي بحيث لا تصبح مسدودة، والاقتراب بلطف الخلايا العصبية المستهدفة مع غيض من القطب.
- تحقق ورصد مقاومة القطب في وضع الجهد المشبك باستخدام برنامج مسجل المحاور ومكبر للصوت Axoclamp 200B مع برنامج مسجل المحاور (أكسون صكوك). عندما ترون من الشاشة الفيديو التي غيض من القطب هو على سطح الخلايا العصبية ومن العرض مسجل المحاور أن المقاومة تغييرات طفيفة، الافراج عن الضغط الايجابي وتطبيق ضغط سلبي طفيف إذا لزم الأمر لجعل منخفضة المقاومة الختم على الخلايا العصبية (<100 MΩ).
- التبديل إلى الوضع الحالي، المشبك، وتسجيل غشاء الجهد باستمرار دون أي المدخلات الحالية، وتعديل نطاقمن الجهد ومعدل التسجيل في حال الضرورة. ويتم جمع البيانات وتحليلها بواسطة برنامج Powerlab (ADInstruments شركة).
- سجل النشاط الكهربائي خط الأساس في المياه المالحة الأسماك العادية لمدة 5 دقائق قبل أي علاج (الشكل 2A). نضح حمام من الأدوية، الهرمونات، والببتيدات، الخ. وأضاف أن المياه المالحة الأسماك لا تزال بمعدل 200 ميكرولتر / دقيقة، تليها فترة إخفاق في الحالات العادية الأسماك المالحة 5، 6، 11.
- تسجيل خلية كاملة من غشاء المحتملة
التصحيح خلية كاملة المشبك الكهربية الإجراء هو نفسه كما ان من إجراء التسجيل فضفاضة التصحيح خارج الخلية المذكورة أعلاه، من خطوات 3.1.1 - 3.1.4. ثم الإجراءات تحيد تبعا لذلك:- تحقق ورصد مقاومة القطب في وضع الجهد المشبك. عندما ترون من الشاشة الفيديو التي غيض من القطب هو على سطح الخلايا العصبية والذبذبات من أن التغييرات المقاومة قليلا، والإفراج عن إيجابيةالضغط وتطبيق الضغط السلبي قليلا لجعل مقاومة عالية ختم على الخلايا العصبية (~ 3 جيجا Ω). تطبيق طيف الامتصاص عن طريق الفم إلى تمزق غشاء مرقع، وسوف نرى انخفاض مفاجئ للمقاومة إلى حوالي 120-250 MΩ.
- التبديل إلى الوضع الحالي، المشبك، وتسجيل غشاء الجهد باستمرار دون أي المدخلات الحالية، وتعديل حجم الجهد ومعدل التسجيل في حال الضرورة.
- سجل النشاط الكهربائي خط الأساس في المياه المالحة الأسماك العادية لمدة 5 دقائق قبل أي علاج، كما هو موضح أعلاه في 3.1.7 (الشكل 2B).
النتائج
ويرد مثال على مجموعات ثنائية من GFP المسمى TN-GnRH3 الخلايا العصبية من الدماغ رفعه من الأسماك الميداكا في أرقام 1B و 1C. كل مجموعة تحتوي على حوالي 8-10 الخلايا العصبية هرمون GnRH. وسجلت أنشطة الخلايا العصبية عفوية من الهدف TN-GnRH3 في الوضع الحالي، المشبك (I = 0) مع معدلات اطلاق نموذجية من 0،5-6 هرتز. هذا النمط من العمل اطلاق النار المحتملة هو عادة نمط منشط أو الضرب، مع فاصل زمني interspike منتظم إلى حد ما. وتظهر آثار عينة في الشكل 2 (2A: فضفاضة التصحيح؛ 2B: خلية كاملة).
هذا النهج التجريبي هو أيضا ناجحة في التسجيل من GFP المسمى الخلايا العصبية هرمون GnRH الموجود في الدماغ المقدم من الكبار الزرد (أرقام 3A و3B). تم تسجيل النشاط الكهربائي في الخلايا العصبية والمخ سليمة رفعه في طريقة مماثلة كما هو موضح أعلاه في الميداكا بواسطة فضفاضة التصحيح (الشكل 3C) وتسجيل كامل الخلية ( الشكل 3D). على عكس الخلايا العصبية مع الميداكا TN-نره]، هذا النمط من إمكانات العمل العفوي إطلاق الخلايا العصبية هرمون GnRH الزرد في المنطقة أمام البصرية، الدماغ الانتهائي بطني، وتحت المهاد هو في كثير من الأحيان غير النظامية.
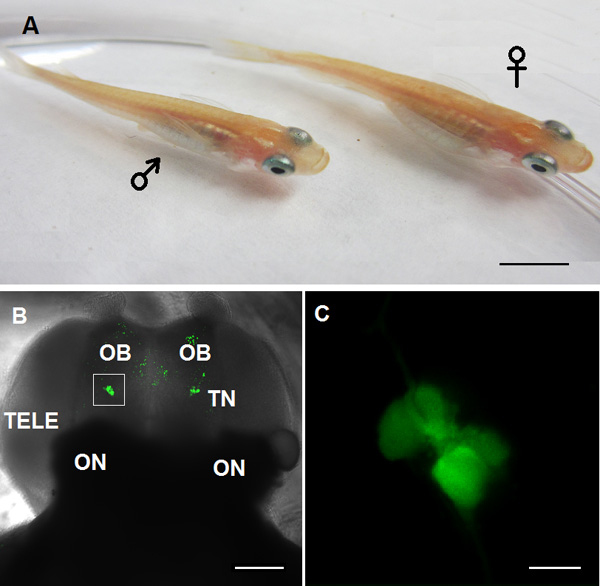
الشكل 1. نموذج حيواني المستخدمة في الدراسة TN-GnRH3 الخلايا العصبية في هذا الفيديو A: الكبار الميداكا GnRH3: GFP المعدلة وراثيا الأسماك، اليسار: ذكر؛ اليمين:. أنثى B: صورة متحد البؤر من وجهة النظر البطنية من الدماغ الأمامي. OB: البصلة الشمية؛ TN: العصب الطرفي GnRH3 الخلايا العصبية؛ TELE: الدماغ الانتهائي؛ ON:. العصب البصري C: التكبير عالية من TN-GnRH3 الخلايا العصبية هو مبين في مربع أبيض من لوحة B. (شريط مقياس: ج: 5 مم؛ B: 100 ميكرومتر؛ C: 20 ميكرون).
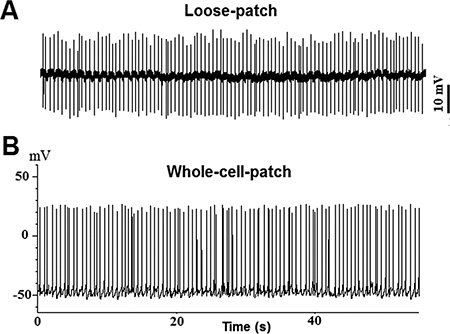
الشكل 2. مكتب التخطيط الاستراتيجيإمكانات العمل ntaneous سجلت من TN-GnRH3 الخلايا العصبية في الوضع الحالي، المشبك (I = 0) ج: تتبع عينة من تسجيل فضفاضة التصحيح؛ B:. تتبع عينة من تسجيل كامل الخلية.

الشكل (3). تسجيل GnRH3: EMD (الزمرد الأخضر بروتين فلوري) نشاط الخلايا العصبية من إعداد الدماغ سليمة من الكبار الزرد المعدلة وراثيا 9 باستخدام المنهج التجريبي نفسها كما هو موضح لإعداد المخ الميداكا A:. GnRH3: الخلايا العصبية الموجودة في الدماغ الانتهائي EMD بطني (VT) وأمام البصرية . منطقة (POA) في الدماغ المقدم من الزرد الكبار B: GnRH3: الخلايا العصبية EMD تقع في تحت المهاد (HYPO). أشرطة النطاق: 100 ميكرون C:. تتبع عينة من تسجيل فضفاضة التصحيح من GnRH3: EMD الخلايا العصبية فيVT D:. تتبع عينة من تسجيل التصحيح خلية كاملة من VT.
Discussion
هرمون GnRH 3: GFP الأسماك المعدلة وراثيا تقدم نماذج فريدة لدراسة الآليات العصبية الكامنة وراء التكامل العصبية والتنظيم في السيطرة المركزية من السلوكيات التي هي على حد سواء يشارك بصورة مباشرة وغير مباشرة في الإنجاب 3، 8-10. واحدة من مزايا كبيرة من هذا النظام النموذجي هو أن العديد من الخلايا العصبية GnRH3 معربا عن GFP هي قريبة من السطح البطني من الدماغ، مما يسمح لسهولة نسبيا الوصول إلى الخلايا العصبية لتسجيل الكهربية دون تعطيل الدوائر العصبية 6، 9، 11، 12 (الشكلان 1B و 1C؛ أرقام 3A و3B). في هذا الفيديو، ونحن على حد سواء وقد أظهرت التسجيلات فضفاضة التصحيح وخلية كاملة من TN-GnRH3 الخلايا العصبية في الدماغ الكبار سليمة من الأسماك الميداكا. TN-GnRH3 الخلايا العصبية يحمل منشط أو الضرب نمط من إمكانات العمل العفوي اطلاق النار مع تواتر 0.5-6Hz.There لم الفروق بين الجنسين التي يمكن اكتشافها في اطلاق عفويةتصنيف 5، ولكن كانت هناك تغييرات دراماتيكية التنموية في GnRH3 الخلايا العصبية الأنشطة الكهربائية خلال مرحلة التطور الجنيني 9. فضفاضة التصحيح والكهربية خلية كاملة لديها مزايا وعيوب منهجية مختلفة. فضفاضة التصحيح هو أسهل من الناحية التقنية من تسجيل كامل الخلية، ولكن لا يظهر الا في نمط إطلاق الخلايا العصبية والتردد. من ناحية أخرى، يمكن تسجيل كامل الخلية توفير المزيد من المعلومات: غشاء المحتملة يستريح، إطلاق نمط والتردد، وعمل تحليل المحتملة، السعة غشاء والمقاومة. لأن لا يفطر تسجيل فضفاضة التصحيح غشاء الخلية وتعطيل أيون بين الخلايا، وتركيزات رسول الثانية، فهي مثالية للتسجيل طويل الأجل من نشاط الخلايا العصبية. كله التسجيلات الخلية تمزق غشاء الخلية وتؤدي في النهاية إلى غسيل الكلى من الجزيئات داخل الخلايا، وبالتالي يحتمل أن تغيير خصائص الخلايا العصبية مع تسجيلات أكثر لفترات طويلة. بسبب مزايا وعيوب كل من electrophysiطرق ological، فإنه يمكن أن تكون هامة لدراسة خصائص الخلايا العصبية باستخدام كل التقنيات. لأن كلا من درجة الحموضة والأسمولية هي مهمة جدا لبقاء الخلايا العصبية وظيفة، كل الحلول في استخدام هناك حاجة الى تعديلها بشكل صحيح.
لتأكيد هوية من الخلايا العصبية المسجلة، يتم تطبيق الضغط السلبي بعد الانتهاء من عملية التسجيل، ويتم تأكيد ثم مضان في غيض من القطب باستخدام التصوير مضان المجهري. قد يتم تضمين الأصباغ الجزيئية الصغيرة أو المسابير (مثل اليكسا فلور 568 صبغ أو biocytin) في الحل داخل الخلايا لتسجيل خلية كاملة للاحتفال الخلايا العصبية سجلت لمزيد من التحليل الصرفي.
لتسجيل بنجاح من الخلايا العصبية المستهدفة في الدماغ سليمة، وعمق من موقع الخلايا العصبية أمر بالغ الأهمية - وأعمق من الخلايا العصبية، وصعوبة التصحيح (على حد سواء فضفاضة التصحيح وخلية كاملة). عموما، وعمق مجدية لترميم الناجح هو حوالي 5-6 طبقات الخلية من على سطح الأرض. ميدالملقب TN-GnRH3 الخلايا العصبية عادة ما تكون على السطح البطني من الدماغ، بينما الزرد طائي الخلايا العصبية GnRH3 يمكن أن تصل إلى 6 طبقات الخلية من السطح. ضغط إيجابي مفيد جدا لمنع القطب تسجيل من انسداد في حين يقترب من الخلايا. هذا النوع من المنهج التجريبي يمكن استخدامها لأي الخلايا العصبية التي يتم المسمى وراثيا مع بروتين فلوري. لدراسة نشاط الخلايا العصبية في الدماغ هرمون GnRH الكبار، ونحن بشكل روتيني استخدام الأسماك والميداكا الزرد من 4-6 أشهر من العمر. فإن الأسماك الأصغر سنا مع أدمغة أصغر أو الأسماك القديمة مع أكثر الجماجم متكلسة، وجعل تشريح أكثر تحديا. وTN: GnRH3 الخلايا العصبية يمكن الوصول إليها بسهولة عن الكهربية من الكبار الميداكا الدماغ، ولكن هذا ليس هو الحال بالنسبة لالزرد الكبار التي TN: GnRH3 الخلايا العصبية هي المغطى في غمد الضام صعبة. من ناحية أخرى، GnRH3 الخلايا العصبية في برنامج العمل، VT، وتحت المهاد هي أكثر يمكن الوصول إليها بسهولة عن الكهربية في الدماغ الزرد الكبار من من الميداكا. لا يوجد الجنساختلافات على أساس الصعوبات من تشريح وتسجيل الكهربية إما الأنواع.
على الرغم من أن هذه ليست في المنهج التجريبي الجسم الحي، التسجيل من الدوائر العصبية سليمة نسبيا مع الحد الأدنى من الضرر هو وسيلة جذابة لاستكشاف وظيفة فسيولوجية وتنظيم نظام الخلايا العصبية من الفائدة. إعداد الدماغ سليمة يستمر لمدة ساعة، وتسجيل جيد يمكن أن تستمر لأكثر من ساعة 6. هذا البروتوكول هو مناسبة للباحثين الذين لديهم بالفعل المعارف الأساسية والخبرات مع تقنيات الكهربية 13، وكذلك المعدات المتخصصة اللازمة للقيام بهذا العمل.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
نشكر الدكتور منغ تشين لين والسيدة دونغ يوان للمساعدة التقنية. وأيد هذا العمل من خلال منحة من المعاهد القومية للصحة HD053767 (من الباطن إلى NLW)، وصناديق من قسم علم وظائف الأعضاء ومكتب نائب مدير الجامعة للأبحاث، جامعة كاليفورنيا في لوس انجليس (NLW).
Materials
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | Comments |
| Microscope | Olympus | BX50W (Upright) | |
| Amplifier | Axon Instruments | Axoclamp 200B | |
| A-D converter | Computer Interference Corp. | Digidata ITC-18 | |
| Cooled CCD camera | PCO Computer Optics | Sensicam | |
| Xenon lamp | Sutter Instruments Co. | ||
| GFP filter set | Chroma Technologies | ||
| Imaging Software | Intelligent Imaging Innovations | Slidebook software | |
| Electrophysiology Data Acquisition Software | Axon Instruments | Axograph software | |
| Electrophysiology Data Acquisition Software | AD Instruments Inc. | PowerLab | |
| Headstage for electrophysiology | Axon Instruments | CV 203BU | |
| Micromanipulator | Sutter Instrument Co | MP-285 | |
| Recording Chamber Platform | Warner Instrument Corp. | P1 | |
| Recording Chamber | Warner Instrument Corp. | RC-26G | |
| Electrode Puller | Sutter instruments | P87 | |
| Filament for electrode puller | Sutter Instruments | FB330B | 3.0 mm wide trough filament |
| 1.5 mm glass capillaries | World Precision Instruments | 1B150-4 | Microelectrode for recording |
| Syringe | Becton Dickinson | 309586 | 3 ml |
| MS-222 | Sigma | E10521-10G | Ethyl 3-aminobenzoate methanesulfonate salt |
| Fish saline | mM: 134 NaCl; 2.9 KCl; 2.1 CaCl2; 1.2 MgCl2; 10 HEPES | ||
| Electrode solution (loose-patch) | mM: 150 NaCl; 3.5 KCl; 2.5 CaCl2; 1.3 MgCl2; 10 HEPES; 10 glucose | ||
| Electrode solution (whole-cell patch) | mM: 112.5 K-gluconate; NaCl; 17.5 KCl; 0.5 CaCl2; 1 MgCl2; 5 MgATP; 1 EGTA; 10 HEPES; 1 GTP; 0.1 leupeptin;10 phospho-creatine |
References
- Kah, O., Lethimonier, C., Lareyre, J. J. Gonadotrophin-releasing hormone (GnRH) in the animal kingdom. J. Soc. Biol. 198 (1), 53-60 (2004).
- Ramakrishnan, S., Wayne, N. L. Social cues from conspecifics alter electrical activity of gonadotropin-releasing hormone neurons in the terminal nerve via visual signals. Am. J. Physiol. Regul. Integr. Comp. Physiol. 297 (1), R135-R141 (2009).
- Abe, H., Oka, Y. Mechanisms of neuromodulation by a nonhypophysiotropic GnRH system controlling motivation of reproductive behavior in the teleost. 57 (6), 665-674 (2011).
- Oka, Y. Tetrodotoxin-resistant persistent Na+ current underlying pacemaker potentials of fish gonadotrophin-releasing hormone neurones. J. Physiol. 482 (Pt. 1), 1-6 (1995).
- Zhao, Y., Wayne, N. L. Effects of Kisspeptin1 on Electrical Activity of an Extrahypothalamic Population of Gonadotropin-Releasing Hormone Neurons in Medaka. PLoS One. 7 (5), e37909 (2012).
- Wayne, N. L., et al. Whole-cell electrophysiology of gonadotropin-releasing hormone neurons that express green fluorescent protein in the terminal nerve of transgenic medaka (Oryzias latipes). Biol. Reprod. 73 (6), 1228-1234 (2005).
- Okubo, K., et al. Forebrain gonadotropin-releasing hormone neuronal development: insights from transgenic medaka and the relevance to X-linked Kallmann syndrome. Endocrinology. 147 (3), 1076-1084 (2006).
- Okubo, K., et al. A novel form of gonadotropin-releasing hormone in the medaka, Oryzias latipes. Biochem. Biophys. Res. Commun. 276 (1), 298-303 (2000).
- Ramakrishnan, S., et al. Acquisition of spontaneous electrical activity during embryonic development of gonadotropin-releasing hormone-3 neurons located in the terminal nerve of transgenic zebrafish (Danio rerio). Gen. Comp. Endocrinol. 168 (3), 401-407 (2010).
- Abraham, E., et al. Targeted gonadotropin-releasing hormone-3 neuron ablation in zebrafish: effects on neurogenesis, neuronal migration, and reproduction. Endocrinology. 151 (1), 332-340 (2010).
- Wayne, N. L., Kuwahara, K. Beta-endorphin alters electrical activity of gonadotropin releasing hormone neurons located in the terminal nerve of the teleost medaka (Oryzias latipes. Gen. Comp. Endocrinol. 150 (1), 41-47 (2007).
- Oka, Y. Three types of gonadotrophin-releasing hormone neurones and steroid-sensitive sexually dimorphic kisspeptin neurones in teleosts. J. Neuroendocrinol. 21 (4), 334-338 (2009).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved