Method Article
トランスジェニックフィッシュの無傷の脳内で識別ニューロンからの電気的活動を記録する
要約
このビデオでは、複雑な神経回路を維持し、脳全体の準備、で識別される単一のニューロンからの電気的活動を記録する方法を説明します。私たちは、ゴナドトロピン放出ホルモン(GnRH)ニューロンは遺伝的に無傷の脳の準備の識別のための蛍光タンパク質でタグ付けされたトランスジェニック魚を使用しています。
要約
複雑な行動を調節する神経回路の細胞生理学を理解することは、この作業はCNSの神経回路は無傷のままで無傷の脳の調製において実行可能なモデルシステムを使用して、大幅に高められる。私たちは、ゴナドトロピン放出ホルモン(GnRH)ニューロンは遺伝的に無傷の脳内の識別のための緑色蛍光タンパク質でタグ付けされたトランスジェニック魚を使用しています。魚のGnRHニューロンの複数の集団があり、その機能は、脳内の場所と、彼らは1を表現することのGnRH遺伝子に依存しています。我々は、トランスジェニックメダカの無傷の脳( 図1BおよびC)を使用して、嗅球に関連付けられているターミナル·神経(TN)に位置GnRH3ニューロンに私たちのデモを当てている。研究はメダカTN-GnRH3ニューロンは外部環境から中枢神経系への情報の送信器として作用する、神経調節であることを示唆している。トンちょっとなどのよく知られた視床下部GnRH1ニューロン2、3を実行します。TN-GnRH3ニューロンの自発活動電位の発火のトニックパターンが固有の特性4-6、周波数であり、下垂体-性腺機能の調節に直接的な役割を果たしていない同種2と神経ペプチドキスペプチン1 5からの視覚的な手がかりによって変調となっている。このビデオでは、TN-GnRH3のニューロンは神経細胞を識別し、脳全体での電気的活動を監視する方法をお見せするために強化された緑色蛍光タンパク質7にリンクGnrh3のプロモーター領域を含む導入遺伝子を発現するトランスジェニックメダカの安定したラインを使用準備6。
プロトコル
1。大人のメダカから脳の解剖
- に浸漬することにより( 図1A)、男性または女性成人を麻酔5ミリリットルMS-222(150 mg / Lで、pHは7.4)、エラの動きがdecapitating前に中止した後、数分待ってください。すべての手順は、カリフォルニア大学ロサンゼルス校の制度動物実験委員会によって承認された。
- 60 mmの直径のペトリ皿にハサミで蓋の尾側端で魚の生理食塩水で魚の首を刈る。
- 脳の解剖のために頭を置き、保護するためにその中にうつ病を持っている35 mmの直径ペトリ皿、半魚の生理食塩水で満たされ、シルガードが並んへの転送魚の頭を。位置や虫ピンと背側の頭を固定します。
- 注意深く細かいハサミでその周囲に頭蓋骨の背の部分をカットし、静かに脊髄の前方部分を含む完全に脳の背の部分を露出させ、ピンセットでそれを削除します。 <リチウム>細かいチップピンセットで軽く脊髄を持ち上げて、先の細いハサミで二国間の結合神経切断:の前方部分に脳神経、脊髄神経と視神経、脳の腹側に、そして嗅覚神経を脳。
- 魚の生理食塩水で満たされた新鮮なペトリ皿に完全に解剖脳を置き、全体の脳は、任意の切り傷や刺し傷なし(下垂体を含む)を無傷であることを確認するために、顕微鏡下で慎重に確認してください。損傷した脳を実験のために使用されていません。
2。録音室における脳の取り付け
- 記録室の中心に針を持つシアノアクリレートまたはいくつかの他の速効性接着剤の小滴を置き、1cm 2の約 のりを広げた。
- 迅速に腹側を上位置に脳とのり、それを下に移す。
- それは録音室を埋め、脳を覆うように、魚の生理食塩水1 mlを加える。連続灌流少なくとも200μL/分の速度で通気魚の生理食塩水で脳。
- 微先端鉗子を使用すると、慎重に脳の記録領域の表面上髄膜を除去します。
3。電気生理学
- 活動電位の発火の緩いパッチ記録
- ガラス微小電極(MΩ6-10)は、電極プラー( 例えばサッターP-87)を使用して、ホウケイ酸ガラスピペット(1B150F-4、世界の精密機器)から構成され、バックアップルーズパッチ録音ソリューション中途半端で満たされている電極。
- 次いで、40×水浸対物レンズ( 図1C)、冷却された電荷結合素子(CCD)カメラで直立蛍光顕微鏡を用いて、GFPを発現する10倍( 図1B)を介してTN-GnRH3ニューロンを見つける。彼らは終脳のすぐ前方嗅球の腹面内または付近に位置しています。
- 提供しているビデオモニターに切り替え顕微鏡からリアルタイム画像TN-GnRH3ニューロンクラスター( 図1C)を検索する。
- 電極の先端がニューロン目標を超えているように、お風呂に微小電極を配置します。それが目詰まりしないように、微小電極に一定の若干正圧を適用し、ゆっくりと電極の先端とターゲットニューロンに近づく。
- AxoGraphソフトウェアとAxographソフトウェア(アクソン·インスツルメンツ)のアンプAxoclamp 200Bを使用して電圧クランプモードで電極抵抗を確認し、監視する。あなたは、電極の先端が神経細胞の表面上に、抵抗が若干変化することAxoGraph表示からであると、ビデオモニタから見ることができる場合には、低オン抵抗のシールを作るために正圧を解放し、必要に応じてわずかな負圧を適用するニューロン(<100MΩ)。
- 電流クランプモードに切り替えて、スケールを調整し、任意の現在の入力なしで連続して膜電位を記録電圧と記録速度の必要に応じ。データは、パワーラブソフトウエア(ADInstruments社製)により回収し、分析する。
- 任意の治療( 図2A)の前に、約5分間、通常の魚の生理食塩水のレコードベースラインの電気的活動。薬、ホルモン、ペプチドなどの浴灌流。魚の生理食塩水に加え、通常の魚の生理食塩水5、6、11でウォッシュアウト期間が続く200μL/分の速度、に続く。
- 膜電位の全細胞記録
3.1.4 - 全細胞パッチクランプ電気生理学的手順は、ステップ3.1.1から、上述した外ルーズパッチ記録過程と同様である。その後の手順は、それに応じてずれる。- 電圧クランプモードで電極抵抗を確認し、監視する。あなたは、電極の先端が神経細胞の表面上に、抵抗変化がわずかに正を解放することをオシロスコープであることから、ビデオモニタから見ることができる圧力とニューロン(〜3ギガΩ)上の高抵抗シールを作るには少し負圧を適用する。破裂パッチを適用した膜に口で優しく吸引を適用し、あなたはMΩ約120から250への抵抗の急激な低下が表示されます。
- 電流クランプモードに切り替え、必要に応じて電圧と記録速度のスケールを調整し、任意の現在の入力なしで連続して膜電位を記録します。
- 3.1.7( 図2B)で上記のように任意の治療の前に、約5分間の通常の魚の生理食塩水のレコードベースラインの電気的活動。
結果
メダカの摘出脳からGFP標識TN-GnRH3ニューロンの二国間のクラスタの例を図1B及び1Cに示されている。各クラスタは、約8-10のGnRHニューロンを含んでいます。ターゲットTN-GnRH3の自発神経活動は、0.5〜6 Hzでの典型的な発火率と電流クランプモード(I = 0)で記録した。活動電位の発火のパターンはかなり規則的なスパイク間間隔で、通常はトニックや鼓動パターンです。サンプルトレースは図2(:;:全細胞2Bルーズパッチ2A)に示されている。
この実験的なアプローチでは、成人のゼブラフィッシュ( 図3Aおよび図3B)の前脳に位置GFP標識のGnRHニューロンからの記録でも成功しています。ルーズパッチ( 図3C)および全細胞記録(によってメダカに上記のように切 除し、無傷の脳内の神経細胞の電気的活動は、同様の方法で記録された図3D)。メダカTN-GnRHのニューロンとは異なり、視索前野、腹側終脳、および視床下部におけるゼブラフィッシュのGnRHニューロンの自発活動電位の発火のパターンはしばしば不規則である。
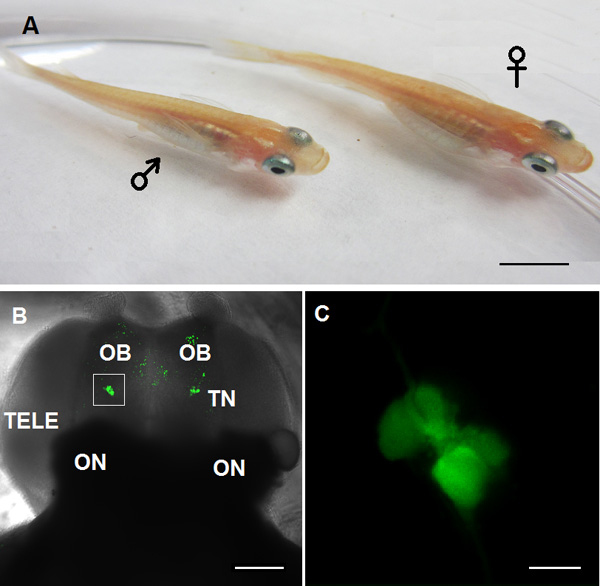
図1。このビデオではTN-GnRH3ニューロン研究のために使用される動物モデル :アダルトメダカGnRH3:GFPトランスジェニック魚、左:男性、右:。女性B:前脳の腹側のビューの共焦点画像。 OB:嗅球、TN:ターミナル神経GnRH3ニューロン; TELE:終; ON:。視神経C:パネルBのホワイトボックス(スケールバーに示すTN-GnRH3ニューロンの高倍率:5ミリメートル、B:100 μmの、C:20μm)を。
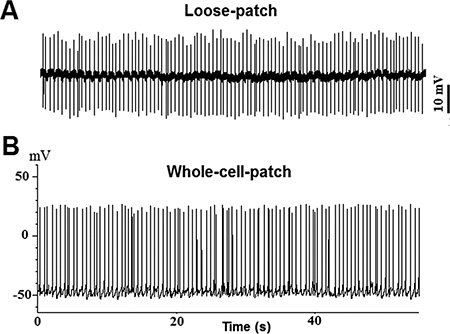
図2。 SPO電流クランプモード(I = 0)におけるTN-GnRH3ニューロンから記録ntaneous活動電位:ルーズパッチ記録からのサンプルトレース、B:ホールセル記録からのサンプルトレース。

図3。 GnRH3の録音:EMD(エメラルド緑色蛍光タンパク質)メダカの脳の準備のために説明したのと同じ実験的なアプローチを用いた成人のトランスジェニックゼブラフィッシュ9そのまま脳の準備からニューロン活動:。GnRH3:腹側終脳(VT)と視索前野に位置EMDニューロン。成体ゼブラフィッシュの脳内の領域(POA)B:GnRH3:視床下部(HYPO)に位置EMDニューロン。スケールバー:100μmのC:。GnRH3からルーズパッチ記録のサンプルトレース:EMDニューロンにおけるVT D:VTからホールセルパッチ記録のサンプルトレース。
ディスカッション
GnRHの3:GFPトランスジェニック魚は、直接·間接的に再生3、8-10に関与している行動の中央制御の神経統合や規制の基礎となる神経生理学的メカニズムを研究するためのユニークなモデルを提供します。このモデルシステムの重要な利点の一つは、12、神経回路6を中断することなく、電気生理学的記録のための神経細胞、9、11には比較的簡単にアクセスできるように、GFPを発現していることを多くのGnRH3ニューロンが脳の腹側表面に近いです( 図図1B及び図1C、図3Aおよび図3B)。このビデオでは、メダカの無傷の成体脳におけるTN-GnRH3ニューロンから両方緩いパッチと細胞全体の記録を示している。 TN-GnRH3ニューロンは0.5-6Hz.Thereの周波数で発射自発的活動電位のトニックや鼓動パターンが自然発火で検出可能な性差なかった展示率5が、GnRH3ニューロンの電気活動の劇的な発達的変化は胚9時にありました。ルース·パッチと全細胞電気生理学は、異なる方法論の利点と欠点を持っている。ルース·パッチが全細胞記録よりも技術的には簡単ですが、唯一のニューロン発火パターンと周波数を示しています。静止膜電位、発火パターン、周波数、活動電位分析、膜容量や抵抗:一方、全細胞記録は、より多くの情報を提供することができる。ルーズパッチ記録、細胞膜を破壊し、細胞内のイオンとセカンドメッセンジャー濃度を中断されることはありませんので、神経活動の長期的な記録のために理想的です。それによって潜在的にもっと長時間録音とニューロン特性を変える全細胞記録破裂細胞膜、最終的に細胞内の分子の透析につながる。なぜならelectrophysi両方の長所と短所ologicalの方法は、両方の技術を用いてニューロン特性を研究することが重要であることができる。 pH及び浸透圧の両方がニューロンの生存および機能のために非常に重要であるため、使用中のすべての溶液は、適切に調整する必要がある。
記録されたニューロンの同一性を確認するために、負圧を、記録が完了した後に印加され、電極の先端その後蛍光顕微鏡は蛍光画像を用いて確認された。小分子染料又はプローブ(例えば、アレクサ568フルオル染料またはビオシチンなど)をさらに形態素解析のために記録されたニューロンをマークする全細胞記録用溶液内に含まれていてもよい。
そのまま脳内の標的ニューロンから正常に記録するには、ニューロンの場所の深さは非常に重要です - より深いニューロン、パッチ(緩い - パッチと全細胞の両方)に困難。一般的に、成功したパッチを適用するための実現可能な深さは表面から約5〜6細胞層である。メッドゼブラフィッシュ視床GnRH3ニューロンが表面から6細胞層まで可能ながら別名TN-GnRH3ニューロンは、脳の腹側表面に、通常です。正圧は、細胞に近づいている間目詰まりから記録電極を防ぐために非常に便利です。実験的なアプローチこの種の遺伝的蛍光タンパク質で標識されている任意のニューロンに使用することができる。成体脳内のGnRHニューロン活動を調べるために、我々は日常的に生後4-6カ月のメダカとゼブラフィッシュを使用しています。小さい脳で若い魚以上石灰頭蓋骨の高齢魚は、解剖がより困難になります。 TN:GnRH3ニューロンは成体メダカの脳からの電気生理学のために簡単にアクセスできますが、これは、テネシー州で成人のゼブラフィッシュの場合ではありません:GnRH3ニューロンは厳しい結合鞘に収められています。一方、POA、VT、および視床下部でGnRH3ニューロンはより容易にアクセス可能な電気生理学のための大人のゼブラフィッシュの脳内メダカからもされています。全くセックスがありませんどちらの種の解剖と電気生理学記録の難しさに基づいて相違。
これは、in vivo実験的なアプローチではありませんが、最小限のダメージで比較的無傷の神経回路からの記録は、関心のある神経系の生理機能と規制を探索するための魅力的な方法である。無傷の脳の準備は時間持続し、良い記録が時間6以上続くことができます。このプロトコルは、すでに基本的な知識と電気生理学技術13と、同様の作業を行うために必要な専門的な機器と経験を持っている研究者に適しています。
開示事項
著者らは、開示することは何もありません。
謝辞
我々は技術支援のために博士孟チン林さんと元ドン感謝。この作品は、健康HD053767の国立研究所からの助成金(NLWに下請け)でサポートされている、研究担当副学長、カリフォルニア大学ロサンゼルス校(NLW)の生理学とOfficeの部門からの資金によってされました。
資料
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | Comments |
| Microscope | Olympus | BX50W (Upright) | |
| Amplifier | Axon Instruments | Axoclamp 200B | |
| A-D converter | Computer Interference Corp. | Digidata ITC-18 | |
| Cooled CCD camera | PCO Computer Optics | Sensicam | |
| Xenon lamp | Sutter Instruments Co. | ||
| GFP filter set | Chroma Technologies | ||
| Imaging Software | Intelligent Imaging Innovations | Slidebook software | |
| Electrophysiology Data Acquisition Software | Axon Instruments | Axograph software | |
| Electrophysiology Data Acquisition Software | AD Instruments Inc. | PowerLab | |
| Headstage for electrophysiology | Axon Instruments | CV 203BU | |
| Micromanipulator | Sutter Instrument Co | MP-285 | |
| Recording Chamber Platform | Warner Instrument Corp. | P1 | |
| Recording Chamber | Warner Instrument Corp. | RC-26G | |
| Electrode Puller | Sutter instruments | P87 | |
| Filament for electrode puller | Sutter Instruments | FB330B | 3.0 mm wide trough filament |
| 1.5 mm glass capillaries | World Precision Instruments | 1B150-4 | Microelectrode for recording |
| Syringe | Becton Dickinson | 309586 | 3 ml |
| MS-222 | Sigma | E10521-10G | Ethyl 3-aminobenzoate methanesulfonate salt |
| Fish saline | mM: 134 NaCl; 2.9 KCl; 2.1 CaCl2; 1.2 MgCl2; 10 HEPES | ||
| Electrode solution (loose-patch) | mM: 150 NaCl; 3.5 KCl; 2.5 CaCl2; 1.3 MgCl2; 10 HEPES; 10 glucose | ||
| Electrode solution (whole-cell patch) | mM: 112.5 K-gluconate; NaCl; 17.5 KCl; 0.5 CaCl2; 1 MgCl2; 5 MgATP; 1 EGTA; 10 HEPES; 1 GTP; 0.1 leupeptin;10 phospho-creatine |
参考文献
- Kah, O., Lethimonier, C., Lareyre, J. J. Gonadotrophin-releasing hormone (GnRH) in the animal kingdom. J. Soc. Biol. 198 (1), 53-60 (2004).
- Ramakrishnan, S., Wayne, N. L. Social cues from conspecifics alter electrical activity of gonadotropin-releasing hormone neurons in the terminal nerve via visual signals. Am. J. Physiol. Regul. Integr. Comp. Physiol. 297 (1), R135-R141 (2009).
- Abe, H., Oka, Y. Mechanisms of neuromodulation by a nonhypophysiotropic GnRH system controlling motivation of reproductive behavior in the teleost. 57 (6), 665-674 (2011).
- Oka, Y. Tetrodotoxin-resistant persistent Na+ current underlying pacemaker potentials of fish gonadotrophin-releasing hormone neurones. J. Physiol. 482 (Pt. 1), 1-6 (1995).
- Zhao, Y., Wayne, N. L. Effects of Kisspeptin1 on Electrical Activity of an Extrahypothalamic Population of Gonadotropin-Releasing Hormone Neurons in Medaka. PLoS One. 7 (5), e37909 (2012).
- Wayne, N. L., et al. Whole-cell electrophysiology of gonadotropin-releasing hormone neurons that express green fluorescent protein in the terminal nerve of transgenic medaka (Oryzias latipes). Biol. Reprod. 73 (6), 1228-1234 (2005).
- Okubo, K., et al. Forebrain gonadotropin-releasing hormone neuronal development: insights from transgenic medaka and the relevance to X-linked Kallmann syndrome. Endocrinology. 147 (3), 1076-1084 (2006).
- Okubo, K., et al. A novel form of gonadotropin-releasing hormone in the medaka, Oryzias latipes. Biochem. Biophys. Res. Commun. 276 (1), 298-303 (2000).
- Ramakrishnan, S., et al. Acquisition of spontaneous electrical activity during embryonic development of gonadotropin-releasing hormone-3 neurons located in the terminal nerve of transgenic zebrafish (Danio rerio). Gen. Comp. Endocrinol. 168 (3), 401-407 (2010).
- Abraham, E., et al. Targeted gonadotropin-releasing hormone-3 neuron ablation in zebrafish: effects on neurogenesis, neuronal migration, and reproduction. Endocrinology. 151 (1), 332-340 (2010).
- Wayne, N. L., Kuwahara, K. Beta-endorphin alters electrical activity of gonadotropin releasing hormone neurons located in the terminal nerve of the teleost medaka (Oryzias latipes. Gen. Comp. Endocrinol. 150 (1), 41-47 (2007).
- Oka, Y. Three types of gonadotrophin-releasing hormone neurones and steroid-sensitive sexually dimorphic kisspeptin neurones in teleosts. J. Neuroendocrinol. 21 (4), 334-338 (2009).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved