Method Article
Количественный анализ Аутофагия использованием Advanced 3D флуоресцентной микроскопии
В этой статье
Резюме
Аутофагия вездесущий процесс, который позволяет клеткам деградировать и переработку белков и органелл. Мы применяем передовые флуоресцентной микроскопии для визуализации и количественной небольшой, но существенный, физические изменения, связанные с индукцией аутофагии, в том числе формирование и распределение аутофагосом и лизосом, и их слияние в autolysosomes.
Аннотация
Рак предстательной железы является ведущей формой злокачественных новообразований среди мужчин в США, а операция несет в себе существенный риск импотенция и недержание мочи, традиционные химиотерапевтические подходы были в значительной степени неудачны. Гормональная терапия является эффективным на ранней стадии, но часто не с возможным развитием гормонорефрактерный опухолей. Мы были заинтересованы в разработке терапии, ориентированные на конкретные метаболические дефицита опухолевых клеток. Недавно мы показали, что клетки опухоли простаты в частности отсутствие фермента (argininosuccinate синтазы или АСС), участвующих в синтезе аминокислоты аргинина 1. Это состояние приводит к опухолевым клеткам, чтобы стать зависимыми от экзогенных аргинин, и они подвергаются метаболическому стрессу, когда свободного аргинина исчерпывается аргинин deiminase (ДСП) 1,10. Действительно, мы показали, что человеческие клетки рака простаты CWR22 Rv1 эффективно убит ADI с каспазы-независимого апоптоза и агрессивных autophaГр (или макроаутофагии) 1,2,3. Аутофагия эволюционно-консервативный процесс, который позволяет клеткам усваивать нежелательных белков лизосомальными пробоя при питании 4,5 голода. Хотя основные компоненты этого пути хорошо характеризуется 6,7,8,9, многие аспекты молекулярного механизма до сих пор неясны - в частности, какова роль аутофагии в смерти-ответ клеток рака простаты после лечения ADI ? Для того, чтобы ответить на этот вопрос, мы потребовали экспериментального метода для измерения уровня и степени аутофагической ответа в клетках - и так как нет никаких известных молекулярных маркеров, которые могут точно отслеживать этот процесс, мы решили развивать изображений подход, используя количественной флуоресцентной микроскопии 3D 11,12.
Использование CWR22Rv1 клеток, специфически-меченных флуоресцентными зондами для аутофагосомы и лизосом, мы показываем, что 3D-изображение, полученное стеки либо с Widefield деконволюцией микроскопии (а позднее, с супер-разрешения, структурированное освещения микроскопия) может четко захватить на ранних стадиях аутофагию индукции. С помощью коммерчески доступных цифровых приложений анализа изображений, мы можем легко получить статистическую информацию о аутофагосом лизосом и количество, размер, распределение и степень колокализации из любого отображаемого клетки. Эта информация позволяет нам точно отслеживать прогресс аутофагию в живых клетках и позволяет нашим продолжение расследования роли аутофагию в химиотерапии рака.
протокол
1. Часть 1: Культура клеток и иммуно-флуоресцентное мечение
- Grow CWR22 Rv1 опухолевых клеток человека простаты на покровные стекла (# 1,5 или 170 мкм толщиной), помещенный в 6-луночных планшетах, с RPMI (Mediatech, VA), содержащей 10% фетальной бычьей сыворотки (FBS) и 1% пенициллин / стрептомицин / глутамин.
- Вызвать аутофагия обработки выбранных образцов с аргинином deiminase (ДСП, 0,3 мкг / мл) в забуференном фосфатом физиологическом растворе (PBS).
- Fix клетки с использованием 4% параформальдегида (PFA, Fisher Scientific, NH) разводили в PBS, 100 мкл на покровное стекло, в течение 10 мин при комнатной температуре.
- Вымойте клеток с 3x 1 мл HBS / BSA.
- Проницаемыми клетки с 0,05% сапонина (Sigma, MO) в HEPES (HBS) / BSA, 100 мкл на покровное стекло, в течение 15 мин при комнатной температуре.
- До иммуно-маркировки, блок образцы с 2,5% казеина (Sigma, MO) в HBS / BSA, 100 мкл на покровное стекло, в течение 1 часа при комнатной температуре.
- Выдержите фиксированные клетки с первичными антителами разводят в 2,5% казеина / HBS / BSA, 100 мкл на coverslIP, O / N при 4 ° C.
- Вымойте клеток с 3x 1 мл HBS / BSA.
- Инкубируют зафиксированные клетки с вторичными антителами разводят в 2,5% казеин / HBS / BSA, 100 мкл на покровное стекло, в течение 1 часа при комнатной температуре.
- Вымойте клеток с 3x 1 мл HBS / BSA.
- Установите подготовленную покровные на регулярных Предметные стекла с золотой SlowFade или продлить Золото Antifade реагента (Invitrogen, CA), содержащего 4 ',6-диамидино-2-фенилиндолом (DAPI).
- Печать края покровного с лаком для ногтей. Для достижения наилучших результатов визуализации, дать время (в идеале O / N) для борьбы с увядают СМИ тщательно пронизывают клетки.
- Очистить поверхность покровного с метанолом и / или хлороформ.
- Добавить иммерсионного масла (показатель преломления 1,520 при визуализации при 37 ° С, или 1,516 при визуализации при комнатной температуре) до 60X 1,42 NA линзы объектива (Olympus, Япония).
- Позиция слайда на столик микроскопа и установить фокус, с клетками интерес.
2. Часть 2: Подготовка Клетки для живых изображений
- Расти КВР22 Rv1 клеток, экспрессирующих зеленый флуоресцентный белок легкой цепи 3 (LC3-GFP) в культуральной среде RPMI, содержащей 10% FBS и 1% антибиотиков на 35 мм поли-D-лизином стеклянным дном чашки для культивирования (MatTek, MA). Клетки должны быть покрыты при достаточной плотности для обеспечения быстрого распространения, но не настолько, чтобы клетки зарастают и слипаются на момент съемки.
- Лечить выбранной ячейки образцов с ADI (0,3 мкг / мл) в PBS.
- Приблизительно 1 ч до обработки изображений, разбавленных 1,5 мкл Lysotracker Красный беспокоить-99 (Invitrogen, CA) с 20 мл RPMI. , содержащей 10% FBS и 1% антибиотиков. Используйте растворы, содержащие ADI для выбранных образцов. Довести все средства массовой информации до 37 ° С перед добавлением в культуре блюдо.
- Инкубируют клетки RPMI содержащий Lysotracker Красный беспокоить-99 на 15-45 мин при 37 ° С.
- Примерно за 30 мин до визуализации, включите WeatherStation экологические корпуса и позволяют уравновесить до 37 ° С и 5% CO 2 (с увлажнительIED воздуха).
- Мытье клеток с PBS и замены среды со стандартными RPMI содержащих только 10% FBS и 1% антибиотиков. Добавить ADI с образцами, как указано.
- Горы 35 мм покровного стекла дном чашки для культивирования в индивидуальных адаптер (прикладная точность, Inc, штат Вашингтон), и положение на столик микроскопа. Используйте иммерсионное масло (показатель преломления 1,520) на 1,42 60X объектив Н.А., и расположите установлен культуры блюдо на сцене.
3. Часть 3: Деконволюция микроскопии и анализа
Протокол в этом разделе предполагается использование DeltaVision Личная деконволюцией DV микроскопом и связанных с ними приложений Softworx (прикладная точность, Inc, штат Вашингтон).
- Включите микроскоп системы, в том числе рабочих станций приобретение и инструмент управления. Откройте Resolve3D приложение для инициализации столик микроскопа и включите источник света ксенона. Разрешить 10 минут для источника света, чтобы разогреться и достичь стабильных условиях.
- Добавитькаплю иммерсионного масла (показатель преломления 1,520 для живых образцов при 37 ° С и 1,516 для фиксированных образцов при комнатной температуре) в 60X 1,42 NA линзы объектива, и в центре слайд образца (покровное стекло лицевой стороной вниз) через линзу объектива.
- При использовании любого из светлого поля или внешнего освещения и грубой настройки фокуса ручку, медленно поднимать объектива, пока шарик погружения масло не вступает в контакт с перевернутой стеклянной крышкой. (С этой точки зрения, клеточный слой должен приходить в фокус в пределах нескольких витков тонкой фокусировки регулировать ручки). При работе с фиксированными образцами на слайдах, рекомендуется, чтобы избежать клетки внутри или вблизи любых областях с пузырьками. При просмотре с живой образцов на стеклянным дном тарелки, во избежание перемещения линзы объектива за пределами границы покровным стеклом.
- Аутофагосомы могут быть идентифицированы по УЗФБ сигнал (зеленый). Лизосом определены Lysotracker Красный (живой образец) или анти-флуоресцентные лампы 1 антитела (установленного образца). Ядра клеток идентифицируются по ул DAPIAining (установленного образца).
- Выберите нужное поле зрения. В идеале, клетки должны обладать хорошей флуоресцентного сигнала во всех соответствующих каналов и достаточно прилагается и выкладывается на покровное поверхности так, чтобы внутриклеточного содержимого легко визуализировать. Небольшие корректировки в боковых х, у, и Z-фокус можно управлять с помощью компьютера с помощью Acquire3D интерфейс. Установить биннинге в 1x1 или 2x2, в зависимости от желаемого поля обзора (больше клеток можно увидеть в поле, когда биннинге установлен в 2x2).
- Для данного изображения через среднюю часть клетки, установить экспозицию параметров (например,% электропередачи и времени экспозиции) такая, что максимальная интенсивность пикселя не превышает 3000 пунктам. Как правило,% передачи должен быть установлен как можно ниже, не поднимая соответствующее время облучения за 1 сек. Повторите эту процедуру для каждого цвета флуоресценции для включения в образ и для каждого отдельного поля зрения для получения изображения высочайшего качества.
- Установите UДОРП и нижний пределы Z-стек регулировать фокусировку чуть больше верхней и нижней части клетки образца соответственно. Общее количество изображений в данной Z-стек таким образом будут определяться эти пределы и расстояние между слоями (значение по умолчанию: 0,2 мкм).
- Чтобы свести к минимуму артефакты движения во время получения изображения, рекомендуется установить режим получения изображения на "длину волны, то Z-стек" для фиксированных образцов, а "Z-стек, то длина волны" для живых образцов.
- Флуоресценции изображения деконволюции использованием Softworx (прикладная точность, штат Вашингтон), а затем анализировали с помощью Volocity (Improvision, теперь Perkin Elmer, MA).
4. Часть 4: супер-разрешения, структурированное освещения (OMX) микроскопии
Протокол в этом разделе относится к использованию OMX Структурированные микроскоп освещению (прикладная точность, штат Вашингтон).
- Включите питание и желаемых лазеров (410 нм, 488 нм, и / или 532 нм). Подождите 20 мильN для лазеров быть термически стабилизирована.
- Добавить иммерсионного масла (показатель преломления 1,516 для фиксированных образцов при комнатной температуре) на 1,42 60X объектив NA. Если пузырьки видны в капли масла, очистите объективных и добавить масло снова.
- Поместите образец слайдов на сцене и, при необходимости, позволяют 10 мин для клеток, чтобы поселиться на покровное.
- Инициализация программы приобретения. Используйте флуоресценции освещенности для регулировки фокуса, пока резкие контуры ячейки не видно. (Уход должно быть принято в любое время, чтобы минимизировать воздействия на клетки возбуждения флуоресценции, до фактического получения изображения).
- Сканирования спираль мозаики могут быть получены для предварительного просмотра больших областей образца для выбора ячейки или зоны интереса. Рекомендуется использовать короткое время воздействия (1-10 мс) и низкой мощности возбуждения (0,1-1% передач) во время сканирования образца или нахождение целей.
- Определить аутофагосомы по GFP-LC3 флуоресценции. Определить лизосом по Alexa Fluor 555 анти-LAMP(Связанного с лизосомой мембранного белка) и клеточных ядер с использованием DAPI (фиксированные образцы).
- Выберите экспериментальных условиях, включая длины волны возбуждения, область изображения (например, 512x512), стек толщина, время экспозиции, и процент передачи лазера. Для супер решен изображения, убедитесь, что опция структурированной подсветки включена. Для деконволюцией микроскопии на OMX, выберите обычный вариант освещения.
- Для достижения наилучших результатов реконструкции, выбора условий эксперимента так, чтобы максимальное количество интенсивности между 10000 и 15000 при приобретении. Если фотообесцвечивания вызывает беспокойство, работы с изображениями по более низкой экспозицией (оценкам, от 5000 до 10000) могут быть использованы. В идеале, считается не должна уменьшаться более чем в два раза в течение всей записи, и уменьшается более чем в четыре раза следует избегать. При необходимости уменьшить толщину стека для обеспечения устойчивого интенсивности счета. Камера насыщается при 64000 подсчитывает, поэтому максимум винтенсивность не должна превышать этого. Для хороших образцов, мы обнаружили, что условия эксперимента на 10 ~ 50 мс Выдержка 1% лазерной передачи. Светлые и фотостабильный образцов, которые могут быть отображены повторно являются предпочтительными. Стабильное пятно требуется для покадровой, супер решен изображений.
- Для снижения уровня шума, скорость считывания 95 МГц (средний вариант скорость) и времени измерения 2 мс или более рекомендуется. Повышенная артефакты, полученные в реконструированном отображаемого, когда образец движется во время приобретения. В связи с этим аффекта, коротких экспозиций рекомендуются для неадгезивные или быстро движущихся клеток.
- Многоканальные Такая операция может выполняться одновременно или последовательно. Последовательный выход режиме меньше перекрестных помех и, таким образом рекомендуется.
- Чтобы уменьшить фотообесцвечивания, как правило, рекомендуется, чтобы изображение с более длин волн возбуждения первого (532 нм, 488 нм, а затем 410 нм). Тем не менее, для экспериментальных результатов, показанных на фигуре 3, этот порядок был обратнымг (т.е. 48 нм, 532 нм и 410 нм) в связи с фотостойкость данном образце.
- Установите верхний / нижний предел Z-стек, перемещая столик микроскопа до верхней / нижней части клетки не немного не в фокусе. Требуемое расстояние между каждого изображения должны быть постоянными при 0,125 мкм для сверхвысокого разрешения изображений, а программное обеспечение реконструкции принять это значение по умолчанию.
- Реконструкция стеки использованием Softworx (прикладная точность, штат Вашингтон) и анализа использования Volocity 6,0 (Perkin Elmer, MA).
Результаты
Изображение последовательности, показанной на рисунке 1 показывает физические изменения, которые происходят в CWR22 клетки в течение первых 80 мин аутофагия индукции. В этом и других исследованиях (не показано) мы последовательно наблюдается: (1) смещением ядра от центра ячейки, (2) снижение адгезии координационные центры, а также (3) Общий транслокации аутофагосом и лизосом к центру клетке. Кроме того, мы также наблюдали небольшое увеличение колокализации (отмечены желтым) между аутофагосомы (зеленый) и лизосом (красный), в более поздние моменты времени.
В качестве демонстрации на основе образа цитометрии, мы использовали Volocity Digital Imaging приложений (версия 6.0, импровизация / Perkin-Elmer), чтобы определить, соперника, собирать статистические данные о меченых аутофагосомы и лизосом в образах CWR22 клетки показано на Рисунок 1. Как показано на графиках на рисунке 2, количества и размера тОн аутофагосом (после их первоначального формирования и внешний вид) действительно изменяются со временем: после 80 мин аутофагии индукции, был постепенным, но чистое уменьшение числа аутофагосом (рис. 2А) с соответствующим увеличением среднего размера аутофагосомы ( Фиг.2В). Кроме того, было измеримое увеличение колокализации аутофагосомы и лизосом, на основе корреляции Пирсона Коэффициент анализа (рис. 2С). Вместе взятые, эти результаты говорят о том, что после стимуляции аутофагии, многочисленные мелкие аутофагосомы сливаются, образуя большие аутофагосомы с течением времени (рис. 2D). В то время как 1 и 2 отражает результаты только одного исследования изображений, и более строгий количественный анализ будет необходимо провести четкую заключение он иллюстрируют особенности и преимущества количественной флуоресцентной микроскопии. Мы активно используют эту технику в НУR продолжает исследование молекулярного механизма и процесс клеточной аутофагии.
3А показывает бок-о-бок сравнения изображений, полученных и реконструированный в режиме DV (имитация широкопольных деконволюцией, слева) и структурированный освещения режиме с помощью микроскопа OMX (справа). Боковые резолюции улучшилось до 120 нм, что вдвое превышает разрешение обычных дифракционной микроскопии 14,15. Малые колокализации аутофагосом и лизосом (рис. 3В, отмечены стрелками), были очевидны с супер-разрешения микроскопа, тогда как они были едва заметной с обычной флуоресцентной микроскопии.
Одним из преимуществ использования Деконволюция микроскопия является реконструкция всех изображений в 3D-модель, которая покажет более точную пространственную информацию между различными молекулами. Movie 1 показывает общую картину CWR22 Rv1 клетки undergoiнг аутофагию на более позднем этапе, где значительное количество колокализации между аутофагосом лизосом и начинают происходить. E-кадгерина окрашивания (как указано в белый цвет) показывает контур клетки-мишени. В кино 2, 3D реконструированного модель обеспечивает более пространственный детали слияния между аутофагосомы и лизосом (как указано в желтый цвет). Мы ясно видим, взаимодействие между зелеными LC3 сигналы и сигналы красного Лизосома, и слияние двух сигналов для получения желтого сигналов.

Рисунок 1. Time-Lapse изображения CWR22 Rv1 клетки, обработанные ADI. Изображение показывает последовательность CWR22 Rv1 клетки, обработанные ADI в течение 80 мин. (2D изображения, полученные с оригинальных стеки изображение максимальной проекцией Z). WHITE пунктирная линия представляет контур ячейки, и свет-заштрихованная область представляет положение ядра.

Рисунок 2. Статистического анализа. Статистические тенденции были извлечены путем анализа последовательности изображений показано на рисунке 1 в качестве демонстрации того, что данные изображения количественно. Нажмите здесь, чтобы увеличить рисунок .
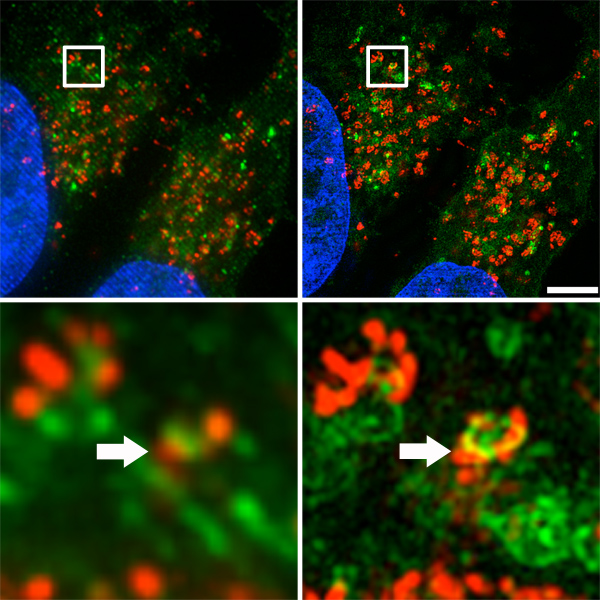
Рисунок 3. Аутофагосом и лизосомы распределение в клетке. А. Top) Бок о бок Сравнение изображений, полученных и реконструированный в режиме DV (имитация широкопольных деконволюцией, слева) и структурированный освещения режиме с помощью микроскопа OMX (справа). Шкала бар представляет 5 мкм. B. Внизу) Малые колокализации аутофагосом и лизосом (указаны стрелками).
Фильм 1 и Фильм 2. 3D-реконструкция CWR22 Rv1 Сотовые Проходят Аутофагия. Этот фильм иллюстрирует нормальную индукцию аутофагии после лечения ADI. Z-Stack изображения были реконструированы в 3-мерной модели. Этот фильм был создан, вращая ячейку 360 ° по горизонтали и 360 ° по вертикали. Зеленый сигнал представляет LC3, красный сигнал представляет лизосом, белый сигнал представляет E-Cadherin и синий сигнал представляет ядро. Нажмите здесь, чтобы посмотреть фильм 1 или= "_blank"> Нажмите здесь, чтобы посмотреть фильм 2.
Обсуждение
В то время как непосредственное наблюдение клетки помечены флуоресцентными зондами против LC3 широко применяется в качестве стандартного метода для подтверждения аутофагической ответ 6, количественные изображения в 3D и той же системе (как мы сделали) обеспечивает беспрецедентную информацию и подробности о сложном процессе клеточного аутофагию . В частности, мы видим, что сотни (если не тысячи) аутофагосом в живых клетках образуются в течение 80 мин аутофагии индукции. Аналогичным образом, мы наблюдаем очень интересную морфологические изменения в распределении лизосомальных отсеков во время аутофагию индукции. В данной клетке, снижение аутофагосом число и соответствующее увеличение их среднего размера с течением времени, показывают, что аутофагосомы становятся большими путем слияния друг с другом, перед объединением с лизосомами в форме autolysosomes. Высокое разрешение 3D флуоресцентной микроскопии живых клеток позволяет исследовать ли аутофагосомы должны достичь критического размера ДОэлектронной сливается с лизосом, или может аутофагию идет просто в меньших физических размеров. Действительно, учитывая количество очень маленьких аутофагосомы, которые появляются на ранней активации только на пределе разрешающей способности микроскопа деконволюцией, и гораздо более четко решен на OMX структурированное освещения микроскопа 13, это может быть так, что основная часть деятельности фактически аутофагической На этой ступени.
Возможность мониторинга живых клеток в течение аутофагия является критически важным, так как изменение количества и размера аутофагосомы в данной соте может быть небольшим по отношению к вариации этих параметров от клетки к клетке. Изучая единый живой клетки с течением времени - мы можем быть более уверены, что морфологические изменения, которые мы наблюдаем обусловлены экспериментальных условиях, а не статистическую дисперсию.
Наконец, со специфическими молекулярными маркерами, то можно применить эти методы визуализации для изученияраннее формирование аутофагосом, проследить происхождение autophagosomal мембран, а также определить возможные органелл и / или внутриклеточных компонентов, которые были специально охвачен аутофагосомы во аутофагию индукции. Мы также надеемся, что такой подход позволяет исследовать роль аутофагии выживания клеток и гибель клеток, и лучше охарактеризовать последствия потенциальных лекарственных препаратов и ингибиторов на аутофагии.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Грантовая поддержка: NIH CA165263, NIH CA150197, NIH CA150197S1 (HJ Kung), NIH CA150197S1 (CA Changou), NSF PHY-0120999 Биофотоники Центр Науки и Технологии (DL Wolfson, FYS Чжуан), DOD PC073420 (RJ Жирный), Научно-исследовательский Совет Норвегии, Leiv Eiriksson грант 209286/F11 (BS Ахлувалия). HJ Кунг также благодарит за поддержку Рыжий Общественный фонд рака фонда. RJ Жирный также благодарит за поддержку J. McDonald одаренность.
Мы благодарим доктора Дженни Вэй-Jen Кунг-и д-р Бор-на Вэнь У DesigneRx на щедрые поставки ADI.
Материалы
| Name | Company | Catalog Number | Comments |
| Arginine Deiminase (ADI) | DesigneRx | ||
| HEPES | Sigma | H4034 | |
| Casein | Sigma | C5890 | |
| Paraformaldehyde | Fisher | 4042 | |
| Saponin | Sigma | S4521 | |
| Alexa anti-mouse 555 | Invitrogen | A21422 | |
| Alexa anti-rabbit 647 | Invitrogen | A21244 | |
| LysoTracker Red DND-99 | Invitrogen | L7528 | |
| anti-Lamp1 | DSHB | H4A3 | |
| anti-Cadherin | Cell Signaling | #3195 | |
| SlowFade Gold | Invitrogen | S36936 | |
| 35 mm poly-d-lysine coated glass bottom plate | MatTek | P35GC-1.5-1.4-C | |
| No.1, 22 mm coverslip | Corning | #2865-22 | |
| Microscope slides | Globe Scientific | 1324G |
Ссылки
- Kim, R. H., Coates, J. M., Bowles, T. L., McNerney, G. P., Sutcliffe, J., Jung, J. U., Gandour-Edwards, R., Chuang, F. Y., Bold, R. J., Kung, H. J. Arginine deiminase as a novel therapy for prostate cancer induces autophagy and caspase-independent apoptosis. Cancer Res. 69 (2), 700-708 (2009).
- Miyazaki, K., Takaku, H., Umeda, M., et al. Potent growth inhibition of human tumor cells in culture by arginine deiminase purified from a culture medium of a Mycoplasma-infected cell line. Cancer Res. 50, 4522-4527 (1990).
- Takaku, H., Matsumoto, M., Misawa, S., Miyazaki, K. Anti-tumor activity of arginine deiminase from Mycoplasma argini and its growth-inhibitory mechanism. Jpn. J. Cancer Res. 86, 840-846 (1995).
- Levine, B., Klionsky, D. J. Development by self-digestion: molecular mechanisms and biological functions of autophagy. Dev. Cell. 6, 463-477 (2004).
- Mizushima, N., Levine, B., Cuervo, A. M., Klionsky, D. J. Autophagy fights disease through cellular self-digestion. Nature. 451, 1069-1075 (2008).
- Kabeya, Y., Mizushima, N., Ueno, T. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO J. 19, 5720-5728 (2000).
- Pattingre, S., Espert, L., Biard-Piechaczyk, M., Codogno, P. Regulation of macroautophagy by mTOR and Beclin 1 complexes. Biochimie. 90, 313-323 (2008).
- Maiuri, M. C., Criollo, A., Tasdemir, E., et al. BH3-only proteins and BH3mimetics induce autophagy by competitively disrupting the interaction between Beclin 1 and Bcl-2/Bcl-X(L). Autophagy. 3, 374-376 (2007).
- Crighton, D., Wilkinson, S., O'Prey, J., et al. DRAM, a p53-induced modulator of autophagy, is critical for apoptosis. Cell. 126, 121-134 (2008).
- Dillon, B. J., Prieto, V. G., Curley, S. A., et al. Incidence and distribution of argininosuccinate synthetase deficiency in human cancers: a method for identifying cancers sensitive to arginine deprivation. Cancer. 100, 826-833 (2004).
- Dale, B. M., McNerney, G. P., Thompson, D. L., et al. Cell-to-cell transfer of HIV-1 via virological synapses leads to endosomal virion maturation that activates viral membrane fusion. Cell Host & Microbe. 10 (6), 551-562 (2011).
- Cogger, V. C., McNerney, G. P., Nyunt, T., et al. Three-dimensional structured illumination microscopy of liver sinusoidal endothelial cell fenestrations. J. Struct. Biol. 171 (3), 382-388 (2010).
- York, A. G., Parekh, S. H., Nogare, D. D., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by factor of two using structured illumination microscopy. Journal of Microscopy. 198, 82-87 (2000).
- Shao, L., Kner, P., Rego, E. H., Gustaffson, M. G. Super-resolution 3D microscopy of live whole cells using structured illumination. Nat. Method. 8 (12), 1044-1046 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены