Method Article
Выделение и культуры клеток нервного гребня из эмбриональных мышей нервной трубки
В этой статье
Резюме
Выделение эмбриональных нервного гребня из нервной трубки облегчает использование В пробирке Методы изучения миграции, самообновления и multipotency из нервного гребня.
Аннотация
The embryonic neural crest (NC) is a multipotent progenitor population that originates at the dorsal aspect of the neural tube, undergoes an epithelial to mesenchymal transition (EMT) and migrates throughout the embryo, giving rise to diverse cell types 1-3. NC also has the unique ability to influence the differentiation and maturation of target organs4-6. When explanted in vitro, NC progenitors undergo self-renewal, migrate and differentiate into a variety of tissue types including neurons, glia, smooth muscle cells, cartilage and bone.
NC multipotency was first described from explants of the avian neural tube7-9. In vitro isolation of NC cells facilitates the study of NC dynamics including proliferation, migration, and multipotency. Further work in the avian and rat systems demonstrated that explanted NC cells retain their NC potential when transplanted back into the embryo10-13. Because these inherent cellular properties are preserved in explanted NC progenitors, the neural tube explant assay provides an attractive option for studying the NC in vitro.
To attain a better understanding of the mammalian NC, many methods have been employed to isolate NC populations. NC-derived progenitors can be cultured from post-migratory locations in both the embryo and adult to study the dynamics of post-migratory NC progenitors11,14-20, however isolation of NC progenitors as they emigrate from the neural tube provides optimal preservation of NC cell potential and migratory properties13,21,22. Some protocols employ fluorescence activated cell sorting (FACS) to isolate a NC population enriched for particular progenitors11,13,14,17. However, when starting with early stage embryos, cell numbers adequate for analyses are difficult to obtain with FACS, complicating the isolation of early NC populations from individual embryos. Here, we describe an approach that does not rely on FACS and results in an approximately 96% pure NC population based on a Wnt1-Cre activated lineage reporter23.
The method presented here is adapted from protocols optimized for the culture of rat NC11,13. The advantages of this protocol compared to previous methods are that 1) the cells are not grown on a feeder layer, 2) FACS is not required to obtain a relatively pure NC population, 3) premigratory NC cells are isolated and 4) results are easily quantified. Furthermore, this protocol can be used for isolation of NC from any mutant mouse model, facilitating the study of NC characteristics with different genetic manipulations. The limitation of this approach is that the NC is removed from the context of the embryo, which is known to influence the survival, migration and differentiation of the NC2,24-28.
протокол
1. Подготовка пластин
- Использование стерильных во все времена.
- Подготовить фибронектин (FN) путем разбавления 100 мкл плазмы человека запас FN в конечном объеме 3,3 мл в PBS Дульбекко (DPBS). Конечная концентрация 30 мкг / мл, и это можно хранить при температуре 4 ° С в течение 1 недели.
- Крышка нижней части каждой скважины стерильной культуры тканей четыре хорошо пластины с решением FN и оставьте на 15 минут. Убедитесь, что вся поверхность покрыта. Сделать средств массовой информации в течение этого времени (шаги 2 и 3).
- Удалить НФ решения и позволяют пластины для просушки. Аккуратно промойте скважин с 500 мкл DMEM, удалить DMEM, и добавить 500 мкл самообновления (SR) среды (см. ниже). Инкубировать при температуре 37 ° C в увлажненном инкубаторе, содержащем 5 процентов CO 2. Заполните эту примерно за час до вскрытия, так что пластины будет сухой перед использованием.
2. Подготовка SR среднего
- Для культуры и блуждающего ствола NCиз десяти эмбрионов (примерно один помет, в зависимости от генетического фона мыши линии), подготовить 25 мл средней SR. Комбинат 12,5 мл DMEM низкий уровень глюкозы, 7,5 мл Neurobasal Средний, 25 мкл ретиноевой кислотой (117 мкМ конечная концентрация) и 25 мкл 2-меркаптоэтанол (50 мМ конечной концентрации). Все хорошо перемешать.
- Добавить 3,75 мл куриного эмбриона экстракта, 250 мкл N 2 соль добавки, 500 мкл B27 дополнения и 250 мкл пенициллин-стрептомицина (1% конечной концентрации). Фильтр среду через 0,22 мкм фильтр.
- Добавить 10 мкл стерильной IGF1 (20 мкг / мл, конечная концентрация) и 20 мкл стерильной bFGF (20 мкг / мл конечной концентрации). Смешайте обращением. Хранить при температуре 4 ° C.
3. Подготовка Wash среднего
- Для примерно 10 эмбрионов подготовить 50 мл промывочного среды. Комбинат 50 мг BSA с 35 мл DMEM низкий уровень глюкозы, 15 мл Neurobasal средних и 500 мкл пенициллин-стрептомицина (1% конечной концентрации). Стерильные фильтры с 0,22мкм.
4. Подготовка коллагеназы / dispase
- Добавить 50 мкл 100 мг / мл коллагеназы / dispase до 5 DPBS мл. Все хорошо перемешать.
- Шприц с фильтром 0,2 мкм процедить и добавить 1,5 мл в каждом из трех скважин на двенадцать и пластины. Внесите примерно 1 мл мытья среды в оставшиеся лунки. Храните всю пластинку на льду, пока готовы переварить расчлененный ткани.
- Отрежьте кончики p20 и P1000 пипетки фильтра кончик стерильным лезвием. Вырезать чуть ниже скошенный край наконечника. Отсечения P1000 будет использоваться для передачи всего эмбриона в то время как p20 будет использоваться для передачи части изолированных тканей.
5. Изоляция блуждающего нерва и магистральные нервной трубки от 9,5 эмбрионов ЦОД
- Для приурочен беременности, плотин с вагинальным плагин считается 0,5 ЦОД в полдень утром плагина не наблюдается. Жертва и удаление матки 9,5 DPC.
- Удалить децидуальной из матки и аккуратно талить эмбрион от децидуальной оболочки. Как только опыт работы с этим протоколом, изолировать 3-4 9,5 DPC эмбрионов в то время, в стерильных DPBS. Использование стерильных и стерилизовать инструменты вскрытия. Инструменты можно стерилизовать автоклавированием, тепловой стерилизации или инкубации в этаноле.
- Для переднего блуждающего NC: с помощью инсулина, иглы, сократить нервной трубки в середине ушной плакоды. Вырезать снова у заднего края 4-й сегмент. Обрежьте ткань брюшной части нервной трубки для удаления глотки арки и сердца.
- Для магистральных NC: с помощью инсулина, иглы, удалите часть нервной трубки между сомитов 16-22 (или последний сегмент, если эмбрионы умственно раньше, чем 22 сомитов).
- Держите желточного мешка и оставшиеся эмбриональной ткани для генотипирования.
6. Удаление без нейронных эктодермы и мезодермы
- Поместите нервной трубки содержащие сегментов в коллагеназа / dispase при комнатной температуре в течение 10 минутс. Немедленно промыть в промывочной среды.
- Вернуться к стерильной ткани DPBS. Используя стерильные иглы инсулин, аккуратно удалить не-нейронных эктодермы из ткани и отделить сомитов от нервной трубки. Последние оставшиеся части мезодермы из сомитов тканей можно удалить, слегка растирая помощью урезанной p20 чаевые. Будьте осторожны, чтобы не повредить нервную трубку. Соблюдать это близко во время растирания.
- Поместите изолированной нервной трубки через второй и третьей 30-секундный мыть мыть среды.
- Мыть раз в средней SR, и поместить изолированной нервной трубки в центре FN-покрытием и которая была подготовлена ранее (шаг 1.3). Увлажняйте гипоксии камеру с блюдом стерильной водой. Поместите блюдо в камере гипоксии и очистить камеру с газовой смеси до 3% O 2 (использовать резервуар, содержащий смесь 1% O 2, 6% CO 2, 93% N 2).
- Обращайтесь с камерой очень тщательно, чтобы обеспечить Thaт эксплантов это спокойно и по-прежнему в центре скважины.
- Инкубировать при температуре 37 ° C. Резюме шаги 5-6 показано на рисунке 1.
7. Удаление нервной трубки
- После 24 часов инкубации удалить нервной трубки, слегка дразнить края нервной трубки от мигрирующих клеток с помощью стерильной иглы инсулин. Удаляют нервной трубки из среды с использованием стерильного сокращение p20, как в пункте 6.2 и замените носитель свежей средой SR (рис. 2). Проще всего это сделать с помощью инвертированного микроскопа.
8. Представитель Результаты
После 24 часов инкубации при 37 ° C в условиях гипоксии, NC клетки мигрировали от нервной трубки в почти чистый населения (рис. 3а). Иногда, далеки от идеальных культур не даст надежные наросты. Например, вполне возможно, что после 24 часов тОн нервная трубка будет свернувшись калачиком на себя и НК не будет мигрировать от нервной трубки (рис. 3б). Иногда нервная трубка не будет привязан к фибронектина покрытие пластин.
По нашему опыту, неоптимальной NC миграции и проблем с приложением нервной трубки могут оказать негативное воздействие на условия или нормоксии концентрации фибронектина, соответственно. Ферментативной активности коллагеназы / dispase немного отличается от партии и время переваривания должна быть скорректирована соответствующим образом, однако, не переваривать ткань дольше, чем пятнадцать минут. Overdigestion нервной трубки, содержащей ткани коллагеназы / dispase также приведет к недостаточной наросты. Если сегмент тканей не так легко удалены из нервной трубки после инкубации в коллагеназа / dispase, нервной трубки можно инкубировать в течение более десяти минут. Иногда нервная трубка не будет прикрепляться к субстрату. Если это так, проверьте fibronecконцентрация олова и условиях гипоксии.
Хотя гипоксическим условиям могут быть использованы для культуры дикого типа NC, условиях гипоксии более тесно имитировать в естественных условиях окружающей среды 29,30. По нашему опыту, условиях гипоксии стала критической, когда культивирование мутант NC. Например, когда Foxd3 мутант NC культивировали в гипоксическим условиям, ствол NC была значительно уменьшена клетки результат по сравнению с контрольной группой. Эта разница в размере результат был удален, когда эксплантаты культивировали в условиях гипоксии (рис. 4). Кроме того, при дикого типа нейронных эксплантов трубки культивировали в нормоксии, количество каспазы-положительных клеток было больше чем у аналогичных эксплантатов культивировались в условиях гипоксии (данные не представлены). Поддерживая все культуры НК в условиях гипоксии, сравнения могут быть более легко между динамикой управления и мутантных культур.

Рисунок 1. В целом схема выделения НК. А) Проанализируйте регионах, представляющих интерес с эмбрионом. B) Дайджест нервной трубки у коллагеназы / dispase в течение десяти минут (не превышает пятнадцати минут). C) Промойте в промывочной среды. D) Проанализируйте от не-нейронных эктодермы и мезодермы. EF) промыть дважды в промывочной среды. G) в себя плиты средней обновления. Инкубировать при температуре 37 ° С в 3% O 2 условиях гипоксии.
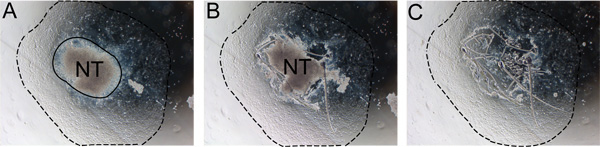
Рисунок 2. Поэтапное удаление нервной трубки из эксплантов. Нервной трубки должны быть удалены после 24-48 часов, чтобы предотвратить загрязнение с не-NC клеток. А) Обратите внимание, что границы между нервной трубки и результат NC (сплошная линия). Б) Разрежьте вдоль края нервной трубки с инсулиновой иглой. C) Откажитесь от нервной трубки и заменить среднего свежей средой обновления себя. Пунктирная линия показывает степень результат. Сокращенное наименование: NT, нервной трубки.
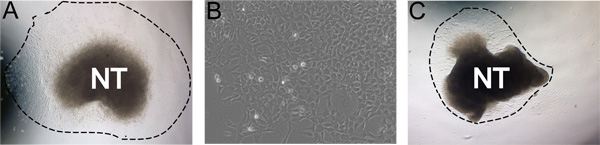
Рисунок 3. Примеры представитель результаты. А) Типичный результат эксплантов после 24 часов инкубации в себя средние обновления в условиях гипоксии (пунктирная линия показывает степень результат). Б) увеличенное изображение результатом NC после 48 часов в культуре. C) меньше идеального культуры с низкой доходностью результат. И C культивировали при тех же условиях. Изображения демонстрируют естественный ареал культуры надежности. Это может повлиять на эффективность нейронных изоляции труб, концентрации FN, условиях гипоксии, и время в коллагеназа / dispase пищеварения.
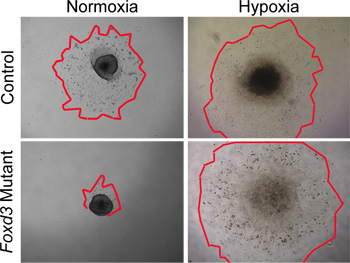
Рисунок 4. В лабораторных анализов НК эксплантов культур в нормоксии против гипоксии. Контроль (дикий тип) NC клетки мигрировали из нейронных эксплантов трубку после 48 часов в гипоксическим условиям культуры. В отличие от Foxd3 мутантNC резко снизить клетки выросты в нормоксии (красный контур знака краям выростов NC). При сопоставимых эксплантов были выращены в условиях гипоксии, Foxd3 мутант NC эксплантов выросли сравнительно с контрольной группой, что позволяет последующего анализа. Обратите внимание, что такое поведение хорошо коррелирует с поведением Foxd3 мутант НК в естественных условиях.
Обсуждение
Особое внимание следует обратить на стадии развития эмбриона, чтобы обеспечить успех этого подхода. Подсчет сомитов ранних эмбрионов мыши имеет решающее значение как для стадии эмбриона в соответствие мусора и правильно определить регионы нервной трубки для изоляции. Изменение одного или двух сомитов между эмбрионов в разумных пределах развивающего времени, в зависимости от разрешения эксперимент. Эмбриона в возрасте от 9 до 9,5 ЦОД будут иметь от 17 до 25 сомитов. Если эмбрион имеет более чем 25 сомитов, НК еще более продвинулась в развитии времени и NC наросты будут менее надежными в сфере культуры. Постановка эмбрионы на основе сомитов число способствует точности экспериментов, когда стадия развития эмбриона и, следовательно, NC, может повлиять на исход эксперимента. В 9,5 эмбриона DPC, блуждающего NC мигрирует из спинной нервной трубки в определенных передне-задней пределах: от середины к слуховым плакоды сомитов 7.Кроме того, ствол NC мигрирует из нервной трубки на уровне сомитов 8 сомитов 24. Для выделения отдельных популяций предшественников НК, как указано в этом протоколе, дискретные суб-регионов в рамках каждого из этих доменов являются изолированными. Области нервной трубки использовались будет меняться в зависимости от конструкции эксперимента и передне-задней области NC изучается.
Культура условий, описанных выше, в том числе средних и условия инкубации, специально адаптированных к культуре мышиных NC. Подобные средней SR был впервые использован для культуры крысы NC 11. В наших руках, это крыса среде с добавлением Neurobasal среднего, производит надежные результат мышей прародители ЧПУ. Кроме того, в отличие от предыдущих работ культивирования клеток птичьего NC, фидерного слоя не является необходимым для культуры млекопитающих NC с помощью этого метода 11,13,21,22. Хотя существуют многочисленные протоколы подробным и птиц и млекопитающих NC культуры в нормоксических заболе дополнений 9,22, то 23 (рис. 4), наряду с другими в области 20, обнаружил, что культивирования мышиных клеток НК в условиях гипоксии, как описано здесь значительно средства выживания и самообновления, предположительно, из-за гипоксии более точно имитирует физиологический уровень кислорода в зародыше 20,29,30.
Оценка экспрессии молекулярных маркеров значительно облегчает идентификацию клеток НК и их дифференцированной производных. К ним относятся выражения Foxd3, p75 и Sox10 для клеток НК стебля. Маркеры дифференцированных NC включают гладкие мышцы альфа актина (SMA) для миофибробластов, глиального фибриллярного кислого белка (GFAP) для глии, микрофтальмия связанного фактора транскрипции (MITF) для меланоцитов, а также бета-III тубулина, белка продукт гена 9,5 (PGP9.5 ), а peripherin для нейронов. Эти маркеры могут быть использованы для определения эффективности эксплантов и дифференцировку предшественников NC.
Содержание "> Как только эта техника освоена, культурный НК могут быть использованы в различных анализов, включая количественное распространение, гибели клеток, динамика миграции и / или дифференциации статуса. НК может быть клонально культурного расследовать самообновлению или multipotency из отдельные предшественники NC 23. После того, как нервная трубка отделяется от культуры, отделить НК клеток в 100 мкл Трипсин-EDTA (0,25%) ровно 5 минут при 37 ° C. угашайте Трипсин-EDTA превышает средний стирки (8-10 мл) с добавлением 800 мкл на лунку и передачи отдельных 15 мл пробирки мыть среды. Осторожно центрифуги клетки при 150 мкг в течение 3 минут, удалить супернатант и ресуспендируют осадок клеток в 1 мл средней SR. Граф клеток с использованием гемоцитометра и пластины их Плотность 25 клеток / см 2. Эти колонии может быть последовательно пассировать на анализе самообновлению. Для анализа multipotency, поддерживать НК клеток в клональных плотность в средней SR в течение 6 дней, а затем перейти к дифференциациисредний (10 нг / мл bFGF и 1% экстракт куриных эмбрионов). Культуры клеток в дифференциации среды при гипоксии в течение 8 дней до анализа состава колонии с молекулярными маркерами, как и выше 11.В заключение, этот метод выделения НК клеток из эмбрионов мыши производит подачи бесплатно приверженцем культуры клеток premigratory NC без использования СУИМ. Анализ экспериментов с использованием этих клеток может быть легко определена. Хотя эта техника очень проста, ее применение для изучения характеристик НК миграции, самообновления и дифференцировки великое множество. Кроме того, изоляция NC из генетически модифицированных эмбрионов мыши позволяет непосредственного изучения отдельных генов и путей в контексте НК миграции, выживание, и / или дифференциации.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Марка Возняка для видео-помощь. Мы также хотели бы признать, Шон Моррисон в Техасском Университете в оригинальный протокол для культивирования клеток крысы NC. Работа выполнена при поддержке Университета Вандербильта Медицинского центра академической поддержки программ и грантов от NIH (HD36720 и HD036720-11S109) и АНА 11GRNT7690040 в PAL, predoctoral стипендии от AHA (0615209B) и NIH (NS065604), чтобы Движение неприсоединения, а также ERP было поддерживается обучение NIH грант T32HD007502.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Компания | Номер по каталогу | Комментарии |
| DMEM (низкий уровень глюкозы) | Гибко / Invitrogen | 11885 | |
| Neurobasal среднего | Гибко | 21103 | |
| BSA | Сигма | A3912-10G | |
| DPBS | Гибко | 14190-144 | |
| IGF1 | BD Biosciences | 354037 | Хранить в 50 мкг / мл аликвоты при -20 ° C. |
| bFGF | BD Biosciences | 354060 | Хранить в 25 мкг / мл аликвоты при -20 ° C. |
| Фибронектин | Гибко | 33016-015 | Хранится в 1mg/mL др.iquots при температуре -20 ° C. |
| Ретиноевой кислоты | Сигма | R2625 | Хранить в 35 мкг / мл порции после воссоздания в этаноле при температуре -20 ° C. |
| 2-меркаптоэтанол | Сигма | D-5637 | |
| N 2 дополнения | Гибко | 17502-048 | |
| B27 добавки | Гибко | 17504-044 | |
| Steriflip 0,22 мкм фильтры | Millipore | SCGP00525 | |
| Пенициллин, стрептомицин | Invitrogen | 15140122 | |
| 0,20 мкм фильтры | Гранулирование | 431219 | |
| Шприцы (для фильтрации) | BD Biosciences | 301604 | |
| Четыре луночных | Thermo Fisher Scientific | 176740 | |
| Коллагеназы / Dispase | Roche | 269 638 | Активность меняется в зависимости от партии. Хранить в 100 мг / мл аликвоты при -20 ° C. |
| Инсулин иглы (29 ½ залог) | Becton Диксон | 309306 | |
| Гипоксия палаты | Биллапс-Ротенберг | ||
| Кислородный анализатор | Биллапс-Ротенберг | ||
| Пинцет # 5 | Изобразительных средств наук | Для удаления матки и децидуальной. | |
| Трипсин-EDTA (0,25%) | Гибко | 25200 |
Ссылки
- Le Douarin, N., Kalcheim, C. . The neural crest. , (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -. P. . Neural crest induction and differentiation. , (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e. Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены