Method Article
从小鼠胚胎神经管的神经嵴细胞的分离和培养
摘要
胚胎神经嵴的神经管分离,便于使用在体外学习迁移,自我更新和多能神经嵴的方法。
摘要
胚胎神经嵴(数控)是一个多能祖人口,背神经管方面的,经历了一个上皮间质转化(EMT)和迁移整个胚胎,从而引起不同的细胞类型1-3。数控也有独特的能力,影响靶器官4-6的分化和成熟。 在体外 explanted时,数控祖细胞进行自我更新,迁移和分化成各种组织类型,包括神经元,神经胶质细胞,平滑肌细胞,软骨和骨。
数控多能首次描述7-9禽流神经管的外植体。数控细胞体外分离,有利于数控加工动力学研究,包括细胞增殖,迁移和多能。在禽流感和大鼠系统的进一步工作表明,explanted数控细胞保留其数控潜力,移植胚胎10时-13。因为这些固有的保存explanted数控祖细胞特性,神经管外植体检测提供了一个有吸引力的选择研究在体外数控。
为了达到更好地了解了哺乳动物的数控,许多方法已受聘隔离数控人口。数控源性祖细胞培养胚胎和成年后洄游数控祖11,14-20研究动态,可以从迁移后的位置然而数控祖细胞的分离,因为他们从神经管移民提供最佳的保护, NC细胞的潜力和洄游特性13,21,22。有些协议采用荧光激活细胞分类(FACS)来隔离丰富的NC为11,13,14,17尤其祖人口。然而,与早期胚胎开始时,细胞数量足够用于分析是很难获得与流式细胞仪,复杂的隔离早期数控人群的从单个胚胎的NS。在这里,我们描述的方法,不依赖流式细胞仪和结果约96%的纯数控1 WNT1-Cre重组酶激活血统记者23人口。
这里介绍的方法是改编从大鼠数控11,13文化优化的协议。以前的方法相比,这种协议的优点是:1)细胞生长饲养层,2)没有需要获得一个相对纯净的的数控人口,3)premigratory数控细胞分离和4流式细胞仪)的结果很容易量化。此外,该协议可用于数控隔离任何突变小鼠模型,促进数控特点与不同的基因操作的研究。这种方法的局限性是数控的胚胎,这是众所周知的影响数控2,24-28的存活,迁移和分化的背景下删除。
研究方案
1。准备板
- 在任何时候使用无菌技术。
- 纤维连接蛋白(FN)Dulbecco的PBS(DPBS)在3.3毫升的稀释成终体积100μL人体血浆FN的股票准备。终浓度为30微克/毫升,这可以在4°C保存1周。
- 覆盖的底部,并让每个无菌组织培养与FN的解决方案4孔板以及坐了15分钟。确保覆盖整个表面。在这段时间内(步骤2和3)媒体。
- 删除FN的解决方案,并让板干燥。轻轻冲洗井与500μL的DMEM培养液,去除培养液,添加500μL的自我更新(SR)中(见下文)。在37°C的潮湿含5% 二氧化碳培养箱中孵育。完成这个约一小时前清扫,使板块将使用前干燥。
2。准备简中等
- 为迷走神经和主干数控文化从10个克隆胚胎(约一乱抛垃圾,取决于遗传背景的鼠标线),准备25毫升的SR培养基。结合低血糖12.5毫升培养液,7.5毫升的Neurobasal中等,25μL维甲酸(117微米的最终浓度),25μL2 - 巯基乙醇(50毫米终浓度)。拌匀。
- 加入3.75毫升鸡胚提取物,250μL的氮盐的补充,500μL,B27的补充和250μL的青霉素,链霉素(终浓度1%)。通过0.22微米的过滤器的过滤介质。
- 加入10微升无菌IGF1的(20μg/ mL的终浓度)和20μL无菌碱性成纤维细胞生长因子(20μg/ mL的终浓度)。混合相。保存于4°C。
3。准备洗净中等
- 约10胚胎准备清洗液50毫升。结合35毫升低糖DMEM培养液,15毫升的Neurobasal中等,和500μL的青霉素,链霉素(终浓度1%)50毫克,牛血清白蛋白。 0.22无菌过滤微米过滤器。
4。准备胶原酶/ Dispase酶
- 加入50μL100 mg / mL胶原酶/ Dispase酶5毫升DPBS。拌匀。
- 注射器用0.2微米的过滤器过滤和添加到三个井的12孔板每1.5毫升。吸取约1毫升,其余井洗介质。存储整个冰板,直到准备好消化解剖组织。
- 削减1 P20和P1000移液器过滤嘴用无菌刀片的技巧。削减略低于针尖的斜面边缘。削减了P1000将用于转移整个胚胎,而P20将用于传输孤立的组织块。
5。从9.5 DPC胚胎分离迷走神经干的神经管
- 与对于超时怀孕,阴道塞坝被认为是在中午0.5 DPC上午插头观察。牺牲和删除9.5 DPC的子宫。
- 删除从子宫蜕膜和轻轻ŕemove的胚胎从蜕膜。一旦该协议经历,隔离在无菌DPBS 3-4 9.5 DPC胚胎。使用无菌技术和消毒清扫工具。仪器可以灭菌消毒,热杀菌或乙醇的培养。
- 对于前迷走神经数控:使用胰岛素针,切中期耳基板的神经管。再次削减在第 4 届体节的后边缘。修剪消除咽弓和心脏神经管腹侧组织。
- 为主干数控:使用胰岛素针,取出部分之间的神经管体节16-22(或如果胚胎发育早于22体节期的最后体节)。
- 保持卵黄囊和任何剩余胚胎的基因分型组织。
6。拆除非神经外胚层和中胚层
- 将神经管胶原酶/ Dispase酶分割成包含在室温下10分钟第立即洗涤液洗。
- 返回组织无菌DPBS。使用无菌胰岛素针,轻轻地从组织中删除非神经外胚层远离神经管分离体节。最后剩下的部分中胚层体节组织可以去掉研制过程中轻轻用截止P20尖。小心不损害神经管。密切观察这期间研磨。
- 通过第二个和第三个30洗介质的第二洗,将孤立的神经管。
- 在SR培养基洗一次,孤立的神经管放入一个FN涂层以及准备(步骤1.3)的中心。加湿缺氧室,无菌水菜。菜放入低氧室和冲洗室至3%的O 2(含1%O 2 6%CO 2,93%N2混合使用坦克)的混合气体。
- 总是处理室非常仔细,以确保THAţ植原状,并留在井的中心。
- 在37°C。步骤5-6摘要如图1所示。
7。去除神经管
- 培养24小时后,取出神经管神经管细胞迁移使用无菌胰岛素针距边缘轻轻逗弄。从中期的神经管在步骤6.2使用无菌P20停产删除和丢弃和更换介质,用新鲜的SR中( 图2)。这是最容易使用倒置显微镜。
8。代表结果
经过24小时的潜伏期在37°C在缺氧条件下,数控细胞迁移的神经管在一个近乎纯的人口( 图3a)。有时,小于理想的文化,不会产生强大的副产物。例如,它是可能的后24小时内ţ蜷缩着他的神经管会根据本身和数控不会迁移从神经管( 图3b)。偶尔,神经管不会附加到纤维连接蛋白涂层板。
次优数控迁移或神经管附件的问题,在我们的经验,可以产生不利影响常氧条件或纤维连接蛋白的浓度,分别为。胶原酶/ Dispase酶的酶活性略有不同批次和消化时间必须适当调整,但不超过十五分钟消化组织不再。过量也会导致含有胶原酶/ Dispase酶在组织神经管缺陷的副产物。如果体节的组织是不会轻易从神经管胶原酶/ Dispase酶在孵化后取出,神经管可以培养超过10分钟。神经管有时会不重视基板。如果是这种情况,仔细检查fibronec锡浓度和缺氧的条件。
虽然常氧条件下可用于文化野生型数控,缺氧条件下,更加紧密地模仿体内环境29,30。根据我们的经验,缺氧条件下成为关键的时候培养突变数控。例如,当突变数控Foxd3在常氧条件下培养,主干数控大大降低细胞生长与对照组相比。这一产物大小悬殊被删除时,外植体在缺氧条件下培养( 图4)。此外,野生型神经管外植体时,在常氧培养,凋亡阳性细胞数大于缺氧培养的类似植(数据未显示)。维持在缺氧的所有NC文化,比较可以更方便地进行动态控制和突变文化之间。

图1。数控隔离的整体示意图。甲)从胚胎解剖感兴趣的地区。乙)为10分钟(不超过十五分钟)胶原酶/ Dispase酶消化,神经管。 c)清洗在清洗介质。四)解剖了非神经外胚层和中胚层。英法)洗涤液洗两次。 G)的自我更新介质板。在37°C孵育在3%O 2和缺氧条件下。
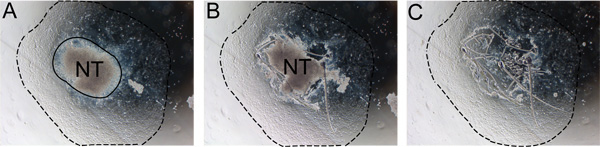
图2。神经管植逐步去除。神经管的,必须拆除后24-48小时,以防止污染与非数控细胞。一)注意神经管和NC的产物(实线)之间的边界。 b)切割神经管的边缘,随着胰岛素的针。三)丢弃的神经管,并更换新鲜的自我更新介质的介质。虚线表示程度的产物。缩写:新台币,神经管。
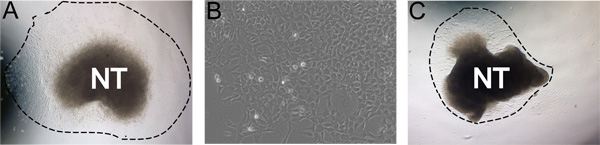
图3。代表结果的例子。一)培养24小时后典型的外植体在缺氧条件下的自我更新介质的产物(虚线表示程度的产物)。 b)放大后,48小时在文化的数控产物。 c)不太理想的文化产物产量低。 A和C在相同条件下进行培养。图片展示文化鲁棒性的自然范围。这可能会影响神经管隔离,FN的浓度,缺氧条件下,胶原酶/ Dispase酶消化时间效率。
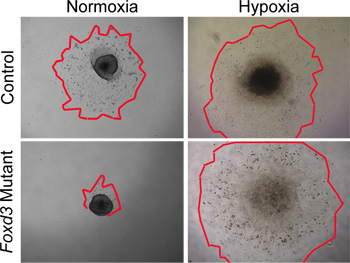
图4。 在体外常氧与缺氧数控植文化分析。控制(野生型)数控从神经管植在常氧培养条件下48小时后的细胞迁移。相比之下,Foxd3突变数控大大降低细胞在常氧副产物(红色标记边缘轮廓的数控副产物)。可比植体缺氧条件下生长时,Foxd3突变数控植可比增长控制,使后续分析。请注意,此行为与与Foxd3突变数控体内的行为。
讨论
小心应注意的胚胎发育阶段,以确保这种方法的成功。计数小鼠早期胚胎的体节是匹配的胚胎内的枯枝落叶,并确定正确地区神经管隔离阶段的关键。一个或两个胚胎体节之间的变化是在合理的范围内的发展时机,取决于进行试验的决议。 DPC 9和9.5之间的胚胎将有17和25体节之间。如果胚胎拥有超过25体节,是进一步推进数控发育时间,数控副产物,将在文化,那么强劲。分期根据胚胎体节数,便于在实验中发育阶段的胚胎,因此,数控,可以影响实验结果的精度。在9.5 DPC胚,迷走神经NC定义前后限制从背神经管迁移:从中期耳基板至7体节。同样,躯干数控迁移在各级体节8体节神经管24。来隔离不同数控祖人群,如在本协议中所述,在每个域的离散分区域隔离。使用神经管的地区会有所不同根据的实验设计和正在研究的数控前后地区。
如上所述,文化条件,包括中期和培养条件,是专门为适应小鼠数控文化。类似的SR中第一次使用对大鼠NC 11的文化。在我们的手中,这与大鼠中等的Neurobasal中等此外,产生的小鼠数控祖健壮生长。此外,不像以前的工作培养禽流数控细胞,饲养层哺乳动物的NC使用这种方法11,13,21,22文化是不必要的。虽然有众多的鸟类和哺乳动物的数控文化详述在常氧conditi协议组件9,22,23( 图4),以及与他人在外地20,已经发现,在缺氧条件下培养小鼠数控细胞这里描述大大艾滋病的生存和自我更新,大概是因为缺氧,更加紧密地模仿生理氧气含量内胚20,29,30。
评估分子标记的表达,极大地方便了数控细胞及其分化衍生物的识别。这些措施包括Foxd3,p75的表达,数控干细胞SOX10。数控区别的标记包括为肌纤维母细胞平滑肌α肌动蛋白(SMA)的,胶质纤维酸性蛋白(GFAP)的胶质细胞,眼球相关转录因子(MITF)为黑色素细胞,β-III微管蛋白,蛋白基因产物9.5(PGP9.5 ),和外周神经元。这些标记可以被用来确定植效率和数控祖细胞的分化。
内容">培养数控一旦掌握这项技术,可用于包括量化的增殖,细胞死亡,移民动态,和/或分化状态的各种实验,NC也可以自我更新或者多能克隆培养的调查个别数控祖23后的神经管。从文化中删除,游离整整5分钟的数控细胞100μL胰蛋白酶-EDTA(0.25%),在37°C。多余的洗涤介质中淬火胰蛋白酶EDTA(8-10 MLS每孔加入800μL,转移到个人15毫升管包含清洗介质。)轻轻离心150 XG细胞3分钟,去除上清,重悬细胞沉淀在1毫升的SR介质计数细胞使用血球和盘子里。这些殖民地的25个细胞/厘米2的密度。可连续传代法的自我更新。法多能维持在6天的数控细胞克隆在SR介质密度,然后切换到分化中等(10毫微克/毫升碱性成纤维细胞生长因子和1%鸡胚提取物)。文化的缺氧条件下的细胞在分化培养基为8天前殖民地组成11以上的分子标记分析。总之,这种隔离数控从小鼠胚胎细胞的方法产生不使用流式细胞仪饲养premigratory数控细胞贴壁培养。使用这些细胞的实验分析,可以很容易地被量化。虽然这种技术很简单,其应用的迁移,自我更新和分化的NC特征的研究是巨大的。此外,从转基因小鼠胚胎中分离数控允许NC迁移,生存,和/或分化的背景下直接研究特定基因和途径。
披露声明
我们什么都没有透露。
致谢
我们要感谢马克·沃兹尼亚克视频援助。我们也想承认在得克萨斯大学西南肖恩·莫里森的培养大鼠数控细胞的原始协议。这项工作是支持范德比尔特大学医学中心的学术计划支持,由国立卫生研究院(HD36720,HD036720-11S109)和的果酸11GRNT7690040的为PAL,从AHA(0615209B)和国立卫生研究院(NS065604)博士前奖学金不结盟运动,和ERP赠款由美国国立卫生研究院培训资助T32HD007502支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂 | 公司 | 目录编号 | 评论 |
| DMEM培养基(低糖) | GIBCO / Invitrogen公司 | 11885 | |
| 的Neurobasal中等 | Gibco公司 | 21103 | |
| 牛血清白蛋白 | 西格玛 | A3912-10G | |
| DPBS | Gibco公司 | 14190-144 | |
| IGF1的 | BD公司 | 354037 | 储存在50微克/毫升,分装在-20°C |
| 碱性成纤维细胞生长因子 | BD公司 | 354060 | 在25微克/毫升分装保存在-20°C |
| 纤维连接蛋白 | Gibco公司 | 33016-015 | 存储在为1mg/mL人iquots在-20°C。 |
| 维甲酸 | 西格玛 | R2625 | 乙醇在-20°C重组后,在35微克/毫升分装店 |
| 2 - 巯基乙醇 | 西格玛 | D - 5637 | |
| 氮的补充 | Gibco公司 | 17502-048 | |
| B27的补充 | Gibco公司 | 17504-044 | |
| steriflip 0.22微米的过滤器 | Millipore公司 | SCGP00525 | |
| 青霉素链霉素 | Invitrogen公司 | 15140122 | |
| 0.20微米的过滤器 | 康宁 | 431219 | |
| 注射器(过滤) | BD公司 | 301604 | |
| 四孔板 | 赛默飞世尔科技 | 176740 | |
| 胶原酶/ Dispase酶 | 罗氏公司 | 269 638 | 活动由一批不同。储存在-20°C 100毫克/毫升等分 |
| 胰岛素针 (29半规) | 贝克顿·迪克森 | 309306 | |
| 缺氧商会 | 比卢普斯-罗滕伯格 | ||
| 氧分析仪 | 比卢普斯-罗滕伯格 | ||
| 镊子#5 | 罚款科学工具 | 为消除子宫和蜕膜。 | |
| 胰蛋白酶-EDTA(0.25%) | Gibco公司 | 25200 |
参考文献
- Le Douarin, N., Kalcheim, C. . The neural crest. , (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -. P. . Neural crest induction and differentiation. , (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e. Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。