Method Article
Функциональные нейровизуализации с использованием ультразвуковых Гематоэнцефалический Разрушение барьеров и марганца-МРТ
В этой статье
Резюме
Описана методика для широкого открытия гематоэнцефалического барьера у мышей использованием микропузырьков и ультразвука. Используя эту технику, марганца могут быть введены в мозг мыши. Поскольку марганец МРТ контрастом, который накапливается в деполяризованной нейронов, этот подход позволяет визуализации нейронной активности.
Аннотация
Хотя мышей являются доминирующими модельной системой для изучения генетических и молекулярных основ неврологии, функциональной нейровизуализации у мышей остается технически сложным. Один подход, активация Индуцированные Марганец-МРТ (AIM МРТ), успешно используется для отображения нейронной активности у грызунов 1-5. В AIM МРТ, Mn 2 + действует кальция аналоговых и накапливается в деполяризованной нейронов 6,7. Потому что Mn 2 + сокращает T 1 тканей собственности, регионы повышенной активности нейронов повысят в МРТ. Кроме того, Mn 2 + очищает медленно активированных регионах, поэтому стимуляция может осуществляться за пределами магнита до изображения, что обеспечивает повышенную гибкость экспериментальной. Однако, поскольку Mn 2 + с готовностью не пересекает гематоэнцефалический барьер (ГЭБ), необходимо, чтобы открыть BBB ограничил использование AIM МРТ, особенно у мышей.
Одним из инструментов для открытия BBB является ииrasound. Хотя потенциально опасных, если ультразвук применяют в сочетании с газовых микропузырьков (например, агенты ультразвукового контраста), звуковое давление, необходимое для открытия BBB значительно ниже. Такое сочетание ультразвука и микропузырьков может быть использован для надежного открытия BBB, не вызывая повреждения тканей 8-11.
Здесь представлен метод для выполнения AIM МРТ с использованием микропузырьков и ультразвука, чтобы открыть BBB. После внутривенного введения микропузырьков perflutren, сфокусировано импульсного ультразвукового луча наносится на бритые головы мыши в течение 3 минут. Для простоты мы называем эту технику Открытие BBB с микропузырьков и ультразвука BOMUS 12. Использование BOMUS открыть BBB протяжении обоих полушарий головного мозга, марганца вводят весь мозг мыши. После экспериментальной стимуляции слегка седативные мышей, AIM МРТ используется для отображения нейронов ответ.
Кпродемонстрировать этот подход, в этом BOMUS и AIM МРТ используется для отображения одностороннем механическое раздражение вибриссы в легкие седативные мышей 13. Потому что BOMUS может открыть BBB всей обоих полушариях, нестимулированных часть мозга используется для контроля за неспецифической стимуляции фона. Полученные 3D-карта активации хорошо согласуется с опубликованными представления вибрисс регионов баррель поле коры 14. Ультразвуковой открытие BBB быстрый, неинвазивный, и обратимым, и, следовательно, этот подход подходит для высокой пропускной способности и / или продольных исследованиях у бодрствующих мышей.
протокол
1. Собрать и калибровку Ультразвуковая система
- Ультразвуковая система начинается с одного элемента ультразвуковой датчик с диаметром достаточно широким, чтобы охватывать мозг мыши и центральную частоту в диапазоне от 2 МГц. Преобразователь управляется 50 дБ, усилитель мощности, который соединен с генератором сигналов, что дает последовательность ультразвукового импульса.
- Для калибровки звукового давления ультразвуковых систем, с помощью гидрофона связать приложенного напряжения к полученному акустического давления. Поместите датчик в резервуар для воды на гидрофон. Применение простой импульс (например, 10-цикл синусоиды с частотой датчика импульсов с частотой 10 Гц) для преобразователя. Использование 3-х осевой стадии перевода, чтобы найти максимальную чувствительность, которая должна быть в центре ультразвукового пучка на природный очаг преобразователя (около 60 мм для наших 13 мм в диаметре 2,15 датчик МГц).
- Сделайте несколько измерений в зазвониле входного напряжения (например, 50-400 мВ пик-пик) для проверки линейности системы. Используйте простой линейной регрессии для оценки взаимосвязи между входным напряжением и звукового давления. В нашей системе, входное напряжение 258 и 167 мВ стр. соответствует пик отрицательного давления акустических 0,52 и 0,36 МПа.
- Программа генератора сигналов для получения последовательности ультразвукового импульса, состоящая из всплесков синусоидальных импульсов на преобразователь частоты с 50000 циклов за взрыв и взрыв периодом 64 мс. На основе калибровочных измерений, установить амплитуда импульса для создания отрицательного пика акустического давления 0,36 МПа в центре природного очага преобразователя.
2. Подготовка реагентов
- Растворите Марганец тетрагидрата хлорид (MnCl 2 · 4H 2 O) в стерильной воде в концентрации 100 мМ (300 мОсм) и фильтр стерилизуют.
- Продукция липидный perflutren микросфер "activatinг "флакона в поставляемых производителем мешалкой в течение 45 сек. За день эксперимента, один флакон может быть активирована один раз в начале дня и использовать без реактивации до конца дня.
- Непосредственно перед микросфер администрации агитировать флаконе вручную в течение 1 мин для ресуспендирования микросфер. При снятии микропузырьков из флакона, не вводить воздуха в помещении во флакон, так как это ухудшает оставшихся микропузырьков. Оставьте флакон, пока последний использование день, а потом хранить его в холодильнике. Поддержкой таким образом, один флакон может длиться несколько дней. Повторное включение хранится флакон в агитатора, до первого использования в последующие дни.
3. Подготовка животных
- Обезболивания животных ИФ, с которым выступил носового конуса. Аппарат носового конуса должны быть разработаны, чтобы исправить голову животного точно и надежно в таком же положении каждый раз. Наше устройство 15 поддерживает голову в гое "череп плоский" позиции (то есть спинной поверхности черепа горизонтальный), используемые в Paxinos мозга Атлас 16. Титруйте анестезии для поддержания дыхания от 85 до 125 вдохов в минуту. Поддержание температуры тела использованием лампы тепло или выдувного воздуха. Защитите глаза смазки.
- Удаление волос с головы мыши с помощью электрического триммера.
- Поместите хвостовую вену катетер и внутрибрюшинно (IP) катетер. Для выживания исследования, не забудьте использовать соответствующие стерильных; IP катетера продемонстрировала в клипе на эту статью подходит только для выживания без экспериментов.
- Сделать дополнительные препараты, необходимые для нейронов эксперименте стимуляция. Для отображения вибрисс стимуляции коры ствол поля, используйте рассечения микроскопа и микрохирургической ножницы, чтобы вырезать вибриссы как можно ближе к поверхности кожи, не раздражая фолликулы и кожу вокруг.
- Место ультразвукового геля наволосистой части головы, а затем нижние толщи воды содержится тонкий лист пластика (например, 7,6 мкм мусорное ведро вкладыш) на голове. Достигнуть через толщу воды с ватным тампоном наконечником, чтобы вытеснить пузырьки воздуха, которые пойманы в ловушку в ультразвуковой гель. Расположите ультразвуковой датчик на природный фокусное расстояние (58 мм) непосредственно на мозг мыши в колонке воды и протрите датчик с пальцем для удаления пузырьков воздуха.
4. Гематоэнцефалический барьер открытия с микропузырьков и ультразвука (BOMUS)
- Дайте внутрибрюшинного введения раствором марганцовки в дозе 0,5 ммоль / кг IP. Закройте внутрибрюшинного катетера, так что марганец не вытечет, и подождите 10 минут, чтобы позволить ему распространять (рис. 1).
- Чтобы открыть BBB, управлять 30 мкл perflutren липидные микросферы (активированный DEFINITY) через хвост катетер вены, и одновременно инициировать последовательность ультразвукового импульса. Cозвучивание оказанию в течение 3 минут.
5. Стимуляция нейронов
- Позвольте около 40 минут для мозгового уровня Mn 2 + для стабилизации перед началом стимуляции нейронов. Таким образом, резкое повышение базовой из-за Mn 2 + диффузии через ГЭБ можно отличить от тонкого повышение дифференциальной за счет стимуляции. Затем начинается стимуляция с помощью парадигмы выбора (рис. 1).
- Для стимуляции вибриссы, выключить и удалить ИФ носовой конус. Переместите кисть мягкую художника вручную круговыми движениями (1-5 Гц) с помощью вибрисс массива на расстоянии примерно 2-5 мм от кожи. Продолжайте стимуляцию в течение 90 мин. Марганца оказывает седативное действие, которое позволяет безудержное возбуждение животного. Если животное становится беспокойным, управлять 5% ИФ через носовой конус примерно на 15 секунд.
6. MagnetiС-резонансная томография
- После стимуляции, резюме анестезией через носовой конус. Продолжить поддержания температуры тела и титрования ИФ уровне частота дыхания от 85 до 125 вдохов в минуту.
- Наведите в катушке изображения MR и передать МРТ системы. Получить высокое разрешение 3D-Т 1-взвешенной МРТ. Например, можно использовать 3D испорченный градиент напомнил эхо (SPGR) последовательность со следующими параметрами: время повторения 25 мс; эхо время отклика 2 мс; флип углом 30 градусов, пропускная способность 15,63 кГц, поле зрения 20 × 20 × 12 мм, матрица 128 × 128 × 60.
7. Image Analysis
- Анализ изображений является специфичным для стимуляции парадигма используется. Для стимуляции вибрисс эксперимента (рис. 2), импортировать изображения из нескольких животных в благоприятных условиях анализа. Если некоторые животные были стимулированы на правом, а другие были стимулированы на левом, этф некоторые так, что все изображения эффективно "левой стимулировали". Затем, чтобы сравнить стимулировали стороны каждого мозг его контралатеральной нестимулированных стороны, создать дублируется и отражается левой нестимулированных набор изображений создается. Регистрация всех изображений в единое пространство, а затем сгладить их с 3 × 3 × 3 пикселя ядро Гаусса.
- Экспорт данных в среде математического анализа, такие как MATLAB. При желании скрыть не имеет значения анатомии в наборах данных. Интенсивность, нормализации изображений методом итераций в Venot соавт. 17,18.
- Использование парных, один хвост т тест для сравнения каждого воксела вынужденного стороны каждого мозга к соответствующим контралатеральной вокселей на нестимулированных стороны каждого мозга.
- Отображение результирующего значения р-карта для идентификации регионов дифференциальной активности (рис. 3).
8. Представитель Результаты
Метод, представленные здесь есть два фонда amental шага: (1) с BBB Открытие микропузырьков и ультразвуковые (BOMUS) и (2) Активация Индуцированные Марганец-МРТ (AIM МРТ). Потому что последний шаг зависит от первого, очень важно проверить успешное BOMUS реализации.
Нарушение гематоэнцефалический барьер после введения T 1-сокращение контрастного вещества (например, марганца или гадолиния на основе агента) приводит к увеличению сигнала в паренхиму мозга на Т1-взвешенных изображений по сравнению с мозгом, в котором BOMUS не была выполнена (рис. 4). Распределение этой марганца повышение не является полностью однородным, хотя это достаточно последовательно между животными. Распределение отражает не только неоднородности в открытии BBB, а также внутреннюю неравномерным распределением марганца в головном мозге 19. Пространственной и временной динамике открытия BBB были подробно описаны ранее 12.
ENT "> После BOMUS была успешно реализована, следующим шагом является проведение МРТ AIM многих экспериментальных парадигм, возможно,.. однако, потому что есть много смешивает потенциал, контроля и анализа должны быть тщательно разработаны Смешанные эффекты включают в себя неоднородные открытия BBB, неоднородное накопление марганца в головном мозге, временная динамика диффузии Mn, и неспецифическую активность нейронов. В этой демонстрации, нейронные ответ на одностороннее раздражение вибриссы были нанесены на карту. Для учета неоднородности и Mn потока, нестимулированных стороне каждой мозга был использован в качестве внутреннего контроля. Для учета неспецифической активности нейронов, которые могут варьироваться от животных, анализа использовались статистические тестирования для выявления областей, которые были последовательно различные среди животных (рис. 2). результаты трехмерной карте и разница трехмерном р-значение карты (рис. 3), в правой части которого указано регионахвысшего сигнал контралатеральной к вынужденному вибриссы. В левой части карты указано, какие регионы были значительно выше, сигнал ипсилатерального в вынужденном вибриссы. Р-значение карте определил широкую область повышенного сигнала контралатеральной к вынужденному вибриссы, которые соответствовали баррель области первичной сенсорной коры, которой ответ на стимуляцию вибриссы были хорошо документированы по электрофизиологии 20,21 и 2-дезоксиглюкозы исследований. Более полное описание этих результатов было опубликовано ранее 13.
Рисунок 1. Протокол сроки функциональной нейровизуализации с BOMUS и AIM МРТ (адаптировано из Howles соавт. 13).
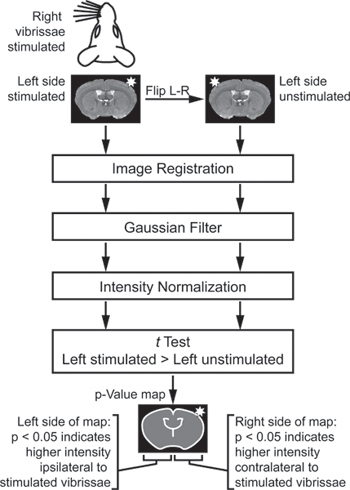
Рисунок 2. Анализ схемы для идентификации регионов ое различной интенсивности между стимулировало и стимулированных стороны каждого мозга. Для сравнения стимулировали стороны каждого мозг его контралатеральной нестимулированных стороны, дублируется и отражается левой нестимулированных набор изображений создается. Эти изображения являются зарегистрированными, фильтруют и нормализовался. Наконец, в тесте сравниваются левой стимулировали и левой нестимулированных изображений. Тест Т "в паре", чтобы стимулировать стороны каждого мозг только по сравнению с нестимулированных стороны одного и того же мозга. Тест Т "один хвост", так что с одной стороны р-карта указывает значение значительно выше сигнала на стимулировало часть мозга, а с другой стороны р-карта указывает значение значительно выше сигнала на нестимулированных стороны мозга (адаптировано из Howles соавт. 13).
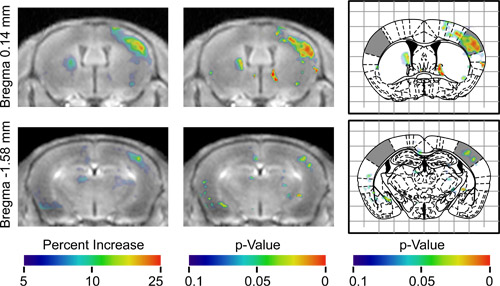
Рисунок 3. Результаты объединенного анализа 7 животных в двух различных аксиальных положениях. Т Он первый столбец показывает среднее всех зарегистрированных выравнивание изображений, так что фактически все мыши были левые вибрисс стимулируется. Эти изображения накладываются с цветной карты с указанием средней процентное увеличение сигнала на каждый вокселей по отношению к противоположной полушария, как указано в цвет панели. Цветные области на правой стороне изображения показывают, где полушария контралатеральной стимуляции имели более высокий сигнал. Цветные области на левой стороне изображение показывают, где полушария ипсилатеральной стимуляции имели более высокий сигнал. Второй столбец показывает то же самое изображение накладывается с р-значение карты с указанием статистической значимости увеличения сигнала. Третья колонка показывает тот же р-значение карта накладывается на соответствующие цифры от Paxinos стереотаксической атлас 16 с барреля поля сенсорной коры тени (адаптировано из Howles соавт. 13).
/ 4055/4055fig4.jpg "/>
Рисунок 4. Пространственное распределение Mn 2 + в мозге. Изображения были получены 170 мин после 0,5 ммоль / кг IP MnCl 2 из BOMUS обращению (п = 5) и контрольную (п = 4) мышей. После нормализации, среднее значение и стандартное отклонение карты были рассчитаны (левая панель). Повышение было больше в BOMUS обработанных мышей. Хотя это увеличение не было равномерным по всему мозгу, это был довольно последовательным, за исключением области вблизи края мозга и желудочков. Использование областей интереса (трансформирования) обращается вокруг различных структур, средняя SNR (+1 SD) был рассчитан по каждой группе (правая панель). BOMUS обработанных животных показали больше SNR, но и большая разница между структурами и между животными (адаптировано из Howles соавт. 13).
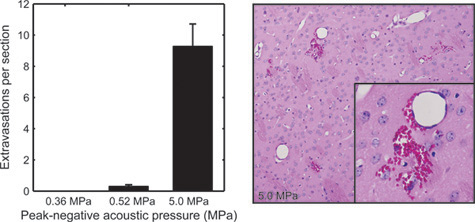
Рисунок 5. Для изучения тканей эффекты BOMUS, мозги от BOMUS обработанных мышей были зафиксированы, SEctioned на 500 - мкм промежутки времени, и окрашивали гематоксилином и эозином. Среднее количество эритроцитов кровоизлияний видел в каждом из разделов головного мозга показана для акустического давления 0,36 МПа (п = 3), 0,52 МПа (п = 4) и 5,0 МПа (п = 1). Ошибка бары показывают стандартную ошибку. Вторая панель показывает пример тяжелые красные клетки крови кровоизлияние в мозг подвергается до 5,0 МПа (адаптировано из Howles соавт. 12).
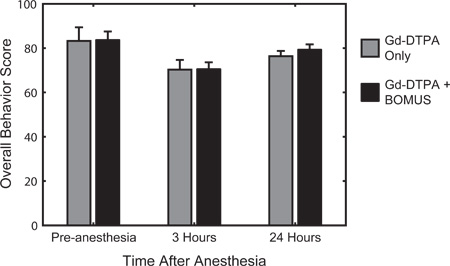
Рисунок 6. Количественные поведенческого тестирования была использована для оценки деятельности, возбуждение, и отзывчивость перед наркозом, 3 и 24 часов после восстановления от анестезии. Балльная система, описанная ранее 12, был основан на устоявшихся количественных мыши поведенческой оценки разработкиред Ирвином в 1968 году 22. Средняя поведения (± SEM) для управления счетом (п = 3) и BOMUS (0,36 МПа) лечение (n = 8) животных показали. По сравнению с предварительной анестезии базовой, все животные показывают снижение в поведении счетом через 3 часа после наркоза, но они в значительной степени восстановить на следующий день. В каждый момент времени, не видели разницы между этими двумя группами, что указывает на BOMUS не заметно влиять на поведение животных (адаптировано из Howles соавт. 12).
Обсуждение
Здесь был предложен метод для неинвазивного открытия BBB всей мозг мыши с помощью ультразвука и микропузырьков (BOMUS). С BBB открытым, Mn 2 + вводили и активации вызванные марганцем МРТ (AIM МРТ) был использован для изображений нейронов ответ на кратковременное возбуждение в легкие седативные мышей.
Адекватная открытия BBB была достигнута с пика негативный звуковое давление 0,36 МПа. Обратите внимание, это давление на поверхность кожи головы в центре ультразвукового луча. Измерения профиля пучка из одного элемента датчика показывают, что звуковое давление в пучке края составляет лишь около 0,12 МПа. Впоследствии, затухание через череп снижает давление, поступающая в мозг примерно на 25% (ухудшение на основе Choi и соавт. 23 и с учетом частоты). Это означает, что BBB нарушение произошло в пик-отрицательной акустической давление 0,09 МПа (в центре нашего луч) До 0,03 МПа (на границе). Это давление ниже, чем уровни (как правило, от 0,4 до 0,5 МПа) в других источниках 24. Это привело к снижению порога давления может быть связано с более высокой дозой липидного микропузырьков, используемые в этой работе (около 1,2 мл / кг) по сравнению с другими. В то время как доза микропузырьков использовал выше рекомендуемой дозы для человека диагностические (10 мкл / кг), негативных последствий не наблюдалось.
Как указано здесь, BOMUS техника неинвазивных и обратимым, однако она имеет потенциал, чтобы нанести ущерб. В предыдущей работе 12 мышей, получавших BOMUS были оценены для гистологического повреждения (рис. 5) и поведенческие изменения (рис. 6). Пик отрицательного давления акустических 0,36 МПа были связаны с не наблюдается отрицательный эффект (рис. 6). Тем не менее, 0,52 МПа-BOMUS было связано с небольшим количеством красного внутримозговых кровоизлияний клеток крови в подмножество животных ( Рисунок 5), и некоторые животные не восстановиться полностью после процедуры. Мы рекомендуем, чтобы звуковое давление, которое не вызывает кровоизлияние должны использоваться для AIM МРТ эксперименты.
Подобно тому, как BOMUS техника потенциально опасные, марганца также известный токсичности 25. Mn 2 +, как известно, оказывают токсическое воздействие на нервно-мышечном соединении 26 и нервной системы 27. Это токсичность, скорее всего, ответственен за сонливость мышей после введения, хотя механизм этого эффекта неизвестен. В течение примерно первых 60 минут стимуляции, мышь остается несколько сонный, но все еще реагируют на болевые стимулы, такие как ноги шнура. Это позволяет мыши терпеть стимуляцию без физического воздействия. По нашему опыту, это сонливость достаточно около 60 минут, после чего животное может стать беспокойным. Дополнительные ограничения могут быть химическиеchieved по мере необходимости с 15 секунд на 5% через ИФ головная часть. В этой демонстрации, сонливость способствовало стимуляции вибриссы, однако она также может быть уменьшен ответ нейронов в стволе мозга.
Помимо того, что управляющий Mn 2 +, BOMUS методика может быть использована для глобального управления других диагностических или терапевтических агентов. В предыдущих работ, BOMUS был использован для управления Gd-DTPA, МРТ контрастного вещества, в мозг 12. Тем не менее, остается много вопросов о природе проницаемость ГЭБ достигается BOMUS. Во-первых, не ясно, какой размер средств могут пересекать BBB после BOMUS. И Mn 2 + и Б-DTPA (500 Da) достаточно малых молекул. Во-вторых, не ясно, сколько проницаемость ГЭБ изменяется в головном мозге. В-третьих, не ясно, будет ли открытие BBB является относительно двоичного эффекта, или если некоторые параметры открытия могут повлиять на размер и скорость материалпроникновение. Хотя Б-DTPA распределены довольно равномерно через мозг в предыдущем исследовании, возможно, были слишком малы и диффундирующие выявить любые различия в проницаемости.
Несмотря на эти неопределенности в отношении BOMUS, этот метод является эффективным для быстрого управляющий Mn 2 + для AIM-МРТ. AIM-МРТ используется в мыши для отображения нейронов ответ на долгосрочные (1-2 дня) стимуляции у мышей, 28-30, но с этим новым подходом, краткосрочные эксперименты стимуляции теперь это возможно. Ранее, быстрое администрации Mn 2 + было возможно только с осмотическим нарушение BBB использованием intracarotid вливание гипертонического маннит. Этот подход был единственным практическим у крыс и более крупных моделей животных, но даже у крыс, эти исследования были ограничены инвазивность и односторонность этого метода. Потому что BOMUS могут быть выполнены неинвазивно, проснулся и стимулирование долгосрочных исследований должно быть возможным. Кроме того, Becaиспользовать Mn 2 + могут быть введены в обоих полушарий головного мозга, широкий спектр стимуляции парадигмы возможно. В приведенном выше демонстрации, двусторонние администрации Mn 2 + позволило нестимулированных полушарии в качестве внутреннего контроля, так что нейронные реакции на неспецифические фоне стимуляции может быть отделена от ответа на односторонней стимуляции вибриссы.
В дополнение к контролю за неспецифическую фоне стимуляции, нестимулированных полушарии также была использована для контроля однородности и последовательности марганца администрации. Как видно из других марганца МРТ эксперименты 19, распределение данных (рис. 4) показывают, что BOMUS техника не обеспечивает однородное повышение мозга. Таким образом, без надлежащего контроля (контрольных животных или нестимулированных полушарии), регионы с более высокой базовой повышение трудно отличить от регионов, элементовактивированных сигнала из-за активности нейронов.
Хотя базовые Mn 2 + повышение не является однородным, картина достаточно последовательно между людьми. Тем не менее, незначительные изменения в базовый повышение может скрыть AIM-МРТ сигнала. В нашем примере мы рассмотрели эту потенциальную проблему путем усреднения AIM-МРТ сигнала в течение нескольких животных. Кроме того, различия в исходных повышение может быть объяснено за счет приобретения предварительной стимуляции изображений.
Метод, представленные здесь требует значительных статистический анализ изображений, которые, в свою очередь, требует высокой точности регистрации изображений. Конечно, такая регистрация имеет смысл только в том случае, если исходные данные, полученные с разрешением (во всех трех измерениях), достаточно тонкие, чем структуры интересов. В этой демонстрации 3D-изображения были получены с почти изотропным вокселей около 160 мкм в каждом направлении, что позволило за отличнуюанатомических регистрации. Тем не менее, образ регистрации может ограничить пространственное разрешение этого метода, небольшой misregistration мог среднем из очень малых областей улучшения. Мозжечок и обонятельные луковицы может быть особенно трудно зарегистрировать, потому что у них мелко слоистой улучшение и часто из соответствия головного мозга.
Здесь мы представили метод для отображения нейронов ответ на кратковременные стимулы бодрствования мышей. Хотя это и не простой, метод относительно практической и доступной. Это детальное обсуждение ограничений и тонкости, будем надеяться, позволит читателю применить технику для своих экспериментальных вопросов.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Все работы были выполнены на герцога центра в Vivo микроскопии, NIH / NIBIB национальных биомедицинских технологий ресурсный центр (P41 EB015897) и NCI мелких животных изображений ресурсов программы (U24 CA092656). Дополнительная поддержка была оказана из NSF Высшее исследовательский грант (2003014921).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Гидрофон | Сонора Medical Systems, Лонгмонт, CA | SN-251 S4 | |
| Перевод этап | Newport Corporation, Irvine, CA | ||
| Ультразвуковой датчик | Olympus NDT, Inc, Waltham MA | A306S-SU | Обзор тест лист производителя, который сопровождает датчик, чтобы найти точную частоту центра данного датчика, которая может отличаться от номинальной частоты, перечисленные в каталоге. (Например, номинальная частота наших датчик 2,25 МГц, но фактическая частота центр был 2.15 МГц). |
| Vevo изображений станции | VisualSonics, Inc Торонто, Канада | ; | |
| 50 дБ, мощность усилителя | E & I, Rochester, NY | Модель 240L | |
| Генератор сигналов | Agilent Technologies, Санта-Клара, Калифорния | модель 33220A | |
| MnCl 2 - (H2O) 4 | Сигма | Молекулярный вес зависит от партии, назвать производителем для точного измерения | |
| Perflutren липидные микросферы | Lantheus Medical Imaging, Н. Billerica, MA | DEFINITY | |
| Микросферы агитатор | Lantheus Medical Imaging, Н. Billerica, MA | VIALMIX | |
| МРТ катушку | m2m изображений корпорации, Hillcrest, OH | 35 мм диаметр квадратурной приема / передачи объема катушки | |
| МРТ системы | GE Healthcare, Milwaukeе, WI | GE EXCITE консоли операционной 7-T горизонтального отверстия магнита | |
| Среда анализа изображений | Visage Imaging, Сан-Диего, Калифорния, MathWorks, Натик MA | Амира MATLAB |
Ссылки
- Aoki, I. Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI. Magnet. Reson. Med. 50, 7-12 (2003).
- Aoki, I. Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging. DAIM MRI). Magnet. Reson. Med. 48, 927-933 (2002).
- Duong, T. Q., Silva, A. C., Lee, S. P., Kim, S. G. Functional MRI of calcium-dependent synaptic activity: Cross correlation with CBF and BOLD measurements. Magnet. Reson. Med. 43, 383-392 (2000).
- Lin, Y. J., Koretsky, A. P. Manganese ion enhances T-1-weighted MRI during brain activation: An approach to direct imaging of brain function. Magnet. Reson. Med. 38, 378-388 (1997).
- Lu, H. B. Cocaine-induced brain activation detected by dynamic manganese-enhanced magnetic resonance imaging (MEMRI). P. Natl. Acad. Sci. U.S.A. 104, 2489-2494 (2007).
- Drapeau, P., Nachshen, D. A. Manganese fluxes and manganese-dependent neurotransmitter release in presynaptic nerve-endings isolated from rat-brain. J. Physiol-London. 348, 493-510 (1984).
- Narita, K., Kawasaki, F., Kita, H. Mn and Mg influxes through Ca channels of motor-nerve Terminals are prevented by verapamil in Frogs. Brain Res. 510, 289-295 (1990).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-644 (2001).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med. Biol. 30, 979-989 (2004).
- McDannold, N., Vykhodtseva, N., Raymond, S., Jolesz, F. A., Hynynen, K. MRI-guided targeted blood-brain barrier disruption with focused ultrasound: Histological findings in rabbits. Ultrasound Med. Biol. 31, 1527-1537 (2005).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Howles, G. P. Contrast-enhanced in vivo magnetic resonance microscopy of the mouse brain enabled by noninvasive opening of the blood-brain barrier with ultrasound. Magnet. Reson. Med. 64, 995-1004 (2010).
- Howles, G. P., Qi, Y., Johnson, G. A. Ultrasonic disruption of the blood-brain barrier enables in vivo functional mapping of the mouse barrel field cortex with manganese-enhanced MRI. Neuroimage. 50, 1464-1471 (2010).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of sml face cortex with special reference to occurrence of barrels in layer-4. J. Comp. Neurol. 164, 79-94 (1975).
- Howles, G. P., Nouls, J. C., Qi, Y., Johnson, G. A. Rapid production of specialized animal handling devices using computer-aided design and solid freeform fabrication. J. Magnet. Reson. Imag. 30, 466-471 (2009).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2001).
- Cross, D. J. Statistical mapping of functional olfactory connections of the rat brain in vivo. Neuroimage. 23, 1326-1335 (2004).
- Venot, A., Lebruchec, J. F., Golmard, J. L., Roucayrol, J. C. An automated-method for the normalization of scintigraphic images. J. Nucl. Med. 24, 529-531 (1983).
- Aoki, I., Naruse, S., Tanaka, C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia. Nmr. Biomed. 17, 569-580 (2004).
- Welker, E., Vanderloos, H. Quantitative correlation between barrel-field size and the sensory innervation of the whiskerpad - a comparative-study in 6 strains of mice bred for different patterns of mystacial vibrissae. J. Neurosci. 6, 3355-3373 (1986).
- McCasland, J. S., Woolsey, T. A. High-resolution 2-deoxyglucose mapping of functional cortical columns in mouse barrel cortex. J. Comp. Neurol. 278, 555-569 (1988).
- Irwin, S. Comprehensive observational assessment : A systematic quantitative procedure for assessing behavioral and physiologic state of mouse. Psychopharmacologia. 13, 222-257 (1968).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound Med. Biol. 33, 95-104 (2007).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Use of ultrasound pulses combined with definity for targeted blood-brain barrier disruption: A feasibility study. Ultrasound Med. Biol. 33, 584-590 (2007).
- Silva, A. C., Lee, J. H., Aoki, L., Koretsky, A. R. Manganese-enhanced magnetic resonance imaging (MEMRI): methodological and practical considerations. Nmr. Biomed. 17, 532-543 (2004).
- Meiri, U., Rahamimoff, R. Neuromuscular transmission - inhibition by manganese ions. Science. 176, 308 (1972).
- Aschner, M., Guilarte, T. R., Schneider, J. S., Zheng, W. Manganese: Recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharm. 221, 131-147 (2007).
- Watanabe, T., Frahm, J., Michaelis, T. Manganese-enhanced MRI of the mouse auditory pathway. Magnet. Reson. Med. 60, 210-212 (2008).
- Yu, X., Wadghiri, Y. Z., Sanes, D. H., Turnbull, D. H. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat. Neurosci. 8, 961-968 (2005).
- Yu, X. Statistical mapping of sound-evoked activity in the mouse auditory midbrain using Mn-enhanced MRI. Neuroimage. 39, 223-230 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены