Method Article
超音波血液脳関門の破壊とマンガン増強MRIを用いた脳機能イメージングの試み
要約
技術が広くマイクロバブルと超音波を用いたマウスにおける血液脳関門を開くために記述されています。このテクニックを使用して、マンガンは、マウスの脳に投与することができる。マンガンは脱分極の神経細胞に蓄積するMRI造影剤であるため、このアプローチは、神経活動のイメージングを可能にします。
要約
マウスは、神経科学の遺伝的および分子基盤を研究するための支配的なモデルシステムであるが、マウスの脳機能イメージングの試みは、技術的に困難なままである。一つのアプローチは、活性化誘導マンガン増強MRI(AIM MRI)は、げっ歯類1-5の神経活動をマッピングするために首尾よく使用されています。 AIM MRIは、Mn 2 +カルシウムアナログを動作し、脱分極性ニューロン6,7に蓄積されます。のMn 2 + T 1組織のプロパティを短縮するため、高架神経活動の領域は、MRIで強化します。また、Mnは2 +活性化地域から徐々にクリアされますので、刺激はより実験的な柔軟性を可能にし、前の画像への磁石の外で実行することができます。しかし、のMn 2 +は容易に血液脳関門(BBB)を通過しないため、BBBを開く必要は、特にマウスでは、AIM MRIの使用を制限している。
BBBを開くための一つのツールは、ULTですrasound。潜在的に有害なのに超音波は、ガスを充填したマイクロバブル(すなわち、超音波造影剤)と組み合わせて投与される場合は、BBBの開口部に必要な音圧はかなり低くなっています。超音波とマイクロバブルのこの組み合わせは、確実に組織の損傷8-11を引き起こすことなく、BBBを開くために使用することができます。
ここでは、このメソッドは、BBBを開くには、マイクロバブルと超音波を用いてMRI AIMを実行するために提示されます。 perflutrenマイクロバブルの静脈注射した後、やり場のパルス超音波ビームは、3分間剃らマウスの頭部に適用されます。簡単にするために、我々はBOMUS 12としてマイクロバブルと超音波でBBBオープニングのこのテクニックを参照してください。両方の大脳半球全体にBBBを開くためにBOMUSを使用して、マンガンは全体のマウス脳に投与されています。軽く鎮静したマウスの実験的な刺激の後、AIM MRIは神経細胞の応答をマッピングするために使用されています。
へこのアプローチを実証する、ここにBOMUSとAIM MRIは13軽く鎮静マウスの鼻毛の一方的な機械的刺激をマップするために使用されます。 BOMUSは、両半球全体にBBBを開くことができますので、脳の刺激を受けていない側は、非特異的なバックグラウンドの刺激をコントロールするために使用されます。その結果の3Dのアクティベーションマップはバレルフィールド皮質14の鼻毛地域の公開の表現とよく一致している。 BBBの超音波開口部は、高速の非侵襲的、かつ可逆的であり、したがって、このアプローチは覚醒マウスにおける高スループットおよび/または長期的な研究に適しています。
プロトコル
1。超音波システムを組み立て、キャリブレーション
- 超音波システムは、2 MHzの範囲内でマウスの脳と中心周波数をカバーするのに十分な直径を持つ単一要素の超音波トランスデューサから始まります。トランスデューサは、超音波パルスシーケンスを生成する信号発生器に接続されて50 dBのパワー·アンプによって駆動されます。
- 超音波システムの音圧を校正するために、得られる音圧に印加する電圧を関連付けるためにハイドロフォンを使用しています。ハイドロ上の水タンクにトランスデューサを配置します。トランスデューサーに簡単なパルス(例えば、10 Hzのパルス繰り返し周波数を持つ振動子の周波数で10サイクルの正弦波)を適用します。トランスデューサーの自然なフォーカス(私たちの13ミリメートルの直径2.15 MHzのトランスデューサの約60 mm)で超音波ビームの中心であるべきであるピーク応答を検出するために3軸移動ステージを使用しています。
- 鳴っていくつかの測定を行うシステムの直線性を確認するには、入力電圧の電子(例えば、50から400 mV ppで)。入力電圧と音圧との関係を推定するために、単純な線形回帰を使用しています。本システムでは、258および167 mV ppでの入力電圧は0.52と0.36 MPaのピーク負音圧に相当する。
- プログラム信号発生器を5万バーストごとのサイクルと64 msのバースト周期を持つトランスデューサの周波数の正弦波パルスのバーストで構成される超音波パルスシーケンスを生成する。キャリブレーション測定に基づいて、振動子の自然な焦点の中心に0.36 MPaのピーク負音圧を生成するためにパルス振幅を設定します。
2。試薬を準備します。
- 100mMの(300浸透圧)とフィルター滅菌の濃度で滅菌水に塩化マンガン四水和物(MnCl 2をは ·4H 2 O)を溶解する。
- activatin "でperflutren脂質微小球を製造するg "は45秒の製造元が提供するアジテーターのバイアル。実験の日、シングルバイアルは一日の開始時に1回活性化し、その日の残りの再活性化することなく使用することができます。
- マイクロスフェア投与直前に、マイクロスフェアを再懸濁するために1分間手でバイアルを振とうする。これは残りのマイクロバブルを低下させるとして、バイアルからマイクロバブルを引き出すときには、バイアル中に室内の空気を注入しないでください。一日の最後の使用まで、バイアルを除外し、冷蔵庫に保管してください。この方法で維持され、単一バイアルは数日間続くことができます。前に、後続の日に最初に使用する、アジテーターに格納されたバイアルを再起動します。
3。動物の準備
- ノーズコーンが提供する、イソフルランで動物を麻酔。ノーズコーン装置は、同じ位置に正確かつ確実にするたびに、動物の頭を修正するために設計する必要があります。私たちの装置15は、番目に頭を維持する電子Paxinos脳アトラス16で使用される"頭蓋骨フラット"の位置(すなわち、背側頭蓋骨表面が水平である)。 85と125呼吸毎分の間に呼吸を維持するために麻酔を滴定する。ヒートランプや本格的な空気を使用して体温を維持します。潤滑剤で目を保護します。
- 電動トリマーを使って、マウス頭皮から髪を削除します。
- 尾静脈カテーテルおよび腹腔内(IP)カテーテルを配置します。生存試験は、適切な無菌操作を必ず使用して、この記事用のビデオで示したIPカテーテル留置は、非生存実験に適しています。
- 神経刺激実験に必要な追加の準備を行います。バレルフィールド皮質の鼻毛刺激のマッピングについては、刺激性の毛包や周囲の皮膚せずにできるだけ近くに皮膚表面に鼻毛をカットする解剖顕微鏡と顕微はさみを使用しています。
- の上に置き、超音波ゲル頭皮、そして頭の上に薄いプラスチックのシート(例えば、7.6μmのごみ箱ライナー)に含まれている水柱を下げます。超音波ゲルの中に閉じ込められてしまう気泡を押し出すように綿棒で水カラムでリーチスルー。直接マウス脳における水の欄に、その自然の焦点距離(58 mm)で超音波トランスデューサを配置し、任意の気泡を除去するために指の先端にトランスデューサを拭いてください。
4。マイクロバブルと超音波で開く血液脳関門(BOMUS)
- 0.5ミリモル/ kgのIPの用量でマンガン溶液の腹腔内注射を与えます。マンガンが流出し、( 図1)が配布できるようにする10分を待ちませんので、腹腔内カテーテルをキャップ。
- BBBを開くには、尾静脈カテーテルを介してperflutren脂質微小球(活性化DEFINITY)の30μLを管理し、同時に、超音波パルスシーケンスを開始します。 ℃3分間insonificationをontinue。
5。神経刺激
- のMn 2の脳のレベルの約40分かかります+神経刺激を開始する前に安定させる。この方法では、Mn 2による劇的なベースラインの強化は、BBBを越え+拡散は、刺激のために微妙な差の強化と区別することができる。次に、選択のあなたのパラダイム( 図1)で刺激を開始します。
- 鼻毛を刺激するために、イソフルランをオフにして、ノーズコーンを削除します。皮膚から約2〜5 mmの距離で鼻毛配列を介して円運動(1-5 Hz)で手動でソフトなアーティストの絵筆を移動します。 90分間刺激を続けます。マンガンは、動物の気ままな刺激を可能にする鎮静効果を持っています。動物が落ち着かなくなった場合、約15秒間ノーズコーンを介してイソフルラン5%を管理することができます。
6。マレリC共鳴イメージング
- 刺激後、ノーズコーンを介して麻酔を再開します。体温を維持し、85から125呼吸毎分の呼吸速度にイソフルランレベルを滴定を続行します。
- MRイメージングコイルおよびMRIシステムへの転送にマウスを置きます。高解像度の3D T 1加重MR画像を取得します。 、2 msのエコー時間、30度のフリップ角、15.63 kHzの帯域幅、20の視野×20×25ミリ秒の繰り返し時間:たとえば、次のパラメータを使用してエコー(SPGR)シーケンスをリコール3D甘やかされて育ったグラデーションを使用12ミリメートル、128×128×60の行列。
7。画像解析
- 画像解析は、使用される刺激のパラダイムに固有のものです。鼻毛刺激実験( 図2)については、適切な分析環境にいくつかの動物から画像をインポートします。他の人が左側に刺激されながら、いくつかの動物は、FL、右側に刺激された場合IPのすべての画像を効果的に "左刺激した。"されるように、いくつかの次に、その反対側の刺激側にそれぞれの脳の刺激側を比較するために、複製され、左刺激画像セットが作成されるミラーリングを作成します。一般的な空間にすべての画像を登録し、3×3×3画素のガウスカーネルでそれらを滑らかにします。
- MATLABなどの数学的な解析環境にデータをエクスポートします。必要に応じて、データセットに無関係な解剖学的構造をマスクします。 Venot らの反復法による画像の強度正規化します。17,18。
- 各脳の刺激を受けていない側面に対応する反対側のボクセルに各脳の刺激辺の各ボクセルを比較するペアは、単一の両側t検定を使用しています。
- 差動の活性領域( 図3)を識別するために結果のp値マップを表示します。
8。代表的な結果
ここで紹介する方法は2つのファンドを持っている amental手順:(1)BBBは、マイクロバブルと超音波(BOMUS)で開くと(2)活性化誘導マンガン増強MRI(AIM MRI)。後者のステップは、前者に依存するため、それが成功したインプリメンテーションBOMUSを確認することが重要です。
BOMUSの脳に比べてT 1強調画像で脳実質の信号増加でT 1-短縮造影剤投与後の血液脳関門の破壊(例えば、マンガンまたはガドリニウムベースのエージェントなど)の結果( 図4)実行されませんでした。それは動物間にかなり一貫しているが、このマンガン増強の分布は、完全に均一ではありません。ディストリビューションは、BBBの開口部だけでなく不均一性を反映しているだけでなく、脳内の19 Mnの本質的な不均一な分布である。 BBBの開口部の空間的および時間的なダイナミクスは、さらに以前に12に記載されている。
ENT "> BOMUSが正常に実装されていたら、次のステップは、AIMは、MRIを実行することです多くの実験パラダイムが可能である;。しかしながら、多くの潜在的な交絡があるので、コントロール、および分析を慎重に設計する必要があり交絡効果は、不均一なBBBの開口部を含む脳、Mnの拡散の時間的ダイナミクス、非特異的な神経活動中のMnの不均一な蓄積が、このデモでは、鼻毛の一方的な刺激に対する神経応答がマッピングされていました。不均一性およびMnフラックス、それぞれの脳の刺激を受けていない側面を考慮するには内部コントロールとして用いた。動物との間で異なる場合があります非特異的なニューロンの活動を考慮して、分析では、動物( 図2)の間で一貫して異なっていた領域を識別するために統計的検定を使用していました。結果は三次元差分マップとした三次元のp値マップ( 図3)、地域を示し、そのうち右側刺激鼻毛に反対高い信号である。マップの左側には、領域が刺激された鼻毛に同側の有意に高い信号を持っていたが示された。 p値のマップは、応答刺激が広範囲に電気生理学20,21と2 -デオキシグルコースの研究によって実証されている鼻毛する一次感覚野のバレルフィールドに対応した刺激鼻毛に反対側の高架信号の広範な領域を同定した。これらの結果のより完全な議論は、13以前に公開されています。
図1。BOMUSとAIM MRI(Howles らから適応13)と機能的ニューロイメージングのためのプロトコルのタイムライン。
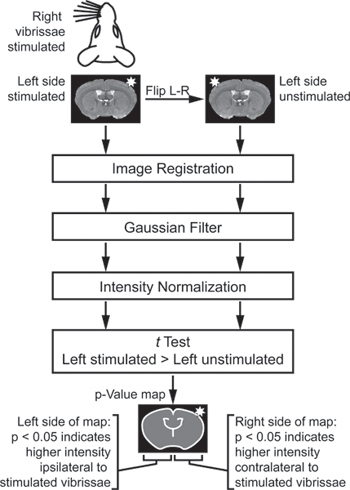
地域Oを識別するための図2。解析スキーム各脳の刺激と刺激の側面の間にfを異なる強度である。その反対側の刺激側にそれぞれの脳の刺激側を比較するには、複製され、左刺激画像セットが作成されるミラー化されます。これらの画像は、登録され、濾過し、正規化されています。最後に、テストで左の刺激と左刺激画像を比較します。各脳の刺激側は、同じ脳の刺激を受けていない側に比べてされるようにt検定は、 "ペア"されています。 t検定は、p-値マップの反対側の刺激側に有意に高い信号を示しながら、p値マップの片側には、脳の刺激側で有意に高い信号であることを示しているので、 "シングル·テイル"です。脳(Howles らから適応13)。
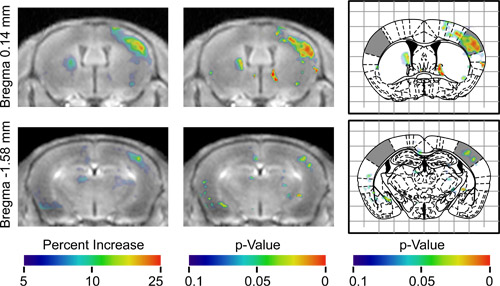
図3 2つの異なる軸方向位置で7匹のプール解析の結果。 T彼は最初の列は実質的にすべてのマウスは、その左の鼻毛は、刺激あったので、整列登録されているすべての画像の平均値を示しています。カラーバーで示されたこれらの画像は、反対側の半球に各ボクセルの相対での信号の平均パーセントの増加を示すカラーマップでオーバーレイされます。刺激対側半球が高い信号を持っていたところ、画像の右側の色の領域が表示されます。刺激に対する同側の半球が高い信号を持っていたところ、画像の左側にある色付きの領域が表示されます。番目の列は、信号の増加の統計的有意性を示すp値のマップを重ねて同じ画像を示しています。番目の列は(Howles らから適応13)影の感覚野のバレルのフィールドを持つPaxinos定位アトラス16から対応する数字の上に重ね、同じp値マップを示します。
/ 4055/4055fig4.jpg "/>
図4。+脳内のMn 2の空間分布。画像は170分BOMUS処理(n = 5)およびコントロール(n = 4)でマウスから0.5ミリモル/ kgのIP MnCl 2を後に取得されました。正規化した後、平均値と標準偏差マップは(左パネル)を算出した。拡張は、BOMUS処置マウスの方が大きかった。この拡張機能は、脳全体で一様ではなかったが、それは脳と心室のエッジ付近を除いて、かなり一貫していた。様々な構造の周りに描か関心領域(ROI)を使用して、平均SNRは(+ 1 SD)の各グループ(右パネル)を越えて算出した。 BOMUSで処置した動物は、よりSNRを示したが、また構造の間と動物の間に大きな差異(Howles らから適応13)。
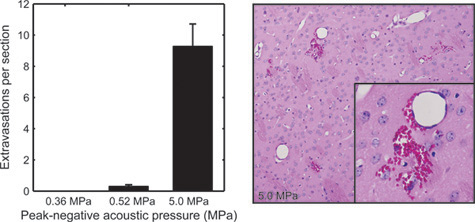
図5。BOMUSの組織の影響を調べるためには、BOMUS処置マウスからの脳は、それ自体、修正されました500℃ctioned - μmの間隔で、ヘマトキシリンおよびエオシンで染色した。脳の各セクションで見られる赤血球extravasationsの平均数が0.36メガパスカル(n = 3)で、0.52メガパスカル(n = 4)で、5.0 MPaの(n = 1)での音圧が示されています。エラーバーは標準誤差を示しています。番目のパネルは、5.0 MPaにさらされる脳から重度の赤血球の溢出(Howles らから適応12)の例を示します。
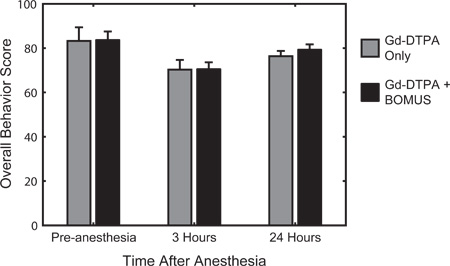
図6。定量的行動テストは、活性を評価するために使用され、覚醒し、麻酔の前に応答性、および3と麻酔からの回復24時間後。以前に12を説明したスコアリングシステムは、行動評価の開発定評のある定量的なマウスに基づいていた1968 22のアーウィンによってED。平均的な振る舞い(±SEM)制御のためのスコア(n = 3)およびBOMUS(0.36 MPa)の治療(n = 8)に動物が表示されます。事前に麻酔のベースラインを基準に、すべての動物は3時間麻酔後の動作スコアの減少を示すが、それらは主に次の日で回復します。各時点で、差はBOMUSは、適度に動物の行動(Howles らから適応12)に影響しなかったことを示す、両群間に見られなかった。
ディスカッション
ここでは、この方法は、非侵襲的に超音波とマイクロバブル(BOMUS)で全体のマウスの脳全体にBBBを開くために提示された。 BBBを開いた状態では、Mn 2 +投与し、活性化誘導マンガン増強MRIは(AIM MRI)軽く鎮静マウスにおける短時間刺激に対するイメージ神経応答に使用されていました。
十分なBBBの開口部は、0.36 MPaのピーク負音圧を実現しました。注:これは超音波ビームの中心で頭皮表面の圧力である。単一要素のトランスデューサのビームプロファイルの測定は、ビームエッジでの音圧は約0.12 MPaであることを示しています。その後、頭蓋骨を介して減衰量が約25%(23。崔らに基づいており、周波数を調整しディレーティング)が脳に到達圧力を低減します。これは、BBBの中断は、(我々のビームの中心に0.09 MPaの負のピーク音圧で発生したことを示し)0.03メガパスカル(エッジで)へ。これらの圧力は他の24の報 告レベル(通常は0.4から0.5 MPa)と比べて低くなっています。この減圧のしきい値は、他に比べて(約1.2 ml / kg)を本研究で使用した脂質マイクロバブルの高用量の原因である可能性があります。使用されるマイクロバブルの用量が推奨される診断ヒト用量(10μL/ kg)と比べて高かったが、負の影響は認められなかった。
ここで規定されているように、BOMUS技術は非侵襲的かつ可逆的であるが、それが損傷を引き起こす可能性を秘めています。前作12では、BOMUSを投与したマウスは、組織損傷( 図5)と行動の変化( 図6)について評価した。 0.36 MPaのピーク負音圧なし、観測マイナスの影響( 図6)と関連していた。しかし、0.52-MPA BOMUSは、動物のサブセットにおける脳内赤血球extravasationsの数が少ないと関連していた( 図5)、およびいくつかの動物は、プロシージャの後に完全に回復しなかった。我々は、血管外漏出を起こさない音圧がAIM MRI実験に使用することをお勧めします。
BOMUS技術は潜在的に有害であるように、マンガンはまた、毒性25よく知られています。のMn 2 +は神経筋接合部26と神経系27の毒性作用を有することが知られている。この効果のメカニズムは不明ですが、この毒性は、投与後のマウスの傾眠の可能性が高い責任があります。刺激の最初の約60分間、マウスはやや眠いが、そのようなつま先のピンチなどの痛み刺激に対する応答がまだ残ります。これは、マウスが物理的な拘束を必要とせずに刺激を容認することができます。我々の経験では、この眠気は、動物が落ち着きになるかもしれませんした後、約60分で十分です。追加の化学拘束をすることができますノーズコーンを介してイソフルラン、5%の約15秒で、必要に応じてchieved。このデモでは、傾眠は鼻毛の刺激を促進しますが、それはまた、バレル皮質の神経応答が低下している可能性があります。
単にのMn 2 +を投与することに加えて、BOMUS技術は、グローバルに他の診断または治療剤を投与するために使用することができます。前の仕事では、BOMUSは、脳へのGd-DTPA、MRI造影剤を管理するために使用されています12それにもかかわらず、多くの質問がBOMUSで達成BBBの透過性の性質について残っている。まず、サイズ剤はBOMUS後、BBBを通過することが何であるかは明確ではありません。のMn 2 +およびGd-DTPA(500 Da)の両方はかなり小さい分子である。第二に、BBBの透過性は、脳を介してどのように変化するかを非常に明確ではありません。第三に、BBBの開口部が相対的にバイナリの効果であるかどうかは明らかではない、または特定の開口部のパラメータは、材料のサイズや速度に影響を与えることができる場合浸透。のGd-DTPA上記の研究では脳を介してかなり均等に分散しても、それはあまりにも小さいと透過性の違いを明らかにするためにも拡散している可能性があります。
BOMUSに関するこれらの不確実性にもかかわらず、このメソッドはすぐにAIM-MRIの目的のためのMn 2 +を管理するための効果的である。 AIM-MRIは、マウス28から30までの長期的(1-2日)刺激に対する神経応答をマッピングするためにマウスで使用されますが、この新しいアプローチにより、短期的な刺激実験が可能になりましたされています。以前には、Mn 2の急速な投与は、+高張マンニトールのintracarotid注入を用いた浸透BBBの中断でのみ可能であった。このアプローチでは、ラットと大きな動物モデルでの唯一の実用的でしたが、さらにラットでは、これらの研究は技術の侵襲性とunilateralityによって制限されていた。 BOMUSは非侵襲的に行うことができますので、目を覚まし刺激と縦断的研究は今可能でなければなりません。さらに、becaのMn 2 +を使用し 、両方の大脳半球に投与することができる、刺激パラダイムの広い範囲が可能です。上記のデモでは、二国間管理のMn 2 +刺激半球が非特異的なバックグラウンドの刺激に対する神経応答が一方的な鼻毛刺激への応答から分離することができたので、内部統制として機能することができました。
非特異的なバックグラウンドの刺激のための制御に加えて、刺激を受けていない半球は、マンガン投与の均一性と一貫性を保つために制御するために使用されていました。他のマンガン増強MRI実験を19に見られるように、分布データ( 図4)BOMUS技術は脳の均一な増強を提供していないことを示しています。したがって、適切なコントロール(対照動物または刺激半球)を使用せずに、より高いベースラインの強化と地域は、そのELE地域と区別しにくいvated信号は、神経活動によるものである。
ベースラインのMn 2 +の拡張機能は、均質ではありませんが、パターンは、個人間でかなり一致しているのに。それにもかかわらず、この基準強化のマイナーなバリエーションがAIM-MRI信号を覆い隠すことができます。このデモでは、我々はいくつかの動物の上にAIM-MRI信号を平均化することによってこの潜在的な問題を取り上げた。また、ベースラインの強化の違いは、事前刺激画像を取得することによって会計処理される可能性があります。
ここで紹介する方法は、順番に、忠実度の高い画像の登録を必要とする実質的な統計的画像解析を必要とします。ソースデータが対象の構造に比べて十分に細かい分解能である(すべて三次元で)取得された場合、もちろん、そのような登録のみ意味があります。このデモでは、3D画像はほぼ等方性ボクセルで優れたに許可され、各ディメンション内の約160ミクロン、取得した解剖登録。それにもかかわらず、画像の登録は強化のこのメソッドは、若干のずれでし平均アウトが非常に小さな領域の空間分解能を制限することがあります。彼らは細かく階層化の強化を持っていると大脳とのずれがよくあるため、小脳と嗅球では、登録することが特に困難な場合があります。
ここでは、覚醒マウスにおける短時間刺激に対する神経応答をマッピングする方法を提案した。シンプルではありませんが、このメソッドは、比較的実用的でアクセス可能です。制限と機微のこの詳細な議論は、うまくいけば、読者は自分の実験的な質問にテクニックを適用するために有効にする必要があります。
開示事項
利害の衝突が宣言されません。
謝辞
すべての作業が生体顕微鏡でのデュークセンター、NIH / NIBIBで行われました 国家医学技術リソース·センター(P41 EB015897)およびNCI小動物イメージングリソース·プログラム(U24 CA092656)。追加のサポートは、NSF大学院研究フェローシップ(2003014921)から提供されていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ハイドロ | ソノラメディカルシステムズ、ロングモント、カリフォルニア州 | SN S4-251 | |
| 翻訳段階 | ニューポート株式会社は、カリフォルニア州アーバイン | ||
| 超音波振動子 | オリンパスNDT社、ウォルサム、MA | A306S-SU | カタログに記載されている公称周波数とは異なる場合があります、その特定のトランスデューサーの正確な中心周波数を見つけるために変換器に付属しているメーカーのテストシートを確認します。 (例えば、我々のトランスデューサの公称周波数は2.25 MHzであったが、実際の中心周波数は2.15 MHzである。) |
| VEVOイメージングステーション | VisualSonics株式会社トロント、カナダ | ; | |
| 50 dBのパワーアンプ | E&I、ニューヨーク州ロチェスター | モデル240L | |
| 信号発生器 | Agilent Technologiesは、サンタクララ、カリフォルニア州 | モデル33220A | |
| のMnCl 2 - (H2O)4 | シグマ | 分子量は、バッチによって異なり、正確な測定のために製造元にお問い合わせ | |
| Perflutren脂質マイクロスフィア | Lantheusメディカルイメージング、N.ビルリカ、MA | DEFINITY | |
| マイクロスフェアアジテーター | Lantheusメディカルイメージング、N.ビルリカ、MA | VIALMIX | |
| MRイメージングコイル | M2Mイメージング(株)、クレスト、OH | 35ミリメートル径直交は、ボリュームコイルを受信/送信 | |
| MRIシステム | GEヘルスケア、MilwaukeE、ウィスコンシン州 | 7-Tの水平ボアマグネットを操作するGE EXCITEコンソール | |
| 画像解析環境 | 顔イメージング、サンディエゴ、CA、The MathWorks社、ナティックMA | アミラMATLAB |
参考文献
- Aoki, I. Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI. Magnet. Reson. Med. 50, 7-12 (2003).
- Aoki, I. Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging. DAIM MRI). Magnet. Reson. Med. 48, 927-933 (2002).
- Duong, T. Q., Silva, A. C., Lee, S. P., Kim, S. G. Functional MRI of calcium-dependent synaptic activity: Cross correlation with CBF and BOLD measurements. Magnet. Reson. Med. 43, 383-392 (2000).
- Lin, Y. J., Koretsky, A. P. Manganese ion enhances T-1-weighted MRI during brain activation: An approach to direct imaging of brain function. Magnet. Reson. Med. 38, 378-388 (1997).
- Lu, H. B. Cocaine-induced brain activation detected by dynamic manganese-enhanced magnetic resonance imaging (MEMRI). P. Natl. Acad. Sci. U.S.A. 104, 2489-2494 (2007).
- Drapeau, P., Nachshen, D. A. Manganese fluxes and manganese-dependent neurotransmitter release in presynaptic nerve-endings isolated from rat-brain. J. Physiol-London. 348, 493-510 (1984).
- Narita, K., Kawasaki, F., Kita, H. Mn and Mg influxes through Ca channels of motor-nerve Terminals are prevented by verapamil in Frogs. Brain Res. 510, 289-295 (1990).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-644 (2001).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med. Biol. 30, 979-989 (2004).
- McDannold, N., Vykhodtseva, N., Raymond, S., Jolesz, F. A., Hynynen, K. MRI-guided targeted blood-brain barrier disruption with focused ultrasound: Histological findings in rabbits. Ultrasound Med. Biol. 31, 1527-1537 (2005).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Howles, G. P. Contrast-enhanced in vivo magnetic resonance microscopy of the mouse brain enabled by noninvasive opening of the blood-brain barrier with ultrasound. Magnet. Reson. Med. 64, 995-1004 (2010).
- Howles, G. P., Qi, Y., Johnson, G. A. Ultrasonic disruption of the blood-brain barrier enables in vivo functional mapping of the mouse barrel field cortex with manganese-enhanced MRI. Neuroimage. 50, 1464-1471 (2010).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of sml face cortex with special reference to occurrence of barrels in layer-4. J. Comp. Neurol. 164, 79-94 (1975).
- Howles, G. P., Nouls, J. C., Qi, Y., Johnson, G. A. Rapid production of specialized animal handling devices using computer-aided design and solid freeform fabrication. J. Magnet. Reson. Imag. 30, 466-471 (2009).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2001).
- Cross, D. J. Statistical mapping of functional olfactory connections of the rat brain in vivo. Neuroimage. 23, 1326-1335 (2004).
- Venot, A., Lebruchec, J. F., Golmard, J. L., Roucayrol, J. C. An automated-method for the normalization of scintigraphic images. J. Nucl. Med. 24, 529-531 (1983).
- Aoki, I., Naruse, S., Tanaka, C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia. Nmr. Biomed. 17, 569-580 (2004).
- Welker, E., Vanderloos, H. Quantitative correlation between barrel-field size and the sensory innervation of the whiskerpad - a comparative-study in 6 strains of mice bred for different patterns of mystacial vibrissae. J. Neurosci. 6, 3355-3373 (1986).
- McCasland, J. S., Woolsey, T. A. High-resolution 2-deoxyglucose mapping of functional cortical columns in mouse barrel cortex. J. Comp. Neurol. 278, 555-569 (1988).
- Irwin, S. Comprehensive observational assessment : A systematic quantitative procedure for assessing behavioral and physiologic state of mouse. Psychopharmacologia. 13, 222-257 (1968).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound Med. Biol. 33, 95-104 (2007).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Use of ultrasound pulses combined with definity for targeted blood-brain barrier disruption: A feasibility study. Ultrasound Med. Biol. 33, 584-590 (2007).
- Silva, A. C., Lee, J. H., Aoki, L., Koretsky, A. R. Manganese-enhanced magnetic resonance imaging (MEMRI): methodological and practical considerations. Nmr. Biomed. 17, 532-543 (2004).
- Meiri, U., Rahamimoff, R. Neuromuscular transmission - inhibition by manganese ions. Science. 176, 308 (1972).
- Aschner, M., Guilarte, T. R., Schneider, J. S., Zheng, W. Manganese: Recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharm. 221, 131-147 (2007).
- Watanabe, T., Frahm, J., Michaelis, T. Manganese-enhanced MRI of the mouse auditory pathway. Magnet. Reson. Med. 60, 210-212 (2008).
- Yu, X., Wadghiri, Y. Z., Sanes, D. H., Turnbull, D. H. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat. Neurosci. 8, 961-968 (2005).
- Yu, X. Statistical mapping of sound-evoked activity in the mouse auditory midbrain using Mn-enhanced MRI. Neuroimage. 39, 223-230 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved