Method Article
Neuroimaging funzionale con l'impiego dell'ecografia emato-encefalica e la barriera di Turbativa del Manganese-enhanced MRI
In questo articolo
Riepilogo
Una tecnica è ampiamente descritta per l'apertura della barriera ematoencefalica nel topo mediante ultrasuoni e microbolle. Utilizzando questa tecnica, manganese può essere somministrato al cervello di topo. Poiché manganese è un agente di contrasto MRI che si accumula nei neuroni depolarizzati, questo approccio permette l'imaging di attività neuronale.
Abstract
Anche se i topi sono il sistema modello dominante per studiare le basi genetiche e molecolari delle neuroscienze, neuroimaging funzionale nei topi rimane tecnicamente difficile. Un approccio, Activation-Induced Manganese-enhanced risonanza magnetica (MRI AIM), è stato usato con successo per mappare l'attività neuronale nei roditori 1-5. In AIM MRI, Mn 2 + agisce un analogo di calcio e si accumula nei neuroni depolarizzate 6,7. Perché Mn 2 + T 1 accorcia la proprietà dei tessuti, le regioni di elevata attività neuronale migliorerà in MRI. Inoltre, Mn 2 + cancella lentamente dalle regioni attivati, pertanto, la stimolazione può essere eseguita al di fuori del magnete e l'imaging, consentendo una maggiore flessibilità sperimentale. Tuttavia, poiché Mn 2 + non attraversano facilmente la barriera emato-encefalica (BBB), la necessità di aprire la BBB ha limitato l'uso di AIM MRI, soprattutto nei topi.
Uno strumento per l'apertura del BBB è ULTrasound. Sebbene potenzialmente dannosa, se ultrasuoni viene somministrato in combinazione con microbolle riempite di gas (cioè, agenti di contrasto ad ultrasuoni), la pressione acustica necessarie per l'apertura BBB è notevolmente inferiore. Questa combinazione di ultrasuoni e microbolle può essere utilizzato per aprire la BBB affidabile senza causare danni ai tessuti 8-11.
Qui, viene presentato un metodo per eseguire AIM MRI microbolle tramite ultrasuoni e per aprire la BBB. Dopo l'iniezione endovenosa di microbolle perflutreno, un fascio non focalizzato ultrasuoni pulsato è applicato alla testa del mouse rasata per 3 minuti. Per semplicità, ci riferiamo a questa tecnica di apertura BBB con microbolle e ultrasuoni BOMUS 12. Utilizzo BOMUS per aprire la BBB tutta entrambi emisferi, manganese viene somministrato al cervello di topo intero. Dopo la stimolazione sperimentale dei topi leggermente sedati, AIM MRI viene utilizzato per mappare la risposta neuronale.
Adimostrare questo approccio, qui BOMUS e AIM risonanza magnetica vengono utilizzate per mappare unilaterale stimolazione meccanica della vibrisse nei topi leggermente sedato 13. Poiché BOMUS può aprire la BBB in tutta entrambi gli emisferi, il lato stimolato del cervello viene usato per controllare per la stimolazione aspecifica di fondo. La mappa risultante di attivazione 3D ben si accorda con rappresentazioni pubblicate delle regioni vibrisse del campo barile corteccia 14. L'apertura ad ultrasuoni del BBB è veloce, non invasivo e reversibile, e quindi questo approccio è adatto per gli studi high-throughput e / o longitudinale nei topi svegli.
Protocollo
1. Assemblare e calibrazione del sistema ad ultrasuoni
- Il sistema a ultrasuoni inizia con un singolo elemento trasduttore di ultrasuoni con un ampio diametro sufficiente a coprire il cervello di topo e una frequenza centrale della gamma di 2 MHz. Il trasduttore è azionato da un 50-dB potenza dell'amplificatore, che è collegato ad un generatore di segnale che produce la sequenza di impulsi ad ultrasuoni.
- Per calibrare la pressione acustica del sistema a ultrasuoni, utilizzare un idrofono in relazione la tensione applicata alla pressione acustica risultante. Posizionare il trasduttore in un serbatoio di acqua sopra il idrofono. Applicare un impulso semplice (per esempio, un 10-ciclo sinusoide a frequenza del trasduttore con frequenza di ripetizione degli impulsi di 10 Hz) al trasduttore. Utilizzare un asse 3-stadio di traslazione per trovare la risposta di picco, che dovrebbe essere al centro del fascio di ultrasuoni al fuoco naturale del trasduttore (circa 60 mm per il trasduttore 13 millimetri di diametro 2,15 MHz).
- Esecuzione delle misure diverse nel corso di un squillòe di tensioni di ingresso (ad esempio, pp 50-400 mV) per verificare la linearità del sistema. Utilizzare una semplice regressione lineare per valutare il rapporto tra tensione di ingresso e la pressione acustica. Nel nostro sistema, tensioni di ingresso di 258 e 167 mV pp corrispondeva a pressioni acustiche picco-negativi di 0,52 e 0,36 MPa.
- Programma il generatore di segnali per produrre una sequenza di impulsi ad ultrasuoni costituito da raffiche di impulsi sinusoidali alla frequenza del trasduttore con 50000 cicli al burst e un periodo di burst di 64 ms. Sulla base delle misure di calibrazione, impostare l'ampiezza dell'impulso di generare picco-negativi pressioni acustiche di 0,36 MPa al centro del fuoco naturale del trasduttore.
2. Preparare i reagenti
- Sciogliere tetraidrato Manganese cloruro (MnCl 2 · 4H 2 O) in acqua sterile alla concentrazione di 100 mM (300 mOsm) e filtro sterilizzare.
- Produrre il lipide perflutreno microsfere da "activating "il flaconcino fornito dal produttore agitatore per 45 s. Per un giorno di esperimenti, una singola fiala può essere attivata una volta all'inizio della giornata e utilizzato senza riattivazione per il resto della giornata.
- Immediatamente prima della somministrazione di microsfere, agitare il flacone a mano per 1 min per risospendere le microsfere. Quando si estrae microbolle dal flaconcino, non iniettare l'aria della stanza nel flaconcino, in quanto questo degrada le microbolle rimanenti. Lasciare il flaconcino out fino l'ultimo uso della giornata, e poi conservare in frigorifero. Mantenuto in questo modo, un singolo flaconcino può durare diversi giorni. Re-attivare il flacone memorizzato nella agitatore, prima del primo uso nei giorni successivi.
3. Preparazione degli animali
- Anestetizzare gli animali con isoflurano, espresso dal cono di naso. L'apparecchio cono dovrebbero essere progettati per fissare la testa dell'animale preciso ed affidabile nella stessa posizione ogni volta. Il nostro dispositivo 15 mantiene la testa in the "cranio-flat" posizione (cioè, la superficie del cranio dorsale è orizzontale) utilizzato nel cervello Paxinos atlante 16. Titolare l'anestetico per mantenere una frequenza respiratoria tra 85 e 125 respiri al minuto. Mantenere la temperatura corporea con una lampada di calore o di aria soffiata. Proteggere gli occhi con lubrificante.
- Togliere i capelli dal cuoio capelluto del mouse utilizzando un trimmer elettrico.
- Posizionare un catetere venoso coda e uno intraperitoneale (IP) del catetere. Per gli studi di sopravvivenza, assicurarsi di utilizzare una corretta tecnica sterile; posizionamento del catetere IP dimostrato nel video di questo articolo è appropriata solo per non-sopravvivenza esperimenti.
- Apportare le preparazioni aggiuntivi necessari per l'esperimento di stimolazione neuronale. Per la mappatura di stimolazione vibrisse della corteccia campo canna, utilizzare un microscopio da dissezione e forbici per tagliare la microchirurgia vibrisse più vicino possibile alla superficie della pelle senza irritare la pelle circostante o follicolo.
- Posizionare gel ultrasuoni sullacuoio capelluto, e poi una minore colonna d'acqua contenuto in un foglio di plastica sottile (ad esempio, un cestino rivestimento 7,6 micron bin) sulla testa. Raggiungere attraverso con colonna d'acqua con un bastoncino di cotone con punta per far uscire eventuali bolle d'aria che vengono intrappolate nel gel per ultrasuoni. Posizionare il trasduttore ad ultrasuoni alla distanza focale naturale (58 mm) direttamente sopra il cervello di topo nella colonna d'acqua, e pulire il trasduttore con la punta di un dito per rimuovere eventuali bolle d'aria intrappolate.
4. Emato-encefalica apertura Barriera con microbolle e Ultra Sound (BOMUS)
- Dai un'iniezione intraperitoneale di soluzione di manganese alla dose di 0,5 mmol / kg IP. Chiudere il catetere intraperitoneale in modo che il manganese non fuoriesce, e attendere 10 minuti per consentire di distribuire (Figura 1).
- Per aprire la BBB, amministrare 30 microlitri di microsfere lipidiche perflutreno (DEFINITY attivato) attraverso il catetere vena della coda, e contemporaneamente, avviare la sequenza di impulsi ad ultrasuoni. Continue insonification per 3 minuti.
5. Stimolazione neuronale
- Attendere circa 40 minuti per i livelli cerebrali di Mn 2 + si stabilizzi prima di iniziare la stimolazione neuronale. In questo modo, il miglioramento drammatico di base a causa di Mn 2 + diffusione attraverso la BBB può essere distinto dal miglioramento differenziale sottile dovuta alla stimolazione. Poi, comincia la stimolazione con il paradigma della scelta (Figura 1).
- Per la stimolazione vibrisse, spegnere la isoflurano e rimuovere il cono. Spostare pennello un artista morbido manualmente in un movimento circolare (1-5 Hz) attraverso la matrice vibrisse ad una distanza di circa 2-5 mm dalla pelle. Continua la stimolazione per 90 min. Il manganese ha un effetto sedativo che consente la stimolazione sfrenata dell'animale. Se l'animale diventa irrequieto, amministrare il 5% isoflurano via cono per circa 15 secondi.
6. Magnetic Resonance Imaging
- Dopo la stimolazione, riprendere l'anestesia tramite cono. Continuare a mantenere la temperatura corporea e il livello di titolazione isoflurano ad una frequenza respiratoria di 85-125 respiri al minuto.
- Posizionare il mouse in una bobina di imaging RM e trasferire al sistema di MRI. Acquisizione ad alta risoluzione 3D T 1-pesate RM. Ad esempio, utilizzare un gradiente 3D viziato ricordato echo (SPGR) sequenza con i seguenti parametri: tempo di ripetizione di 25 ms, tempo di eco di 2 ms, flip angle di 30 gradi; larghezza di banda di 15,63 kHz; campo visivo di 20 × 20 × 12 mm; matrice di 128 × 128 × 60.
7. Image Analysis
- Analisi di immagine è specifico al paradigma stimolazione usato. Per l'esperimento stimolazione vibrisse (figura 2), importare le immagini da animali diversi in un ambiente di analisi appropriato. Se alcuni animali sono stati stimolati a destra, mentre altri sono stati stimolati a sinistra, flalcuni ip in modo che tutte le immagini siano effettivamente "a sinistra stimolato." Poi, per confrontare il lato stimolato di ogni cervello per il suo lato controlaterale non stimolato, creare un duplicato e specchiato sinistra non stimolato set immagine viene creata. Registra tutte le immagini di uno spazio comune e poi lisciare con un 3 × 3 × 3 pixel kernel gaussiano.
- Esportare i dati in un ambiente di analisi matematica, come MATLAB. Facoltativamente, mascherare anatomia irrilevante nei set di dati. Intensità-normalizzare le immagini dal metodo iterativo di Venot et al. 17,18.
- Utilizzare una, appaiati single-coda test t per confrontare ogni voxel dei lati di ogni cervello stimolati al voxel corrispondente controlaterale sui lati di ogni cervello stimolate.
- Visualizzare la risultante p-value mappa per identificare regioni di attività differenziale (figura 3).
8. Risultati rappresentativi
Il metodo presentato qui ha due fondo amental fasi: (1) apertura BBB con microbolle ed ecografia (BOMUS) e (2) Attivazione indotta da Manganese-enhanced risonanza magnetica (MRI AIM). Poiché la fase di quest'ultimo dipende dal precedente, è importante controllare BOMUS attuazione successo.
L'interruzione della barriera sangue-cervello dopo somministrazione di una T 1-accorciamento agente di contrasto (come manganese o gadolinio agente basato) comporta un aumento del segnale nel parenchima cerebrale il T 1-pesate rispetto al cervello in cui BOMUS non è stata eseguita (Figura 4). La distribuzione di questo miglioramento manganese non è perfettamente uniforme, anche se è abbastanza consistente tra animali. La distribuzione riflette disomogeneità non solo in apertura BBB, ma è anche l'intrinseca distribuzione non uniforme della Mn all'interno del cervello 19. Le dinamiche spaziali e temporali dell'apertura BBB sono stati ulteriormente descritti in precedenza 12.
ent "> Una volta BOMUS è stato attuato con successo, il passo successivo è quello di eseguire AIM MRI Molti paradigmi sperimentali sono possibili;.. però, perché ci sono molti potenziali confonde, i controlli e le analisi devono essere attentamente progettati effetti confondenti comprendono disomogeneo apertura BBB, accumulo disomogeneo di Mn nel cervello, dinamiche temporali di diffusione Mn, e non specifica l'attività neuronale. In questa dimostrazione, la risposta neuronale alla stimolazione unilaterale della vibrisse è stato mappato. Per spiegare le disomogeneità e Mn flusso, il lato stimolato di ogni cervello è stato utilizzato come controllo interno. Per spiegare aspecifica attività neuronale che può variare tra animali, l'analisi statistica test utilizzato per identificare le regioni che erano sempre differenti tra gli animali (Figura 2). I risultati erano una mappa tridimensionale e una differenza tridimensionale p-value map (figura 3), il lato destro delle quali indicata regionidi segnale superiore controlaterale al vibrisse stimolato. Il lato sinistro della mappa indicato che le regioni hanno segnale significativamente superiore omolaterale al vibrisse stimolato. Il p-value mappa identificato un'ampia regione di segnale elevata controlaterale alla vibrisse stimolata corrispondente al campo canna della corteccia sensoriale primaria, la cui risposta alla stimolazione vibrisse è stato ampiamente documentato da elettrofisiologia 20,21 e 2-deossiglucosio studi. Una discussione più completa di questi risultati è stato pubblicato in precedenza 13.
Figura 1. Temporale protocollo per neuroimaging funzionale con BOMUS e AIM MRI (Adattato da Howles et al. 13).
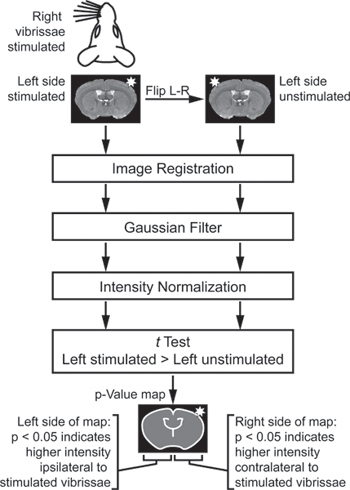
Figura 2. Schema di analisi per identificare le regioni of diversa intensità tra i lati stimolati e senza stimoli di ogni cervello. Per confrontare il lato stimolato di ogni cervello per il suo lato controlaterale non stimolato, un duplicato e specchiato sinistra non stimolato set immagine viene creata. Queste immagini sono registrati, filtrati, e normalizzato. Infine, prova a confronto le immagini a sinistra stimolati e sinistra non stimolate. Il test t è "accoppiato", in modo che il lato stimolato di ciascun cervello è solo rispetto al lato non stimolato del cervello stesso. Il test t è "single-coda" in modo che un lato del p-value mappa indica un segnale significativamente maggiore sul lato stimolato del cervello, mentre l'altro lato del p-value mappa indica un segnale significativamente maggiore sul lato della stimolata cervello (Adattato da Howles et al. 13).
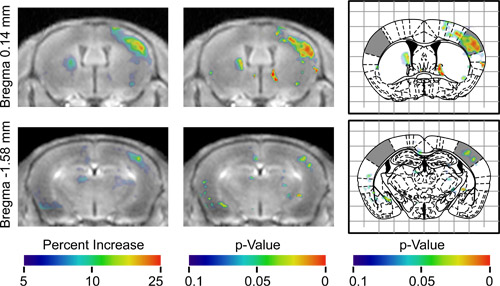
Figura 3. I risultati di un'analisi aggregata di 7 animali in due diverse posizioni assiali. T egli prima colonna indica la media di tutte le immagini registrate allineate, in modo che efficacemente tutti i topi avevano loro vibrisse sinistra stimolato. Queste immagini sono ricoperti con una mappa di colori che indica l'incremento medio percentuale di segnale in ciascun voxel rispetto all'emisfero controlaterale, come indicato dalla barra colore. Regioni colorate sul lato destro dell'immagine indicano dove l'emisfero controlaterale alla stimolazione era maggiore del segnale. Regioni colorate sul lato sinistro dell'immagine indicano dove ipsilaterale emisfero alla stimolazione era maggiore del segnale. La seconda colonna mostra le stesse immagini sovrapposte con il p-value mappa indica la significatività statistica del aumento del segnale. La terza colonna mostra lo stesso p-value map sovrapposto le cifre corrispondenti dal Paxinos atlante stereotassico 16 con i campi di canna della corteccia sensoriale ombreggiata (Adattato da Howles et al. 13).
/ 4055/4055fig4.jpg "/>
Figura 4. Distribuzione spaziale di Mn 2 + nel cervello. Le immagini sono state acquisite dopo 170 min IP MnCl 0,5 mmol / kg 2 da BOMUS-trattato (n = 5) e di controllo (n = 4) topi. Dopo la normalizzazione, la media e le mappe di deviazione standard sono state calcolate (pannello a sinistra). Enhancement era maggiore nei topi trattati con BOMUS. Anche se questo miglioramento non è uniforme in tutto il cervello, era abbastanza consistente, tranne vicino ai bordi del cervello e ventricoli. Uso delle aree di interesse (ROI) disegnato attorno a strutture diverse, la media SNR (+ 1 SD) è stato calcolato in ciascun gruppo (pannello di destra). BOMUS animali trattati hanno mostrato una maggiore SNR, ma anche una maggiore varianza tra strutture e tra gli animali (Adattato da Howles et al. 13).
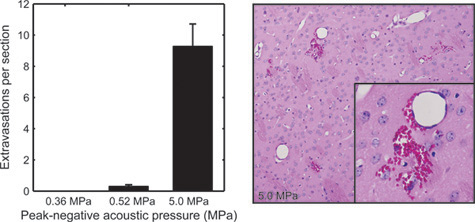
Figura 5. Per esaminare gli effetti dei tessuti di BOMUS, cervelli di topi trattati con BOMUS sono stati fissati, sectioned a 500 - intervalli di micron, e colorate con ematossilina ed eosina. Il numero medio di stravasi globuli rossi visto in ogni sezione del cervello è mostrato per pressioni acustiche di 0,36 MPa (n = 3), 0,52 MPa (n = 4), e 5,0 MPa (n = 1). Le barre di errore indicano l'errore standard. Il secondo pannello mostra un esempio di grave stravaso globuli rossi dal cervello esposto a 5,0 MPa (Adattato da Howles et al. 12).
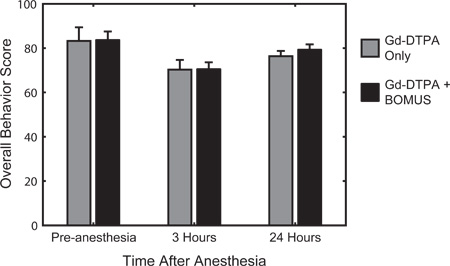
Figura 6. Quantitativa test comportamentale è stato utilizzato per valutare l'attività, l'eccitazione, e la risposta prima dell'anestesia, e 3, e 24 ore dopo il recupero dall'anestesia. Il sistema di punteggio, 12 descritto in precedenza, è basata sulla consolidata valutazione quantitativa topo comportamentale sviluppareed da Irwin nel 1968 22. Il comportamento medio (± SEM) punteggio di controllo (n = 3) e BOMUS (0,36 MPa) trattati (n = 8) è mostrato animali. Rispetto al pre-anestesia di base, tutti gli animali mostrano una diminuzione del punteggio comportamento 3 ore dopo l'anestesia, ma in gran parte recuperare il giorno successivo. Ad ogni punto di tempo, nessuna differenza è stata osservata tra i due gruppi, indicando che BOMUS non misurabile influisce sul comportamento animale (Adattato da Howles et al. 12).
Discussione
Qui, un metodo non invasivo è stato presentato per l'apertura del BBB in tutto il cervello di topo tutto con ultrasuoni e microbolle (BOMUS). Con l'apertura BBB, Mn 2 + è stato somministrato e l'attivazione indotta manganese-enhanced MRI (AIM MRI) è stata utilizzata per la risposta neuronale a immagine di breve durata nei topi stimolazione leggermente sedati.
Un'adeguata apertura BBB stato raggiunto con un picco negativo pressione acustica di 0,36 MPa. Nota, questa è la pressione sulla superficie del cuoio capelluto al centro del fascio di ultrasuoni. Misure di profilo del fascio singolo elemento trasduttore indicano che la pressione acustica alla trave di bordo è di circa 0,12 MPa. Successivamente, attraverso il cranio attenuazione riduce la pressione raggiunge il cervello di circa il 25% (sulla base delle declassamento Choi et al. 23 e regolato per la frequenza). Questo indica che perturbazione BBB verificato a pressioni acustiche picco-negativi di 0,09 MPa (al centro della nostra fascio) A 0,03 MPa (sul bordo). Queste pressioni sono inferiori ai livelli (in genere 0,4-0,5 MPa) riportati altrove 24. Tale soglia pressione ridotta può essere dovuto alla dose più alta di microbolle lipidici utilizzati in questo lavoro (circa 1,2 mL / kg) rispetto ad altri. Mentre la dose di microbolle impiegati era superiore alla raccomandata dose diagnostica umana (10 pl / kg), effetti negativi non sono stati osservati.
Come specificato qui, BOMUS la tecnica non è invasiva e reversibile, tuttavia, ha il potenziale di causare danni. In un precedente lavoro 12, i topi trattati con BOMUS sono stati valutati per danni istologica (figura 5) e cambiamenti comportamentali (Figura 6). Pressioni acustiche Peak-negativi di 0,36 MPa erano associati con osservati effetti negativi (Figura 6). Tuttavia, 0,52 MPa-BOMUS sono stati associati con un piccolo numero di stravasi intracerebrali globuli rossi del sangue in un sottoinsieme di animali ( Figura 5), e alcuni animali non ha recuperato completamente dopo la procedura. Si consiglia una pressione acustica che non provoca stravaso deve essere utilizzato per esperimenti di risonanza magnetica AIM.
Così come la tecnica BOMUS è potenzialmente dannosa, il manganese è anche ben noto tossicità 25. Mn 2 + è conosciuto per avere effetti tossici sulla giunzione neuromuscolare 26 e del sistema nervoso 27. Questa tossicità è probabilmente responsabile della sonnolenza dei topi dopo la somministrazione, sebbene il meccanismo di questo effetto è sconosciuto. Per circa i primi 60 minuti di stimolazione, il mouse resta un po 'sonnolenta ma ancora reattivo agli stimoli dolorosi, come un pizzico punta. Questo permette al mouse di tollerare la stimolazione senza la necessità di contenzione fisica. Nella nostra esperienza, questa sonnolenza è sufficiente per circa 60 minuti dopo che l'animale può diventare inquieto. Il controllo chimico aggiuntivo può essere unchieved se necessario con circa 15 secondi di 5% isofluorano via dell'ogiva. In questa dimostrazione, la sonnolenza facilitato la stimolazione del vibrisse, tuttavia, può anche aver ridotto la risposta neuronale nella corteccia canna.
Oltre alla semplice somministrazione Mn 2 +, la tecnica BOMUS può essere utilizzata per somministrare globalmente altri agenti diagnostici o terapeutici. Nel precedente lavoro, BOMUS è stato utilizzato per amministrare Gd-DTPA, un agente di contrasto per risonanza magnetica, al cervello. Dodici, tuttavia, rimangono molti interrogativi riguardo la natura della permeabilità BBB realizzato con BOMUS. In primo luogo, non è chiaro quello che gli agenti dimensioni sono in grado di attraversare la BBB dopo BOMUS. Sia Mn 2 + e Gd-DTPA (500 Da) sono molecole piuttosto piccoli. In secondo luogo, non è chiaro quanto la permeabilità della BBB varia nel cervello. In terzo luogo, non è chiaro se l'apertura BBB è un effetto relativamente binario, o se i parametri di apertura alcuni possono influire sulle dimensioni o la velocità del materialepermeazione. Anche se Gd-DTPA distribuito abbastanza uniformemente attraverso il cervello nello studio sopra citato, potrebbe essere stato troppo piccolo e troppo diffondibile per rivelare eventuali differenze di permeabilità.
Nonostante queste incertezze sulla BOMUS, il metodo è efficace per somministrare rapidamente Mn 2 + allo scopo di AIM-MRI. AIM-MRI è stato usato nei topi per mappare la risposta neuronale a lungo termine (1-2 giorni) la stimolazione nei topi 28-30, ma con questo nuovo approccio, a breve termine esperimenti di stimolazione sono ora possibili. In precedenza, la somministrazione rapida di Mn 2 + è stato possibile solo con osmotica interruzione BBB con un infuso intracarotid di mannitolo ipertonico. Questo approccio è stato solo pratico nei ratti e nei modelli animali più grandi, ma anche nei ratti, questi studi sono stati limitati dalla invasività e unilateralità della tecnica. Poiché BOMUS può essere eseguita in maniera non invasiva, la stimolazione sveglio e gli studi longitudinali dovrebbe essere possibile. Inoltre, Becautilizzare Mn 2 + può essere somministrato ad entrambi gli emisferi cerebrali, una più ampia gamma di paradigmi di stimolazione sono possibili. Nel dimostrazione sopra, la somministrazione bilaterale Mn 2 + consentito l'emisfero non stimolato ad agire come un controllo interno, in modo che la risposta neuronale a non-specifica stimolazione fondo può essere separato dalla risposta alla stimolazione vibrisse unilaterale.
Oltre a controllare per non-specifica stimolazione sfondo, l'emisfero non stimolate anche stato usato per controllare l'omogeneità e la consistenza della somministrazione manganese. Come visto in altri esperimenti MRI manganese avanzata 19, i dati di distribuzione (Figura 4) indicano che la tecnica BOMUS non fornisce un miglioramento omogeneo del cervello. Così, senza controlli adeguati (animali di controllo o di un emisfero non stimolato), regioni con la valorizzazione di base più alto sono difficili da distinguere da regioni i cui elementivato il segnale è dovuta all'attività neuronale.
Anche se la linea di base Mn 2 + miglioramento non è omogeneo, il modello è abbastanza consistente tra gli individui. Tuttavia, piccole variazioni in questo valorizzazione base potrebbe oscurare l'AIM-MRI segnale. In questa dimostrazione, abbiamo affrontato questo problema potenziale media l'AIM-MRI segnale su diversi animali. In alternativa, le differenze di valorizzazione di base potrebbe essere spiegata con l'acquisizione di immagini pre-stimolazione.
Il metodo qui presentato richiede notevole analisi statistica immagine, che a sua volta, richiede una registrazione ad alta fedeltà dell'immagine. Naturalmente, tale iscrizione ha senso solo se i dati di origine viene acquisito con una risoluzione (in tutte e tre le dimensioni) che è sufficientemente sottile rispetto alle strutture di interesse. In questa dimostrazione, le immagini 3D sono state acquisite con voxel quasi isotropi circa 160 micron di ogni dimensione, che hanno permesso per un'eccellenteregistrazione anatomica. Tuttavia, la registrazione di immagini può limitare la risoluzione spaziale di questo metodo, un mancato registro leggero potrà regioni molto piccole medie-out di miglioramento. Le lampadine cervelletto e olfattivo può essere particolarmente difficile per la registrazione, perché hanno un miglioramento finemente stratificata e sono spesso fuori allineamento con il cervello.
Qui, abbiamo presentato un metodo per mappare la risposta neuronale a stimoli di breve durata nei topi svegli. Sebbene non semplice, il metodo è relativamente pratico e accessibile. Questa discussione dettagliata delle limitazioni e le sottigliezze spera, dovrebbe permettere al lettore di applicare la tecnica alle loro proprie domande sperimentali.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Tutto il lavoro è stato eseguito presso il Centro per la Duke In Microscopia Vivo, uno NIH / NIBIB nazionale Biomedical Technology Resource Center (P41 EB015897) e NSC Piccolo Imaging Programma Animal Resource (U24 CA092656). Ulteriore supporto è stato fornito dalla NSF Graduate Research Fellowship (2003014921).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Idrofoni | Sonora Medical Systems, Longmont, CA | SN-251 S4 | |
| Traduzione stage | Newport Corporation, Irvine, CA | ||
| Trasduttore ad ultrasuoni | Olympus NDT, Inc., Waltham MA | SU-A306S | Rivedere foglio di prova del fabbricante che accompagna il trasduttore per trovare l'esatta frequenza centro di quel trasduttore particolare, che può differire dalla frequenza nominale elencati nel catalogo. (Ad esempio, la frequenza nominale del nostro trasduttore è risultata di 2,25 MHz, ma la frequenza centrale effettiva era 2,15 MHz.) |
| Vevo Imaging Station | VisualSonics, Inc. Toronto, Canada | ; | |
| 50 dB amplificatore di potenza | E & I, Rochester, NY | modello 240L | |
| Il generatore di segnale | Agilent Technologies, Santa Clara, CA | modello 33220A | |
| MnCl 2 - (H2O) 4 | Sigma | Il peso molecolare varia a seconda del lotto, contattare il produttore per la misurazione esatta | |
| Perflutreno microsfere lipidiche | Lantheus Medical Imaging, N. Billerica, MA | DEFINITY | |
| Microsfera agitatore | Lantheus Medical Imaging, N. Billerica, MA | Vialmix | |
| RM coil | m2m Imaging Corp., Hillcrest, OH | 35 mm di diametro quadratura di trasmissione / ricezione bobina del volume | |
| Sistema MRI | GE Healthcare, Milwaukee, WI | GE console EXCITE funzionamento di un 7-T magnete orizzontale foro | |
| Immagine di analisi ambientale | Visage Imaging, San Diego, CA, The MathWorks, Natick MA | Amira MATLAB |
Riferimenti
- Aoki, I. Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI. Magnet. Reson. Med. 50, 7-12 (2003).
- Aoki, I. Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging. DAIM MRI). Magnet. Reson. Med. 48, 927-933 (2002).
- Duong, T. Q., Silva, A. C., Lee, S. P., Kim, S. G. Functional MRI of calcium-dependent synaptic activity: Cross correlation with CBF and BOLD measurements. Magnet. Reson. Med. 43, 383-392 (2000).
- Lin, Y. J., Koretsky, A. P. Manganese ion enhances T-1-weighted MRI during brain activation: An approach to direct imaging of brain function. Magnet. Reson. Med. 38, 378-388 (1997).
- Lu, H. B. Cocaine-induced brain activation detected by dynamic manganese-enhanced magnetic resonance imaging (MEMRI). P. Natl. Acad. Sci. U.S.A. 104, 2489-2494 (2007).
- Drapeau, P., Nachshen, D. A. Manganese fluxes and manganese-dependent neurotransmitter release in presynaptic nerve-endings isolated from rat-brain. J. Physiol-London. 348, 493-510 (1984).
- Narita, K., Kawasaki, F., Kita, H. Mn and Mg influxes through Ca channels of motor-nerve Terminals are prevented by verapamil in Frogs. Brain Res. 510, 289-295 (1990).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-644 (2001).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med. Biol. 30, 979-989 (2004).
- McDannold, N., Vykhodtseva, N., Raymond, S., Jolesz, F. A., Hynynen, K. MRI-guided targeted blood-brain barrier disruption with focused ultrasound: Histological findings in rabbits. Ultrasound Med. Biol. 31, 1527-1537 (2005).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Howles, G. P. Contrast-enhanced in vivo magnetic resonance microscopy of the mouse brain enabled by noninvasive opening of the blood-brain barrier with ultrasound. Magnet. Reson. Med. 64, 995-1004 (2010).
- Howles, G. P., Qi, Y., Johnson, G. A. Ultrasonic disruption of the blood-brain barrier enables in vivo functional mapping of the mouse barrel field cortex with manganese-enhanced MRI. Neuroimage. 50, 1464-1471 (2010).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of sml face cortex with special reference to occurrence of barrels in layer-4. J. Comp. Neurol. 164, 79-94 (1975).
- Howles, G. P., Nouls, J. C., Qi, Y., Johnson, G. A. Rapid production of specialized animal handling devices using computer-aided design and solid freeform fabrication. J. Magnet. Reson. Imag. 30, 466-471 (2009).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2001).
- Cross, D. J. Statistical mapping of functional olfactory connections of the rat brain in vivo. Neuroimage. 23, 1326-1335 (2004).
- Venot, A., Lebruchec, J. F., Golmard, J. L., Roucayrol, J. C. An automated-method for the normalization of scintigraphic images. J. Nucl. Med. 24, 529-531 (1983).
- Aoki, I., Naruse, S., Tanaka, C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia. Nmr. Biomed. 17, 569-580 (2004).
- Welker, E., Vanderloos, H. Quantitative correlation between barrel-field size and the sensory innervation of the whiskerpad - a comparative-study in 6 strains of mice bred for different patterns of mystacial vibrissae. J. Neurosci. 6, 3355-3373 (1986).
- McCasland, J. S., Woolsey, T. A. High-resolution 2-deoxyglucose mapping of functional cortical columns in mouse barrel cortex. J. Comp. Neurol. 278, 555-569 (1988).
- Irwin, S. Comprehensive observational assessment : A systematic quantitative procedure for assessing behavioral and physiologic state of mouse. Psychopharmacologia. 13, 222-257 (1968).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound Med. Biol. 33, 95-104 (2007).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Use of ultrasound pulses combined with definity for targeted blood-brain barrier disruption: A feasibility study. Ultrasound Med. Biol. 33, 584-590 (2007).
- Silva, A. C., Lee, J. H., Aoki, L., Koretsky, A. R. Manganese-enhanced magnetic resonance imaging (MEMRI): methodological and practical considerations. Nmr. Biomed. 17, 532-543 (2004).
- Meiri, U., Rahamimoff, R. Neuromuscular transmission - inhibition by manganese ions. Science. 176, 308 (1972).
- Aschner, M., Guilarte, T. R., Schneider, J. S., Zheng, W. Manganese: Recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharm. 221, 131-147 (2007).
- Watanabe, T., Frahm, J., Michaelis, T. Manganese-enhanced MRI of the mouse auditory pathway. Magnet. Reson. Med. 60, 210-212 (2008).
- Yu, X., Wadghiri, Y. Z., Sanes, D. H., Turnbull, D. H. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat. Neurosci. 8, 961-968 (2005).
- Yu, X. Statistical mapping of sound-evoked activity in the mouse auditory midbrain using Mn-enhanced MRI. Neuroimage. 39, 223-230 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon