Method Article
Колонизация Euprymna scolopes Squid по Vibrio fischeri
В этой статье
Резюме
Метод описывается процедура, посредством которой Гавайских кальмар бобтейл, Euprymna scolopes И бактериальных симбионтов, Vibrio fischeri, Поднимаются отдельно, а затем ввели, чтобы обеспечить определенный колонизации органа свет кальмаров бактериями. Колонизация обнаружения бактериально-производные люминесценции и прямым подсчетом колонии описаны.
Аннотация
Специальные бактерии обнаружены в связи с тканей животных 1-5. Такой хост-бактериальных ассоциаций (симбиоз) может иметь пагубные последствия (патогенные), не фитнес-следствие (комменсалы), либо быть полезным (взаимопомощи). В то время много внимания уделялось патогенные взаимодействия, мало известно о процессах, которые определяют воспроизводимых приобретение полезных / комменсальных бактерии из окружающей среды. Световых орган взаимности между морскими грамотрицательные бактерии V. fischeri и Гавайских бобтейл кальмары, Е. scolopes, представляет собой весьма специфическое взаимодействие, в котором один хозяин (Э. scolopes) устанавливает симбиотические отношения с только одного вида бактерий (В. fischeri) на протяжении всей своей жизни 6,7. Биолюминесценция производства V. fischeri во время этого взаимодействия дает анти-хищный пользу E. scolopes во время ночных мероприятий 8,9, в то времяБогатые питательными веществами тканей хозяина обеспечивает V. fischeri с защитой ниша 10. В каждом хосте поколения, эти отношения воспроизводятся, тем самым обеспечивая предсказуемый процесс, который может быть оценен подробно на различных этапах развития симбиотических. В лаборатории несовершеннолетних кальмар люк aposymbiotically (неколонизированных), и, если они собираются в течение первых 30-60 минут и переданы симбионта без воды не может быть колонизирована за исключением экспериментальных посевной 6. Это взаимодействие обеспечивает, таким образом полезную модель, в которой для оценки отдельных шагов, которые приводят к конкретным приобретение симбиотических микробов из окружающей среды 11,12.
Здесь мы опишем метод оценки степени колонизации, что происходит, когда только что вылупившихся aposymbiotic E. scolopes подвергаются (искусственного) морская вода, содержащая V. fischeri. Этот простой анализ описывает прививки, естественной инфекции и восстановлениебактериальных симбионтов от зарождающегося органа свете E. scolopes. Особое внимание уделяется тому, чтобы обеспечить согласованную среду для животных во время симбиотической развития, особенно в отношении качества воды и света сигналы. Методы характеризуют симбиотических населения описано включают: (1) измерение бактериально-производные биолюминесценции, и (2) прямой подсчет колоний восстановленных симбионтов.
протокол
1. Подготовка бактериальных Инокулят
- День 0
За два дня до прививки кальмары, плиты соответствующих бактериальных штаммов на LBS 13 агара. - Инкубируйте бактерий на 25-28 ° С в течение ночи.
- День 1
Инокулировать 3 мл LBS среды в трубке культуры стекло с одной колонии каждого V. fischeri штамм инфекции. Подготовить дублировать трубы в качестве резервного. - День 2
(Координация бактериальных шаги 1,4-1,6 с шагом кальмар 3.7-3.10)
1 час перед посевом, субкультура бактерии 1:80 (37,5 мкл) в 3 мл LBS в трубку культуры стекла и расти в течение 1 ч с аэрацией. - Измерить диаметр 600 образца до прививки. Типичные измерения 0,3-0,6 в зависимости от штамма.
- Для целевой посевной 3-5 х 10 3 КОЕ / мл рассчитать объем посевного следующим образом: объем посевного (мкл) = 1,25 / OD 600 (например, для OD 600 = 0,5, расчетной посевной объем = 1.25/0.5 = 2.5 мкл). Эта сумма добавляется непосредственно в морской воде содержащей кальмара в шаге 4.1. Этот расчет может потребоваться с учетом различных штаммов V. fischeri или прививкой на более низких или более высоких уровней, чем указано здесь.
2. Подготовка агара в Перечень Инокулят
- Для каждой процедуры, этикетки LBS пластин (2 на лечении) к пластине образцы посевного материала в шаге 4.1.
- Добавьте 5 стерильных бисером покрытия на пластине.
3. Коллекция несовершеннолетних Squid
- Измерьте соленость океана мгновенных помощью рефрактометра и настроить до 35 ‰.
- Фильтр 1 л мгновенных океана использования устройства фильтрации и прилагаемые линии вакуум или вакуумный насос, для создания фильтра стерилизовать мгновенных океана (FSIO). Кислородом воды, вращая энергично до каждого отпуска. Thэлектронного фильтра могут быть использованы в течение 2 дней.
- Алиготе 40-50 мл FSIO в каждом из двух (2) одноразовые чаши образца. Этикетка один, как earlies и один как timelies.
- Подготовить более пластиковой пипетки передачи для приобретения несовершеннолетними кальмары, сокращая пипеткой примерно 1 см от кончика, выше самых низких хребтов (см. Рисунок 3). Это способствует более широкую область, через которую может пройти кальмара на коллекцию. Откажитесь от любого передачи пипетки, в котором есть грубое открытой поверхности.
- Использование подготовленных пипетки передачи, сбора E. scolopes, которые вылупились в ночное время и передать earlies чашу FSIO. Рано птенцов были в яйце системы в течение 1 часа и восприимчивы к колонизации загрязняющих В. fischeri в яйце системы. Не используйте earlies для чувствительных экспериментов колонизации.
- Проверьте яйцо танков каждые 30-45 мин для новых птенцов. Убедитесь, что все птенцы будут удалены в течение каждого счерт. Удалить птенцов с передачи пипетки, а депозит в timelies чашу FSIO. Животные собраны своевременно доступны для колонизации экспериментов.
- Когда коллекция была закончена (~ 45 минут после наступления темноты), передает кальмара в главной лаборатории. Эмпирически это выгодно, чтобы колонизировать животных в лаборатории непрерывного освещения в течение 3 ч прививки.
- Для каждой процедуры, подготовить миску с 40 мл FSIO. Добавить кальмаров с чашами для анализа (максимум п = 40 в миску).
- Подготовить дополнительные чаши, как aposymbiotic (отрицательный) управления.
- Подготовить выделенный пипетки передачи для каждого сеанса.
- Эвтаназии дополнительные кальмара в 2% этанола.
4. Squid Колонизация
- День 2 - Использование P10 Pipetman, отказаться от расчетной Аликвоту бактерий (шаг 1.5) в каждой чаше кальмаров (шаг 3.8) для каждой процедуры. Начало 3 часов таймер сразу послепервые прививки.
- Для каждой процедуры, создать "вихрь" в чашу с выделенной пипеткой передачу размещение пипетки на краю чаши и пипетки вверх и вниз несколько раз, чтобы смешивать воду и кальмаров в течение примерно 10 сек. Тщательно перемешать имеет решающее значение.
- Пластина 50 мкл в каждую тарелку на пластине LBS агар с шага 2.2 (для технических повторяет, плиты два 50 мкл пластин в лечении). Инкубируйте при 25-28 ° С в течение ночи.
- Подготовить мыть миски (100 мл FSIO / шт) для каждого лечения.
- Подготовить Drosophila флаконах (4 мл FSIO / шт) для каждого кальмара.
- Ровно через 3 часа, передает кальмара в их чаши стирки (полная для всех лечения). Это останавливает прививки.
- Приступить к передаче каждого кальмара в своей флакон дрозофилы с FSIO. Использование назначенных передачи пипетки для каждого лечения.
- Перемещение лотков дрозофилы флаконах по установке кальмара, чтобы вернуться в день / пIGHT свет цикл животных испытывали во время эмбриогенеза.
- День 3 - Подготовка Drosophila флаконах (4 мл FSIO / шт) для каждого кальмара.
- До сумерек на 22-24 часов после прививки, передавать друг кальмара в новый флакон дрозофилы. Использование назначенных передачи пипетки для каждого лечения.
- День 4 - подготовить помечены 1,5 мл микроцентрифужных труб (1/squid).
- До сумерек на 46-48 часов после прививки, измерения и регистрации свечения каждого кальмара во флаконе дрозофилы (люминометра набор для интеграции 6 с и автоматическое чтение по закрывающейся крышкой).
- В качестве отрицательного контроля на фоне свечения, измерения флакон с FSIO, что не содержит никаких кальмаров.
- Передача каждого кальмара в объеме около 700 мкл до 1,5 мл микроцентрифужных трубку шаг 4.12. Переместить в картонной коробке морозильник. Как только крышка находится на коробке, не снимайте ее, как свет сигналы для высылки бактерии не вэйл-понял.
- Замораживание микроцентрифужных труб при температуре -80 ° С в течение ночи.
5. Определение уровня колонизации
- Для каждого кальмара, подготовить два (2) микроцентрифужных труб, каждая с 475 мкл FSIO (или автоклаве 70% Мгновенный океан).
- Подготовить пестики первым использованием Kimwipe для очистки пестиком и удалить валовой мусора и / или тканей.
- Место пестики наконечник вниз в 50 мл стакан, содержащий 95% этанола. Этанол должны быть добавлены к высоте примерно 3 см.
- Для каждого пестиком, убрать из стакана и протрите кончик Kimwipe.
- Опустите пестик обратно в ванну этанола, удаления и вставки (до кончика) в стойку трубы микроцентрифужных и дать полностью высохнуть в течение примерно 15 минут.
- Оттепель кальмара в стойку трубы микроцентрифужных (максимум п = 8).
- При необходимости регулировки громкости до 700 мкл.
- С помощью пестика с шага 5.5, нарушить ткань животного, пока чернила мешок РУПтемператур (вода станет мутной серого цвета).
- Удалить пестик и убедиться, что все ткани остается в трубе.
- Vortex ткани кратко ровно 10 секунд (используйте таймер).
- Дайте ткани, чтобы отдохнуть в течение 10 мин. Ткань будет располагаться и бактерий и чернила остаются в растворе. Для расчетов, которые следуют, бактерии / тушь решение [A] разведение (то есть свет Е. scolopes орган гомогената в 700 мкл). Серийные разведения 1:20 ([B] [C]) описаны ниже.
- Для [B] разбавления, добавить 25 мкл [A] на одной из труб микроцентрифужных подготовлен в шаге 5.1. Vortex.
- Для [C] разбавления, добавить 25 мкл [B] в одной из труб микроцентрифужных подготовлен в шаге 5.1. Vortex.
- Пластина 50 мкл каждого разведения на агаре LBS, 2 повторяет за лечение.
- Инкубируйте пластины на 25-28 ° С в течение ночи.
6. Анализ данных
- Для расчета КОЕ / свет органа (LO), страныт колоний на пластину для каждой процедуры, в которых 10-400 колоний присутствуют, и использовать соответствующие формулы:
КОЕ / LO = (колоний [A] пластина) х 14, или
КОЕ / LO = (колоний [B] пластина) х 280, или
КОЕ / LO = (колоний [C] пластина) х 5600. - Сюжет отдельных точек данных и медианы по логарифмической шкале.
- Эти данные часто не нормальное распределение, с различными отклонениями, и выбросы могут содержать биологически осмысленно информации. Таким образом, непараметрические критерии обеспечивают полезный способ определить, является ли лечение существенно различаются.
- Используйте программное обеспечение GraphPad Prism для статистического анализа. В течение двух процедур, использование суммы Уилкоксона ранг тест. Для сравнения среди более двух процедур, использовать Крускала-Уоллиса с соответствующими после испытаний.
7. Представитель Результаты
Результаты анализа колонизации образца показаны на рисунке 4. Два штамма В. fischeri, которые демонстрируют различные относительные уровни свечения каждого были привиты на шесть кальмаров, вместе с шестью кальмара, который служил aposymbiotic (неколонизированных) управления. E. scolopes симбионтов, ES114 14, и тем ярче Sepiola робуста симбионтов, SR5 15,16. Аналогичные уровни посевной (рис. 4) приводит к 100% колонизация в течение 3 часов. В 48 часов свечения уровней (рис. 4, б) и КОЕ считается (рис. 4в) были определены для оценки колонизации знание деформации. Определение удельной люминесценции (рис. 4, в бактерии) позволяет для определения яркости каждого штамма бактерий в симбиозе.
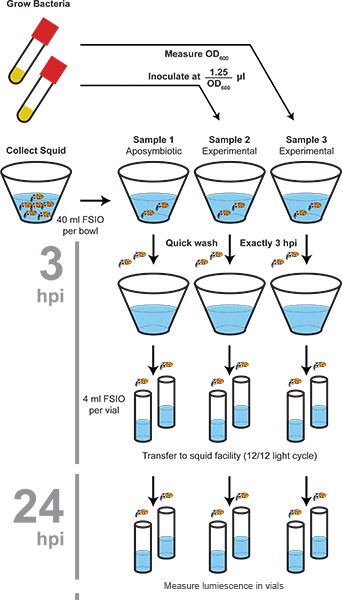
Рисунок 1. Блок-схема процедуры колонизации. Бактерии и кальмаров собирают отдельно, затем смешивают с указанным посевной. Squid моют, а затем переведен на новую воду на 3 часа, 24 часов и 4 8 часов после прививки. В 48 часов свечения измеряется и животных заморожены, который служит для поверхностной стерилизации животных. Светло-орган колонизировали бактерии сохраняют жизнеспособность при температуре -80 ° С через одну оттепель (без дополнительных циклов замораживания-оттаивания).

Рисунок 2. Схема иллюстрирующая гомогенизации и растворения покрытия бактерий. Последовательный 20-кратном разведении обеспечить соответствующий динамический диапазон для перечисления колониальных бактерий.
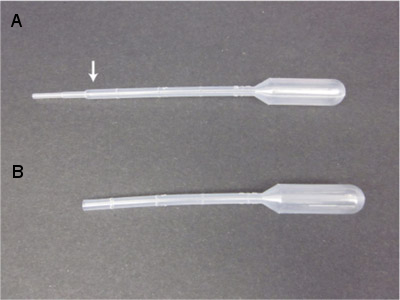
Рисунок 3. Передача пипетки с соответствующим узкий конус вал в узких отверстия (А), что может привести к повреждению несовершеннолетних кальмаров. Предварительная отрезая узкие секции с ножницами или лезвием бритвы дает соответствующий инструмент (B) для передачи несовершеннолетних кальмаров.
s/ftp_upload/3758/3758fig4.jpg "/>
Рисунок 4. Пример данных для колонизации анализа. (A) уровни бактерий в посевной миски. (B) люминесценции отдельных кальмаров. (C) колония считается отдельных кальмаров. (D) Удельная люминесценция отдельных кальмаров. Апо Aposymbiotic (неколонизированных отрицательный контроль).
Обсуждение
Колонизация анализа, описанного позволяет для анализа природных симбиотических процессов в контролируемых лабораторных условиях. Как таковой, он может быть использован для оценки колонизации мутантных штаммов, различных природных изолятов и при различных режимах химических веществ. Вариации на экспериментах, описанных, как правило, используются для оценки различных аспектов симбиоз. Кинетика колонизации может быть измерена путем изучения люминесценции в течение первых 24 ч, которые могут быть обнаружены автоматически в сцинтилляционных счетчиков, в которой совпадение детектор был удален. Кроме того, относительно возможности колонизации одного штамма по отношению к другой может быть измерена с помощью конкурентного анализа колонизация, в которой выходной отношение двух напряжений в набор животных нормированных на вход соотношение (дифференциальное обнаружение различных устойчивость к антибиотикам, флуоресценция или хромогенных [LacZ / Xgal] маркеров). Наконец, колонизация могут быть отображены непосредственно с помощью конфокальной микрoscopy.
Очень важно использовать здоровый несовершеннолетний кальмар для экспериментов. Поведенческие показатели здоровья бедных кальмаров включает купание в кругах (усыпить животное), или животных, которые остаются белыми и не изменяет их хроматофоров в буреют на темной поверхности (использовать с осторожностью). Как вариант существует в принимающей населения, большее число повторных экспериментов с меньшим числом животных, зачастую более ценна, чем меньшее число повторных экспериментов с большими размерами образца.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы благодарят Маттиаса Gyllborg для поддержки объекта кальмаров и комментариев к этой рукописи, Майкл Хэдфилд и Лаборатории морской Kewalo за помощь в коллекции полей и членов Рубин и Макфолл-Нгай Лаборатория вклад в этот протокол. Работа в лаборатории Мандель поддерживается NSF IOS-0843633.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Стекло Культура трубы, диаметром 16 мм | VWR | 47729-580 | |
| Крышки для стеклянных трубок культуры | Рыбак | NC9807998 | |
| Видимый спектрофотометр для определения OD 600 | Biowave | CO8000 | Любой спектрофотометр, способный измерять OD 600 будет работать. Это устройство может измерять OD 600 жидкость непосредственно в стеклянные трубки культуры. Некоторые корректировки посевной расчета могут быть необходимы в зависимости от инструмента используются. |
| GloMax 20/20 однотрубные люминометр | Promega | E5311 | Эквивалент Тернер BioSystems 20/20n люминометр. Включает в себя держатель микроцентрифужных трубку. |
| GloMax 20/20 Свет Стандартный | Promega | E5341 | Для люминометра калибровки. |
| Рефрактометр, Handheld | Фостер и Смит водных видов спорта | CD-14035 | Калибровку перед каждым использованием деионизированной водой. Промыть после каждого использования деионизированной водой, чтобы предотвратить накоплению солей. |
| Мгновенный океана (искусственного концентрата морской воды) | Foster & Smith водных видов спорта | CD-16881 | Подготовить на 35 ‰ в деионизованной воде, с использованием рефрактометра, а затем процеживают через 0,2 мкм SFCA фильтр. |
| Фильтрации | Nalgene | 158-0020 | Поверхностно-ацетата целлюлозы (SFCA) мембрана, 0,2 мкм. Мы наблюдали разные результаты с некоторыми поверхностно-содержащих PES фильтры. |
| Передача Пипетки | Рыбак | 13-711 -9 утра | Используя ножницы или лезвие бритвы, вырезать кончиком чистого над первым хребтом увеличить диаметр кончика пипетки и избегать сжимая кальмар птенцов. |
| Одноразовые миски образца (пластиковые стаканы) | Комета | T9s (9 гр.) | Чаши для прививки, с верхним диаметром 3 ¼ ", нижний диаметр 2 ¼", высота 3 ". Миски создать однородную среду, поскольку они не имеют нижний край, в котором кальмар может попасть в ловушку в с низким содержанием кислорода нишу. Размер оптимизирован 40 мл посевной. Доступные в webstaurantstore.com, # 619PI9. |
| Флаконы Drosophila | VWR | 89092-720 | Флакон диаметр соответствует отверстию на люминометра ФЭУ. |
| Пробирки на 1,5 мл Микроцентрифуга | ISC Bioexpress | C-3217-1CS | Трубы должны соответствовать форме пестики. |
| Этанол, 200 Доказательство | Рыбак | BP2818-100 | |
| Пестики | Кимбл Chase / Kontes | 749521-1500 | |
| Покрытие бисера, диаметром 5 мм | Кимбл Chase | 13500 5 | Подготовить 5 процентов труб и автоклав. |
Ссылки
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , PACON International. Honolulu, Hawaii. (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены