Method Article
Colonization von Euprymna scolopes Squid durch Vibrio fischeri
In diesem Artikel
Zusammenfassung
Die Methode beschreibt das Verfahren, mit dem die Hawaiian Bobtail Squid, Euprymna scolopes Und ihre bakteriellen Symbionten, Vibrio fischeri, Werden getrennt und dann eingeführt werden, um für spezifische Besiedlung des Tintenfisches Lichtorgel von den Bakterien ermöglichen angehoben. Colonization Erkennung von Bakterien stammende Lumineszenz und durch direkte Auszählen von Kolonien werden beschrieben.
Zusammenfassung
Spezielle Bakterien werden in Zusammenarbeit mit tierischem Gewebe 1-5 gefunden. Solche Wirt-Bakterien-Assoziationen (Symbiosen) kann schädlich sein (pathogene), haben kein Fitness-Folge (Kommensalen), oder von Vorteil sein (mutualistic). Während viel Wert wurde auf pathogene Interaktionen gegeben wurde, ist wenig über die Prozesse, die die reproduzierbare Erfassung von nützlichen / symbiotischer Bakterien aus der Umwelt zu diktieren bekannt. Die Lichtorgan Mutualismus zwischen der marinen Gram-negative Bakterium V. fischeri und die hawaiianische Bobtail Tintenfisch, E. scolopes, stellt eine sehr spezifische Interaktion, in denen ein Wirt (E. scolopes) stellt eine symbiotische Beziehung mit nur einer Bakterienart (V. fischeri) im Laufe seiner Lebensdauer 6,7. Biolumineszenz von V. produziert fischeri in dieser Interaktion ist daher ein Anti-Verdrängung Vorteil E. scolopes bei nächtlichen Aktivitäten 8,9, währenddas nährstoffreiche Wirtsgewebe stellt V. fischeri mit einer geschützten Nische 10. Während jeder Host-Generation wird diese Beziehung rekapituliert und damit zu einer vorhersehbaren Prozess, der im Detail in verschiedenen Stadien der Entwicklung symbiotische beurteilt werden kann. Im Labor der Jugendliche Tintenfisch Luke aposymbiotically (unbesiedelten), und, wenn innerhalb der ersten 30-60 Minuten gesammelt und an Symbionten-freies Wasser, kann nur durch die experimentelle Inokulum 6 besiedelt werden. Diese Wechselwirkung bietet daher ein nützliches Modell, bei dem die einzelnen Schritte, die für bestimmte Erwerb einer symbiotischen Mikroben aus der Umgebung 11,12 führen zu bewerten.
Hier beschreiben wir eine Methode, um den Grad der Kolonisierung, die beim neu geschlüpften aposymbiotic E. tritt bewerten scolopes werden (künstliche) mit Meerwasser ausgesetzt V. fischeri. Dieser einfache Test beschreibt Inokulation natürlichen Infektion und Erholungder bakteriellen Symbionten aus dem im Entstehen begriffenen Lichtorgel von E. scolopes. Es wird darauf geachtet, um eine konsistente Umgebung für die Tiere während symbiotische Entwicklung zu sorgen, insbesondere im Hinblick auf die Wasserqualität und Licht Cues. Methoden, um die symbiotische Bevölkerung beschrieben charakterisieren, gehören (1) Messung von Bakterien stammende Biolumineszenz, und (2) direkte Zählung der Kolonie erholte Symbionten.
Protokoll
1. Zubereitung von bakteriellen Inokula
- Tag 0
Zwei Tage vor der Impfung Tintenfisch, Teller die relevanten Bakterienstämme auf 13 LBS-Agar. - Inkubieren Bakterien bei 25-28 ° C über Nacht.
- Tag 1
Beimpfen 3 ml LBS-Medium in einem Glas Kultur Rohr mit einer Kolonie von jedem V. fischeri Belastung für eine Infektion. Bereiten Sie doppelte Röhren als Backup. - Tag 2
(Koordinieren bakteriellen 1,4-1,6 Schritten mit Tintenfisch Schritten von 3,7 bis 3,10)
1 h vor der Inokulation, Subkultur Bakterien 1:80 (37,5 ul) in 3 ml LBS in einem gläsernen Röhre und Kultur wachsen für 1 h mit Belüftung. - Messen der OD 600 von der Probe vor der Inokulation. Typische Messungen sind 0,3 bis 0,6 je nach Stamm.
- Für ein Ziel Inokulum von 3-5 x 10 3 CFU / ml Inoculum berechnen Volumen wie folgt: Inokulum Volumen (ul) = 1,25 / OD 600 (z. B. für OD 600 = 0,5, die berechnete Inokulum volume = 1.25/0.5 = 2,5 ul). Dieser Betrag ist direkt mit dem Meerwasser mit Tintenfisch in Schritt 4.1 hinzugefügt. Diese Berechnung kann es für verschiedene Stämme von V. eingestellt werden fischeri oder für die Impfung bei niedrigeren oder höheren Niveaus als die hier angegebenen.
2. Vorbereitung der Agarplatten für Enumeration der Inokula
- Bei jeder Behandlung Label LBS (2 pro Behandlung), um Platten-Proben des Inokulums in Schritt 4.1.
- Geben Sie 5 sterilen Plating Perlen pro Platte.
3. Sammlung von Squid Jugendliche
- Messen Sie den Salzgehalt von Instant Ocean mit dem Refraktometer und passen auf 35 ‰.
- Filter 1 l Instant Ocean mit der Filteranlage und eine angehängte Vakuumleitung oder Vakuumpumpe, um Filter-sterilisierte Instant Ocean (BSV) zu generieren. Oxydieren das Wasser durch Verwirbelung kräftig vor jeder Abgabe. The Filtereinheit für 2 Tage wieder verwendet werden.
- Aliquotieren 40-50 ml BSV in jede von zwei (2) Einweg Probeschälchen. Beschriften Sie ein als Earlies und eine als timelies.
- Bereiten Sie einen Überschuss von Kunststoff Transferpipetten für den Erwerb der juvenilen Tintenfisch durch Zerschneiden des Pipette ca. 1 cm von der Spitze, über den niedrigsten Erhebungen (siehe Abbildung 3). Dies ermöglicht eine größere Fläche, durch die der Tintenfisch bei Abholung übergeben werden können. Verwerfen Sie Transferpipetten, in dem es eine grobe freiliegenden Oberfläche.
- Mit vorbereiteten Transferpipetten, sammeln E. scolopes, dass über Nacht geschlüpft und Transfer zum Earlies Schüssel BSV. Frühe Jungtiere in das Ei für über 1 h waren und sind anfällig für die Ansiedlung von kontaminierenden V. fischeri in dem Ei-System. Verwenden Sie keine Earlies für empfindliche Experimente Kolonisation.
- Überprüfen Sie jedes Ei Tanks 30-45 min für neue Jungtiere. Sicherstellen, dass alle Jungtiere während jedes c werden gelöschtHeck. Entfernen Sie Schlüpflinge mit einer Transferpipette und Einzahlung in die Schüssel mit timelies BSV. Tiere in einer zeitgemäßen Weise gesammelt werden, sind verfügbar für die Kolonisation Experimente.
- Wenn die Sammlung abgeschlossen hat (~ 45 min nach Einbruch der Dunkelheit), überweisen Sie den Tintenfisch an den Haupt-Labor. Empirisch ist es vorteilhaft, die Tiere unter ununterbrochener Labor Lichtverhältnissen für 3 h Impfungen zu kolonisieren.
- Für jede Behandlung, bereiten Sie ein Gefäß mit 40 ml BSV. Fügen Tintenfisch zu den Schalen für den Test (maximal n = 40 pro Schale).
- Bereiten Sie eine zusätzliche Schüssel als aposymbiotic (negative) Kontrolle.
- Bereiten Sie einen dedizierten Transferpipette für jede Behandlung.
- Einschläfern Extra Tintenfisch in 2% igem Ethanol.
4. Squid Colonization
- Tag 2 - Mit einem P10 Pipetman, verzichten die berechnete Aliquot der Bakterien (Schritt 1.5) in jede Schale Tintenfisch (Schritt 3.8) für jede Behandlung. Starten Sie ein 3 h-Timer sofort nachdie ersten Impfung.
- Für jede Behandlung, erstellen Sie einen "Wirbel" in der Schüssel mit dem engagierten Transferpipette, indem Sie die Pipette in der Nähe der Kante der Schüssel und Auf-und Abpipettieren wiederholt, um die Wasser-und Tintenfisch für ca. 10 Sek. mischen. Die Durchmischung ist kritisch.
- Tafel 50 ul aus jeder Schüssel auf einen LBS-Agar-Platte aus Schritt 2.2 (für technische Replikate, Platte zwei 50 ul Platten pro Behandlung). Inkubation bei 25-28 ° C über Nacht.
- Bereiten Waschschüsseln (100 ml BSV / EA) für jede Behandlung.
- Bereiten Drosophila Fläschchen (4 ml BSV / EA) für jeden Tintenfisch.
- Nach genau 3 h, überweisen Sie den Tintenfisch zu ihren jeweiligen Waschschüsseln (komplette Behandlung für alle). Dies hält die Impfung.
- Gehen Sie jedes einzelne Tintenfisch seine eigene Drosophila Fläschchen mit BSV übertragen. Verwenden Sie einen bestimmten Transferpipette für jede Behandlung.
- Bewegen Tabletts von Drosophila Fläschchen an den squid Möglichkeit, auf den Tag / n zurückight Lichtzyklus die Tiere erlebt während der Embryogenese.
- Tag 3 - Prepare Drosophila Fläschchen (4 ml BSV / EA) für jeden Tintenfisch.
- Vor Einbruch der Dunkelheit bei 22-24 h nach der Inokulation übertragen jedes Tintenfisch zu einem neuen Drosophila-Fläschchen. Verwenden Sie einen bestimmten Transferpipette für jede Behandlung.
- Tag 4 - Bereiten Sie 1,5 ml Mikrozentrifugenröhrchen (1/squid) markiert.
- Vor Einbruch der Dunkelheit bei 46 bis 48 h nach der Inokulation, messen und notieren Sie die Lumineszenz der einzelnen Tintenfisch im Drosophila-Fläschchen (Luminometer-Set für 6 s Integration und auf Deckelverschluss Auto-lesen).
- Als negative Kontrolle für Hintergrundlumineszenz, messen Sie ein Fläschchen mit, die BSV enthält keine Tintenfische.
- Übertragen Sie jede Tintenfisch in einem Volumen von etwa 700 ul einer 1,5-ml-Mikrozentrifugenröhrchen aus Schritt 4.12. Gehen Sie zu einem Karton Tiefkühler. Sobald der Deckel auf den Kasten gelegt wird, entfernen Sie es nicht wie die Licht Cues für Bakterien Vertreibung sind nicht WELl-verstanden.
- Freeze Mikrozentrifugenröhrchen bei -80 ° C über Nacht.
5. Bestimmung von Colonization Levels
- Für jeden Tintenfisch, bereiten zwei (2) Mikrozentrifugenröhrchen mit jeweils 475 ul BSV (oder autoklaviert 70% Instant Ocean).
- Bereiten Stößel indem Sie zuerst eine Kimwipe den Stößer sauber und entfernen Sie groben Schmutz und / oder Gewebe.
- Platz Stößel Spitze nach unten in einem 50 ml Becherglas mit 95% Ethanol. Ethanol sollte in einer Höhe von etwa 3 cm, hinzugefügt werden.
- Für jeden Stößel, aus dem Becher zu entfernen, und wischen Sie die Spitze mit einem Kimwipe.
- Tauchen Sie ein Stößel zurück in den Ethanol-Bad, Ziehen und Stecken (Spitze nach oben) in ein Mikrozentrifugenröhrchen Rack und lassen Sie sie vollständig trocknen Luft für etwa 15 Minuten.
- Tauwetter Tintenfisch in einem Mikrozentrifugenröhrchen Rack (maximal n = 8).
- Falls erforderlich, passen Sie die Lautstärke auf 700 ul.
- Mit einem Stößel aus Schritt 5.5, stören die tierischen Gewebe, bis der Tintenbeutel rupren (das Wasser wird eine trübe graue Farbe drehen).
- Entfernen Sie den Stößel und sicherzustellen, dass alle Gewebe bleibt in der Röhre.
- Vortex das Gewebe kurz für genau 10 Sekunden (verwenden Sie eine Zeitschaltuhr).
- Willkommen das Gewebe für 10 min. Das Gewebe wird niederzulassen und die Bakterien und Tinte in Lösung bleiben. Für die Berechnungen, die folgen, ist die Bakterien / Tusche-Lösung die [A] Verdünnung (dh die E. scolopes Lichtorgel Homogenat in 700 ul). Serielle Verdünnungen 1.20 ([B], [C]) beschrieben.
- Für die [B] Verdünnung, fügen Sie 25 ul [A] zu einem der Reaktionsgefäße in Schritt 5.1 vorbereitet. Vortex.
- Für die [C] Verdünnung, fügen Sie 25 ul [B] zu einem der Reaktionsgefäße in Schritt 5.1 vorbereitet. Vortex.
- Tafel 50 ul jeder Verdünnung auf Agar LBS, repliziert 2 pro Behandlung.
- Die Inkubation bei 25-28 ° C über Nacht.
6. Datenanalyse
- Um die KBE / Lichtorgel (LO), Länder berechnent Kolonien auf der Platte für jede Behandlung, in denen 10 bis 400 Kolonien vorhanden sind, und verwenden Sie die entsprechende Formel:
KBE / LO = (Kolonien auf [A] Platte) x 14; oder
KBE / LO = (Kolonien auf [B] Platte) x 280; oder
KBE / LO = (Kolonien auf [C] Platte) x 5600. - Zeichnen einzelne Datenpunkte und Mediane auf einer logarithmischen Skala.
- Die Daten werden oft nicht normal verteilt, mit unterschiedlichen Varianzen, und die Ausreißer können biologisch sinnvoll Informationen enthalten. Deshalb bieten nicht-parametrischen Tests eine nützliche Methode, um festzustellen, ob die Behandlungen signifikant unterscheiden.
- Verwenden Sie GraphPad Prism Software für statistische Analysen. Für zwei Behandlungen, verwenden Sie den Wilcoxon-Rangsummentest. Für Vergleiche zwischen mehr als zwei Behandlungen, verwenden Sie den Kruskal-Wallis-Test mit den entsprechenden Post-Tests.
7. Repräsentative Ergebnisse
Ergebnisse aus einer Probe Kolonisierung Tests sind in 4 gezeigt. Zwei Stämme von V. fischeri, die verschiedene Ebenen der relativen Lumineszenz zeigen wurden jeweils in sechs squid eingeimpft, zusammen mit sechs Tintenfische, die als aposymbiotic (unbesiedelten) Kontrollen dienten. Die E. scolopes Symbionten, ES114 14, und desto heller Sepiola Robusta-Symbionten, SR5 15,16. Ähnliche Inokulumdichten (4A) und 100% Kolonisierung führen innerhalb von 3 h. Nach 48 h wurden die Lumineszenz Ebenen (4B) und Keimzahlen (4C) bestimmt, um die Besiedelung Kenntnisse des Stammes zu bewerten. Bestimmung der spezifischen Lumineszenz (4D; pro Bakterium) ermöglicht die Bestimmung der Helligkeit von jedem Bakterienstamm während der Symbiose.
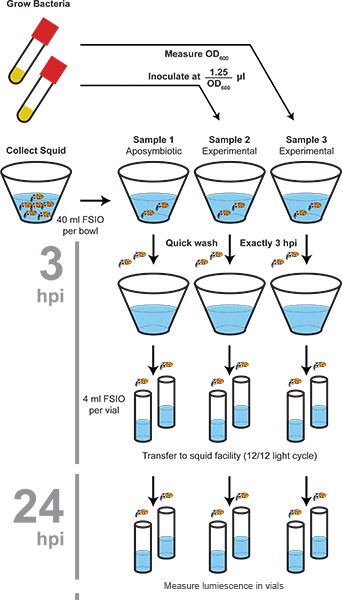
Abbildung 1. Ablaufschema des Verfahrens Kolonisation. Bakterien und Tintenfische werden separat geerntet dann an der angegebenen Inokulum vermischt. Squid gewaschen werden, dann neues Wasser nach 3 h, 24 h und 4 übertragen 8 h nach der Inokulation. Nach 48 h wurde die Lumineszenz gemessen wird und die Tiere werden eingefroren, dient die Oberfläche zu sterilisieren die Tiere. Light-Orgel Bakterien besiedelt bleiben bei -80 ° C lebensfähig durch ein Tauwetter (keine zusätzlichen Frost-Tau-Zyklen).

Abbildung 2. Flussdiagramm, Homogenisierung und Verdünnungsausstrichtechnik der Bakterien. Serielle 20-fache Verdünnungen den geeigneten dynamischen Bereich für die Zählung von Bakterien besiedelt.
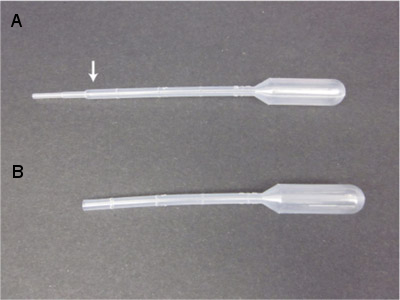
Abbildung 3. Transferpipetten mit einem entsprechend schmalen Schacht verjüngen sich zu einer engen Bohrung (A), die juvenile Tintenfisch beschädigen würde. Vorbehandlung durch das Abschneiden der engsten Stelle mit einer Schere oder einer Rasierklinge liefert ein geeignetes Werkzeug (B) für die Übertragung von jugendlichen Tintenfisch.
s/ftp_upload/3758/3758fig4.jpg "/>
Abbildung 4. Sample-Daten für eine Kolonisierung Assay. (A)-Spiegel von den Bakterien im Inokulum Schüsseln. (B) Lumineszenz einzelner Tintenfisch. (C) Koloniezählungen einzelner Tintenfisch. (D) besondere Lumineszenz einzelner Tintenfisch. Apo, Aposymbiotic (unbesiedelten Negativ-Kontrolle).
Diskussion
Die Kolonisierung beschriebene Assay ermöglicht die Analyse einer natürlichen symbiotischen Prozess, in einer kontrollierten Laborumgebung. Als solche kann sie verwendet werden, um die Besiedlung durch Mutantenstämmen, die von verschiedenen natürlichen Isolaten und unter unterschiedlichen chemischen Regime zu beurteilen. Variationen der beschriebenen Experimente werden üblicherweise verwendet, um verschiedene Aspekte der Symbiose zu bewerten. Die Kinetik der Kolonisierung ist anhand von Lichtemission während der ersten 24 Stunden, das sich automatisch in einem Szintillationszähler, in dem der Koinzidenzdetektor entfernt wurde nachgewiesen, gemessen werden. Ferner kann die relative Besiedlung verschiedener einem Stamm relativ zu einer anderen durch einen kompetitiven Kolonisierung Assay gemessen werden, wobei das Leistungsverhältnis der beiden Stämme in einer Gruppe von Tieren für die Eingangs-Verhältnis (Differentialdetektionsberechnungseinheit durch bestimmte Antibiotika-Resistenz, Fluoreszenz normalisiert oder chromogene [LacZ / Xgal] Marker). Schließlich können Kolonisation direkt durch konfokale MICR abgebildet werdenoscopy.
Es ist entscheidend, um gesund jugendlicher Tintenfisch für die Experimente zu verwenden. Behavioral Indikatoren für ein schlechtes Tintenfisch Gesundheit gehören Schwimmen im Kreis (das Tier einschläfern), oder Tiere, die weiß bleiben und nicht zu einer Veränderung ihrer Chromatophoren zu drehen auf eine dunkle Oberfläche braun (mit Vorsicht). Da gibt es Variationen in den aufnehmenden Bevölkerung, ist eine größere Anzahl von wiederholten Experimenten mit einer kleineren Anzahl von Tieren oft mehr wert als eine kleinere Anzahl von wiederholten Experimenten mit großen Fallzahlen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich Mattias Gyllborg für Kalmare von Einrichtungen zur Förderung und für Kommentare zu diesem Manuskript, Michael Hadfield und die Kewalo Marine Laboratory für die Unterstützung während der Bereich Sammlung, und Mitgliedern der Ruby und McFall-Ngai Labor für Beiträge zu diesem Protokoll. Arbeit in der Mandel-Labor ist von der NSF IOS-0843633 gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
| Glass Kultur Tubes, 16 mm Durchmesser | VWR | 47729-580 | |
| Caps für Kultur Glass Tubes | Fischer | NC9807998 | |
| Visible Spektralphotometer zur Bestimmung der OD 600 | Biowave | CO8000 | Jede Spektrophotometer für die Messung OD 600 funktionieren wird. Dieses Gerät kann die OD 600 von Flüssigkeit direkt zu messen in der Glas-Kulturröhrchen. Einige Einstellung des Inokulums Berechnung kann erforderlich sein, je nach dem verwendeten Instrument. |
| GloMax 20/20 Einzel-Tube Luminometer | Promega | E5311 | Entspricht der Turner BioSystems 20/20n Luminometer. Enthält die Mikrozentrifugenröhrchen Halter. |
| GloMax 20/20 Light Standard | Promega | E5341 | Für Luminometer Kalibrierung. |
| Refraktometer, Handheld | Foster and Smith Wassersport | CD-14.035 | Kalibrieren Sie vor jedem Gebrauch mit entionisiertem Wasser. Spülen Sie nach jedem Gebrauch mit deionisiertem Wasser auf Salz zu verhindern Aufbau. |
| Instant Ocean (künstlichem Meerwasser-Konzentrat) | Foster & Smith Wassersport | CD-16.881 | Bereiten Sie bei 35 ‰ in VE-Wasser, mit dem Refraktometer, filtriert dann über einen 0,2 um Filter SFCA. |
| Filtrationseinheit | Nalgene | 158-0020 | Tensidfreie Celluloseacetat (SFCA)-Membran, 0,2 um. Wir haben unterschiedliche Ergebnisse mit einigen tensidhaltigen PES Filter beobachtet. |
| Transferpipetten | Fischer | 13-711 -09.00 Uhr | Mit einer Schere oder Rasierklinge, schneiden Sie die Spitze sauber über dem ersten Grat, den Durchmesser der Pipettenspitze zu erhöhen und zu vermeiden Zusammendrücken der Tintenfisch Schlüpflinge. |
| Einweg Probeschälchen (Plastikbechern) | Komet | Von T9 (9 oz.) | Schalen für die Impfung, mit oberer Durchmesser 3 ¼ ", unterer Durchmesser 2 ¼", Höhe 3 ". Bowls schaffen eine homogene Umgebung, da sie keinen unteren Rand, in dem Tintenfisch in einer sauerstoffarmen Nische gefangen nicht bekommen können. Die Größe wird optimiert für 40-ml Inokulum. Verfügbar unter webstaurantstore.com, # 619PI9. |
| Drosophila-Vials | VWR | 89092-720 | Vial Durchmesser entspricht der Öffnung auf dem Luminometer PMT. |
| 1,5 ml Mikrozentrifugenröhrchen | ISC Bioexpress | C-3217-1CS | Rohre müssen passen die Form der Stößel. |
| Ethanol, 200 Proof | Fischer | BP2818-100 | |
| Pistille | Kimble Chase / Kontes | 749521-1500 | |
| Plating Perlen, 5 mm Durchmesser | Kimble Chase | 13500 5 | Bereiten Sie 5 pro Rohr und Autoklaven. |
Referenzen
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , PACON International. Honolulu, Hawaii. (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten