Method Article
La colonisation de Euprymna scolopes Squid par Vibrio fischeri
Dans cet article
Résumé
La méthode décrit la procédure par laquelle le calmar Hawaiian bobtail, Euprymna scolopes Et son symbiote bactérienne, Vibrio fischeri, Sont élevés séparément, puis introduit pour permettre la colonisation spécifique de l'orgue de lumière calmar par les bactéries. Détection de la colonisation par luminescence bactérienne dérivés et par le comptage de colonies directe sont décrits.
Résumé
Bactéries spécifiques sont trouvés en association avec des tissus animaux 1-5. Ces associations hôte-bactérie (symbioses) peut être préjudiciable (pathogène), n'a pas de conséquence de remise en forme (commensal), ou être bénéfique (mutualiste). Alors que beaucoup d'attention a été portée aux interactions pathogènes, on sait peu sur les processus qui déterminent l'acquisition reproductible bénéfiques / bactéries commensales de l'environnement. Le mutualisme lumière organe entre le milieu marin bactérie Gram négatif V. fischeri et le Hawaiian bobtail squid, E. scolopes, représente une interaction très spécifique dans lequel un hôte (E. scolopes) établit une relation symbiotique avec une seule espèce bactérienne (V. fischeri) tout au long de sa durée de vie 6,7. Bioluminescence produite par V. fischeri lors de cette interaction fournit un avantage anti-prédateurs à E. scolopes pendant les activités nocturnes 8,9, tandis quele tissu hôte riche en éléments nutritifs fournit V. fischeri avec une niche protégée 10. Au cours de chaque génération d'accueil, cette relation se résume, ce qui représente un processus prévisible qui peut être évaluée en détail à divers stades de développement symbiotique. Dans le laboratoire, le mineur calmars trappe aposymbiotically (non colonisés), et, si elles sont recueillies dans les 30-60 premières minutes et transféré à symbiote sans eau, ne peuvent être colonisés que par l'expérimentation inoculum 6. Cette interaction constitue donc un système modèle utile pour l'évaluation des différentes étapes qui mènent à l'acquisition d'un microbe spécifique symbiotique de l'environnement 11,12.
Nous décrivons ici une méthode pour évaluer le degré de colonisation qui se produit lorsque nouvellement éclos aposymbiotiques E. scolopes sont exposés (artificielle) d'eau de mer contenant des V. fischeri. Ce test simple décrit l'inoculation, l'infection naturelle, et la récupérationde la bactérie symbiote de l'organe de lumière naissante de E. scolopes. On prend soin de fournir un environnement cohérent pour les animaux en cours de développement symbiotique, en particulier en ce qui concerne la qualité de l'eau et signaux lumineux. Méthodes de caractérisation de la population symbiotique décrit incluent (1) de mesure de la bioluminescence des bactéries dérivés, et (2) de colonie directe comptage des symbiotes récupérés.
Protocole
1. Préparation des inoculums bactérien
- Jour 0
Deux jours avant l'inoculation calmars, plaque les souches bactériennes pertinentes sur LBS 13 gélose. - Incuber les bactéries à 25-28 ° C pendant la nuit.
- Jour 1
Inoculer 3 LBS ml de milieu dans un tube de culture en verre avec une colonie de chaque V. souche fischeri de l'infection. Préparer tubes en double que la sauvegarde. - Jour 2
(Coordonner les étapes 1.4 à 1.6 bactériennes avec des étapes de calmars 3.7-3.10)
1 h avant l'inoculation, les bactéries sous-culture 1:80 (37,5 pi) en 3 LBS ml dans un tube de verre de la culture et de grandir pendant 1 h avec l'aération. - Mesurer la DO 600 de l'échantillon avant l'inoculation. Mesures typiques sont de 0,3 à 0,6 selon la souche.
- Pour un inoculum cible de 3-5 x 10 3 CFU / ml de calculer le volume d'inoculum comme suit: volume d'inoculum (pl) = 1,25 / OD 600 (par exemple, Pour DO600 = 0,5, le volume d'inoculum calculée = 1.25/0.5 = 2,5 pi). Ce montant est ajouté directement à l'eau de mer contenant des calmars à l'étape 4.1. Ce calcul peut être nécessaire d'ajuster pour les différentes souches de V. fischeri ou pour l'inoculation à des niveaux inférieurs ou supérieurs à ceux indiqués ici.
2. Préparation de plaques de gélose pour la numération de l'inoculum
- Pour chaque traitement, LBS étiquette plaques (2 par traitement) à des échantillons de plaques de l'inoculum à l'étape 4.1.
- Ajouter 5 perles de placage stériles par plaque.
3. Collection des mineurs Squid
- Mesurer la salinité de l'océan instantanée à l'aide du réfractomètre et ajuster à 35 ‰.
- Filtrez 1 L d'Instant Ocean utilisant l'unité de filtration et une ligne vide ci-joint ou pompe à vide, afin de générer stérilisée par filtration instantanée océan (OFAS). Oxygéner l'eau en agitant vigoureusement avant chaque distribution. The unité de filtre peut être réutilisé pendant 2 jours.
- Aliquoter 40-50 ml de OFAS dans chacun des deux (2) échantillons bols jetables. Étiquette un comme primeurs et un autre comme timelies.
- Préparer un excès de pipettes de transfert en plastique pour l'acquisition de calmars mineurs en coupant la pipette d'environ 1 cm de la pointe, au-dessus des crêtes les plus bas (voir Figure 3). Cela facilite une plus grande surface à travers laquelle le calmar peut passer lors de la collecte. Jeter toutes les pipettes de transfert dans lequel il ya une surface rugueuse exposée.
- Utilisation de pipettes de transfert préparés, de recueillir E. scolopes que éclos durant la nuit et le transfert à la cuvette des primeurs OFAS. Nouveau-nés ont été précoces dans le système d'oeuf pour plus de 1 h et sont susceptibles d'être colonisés par la contamination V. fischeri dans le système d'œuf. Ne pas utiliser pour des expériences de colonisation primeurs sensibles.
- Vérifier que les citernes d'oeufs tous les 30-45 min pour les nouveau-nés de nouveaux. Veiller à ce que tous les nouveau-nés sont effacés au cours de chaque cdiable. Retirer les nouveau-nés avec une pipette de transfert, et le déposer dans le bol du timelies OFAS. Animaux recueillies en temps opportun sont disponibles pour des expériences de colonisation.
- Lorsque la collecte est terminée (~ 45 min après le crépuscule), de transférer le calmar au laboratoire principal. Empiriquement, il est avantageux de coloniser les animaux de moins de ininterrompues conditions lumineuses de laboratoire pour les inoculations h 3.
- Pour chaque traitement, de préparer un bol avec 40 ml OFAS. Ajouter le calmar aux bols pour le dosage (maximum n = 40 par bol).
- Préparez un bol supplémentaire en tant que aposymbiotiques (négative) de contrôle.
- Préparer une pipette de transfert dédié pour chaque traitement.
- Euthanasier calmars supplémentaire dans 2% d'éthanol.
4. Colonisation Squid
- Jour 2 - Utilisation d'un Pipetman P10, dispenser l'aliquote calculée de bactéries (étape 1.5) dans chaque bol de calmar (Étape 3.8) pour chaque traitement. Démarrer une minuterie 3 h, immédiatement aprèsla première inoculation.
- Pour chaque traitement, créer un "vortex" dans le bol avec la pipette de transfert dédiée en plaçant la pipette à proximité du bord de la cuvette et de pipetage de haut en bas plusieurs fois pour mélanger l'eau et de calmars environ 10 secondes. Approfondie de mélange est critique.
- Planche 50 pi de chaque bol sur une plaque de gélose LBS à l'étape 2.2 (pour des raisons techniques réplique, plaque deux plaques 50 pi par traitement). Incuber à 25-28 ° C pendant la nuit.
- Préparer vasques (100 ml OFAS / ch) pour chaque traitement.
- Préparer flacons drosophile (4 ml OFAS / ch) pour chaque calmar.
- Après exactement 3 h, de transférer le calmar à leurs vasques respectifs (complète pour tous les traitements). Cela empêche l'inoculation.
- Passez à transférer chaque calmar individu à son propre flacon Drosophila OFAS. Utiliser une pipette de transfert désignée pour chaque traitement.
- Déplacer les plateaux de flacons de Drosophila pour l'installation de calmar pour revenir à la jour / night cycle lumière les animaux a connu durant l'embryogenèse.
- Jour 3 - Préparer les flacons drosophile (4 ml OFAS / ch) pour chaque calmar.
- Avant le crépuscule à 22-24 h post-inoculation, transférer chaque calmars à un nouveau flacon drosophile. Utiliser une pipette de transfert désignée pour chaque traitement.
- Jour 4 - Préparer étiquetés 1,5 ml microtubes (1/squid).
- Avant le crépuscule à 46-48 h post-inoculation, mesurer et enregistrer la luminescence de chaque calmar dans le flacon la drosophile (ensemble luminomètre pour l'intégration 6 s et d'auto-lire sur la fermeture du couvercle).
- En tant que témoin négatif pour la luminescence de fond, mesurer un flacon avec OFAS qui ne contient pas de calmars.
- Transférer chaque calmars dans un volume d'environ 700 pi à un tube de 1,5 ml de l'étape 4.12. Déplacer vers une boîte de carton congélateur. Une fois que le couvercle est placé sur la boîte, ne le retirez pas tant que les signaux lumineux pour l'expulsion des bactéries ne sont pas well-compris.
- Congeler des microtubes à -80 ° C pendant la nuit.
5. Détermination des niveaux de colonisation
- Pour chaque calmar, préparer deux microtubes (2), chacun avec 475 ul OFAS (ou autoclave 70% Instant Ocean).
- Préparer pilons d'abord l'aide d'un Kimwipe pour nettoyer le pilon et le retirer brut débris et / ou de tissus.
- Lieu pilons pointe vers le bas dans un bécher de 50 ml contenant de l'éthanol à 95%. Éthanol doit être ajouté à une hauteur d'environ 3 cm.
- Pour chaque pilon, retirer du bécher et essuyez l'embout avec un Kimwipe.
- Trempez un pilon dans le bain d'éthanol, retirer et insérer (pointe vers le haut) dans un rack microtube et laisser sécher complètement pendant environ 15 minutes.
- Calmars dégel dans un rack microtube (maximum = n 8).
- Si nécessaire, ajuster le volume à 700 pi.
- L'utilisation d'un pilon à l'étape 5.5, de perturber le tissu animal jusqu'à ce que l'encre sac RUPtures (l'eau prend une couleur gris sale).
- Retirez le pilon et d'assurer tous les tissus reste dans le tube.
- Vortex brièvement les tissus pendant exactement 10 secondes (utilisez une minuterie).
- Laisser le tissu de se reposer pendant 10 min. Le tissu se tasser et les bactéries et d'encre restent en solution. Pour les calculs qui suivent, les bactéries, ou une solution d'encre est le [A] de dilution (c.-à-l'homogénat E. scolopes orgue de lumière dans 700 pi). Dilutions 1:20 série ([B], [C]) sont décrits ci-dessous.
- Pour la [B] de dilution, ajouter 25 ul [A] à l'un des microtubes préparés à l'étape 5.1. Vortex.
- Pour la touche [C] de dilution, ajouter 25 ul [B] à l'un des microtubes préparés à l'étape 5.1. Vortex.
- Planche 50 ul de chaque dilution sur gélose LBS, 2 répétitions par traitement.
- Incuber les plaques à 25-28 ° C pendant la nuit.
6. Analyse des données
- Pour calculer la CFU / orgue de lumière (LO), les payscolonies t sur la plaque pour chaque traitement, dans lequel 10-400 colonies sont présentes, et d'utiliser la formule appropriée:
UFC / LO = (colonies sur [A] la plaque) x 14;
UFC / LO = (colonies sur [B] Plaque) x 280, ou
UFC / LO = (colonies sur [C] Plaque) x 5600. - Tracer points de données individuels et les médianes sur une échelle logarithmique.
- Les données ne sont souvent pas normalement distribuées, avec des variances différentes, et les valeurs aberrantes peuvent contenir des informations biologiquement significative. Par conséquent, des tests non paramétriques de fournir une méthode utile pour déterminer si les traitements diffèrent de manière significative.
- Utilisez un logiciel GraphPad Prism pour l'analyse statistique. Pour deux traitements, utiliser le test de Wilcoxon. Pour les comparaisons entre plus de deux traitements, utiliser le test de Kruskal-Wallis avec des post-tests appropriés.
7. Les résultats représentatifs
Les résultats d'une analyse colonisation échantillon sont présentés dans la figure 4. Deux souches de V. fischeri qui présentent différents niveaux relatifs de luminescence ont été inoculés en six calmars, ainsi que six calmars qui a servi de aposymbiotiques (non colonisé) contrôles. Le E. scolopes symbiote, ES114 14, et plus brillant de la Sepiola robusta symbiote, SR5 15,16. Les niveaux d'inoculum similaires (Fig. 4A) conduire à la colonisation de 100% à moins de 3 h. À 48 h, les niveaux de luminescence (figure 4B) et le nombre de CFU (Fig. 4C) ont été déterminées pour évaluer la compétence de colonisation de la souche. Détermination de la luminescence spécifique (figure 4D; bactérie per) permet la détermination de la luminosité de chaque souche bactérienne pendant la symbiose.
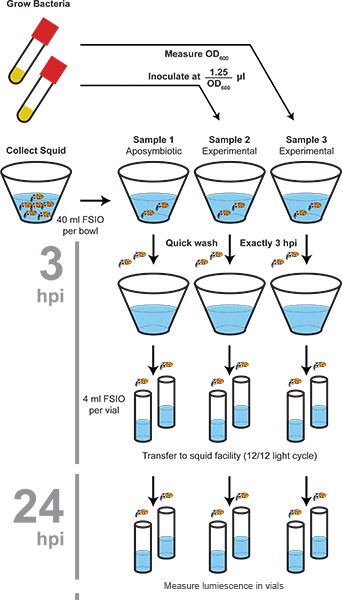
Diagramme Figure 1. De la procédure de la colonisation. Les bactéries et les calmars sont récoltés séparément, puis mélangés à de l'inoculum spécifié. Squid sont lavées, puis transférée à l'eau nouvelle à 3 h, 24 h, et 4 8 h après l'inoculation. A 48 h, la luminescence est mesurée et les animaux sont congelés, qui sert à la surface-stériliser les animaux. Light-organe colonisé les bactéries restent viables à -80 ° C à travers un dégel (pas d'autres cycles gel-dégel).

Diagramme Figure 2. Illustrant l'homogénéisation et dilution et étalement des bactéries. Serial de 20 dilutions de fournir la gamme dynamique appropriée pour le dénombrement des bactéries colonisés.
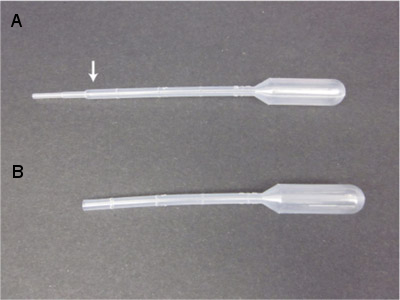
Figure 3. Pipettes de transfert avec un cône du vilebrequin de façon appropriée étroit pour un alésage étroites (A) qui pourraient endommager le calmar juvénile. Prétraitement en coupant la section la plus étroite avec des ciseaux ou une lame de rasoir donne un outil approprié (B) pour le transfert de calmars juvénile.
s/ftp_upload/3758/3758fig4.jpg "/>
Figure 4. Les données d'échantillon pour un test de la colonisation. (A) Les niveaux des bactéries dans les bols inoculum. (B) Luminescence de calmars individuelle. (C) Le dénombrement des colonies de calmars individuelle. (D) de luminescence spécifique de calmars individuelle. Apo, aposymbiotiques (non colonisés contrôle négatif).
Discussion
Le test décrit la colonisation permet l'analyse d'un processus naturel de symbiose dans un environnement de laboratoire contrôlé. En tant que tel, il peut être utilisé pour évaluer la colonisation par des souches mutantes, par différents isolats naturels, et sous des régimes différents produits chimiques. Variations sur les expériences décrites sont couramment utilisés pour évaluer différents aspects de la symbiose. La cinétique de la colonisation peut être mesurée en examinant la luminescence pendant les 24 premières heures, qui peut être détecté automatiquement dans un compteur à scintillation dans lequel le détecteur de coïncidence a été enlevé. En outre, la capacité de colonisation par rapport d'une souche par rapport à l'autre peut être mesurée par un dosage compétitif colonisation, dans lequel le rapport de sortie des deux souches en une série d'animaux sont normalisées à l'entrée rapport (de détection différentielle par la résistance aux antibiotiques distincte, la fluorescence , ou chromogènes [LacZ / Xgal] marqueurs). Enfin, la colonisation peut être imagée directement par micr confocaleoscopy.
Il est essentiel d'utiliser saine calmar juvénile pour les expériences. Indicateurs comportementaux de la santé des pauvres calmars incluent la natation dans les milieux (euthanasier l'animal), ou les animaux qui restent blancs et ne modifient pas leurs chromatophores à virer au brun sur une surface sombre (à utiliser avec précaution). Comme il existe des variations dans les populations d'accueil, un plus grand nombre d'expériences répétées avec de plus petits nombres d'animaux est souvent plus précieux qu'un petit nombre d'expériences répétées avec échantillons de grande taille.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier pour le soutien Mattias Gyllborg installation calmars et des commentaires sur ce manuscrit, Michael Hadfield et le Laboratoire Kewalo Marine pour l'assistance au cours de collecte sur le terrain, et les membres du Laboratoire de Ruby et McFall-Ngai pour ses contributions à ce protocole. Le travail dans le laboratoire Mandel est soutenu par la NSF IOS-0843633.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Entreprise | Numéro de catalogue | Commentaires |
| Les tubes de culture en verre, 16 mm de diamètre | VWR | 47729-580 | |
| Bouchons pour tubes de culture en verre | Pêcheur | NC9807998 | |
| Spectrophotomètre Visible pour la détermination de DO 600 | Biowave | CO8000 | Toute spectrophotomètre capable de mesurer DO 600 va fonctionner. Cet appareil peut mesurer la DO 600 de liquide directement dans les tubes de culture en verre. Un certain ajustement du calcul inoculum peut être nécessaire en fonction de l'instrument utilisé. |
| Glomax 20/20 monotube luminomètre | Promega | E5311 | Equivalent à la luminomètre Turner BioSystems 20/20n. Inclut le support microtube. |
| Glomax 20/20 Standard Light | Promega | E5341 | Pour l'étalonnage luminomètre. |
| Réfractomètre, ordinateur de poche | Foster et Smith Aquatics | CD-14035 | Calibrer avant chaque utilisation avec de l'eau déminéralisée. Rincer après chaque utilisation avec de l'eau déminéralisée pour éviter l'accumulation de sel. |
| Instantanée océan (artificielle concentré d'eau de mer) | Foster & Smith Aquatics | CD-16881 | Préparer à 35 ‰ dans l'eau déminéralisée, à l'aide du réfractomètre, puis filtrer à travers un filtre de 0,2 um SFCA. |
| Unité de filtration | Nalgene | 158-0020 | Sans tensioactif acétate de cellulose (SFCA) membrane, 0,2 um. Nous avons observé des résultats variables avec quelques filtres tensio-actif contenant du PSE. |
| Pipettes de transfert | Pêcheur | 13-711 -9 heures | L'aide de ciseaux ou lame de rasoir, couper la pointe proprement-dessus de la première arête d'augmenter le diamètre de l'embout de la pipette et d'éviter les serrant les nouveau-nés de calmars. |
| Bols jetables (exemples gobelets en plastique) | Comète | T9S (9 onces) | Bols pour l'inoculation, avec un diamètre supérieur de 3 ¼ ", diamètre inférieur de 2 ¼", hauteur 3 ". Bols de créer un environnement homogène car ils n'ont pas rebord inférieur, dans lequel le calmar peut se retrouvent piégés dans une niche à faible teneur en oxygène. La taille est optimisée pour 40 ml d'inoculum. Disponible à l'adresse webstaurantstore.com, # 619PI9. |
| Flacons Drosophila | VWR | 89092-720 | Diamètre correspond à l'ouverture Vial sur le PMT luminomètre. |
| 1,5 ml Microtubes à centrifuger | ISC Bioexpress | C-3217-1CS | Les tubes doivent s'adapter à la forme des pilons. |
| L'éthanol, 200 Proof | Pêcheur | BP2818-100 | |
| Pilons | Kimble Chase / Kontes | 749521-1500 | |
| Perles de placage, 5 mm de diamètre | Kimble Chase | 13500 5 | Préparer 5 par tube et placer en autoclave. |
Références
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , PACON International. Honolulu, Hawaii. (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon