Method Article
Оценка раковых стволовых клеток миграции с помощью Compartmentalizing микрофлюидных устройств и изображений живых клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Compartmentalizing микрофлюидных устройство для исследования раковых стволовых клеток миграции описано. Этот роман платформы создает жизнеспособную сотовой микросреды и позволяет микроскопическим визуализации живых передвижения клетки. Высокая подвижность раковых клеток выделяют для изучения молекулярных механизмов агрессивного проникновения, что может привести к более эффективному лечению будущем.
Аннотация
In the last 40 years, the United States invested over 200 billion dollars on cancer research, resulting in only a 5% decrease in death rate. A major obstacle for improving patient outcomes is the poor understanding of mechanisms underlying cellular migration associated with aggressive cancer cell invasion, metastasis and therapeutic resistance1. Glioblastoma Multiforme (GBM), the most prevalent primary malignant adult brain tumor2, exemplifies this difficulty. Despite standard surgery, radiation and chemotherapies, patient median survival is only fifteen months, due to aggressive GBM infiltration into adjacent brain and rapid cancer recurrence2. The interactions of aberrant cell migratory mechanisms and the tumor microenvironment likely differentiate cancer from normal cells3. Therefore, improving therapeutic approaches for GBM require a better understanding of cancer cell migration mechanisms. Recent work suggests that a small subpopulation of cells within GBM, the brain tumor stem cell (BTSC), may be responsible for therapeutic resistance and recurrence. Mechanisms underlying BTSC migratory capacity are only starting to be characterized1,4.
Due to a limitation in visual inspection and geometrical manipulation, conventional migration assays5 are restricted to quantifying overall cell populations. In contrast, microfluidic devices permit single cell analysis because of compatibility with modern microscopy and control over micro-environment6-9.
We present a method for detailed characterization of BTSC migration using compartmentalizing microfluidic devices. These PDMS-made devices cast the tissue culture environment into three connected compartments: seeding chamber, receiving chamber and bridging microchannels. We tailored the device such that both chambers hold sufficient media to support viable BTSC for 4-5 days without media exchange. Highly mobile BTSCs initially introduced into the seeding chamber are isolated after migration though bridging microchannels to the parallel receiving chamber. This migration simulates cancer cellular spread through the interstitial spaces of the brain. The phase live images of cell morphology during migration are recorded over several days. Highly migratory BTSC can therefore be isolated, recultured, and analyzed further.
Compartmentalizing microfluidics can be a versatile platform to study the migratory behavior of BTSCs and other cancer stem cells. By combining gradient generators, fluid handling, micro-electrodes and other microfluidic modules, these devices can also be used for drug screening and disease diagnosis6. Isolation of an aggressive subpopulation of migratory cells will enable studies of underlying molecular mechanisms.
протокол
1. BTSC в клеточная диссоциация
BTSCs являются производными от уже существующих культур, выращенных в бессывороточной стволовых клеток среду, как нейросферы. Культура которой описано ранее 10, 11.
- Подготовка клеточной суспензии из BTSC полученных нейросферы. BTSC полученных нейросферы собраны в 15 мл коническую трубку и центрифугировали при 900 оборотов в минуту в течение 5 минут. Быстрее центрифугирования может сдвига и / или повреждения нейросферы. Супернатант отсасывали и нейросфер культуры суспендируют в 0,5 мл подогретого Accutase. Этот раствор выдерживают в течение 5-10 минут при температуре 37 ° C позволяет нейросферы, чтобы ослабить. Клетки механически нарушается с 10-20 нежные удары P100 пипетки, а затем 1,5 мл стволовой клеточной среде добавляют к клеткам, чтобы нейтрализовать Accutase.
- BTSCs затем центрифугировали при 1300 оборотах в минуту в течение 5 минут, и снова суспендируют в 1 мл средней стволовых клеток.
- А 50 мкл удаляют из suspensиона и помещен в микроцентрифуге трубки для подсчета клеток. 50 мкл трипанового синего добавляют в пробирку Эппендорфа и суспензию помещают в гемоцитометр для подсчета клеток.
- При необходимости, после подсчета клеток, дополнительный средний стволовых клеток добавляется в BTSC подвески, чтобы дать плотности клеток 20000 живых клеток / мкл СМИ.
2. Изготовление двух-слоистых SU-8 Мастер и литье штамп PDMS (см. рисунок 1)
Мы используем оптической литографии и мягкой литографии для изготовления СУ-8 Мастер и PDMS марки, которые необходимы для сборки микрофлюидных устройств. Немного отличается от стандартной процедуры 12, наши СУ-8 мастер состоит из двух слоев. 3-мкм высотой микроканалов отлиты в первый / нижнего слоя в начале процесса, в то время как 250-мкм высотой посева и получения камерах находятся в секунду / верхнего слоя. Для правильного соединения между двумя культуры отсеков (микроканальныхы и камеры), два слоя должны быть точно выровнены в положении. Тем не менее, толщину и непрозрачность второго слоя являются достаточно большими, чтобы заблокировать координатных / оптический выравниватель доступ к нижней черты. Здесь мы разрабатываем маски с доверительной маркеров при удаленном положении. Таким образом, эти маркеры в первом слое может быть выборочно экранированы при вращении второго слоя. В результате, оба слоя особенностей сделаны в один мастер и готов для формования в барельефом штамп PDMS.
- Разработать и подготовить два фото-масок. Одна маска состоит из двух координатных маркеры и массив микроканалов (400 мкм и 10-50 мкм в ширину) для первого слоя. Другая маска состоит из посева и приемных камер (2 мм в длину и 600 мкм в ширину) для второго слоя. Обе маски предназначены в Illustrator (Adobe, Калифорния), лазерные печатные на прозрачной пленки (тонких металлических частей, штат Колорадо), очищать изопропанола и сушат на воздухе.
- Сделайте первый слойСУ-8 фоторезиста (MicroChem, штат Массачусетс) в соответствии с руководством по продукции от поставщика. Во-первых, спин-пальто ручка пластины (WRS материалы, Калифорния) с 3-мкм толщины фоторезиста Су-8 (5), а затем мягкой выпечки. Фоторезиста является то, подвергшихся воздействию ультрафиолетового и вылечить с соответствующей маски в тесном контакте, а затем после выпечки и развивается.
- Спин-пальто второй слой с 250 мкм Су-8 (2100). В целях предотвращения толстые фоторезиста, блокируя доверительного маркеры с первого слоя, мы рассмотрим эти области скотчем в предыдущие спин-покрытия второго слоя. Лента затем снимают выявить маркеры для выравнивания цели.
- УФ-подвергать второй слой со второй маски. С выравниванием маркеров показало, что просто выровнять их на те, во второй маски с использованием оптических выравниватель маски. Второй слой фоторезиста является то, подвергшихся воздействию ультрафиолетового и лечение в тесном контакте, а затем после выпечки и развивается.
- Anti-палки пальто привели мастера. Для оказания помощи в удалении вылечить PDMS, Су-8 мастер может быть силанизированного с помощью осаждения из паровой фазы, чтобы сделать поверхность антипригарной типа покрытия. Просто поместите его в эксикаторе в течение не менее одного часа, с несколькими каплями трихлор (1Н, 1Н, 2Н, 2Н-перфтороктил) силана решения в вакууме.
- Mold PDMS с мастером. Смешать базы форполимера и целитель из PDMS Sylgard 184 (Dow Corning, штат Мичиган) в соотношении 10:1 тщательно. Поместите его в эксикатор для вакуумной дегазации пока нет воздушного пузыря не наблюдается. Вылейте смесь на маску и Дега снова, если новый пузырь вводится воздух. Лечение плесень на уровне плиты в течение 2 часов при 90 ° С. После охлаждения до комнатной температуры, осторожно освободить штамп PDMS. Таким образом, культивирование каналы, закрепленные в PDMS и готовы к сборке устройства. Мастер многоразовые для литья, пока он треснул или изношены. Антипригарное покрытие должно быть выполнено еще раз, когда липкость возвращается.
3.Собрание микрофлюидных устройств и культивирования клеток (рис. 2)
Для того, чтобы культура клеток, функции гравировкой PDMS штамп крепится на стекло покровное для формирования закрытых каналах. Входы и выходы создаются для загрузки культуры / средства массовой информации. Между тем, очистки и других процедур на подложку из стекла и штамп PDMS, необходимые для обеспечения клеточной совместимости.
- Сделать водохранилища через штамп PDMS использованием биопсии перфоратора. Мы выбираем их диаметр составляет 6 мм. Эти резервуары служат для двух целей. Одним из них является проведение дополнительных питательных веществ для роста клеток. Другой для доступа пипетки загрузки и вакуум-аспирации.
- Замочите штамп PDMS в 70% этаноле в течение 30 минут, а затем промойте его деионизированной воде в течение еще 10 мин. Цель состоит в том, чтобы очистить потенциал органических остатков введены в процесс изготовления, и несшитой PDMS загрязнения. Более интенсивная и тщательная очистка процессов, таких как органические добыча 13 И Сокслета добычи 14 были использованы в другом месте. Тем не менее, мы обнаружили, что нет необходимости в BTSC культуры.
- Стерилизовать штамп PDMS использование автоклава (121 ° C, 35 мин). Этот шаг завершает реакцию сшивания PDMS. Начиная с этого этапа и до стадии 3.6, все процедуры, принятых в стерильных условиях.
- Штамп PDMS затем положил на стекло покровное, который ранее покрытые поли-L-лизин. 15-17 устройство затем покрывают ламинин, заполняя канал с ламинином решение в течение ночи при 37 ° C. Ламинин всасывается из устройства и устройства промывают стволовые клетки среде.
- Загрузите клеточной суспензии со стадии 1 в водоемы и каналы. 11 мкл диссоциированных клеток находятся в одном посеве водохранилища. Вакуум-аспирация используется, чтобы заставить клетки в посеве камеру, если это необходимо. Дополнительные 7 мкл клетки помещают соседних резервуара посева. Примечание: Плотность Средняя клетка 20000 клеток / мкл СМИ. Кормовойэ пяти минут, посева и получения водохранилищ залиты СМИ.
- Поместите 0.5-1 мм предварительно автоклавного PDMS лист сверху. Естественно, произошло поверхность сцепления между двумя частями PDMS сделает культуре клеток запечатанный и готова к транспортировке, инкубации и микроскопических изображений.
4. Долгосрочные покадровой визуализации BTSC миграции с Биостанция IM (Nikon Instruments Inc, Мелвилл, США).
Сочетание камеры, программного обеспечения и инкубатором все в одном окне, это микроскопическая система позволяет изображение культуры клеток, не нарушение в течение нескольких дней. Кроме того, уникальный дизайн двигатель перемещает объектив и держит образец этапе стационарного в точке посещения функцию. Это делает его практичным изображение параллельных экспериментов и передвижения трек ячейки в высокой пропускной способности анализа.
- Предварительно равновесие биостанции IM в течение 45 минут для стабилизации температуры, влаги и воздуха. Добавление нескольких воде продолжениеained блюд в камере для образца используется для поддержания нормальной влажности.
- Загрузите клетки изолирующий устройство в образце камеры микроскопа, и в центре его с помощью микро-пинцет.
- Установить фокус, положение точки и моменты времени в биостанции программное обеспечение и начать замедленной.
5. Представитель результаты:
Примеры визуального осмотра и характеристика миграции клеток рака с помощью compartmentalizing микрофлюидных устройство показаны на рисунках 3 и 4. Клеточных линий является BTSC. С нашей текущей настройки, фаза изображений культуре клеток может быть непрерывно записывается так долго, как 5 дней (рис. 3) и так часто, как каждые 2 секунды (рис. 4). За 5 дней, культуру средств массовой информации должны быть заменены для пополнения питательных и отходы удаляются. Наша долгосрочная покадровой определяет вращающихся последовательность из шести этапов клеток во время своей миграции, основанные на морфологических изменений. В качестве иллюстрации,чены на рисунке 3, мы представляем их как (I) до миграции, (II) инициации, (III) путем разведки, (IV), крейсерская, (V) назначения-exloration и (VI) после миграции. В приемной камере, веретенообразных клеток остаются на стадии (I), как и в объемных опухолей, которые могут расти, делиться и постепенно мигрировать. Как они подходят микроканальных вход, несколько клеток перейдем к стадии (II), когда они расширяются и генерировать клей выступ. Только один из них может занять вход и перейти к стадии (III), которые могут исследовать миграцию направлении. Как только клетка определяет направление миграции, он переходит к стадии (IV) в круиз по микроканальных в устойчивую и высокую скорость, которая проводится на протяжении всего микроканала. В конце микроканальных, сотовые переходит к стадии (V), чтобы исследовать открытое пространство приемную камеру, а затем этап (VI). В микроканальных, мигрирующие власти в основном порожденных блеббинг деятельности, как показано на рисунке 4, подобный тому, амебоидной челл. Блеббинга клеток и мембраны деформации полностью записаны здесь.
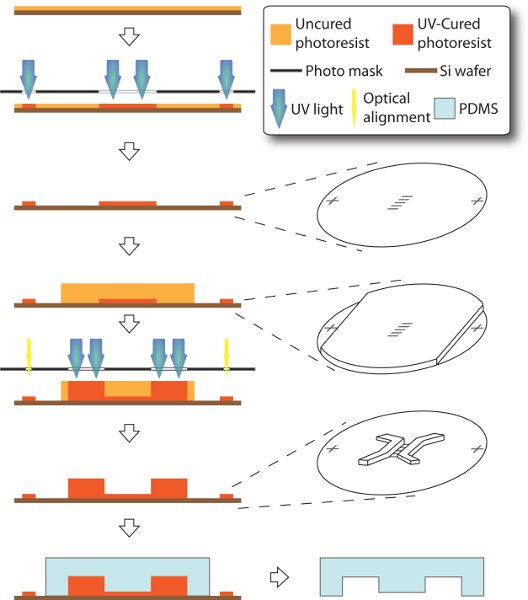
Рисунок 1. Схемы изготовления микрофлюидных устройства. Весь процесс осуществляется на 3-дюймовым пластины кремния через ручку модифицированный метод мягкой литографии. 3-мкм высотой микроканалов и выравнивания маркеров производится, как и в первом слое. Тогда 250-мкм толщиной SU-8 является спин-покрытием, в то время как выравнивание маркеры покрыты скотчем, так что они в дальнейшем могут быть доступны, чтобы замаскировать выравниватель не видел блокировки густой фоторезиста. Таким образом, функции камеры могут быть сделаны как второй слой и точно согласованы с первым слоем. PDMS штамп в конечном итоге формируется с результатом мастера.

Рисунок 2. Схемы сборки устройства и процесса клетки посева. Окружена PDMS и GLзадницей покровное, 3D-пространстве культивирования состоит из камер, резервуаров и микроканалов. Посев камера заполняется культуры клеток, в то время как в приемную камеру первоначально заполнены бесклеточной СМИ. Микроканалов, которые соединяют между ними обеспечивают клетки мигрируют след от посева стороны принимающей стороны.

Рисунок 3. BTSC миграции через микроканала. Верхняя: снимки покадровой показать одну ячейку (выделено зеленым) мигрирует более 400 мкм от посева стороны принимающей стороны. Весь путь занимает около 2 дней, включая последовательность клеточных морфологических изменений. Шкалы составляет 40 мкм. Опустите: мультфильм представления из шести этапов миграции. Предварительно миграции (я): В посеве камеры, веретенообразные и делиться клетки постепенно мигрируют вдоль друг друга. Клетки вблизи микроканальных гонки входом друг с другом посредством поляризационного тела клетки и электронного xerting ламеллоподии выступ. Посвящение (II): мигрирующие клетки с высокой мощностью занимает входного канала в то время как ее конкуренты будут отступать. Путь-разведки (III): миграционные изменения клеток в амебоидной режиме с небольшой полярностью. Этот режим миграции является чрезвычайно подвижны и способны изучить пути во всех направлениях блеббинг небольшие выступы мембраны. Крейсерская (IV): После того как пути миграции определяется, клетка превращается в адаптированный амебоидной режиме, поддерживая дополнительные большим выступом заголовком вперед. Таким образом, клетка поддерживает высокую подвижность, а также устойчивое направление и скорость. Направление-разведки (V): По пути конец, клетки замедляется и развивается filopodias изучить приемной камере для любого вторжения цели. После миграции (VI): После ввода в приемную камеру, мобильный превращается в звезду-образную форму и сохраняет высокую подвижность, но не определяли направление.
"/>
Рисунок 4. Снимки покадровой показать цикл блеббинг деятельности и мембранная деформации BTSC: (AB). посвящения; (BD). Расширение; (DF). Отвод. Стрелки и кривой линии показывают направление и расположение мембраны деформации, соответственно. Снимки собираются каждые 8 секунд.
Обсуждение
Микрофлюидных устройства и записи изображений технику, представленные здесь позволяет визуально характеристик клеточной морфологии во время миграции. По сравнению с существующими традиционными методами, микрофлюидных платформа имеет преимущества экономичности, высокой пропускной способности и гибкости конструкции. Представленные микроскопической системы визуализации позволяет изучать и регистрации долгосрочных живой миграции клеток. Объектив собственная функция позволяет отслеживать несколько путей миграции в изображение с высоким разрешением, не нарушая образца.
При сборке устройства, штамп PDMS не является постоянно соединена с покровным стеклом для удобства нанесения покрытия PDL (шаг 3,4). Это имеет решающее значение для достижения хорошего уплотнения для успеха этого протокола. Загрязнение введен с устройством изготовления, таких, как пузырек воздуха в печать или пыли / мусора на подложке, может поставить под угрозу связи и привести к утечке жидкости. Таким образом, treatiнг устройство в пыли образом важно не допустить ошибки устройства. До PDL-покрытия, стекла покровные являются азотная кислота лечение и PDL раствор центрифугируют для удаления пыли / мусора. Мы считаем, скотч, алкоголь полоскания, и вода ванны очень полезны для удаления пыли / мусора с штамп PDMS, если чистый номер не доступен. После штамп PDMS контакте с покровным стеклом, постукивая штамп осторожно с помощью пинцета облегчает печать.
BTSCs может быть обогащен из человеческих образцов операционного зала через сферу культуры в стволовой клеточной среде, похожие на культуре нормальных нервных стволовых клеток 10. BTSCs обогащенные таким образом продемонстрировать стволовых клеток, как свойства, такие как экспрессия маркеров стволовых клеток (CD133, нестин), дифференциация на несколько нейронных линий (глии и нейронов), и опухоль начала в ортотопической иммунодефицитных мышей с моделью всего 100 клетки 18. Хотя некоторые дебаты существует около purifiкатионов и обслуживание 1 BTSCs, 19-21, сфера взрослый BTSCs лучше поддерживать фенотипа и генотипа родительских опухоли 22-24.
Разобщенным пространство имитирует физиологическую среду для миграции клеток. В нашем устройстве, BTSC проявляют значительный потенциал миграции в размере ограниченных пространством путем регулирования клеточной морфологии. Наша характеристика ячейки морфологических изменений указывает режим-преобразования в шести последовательность этап, который может моделировать возможные новые подробное описание BTSC вторжения в соседние мозга. На ранних стадиях, клетки получают значительное количество полярности и генерировать клей выступы эффективно закрепить себя внутри микроканала. Как только клетка размещение в микроканале установлена, она превращается в крейсерском режиме и поддерживает этот режим в течение всего путешествия по микроканала. На данном этапе, BTSC поддерживать высокую подвижность и последовательное направление, но экономить энергию. Вterestingly, кажется, что одна микроканальных ограничивается одной крейсерской ячейки за один раз, так что, когда одна клетка доходы до этой стадии, другие отступления клеток из микроканала. Этот механизм гарантирует, вероятно, эффективность распространения опухоли и предотвращает чрезмерное потребление питательных веществ в микроканала. После завершения миграции через микроканала, клетка восстанавливает свою склонность к разнонаправленной выступов и дальнейшего изучения заражения цели или новые пути миграции. Compartmentalizing микрофлюидных устройство предлагает новый в пробирке означает создание микроокружения для изучения BTSC инфильтрации паренхимы мозга.
Этот метод может быть легко адаптирована к изучению раковых стволовых клеток (ЦОК) и мигрирующих клеточных линиях, полученных от других типов опухолей. Культивирование клеток в микрофлюидных устройство может быть выполнено в любой современной биологической лаборатории, оснащенной инкубатора и опыта культуре ткани. Оснащен SU-8 мастер, PDMSлитье и сборку устройства возможны с некоторой фундаментальной подготовки в мягкой литографии. Кроме того, эта платформа также может быть расширен для других приложений с интеграцией других функциональных модулей, таких как градиент смеситель, поверхность рисунка, жидкость контроля и микроэлектрода.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
PAC частично поддержана NIH грант T32 Университета Висконсина стволовых клеток Training Program (PA Clark). JSK была частично поддержана опухоли Headrush Brain Research профессора, Роджер Loff Мемориал GBM исследовательского фонда, а фонд UW / Нейрохирургия Brain Research опухоли и образования Фонда. JCW и YH частично поддерживаются NIH грант NIBIB 1R01EB009103-01.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Игла, модифицированной орла среде (DMEM), высокий уровень глюкозы | Gibco / Invitrogen | 11965 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Хэма F12 | Gibco / Invitrogen | 31765 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| B27 добавки витамина минус | Gibco / Invitrogen | 12587-010 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Антибиотик-противогрибковым (PSA) | Gibco / Invitrogen | 15240 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Эпидермальный фактор роста (EGF), рекомбинантный человеческий | Gibco / Invitrogen | PHG0313 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| основной фактор роста фибробластов (шФРФ), рекомбинантный человеческий | Gibco / Invitrogen | PHG0021 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Гепарина натриевую соль, из слизистой оболочки кишечника свиней | Сигма | H1027-250KU | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Ламинин (природный мышь) | Gibco / Invitrogen | 23017-015 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Accutase | Millipore | SCR005 | Опухоль головного мозга стволовых клеток (BTSC) культуры поставки |
| Стволовые клетки среде |
| ||
| Основной фактор роста фибробластов (шФРФ) / Гепарин |
| ||
| Эпидермальный фактор роста (EGF) |
| ||
| Гепарин |
| ||
| СУ-8 фоторезиста | MicroChem | ||
| Силиконовая ручка пластины | WRS материалы | 3P01-5SSP-INV | |
| трихлор (1Н, 1Н, 2Н, 2Н-перфтороктил) силана | Sigma-Aldrich | 448931 | |
| PDMS Sylgard 184 | Dow Corning | ||
| ламинин | BD Bioscience | 50 мкг /мл в PBS буфера в процессе окончательной концентрации | |
| Биостанция IM | Nikon Instruments |
Ссылки
- Carke, M. F. Cancer Stem Cells-Perspectives on Current Status and Future Directions. AACR Workshop on Cancer Stem Cells. Cancer Research. 66, 9339-9344 (2006).
- Stupp, R. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352, 987-996 (2005).
- Sahai, E. Mechanisms of cancer cell invasion. Current Opinion in Genetics & Development. 15, 87-96 (2005).
- Shackleton, M., Quintana, E., Fearon, E. R., Morrison, S. J. Heterogeneity in Cancer: Cancer Stem Cells versus Clonal Evolution. Cell. 138, 822-829 (2009).
- Karnoub, A. E. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature. 449, 557-557 (2007).
- Huang, Y., Agrawal, B., Sun, D., Kuo, J. S., Williams, J. C. Microfluidics-based Devices: New Tools for Studying Cancer and Cancer Stem Cell Migration. Biomicrofluidics. 5, (2011).
- Rolli, C. G., Seufferlein, T., Kemkemer, R., Spatz, J. P. Impact of Tumor Cell Cytoskeleton Organization on Invasiveness and Migration: A Microchannel-Based Approach. Plos One. 5, (2010).
- Chung, S. Cell migration into scaffolds under co-culture conditions in a microfluidic platform. Lab on a Chip. 9, 269-275 (2009).
- Irimia, D., Toner, M. Spontaneous migration of cancer cells under conditions of mechanical confinement. Integrative Biology. 1, 506-512 (2009).
- Svendsen, C. N. A new method for the rapid and long term growth of human neural precursor cells. Journal of Neuroscience Methods. 85, 141-152 (1998).
- Clark, P. A. Glioblastoma cancer stem cells exhibit decreased dependence on exogenous growth factors for proliferation and survival. , .
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37, 551-575 (1998).
- Millet, L. J., Stewart, M. E., Sweedler, J. V., Nuzzo, R. G., Gillette, M. U. Microfluidic devices for culturing primary mammalian neurons at low densities. Lab on a Chip. 7, 987-994 (2007).
- Regehr, K. J. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab on a Chip. 9, 2132-2139 (2009).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nature Cell Biology. 9, 1347-1347 (2007).
- Hu, X. D., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-Dependent Dynamic Microtubule Invasion of Dendritic Spines. Journal of Neuroscience. 28, 13094-13105 (2008).
- Vitzthum, L. Study of Na(+)/H(+) exchange-mediated pH(i) regulations in neuronal soma and neurites in compartmentalized microfluidic devices. Integrative Biology. 2, 58-64 (2010).
- Clark, P. A., Treisman, D. M., Ebben, J., Kuo, J. S. Developmental signaling pathways in brain tumor-derived stem-like cells. Developmental Dynamics. 236, 3297-3308 (2007).
- Chen, R. H. A Hierarchy of Self-Renewing Tumor-Initiating Cell Types in Glioblastoma. Cancer Cell. 17, 362-375 (2010).
- Pollard, S. M. Glioma Stem Cell Lines Expanded in Adherent Culture Have Tumor-Specific Phenotypes and Are Suitable for Chemical and Genetic Screens. Cell Stem Cell. 4, 568-580 (2009).
- Lobo, N. A., Shimono, Y., Qian, D., Clarke, M. F. The biology of cancer stem cells. Annual Review of Cell and Developmental Biology. 23, 675-699 (2007).
- Singh, S. K. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Lee, J. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Research. 64, 7011-7021 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены