Method Article
Evaluation of Cancer Stem Cell Migration Mit Abschottung Mikrofluidiksysteme und Live Cell Imaging
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Eine Abschottung mikrofluidischen Vorrichtung zur Untersuchung von Krebsstammzellen Migration beschrieben. Diese neuartige Plattform schafft eine tragfähige zellulären Mikroumgebung und ermöglicht mikroskopische Visualisierung der lebenden Zelle Fortbewegung. Höchst beweglich Krebszellen isoliert sind, um molekularen Mechanismen von aggressiven Infiltration, was möglicherweise zur wirksameren zukünftige Therapien.
Zusammenfassung
In den letzten 40 Jahren investierte die Vereinigten Staaten über 200 Milliarden Dollar für die Krebsforschung, was nur ein Rückgang um 5% in Todesrate. Ein großes Hindernis für die Verbesserung der Behandlungsergebnisse ist die schlechte Verständnis der zugrunde liegenden Mechanismen Zellwanderung mit aggressiven Invasion von Krebszellen, Metastasierung und Therapieresistenz 1 zugeordnet. Glioblastoma multiforme (GBM), der häufigsten primären bösartigen Erwachsenen Gehirntumor 2, steht beispielhaft für diese Schwierigkeit. Trotz Standard-Operation, Bestrahlung und Chemotherapie, ist geduldig mediane Überlebenszeit nur 15 Monate, aufgrund der aggressiven GBM Infiltration in die benachbarten Gehirn und schnellen Rezidiv 2. Die Wechselwirkungen von aberranten Zelle wandernde Mechanismen und der Tumor-Mikroumgebung wahrscheinlich unterscheiden Krebs aus normalen Zellen 3. Daher verbessert Therapieansätze für GBM erfordern ein besseres Verständnis von Krebs Zellmigration Mechanismen. Neuere Arbeiten schlägt thata kleine Subpopulation von Zellen innerhalb GBM, kann das Gehirn Tumor Stammzellen (BTSC), verantwortlich für Therapieresistenz und Rezidiv. Mechanismen BTSC Migrationsfähigkeit sind erst am Anfang gekennzeichnet 1,4 sein.
Aufgrund einer Einschränkung in der visuellen Inspektion und geometrischen Manipulation konventionellen Zellmigrationsassays 5 werden zur Quantifizierung insgesamt Zellpopulationen beschränkt. Im Gegensatz dazu ermöglichen mikrofluidischen Bauteilen einzelne Zelle Analyse wegen Kompatibilität mit modernen Mikroskopie und Kontrolle über Mikro-Umgebung 6-9.
Wir stellen eine Methode zur detaillierten Charakterisierung BTSC Migration mit Abschottung mikrofluidischen Bauteilen. Diese PDMS-made-Geräte warf den Gewebekultur-Umgebung in drei zusammenhängende Fächer: Aussaat Kammer, Aufnahmeraum und Bridging Mikrokanälen. Wir maßgeschneiderte das Gerät, so dass beide Kammern ausreichende Medien halten, um tragfähige BTSC für 4-5 da unterstütztys ohne Medienbrüche Austausch. Hochmobile BTSCs zunächst in der Aussaat eingeleitet werden nach der Migration aber Bridging Mikrokanäle der parallelen Aufnahmeraum getrennt. Diese Migration simuliert Krebs zellulären Ausbreitung durch die Zwischenräume des Gehirns. Die Phase Live-Bilder der Zellmorphologie während der Migration werden über mehrere Tage aufgenommen. Weit wandernde BTSC kann daher isoliert, rekultivierten, und weiter analysiert.
Abschottung Mikrofluidik eine vielseitige Plattform, um das Zugverhalten von BTSCs und andere Krebsstammzellen zu studieren. Durch die Kombination von Gradienten Generatoren, Fluid Handling, Mikro-Elektroden und anderen mikrofluidischen Modulen, können diese Geräte auch für Wirkstoff-Screening und Diagnose von Krankheiten 6 verwendet werden. Isolation eines aggressiven Subpopulation von wandernden Zellen ermöglichen Studien der zugrunde liegenden molekularen Mechanismen.
Protokoll
Ein. BTSC die Zelldissoziationslösung
BTSCs sind aus bereits bestehenden Kulturen in serumfreiem Medium als Stammzelle Neurospheres gezüchtet abgeleitet. Kultur von denen bisher 10, 11 beschrieben.
- Bereiten Zellsuspension aus BTSC-derived Neurosphären. BTSC-derived Neurospheres werden in einem 15 ml konischen Röhrchen gesammelt und zentrifugiert bei 900 UpM für 5 Minuten. Schnellere Zentrifugation Scher-und / oder Schäden an der Neurosphären. Überstand wird abgesaugt und Neurosphäre Kultur wird in 0,5 ml vorgewärmtes Accutase resuspendiert. Diese Lösung wird für 5-10 Minuten bei 37 ° C ermöglicht die Neurospheres zu lockern. Zellen werden mechanisch mit 10-20 sanften Schlägen eines P100 Pipette und dann 1,5 ml Stammzelle Medium zu den Zellen hinzugefügt, um die Accutase neutralisieren gestört.
- Die BTSCs werden dann bei 1300 UpM für 5 Minuten zentrifugiert, gewaschen und in 1 ml Medium Stammzelle.
- Eine 50 ul-Aliquot wird von den suspens entferntIon und in ein Mikrozentrifugenröhrchen platziert zur Zellzählung. 50 ul Trypanblau ist mit der Eppendorf-Röhrchen gegeben und die Suspension wird in einem Hämozytometer zur Zellzählung platziert.
- Wenn nach Zellzählung benötigt wird zusätzliches Stammzelle Medium zu der BTSC Suspension auf eine Zelldichte von 20.000 lebenden Zellen / ul Medium zu ergeben.
2. Herstellung von zweischichtigen su-8 Master und Formen von PDMS-Stempel (siehe Abbildung 1)
Wir nutzen die optische Lithographie und weiche Lithographie su-8 Master-und PDMS-Stempel, die wesentlich für die Montage der Mikrofluidik-Geräte sind zu fabrizieren. Etwas anders als die Standard-Verfahren 12, ist unser su-8 Master aus zwei Schichten. Die 3-um-tall Mikrokanäle in der ersten / unteren Schicht früher im Prozess gegossen, während die 250-um-tall Säen und Aufnahmekammern in der zweiten / oberen Schicht sind. Um für die richtige Verbindung zwischen zwei Kultur Fächer (Mikrokanals und Kammern), haben die beiden Schichten, um genau in Position ausgerichtet werden. Allerdings sind Dicke und Deckkraft der zweiten Schicht groß genug, um die fiducial / optische Ausrichter der Zugriff auf einen der unten stehenden Funktionen zu blockieren. Hier gestalten wir die Masken mit Bezugsmarken der Ferne positioniert. Somit können diese Marker in der ersten Schicht selektiv abgeschirmt werden beim Spinnen der zweiten Schicht. Als Ergebnis werden beide Schichten von Merkmalen in einem Master hergestellt und bereit zum Formen in Basrelief der PDMS-Stempel.
- Design und bereiten zwei Photomasken. Eine Maske besteht aus zwei Bezugsmarkierungen und einer Anordnung von Mikrokanälen (400 um Länge und 10 bis 50 um Breite) für die erste Schicht. Eine weitere Maske aus Setzen und Aufnahmekammern (2 mm lang und 600 um Breite) für die zweite Schicht. Beide Masken in Illustrator (Adobe, Kalifornien) sind so konzipiert, auf Transparentfolien (Thin Metal Parts, Colorado), mit Isopropanol und luftgetrocknet gereinigt Laserdruck.
- Sprechen Sie die erste Schicht mitSU-8 Fotolack (MicroChem, Massachusetts) je nach Produkt-Handbuch von Lieferanten. Erstens Spin-Beschichtung der Handhabungswafer (WRS Materialien, Kalifornien) mit 3-Mikrometer dicke Photolack SU-8 (5), durch weiche Einbrennen gefolgt. Der Fotolack wird dann UV-belichtet und gehärtet mit der entsprechenden Maske in engem Kontakt, durch Einbrennen und Entwicklung verfolgt.
- Spin-Beschichtung der zweiten Schicht mit 250 um dicken SU-8 (2100). Um dicke Photoresist von Blockierung der Bezugsmarken von der ersten Schicht zu verhindern, decken wir diese Bereiche mit Tesafilm in vor Spin-Beschichtung der zweiten Schicht. Das Band wird dann um die Markierungen für die Ausrichtung Zweck offenbaren geschält.
- UV-Setzen der zweiten Schicht mit der zweiten Maske. Wobei die Ausrichtmarkierungen offenbart, ist es einfach, sie zu den in der zweiten Maske unter Verwendung von optischen Maskaligner auszurichten. Die zweite Schicht aus Fotolack wird dann UV-belichtet und gehärtet in enger berührungsfrei, gefolgt von Nachbrennen und Entwicklungsländer.
- Anti-Stick-Beschichtung der Folge Meister. Zur Entfernung von ausgehärteten PDMS zu unterstützen, kann die SU-8-Master über Gasphasenabscheidung um der Oberfläche eine Antihaft-Typ Beschichtung silanisiert sein. Einfach in einen Exsikkator für mindestens eine Stunde, mit einigen Tropfen Trichlor (1H, 1H, 2H, 2H-Perfluoroctyl) silan Lösung unter Vakuum.
- Mold PDMS mit dem Master. Mix Prepolymer Basis und Heiler der PDMS Sylgard 184 (Dow Corning, Michigan) in Verhältnis 10:1 gründlich. Legen Sie sie in einem Exsikkator Vakuumentgasung, bis keine Luftblasen zu sehen ist. Die Mischung auf der Maske und entgast wieder, wenn neues Luftblase eingeführt wird. Aushärten der Form auf einer Ebene Kochplatte für 2 Stunden bei 90 C. Nach dem es auf Raumtemperatur abgekühlt, vorsichtig loslassen PDMS-Stempel. So werden Kultivierung Kanäle in PDMS graviert und fertig für die Montage des Geräts. Der Master ist wiederverwendbar für Formgebung, bis er geknackt wird oder abgenutzt. Die Antihaft-Beschichtung muss erneut durchgeführt werden, wenn die Klebrigkeit gewinnt.
3.Montage von Mikrofluidikvorrichtungen und Zellkultivierungsraum (Abbildung 2)
Um Zellkulturen ist feature-gravierten PDMS-Stempel mit einem Deckglas an geschlossene Kanäle bilden. Ein-und Auslässe für das Laden der Kultur / Medien geschaffen. Unterdessen sind Bereinigung und andere Verfahren, um das Glassubstrat und PDMS-Stempel notwendig, um die Zelle-Kompatibilität zu gewährleisten.
- Machen Reservoirs durch die PDMS-Stempel mit Biopsie Locher. Wir wählen ihr Durchmesser bis 6 mm betragen. Diese Behälter dienen zwei Zwecken. Eine besteht darin, zusätzliche Nährstoffe für das Zellwachstum zu halten. Der andere ist für den Zugang der Pipette Be-und Vakuum-Aspiration.
- Weichen Sie die PDMS-Stempel in 70% Ethanol für 30 min und dann spülen Sie ihn mit de-ionisiertem Wasser für weitere 10 min. Der Zweck besteht darin, mögliche organische Reste während der Herstellung eingebracht, und unvernetzten PDMS Kontamination zu löschen. Weitere intensive und gründliche Reinigung Prozesse wie organische Extraktion 13 Und Soxhlet-Extraktion 14 wurden an anderer Stelle verwendet werden. Allerdings fanden wir es unnötig in BTSC Kultur.
- Sterilisieren PDMS-Stempel mit Autoklaven (121 ° C, 35 min). Dieser Schritt weiter vervollständigt die Vernetzung Reaktion PDMS. Ausgehend von diesem Schritt und bis Schritt 3,6, alle Verfahren werden in sterile Weise berücksichtigt.
- Die PDMS-Stempel wird dann auf einem Deckglas, die zuvor mit Poly-L-Lysin beschichtet ist festgelegt. 15-17 Die Vorrichtung wird dann mit Laminin durch Füllen des Kanals mit Laminin Lösung über Nacht bei 37 ° C beschichtet Laminin aus der Vorrichtung abgesaugt und die Vorrichtung mit Stammzelle Medium gewaschen.
- Legen Zellsuspension aus Schritt 1 in Stauseen und Kanäle. 11 ul von dissoziierten Zellen werden in einem Aussaat Reservoirs platziert. Vakuumaspiration wird verwendet, um Zellen in die Kammer zu zwingen Aussaat, wenn notwendig. Eine zusätzliche 7 ul Zellen werden die angrenzenden Aussaat Reservoirs platziert. Hinweis: Durchschnittliche Zelldichte beträgt 20.000 Zellen / ul Medien. Achterner fünf Minuten, die Aussaat und Empfangen Reservoirs sind mit den Medien überflutet.
- Legen Sie ein 0,5-1 mm vor autoklaviert PDMS Blatt auf. Der natürlich aufgetreten Oberflächenhaftung zwischen zwei PDMS Stück wird die Zellkultur dicht und bereit für den Transport, die Inkubation und mikroskopische Bildgebung.
4. Langfristige Zeitraffer-Aufnahmen des BTSC Migration mit BioStation IM (Nikon Instruments Inc, Melville, USA).
Die Kombination Kamera, Software und Gründerzentrum alles in einer Box macht diese mikroskopische System ist es möglich, Bild Zellkultur ohne Störung für Tag. Darüber hinaus bewegt sich die einzigartige Motorkonstruktion die Objektivlinse und hält Probentisch stationär in der Punkt-zu besuchen Funktion. Dies macht es praktisch, Bild parallelen Experimenten und Track Zellbewegung in Hochdurchsatz-Assay.
- Pre-Gleichgewicht der Biostation IM für 45 Minuten, um die Temperatur, Feuchtigkeit und Luftzufuhr zu stabilisieren. Zusatz von mehreren Wasser-contained Gerichte in der Probenkammer wird verwendet, um richtige Luftfeuchtigkeit zu halten.
- Legen Sie die Zelle geschlossenes Gerät in den Probenraum des Mikroskops, und in der Mitte ist mit Mikro Pinzette.
- Stellen Sie den Fokus, Position-Punkte und Zeit-Punkte Biostation Software und starten Sie den Zeitraffer.
5. Repräsentative Ergebnisse:
Beispiele für visuelle Inspektion und Charakterisierung von Krebs Zellmigration durch Verwendung einer mikrofluidischen Vorrichtung Abschottung sind in Abbildung 3 und 4 dargestellt. Die Zell-Linie ist BTSC. Mit unserem aktuellen Setup können Phasenbilder der Zellkultur kontinuierlich so lange wie 5 Tage (Abbildung 3) und so häufig wie alle 2 Sekunden (Abbildung 4) aufgezeichnet werden. Beyond 5 Tagen, müssen Kulturmedien für Nährstoff-Nachschub und Abfall entfernt ersetzt werden. Unser langfristiges Zeitraffer identifiziert eine revolvierende Sequenz von sechs Zellstadien während ihrer Migration auf die morphologischen Veränderungen. Wie Abb.trierte in Abbildung 3, beschreiben wir sie als (i) vor der Migration, (ii) die Einleitung, (iii) Pfad-Exploration, (iv) Kreuzfahrt, (v) destination-exloration und (vi) nach der Migration. In der Aufnahmekammer, bleiben spindelförmigen Zellen in Stufe (i) wie in bulk Tumoren, die wachsen können, dividieren und schrittweise Migration sind. Als sie den Mikrokanal Eingang nähern, gehen Sie ein paar Zellen zu inszenieren (ii), wenn sie sich ausdehnen und erzeugen Kleber Vorsprung. Nur einer von ihnen ist in der Lage, um den Eingang zu besetzen und gehen zu Stufe (iii), das die Migrationsrichtung erkunden. Sobald die Zelle bestimmt die Migrationsrichtung, geht er weiter zu Schritt (iv) zu kreuzen durch den Mikrokanal in einer stetigen und hoher Geschwindigkeit, die durch die gesamte Mikrokanal ausgeführt wird. Am Ende des Mikrokanals, Zelle geht zu Stufe (v), um den offenen Raum der Aufnahmekammer zu erforschen, und dann die Stufe (vi). In Mikrokanal migriert Strom überwiegend von blebbing Aktivität wie in 4 dargestellt erzeugt, ähnlich der amöboiden cell. Zelle blebbing und Membranverformung sind voll hier erfasst.
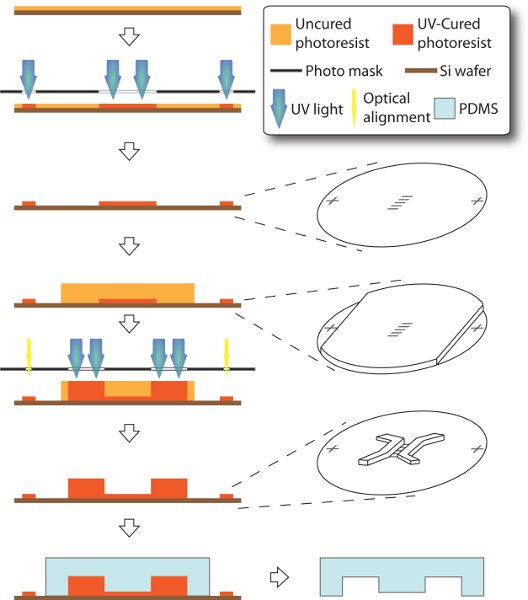
Abbildung 1. Schematische Darstellung der Herstellung von mikrofluidischen Gerät. Der gesamte Prozess wird auf einem 3-Zoll-Silizium-Wafer durch eine modifizierte Technik der weichen Lithographie durchgeführt. 3-um-tall Mikrokanäle und Ausrichtmarken sind wie in der ersten Schicht enthält. Dann wurden 250 um dicke su-8 aufgeschleudert, während die Ausrichtmarkierungen mit Tesafilm bedeckt sind, so dass sie später zugänglich sein Aligners ohne Sicht-Blockierung durch dicke Photoresist maskieren. Somit kann Kammer bietet als die zweite Schicht hergestellt werden und exakt an der ersten Schicht ausgerichtet sind. PDMS-Stempel wird schließlich aus dem resultierenden Master geformt.

Abbildung 2. Schematics des Gerätes Montage und Zellaussaat Prozess. Umgeben von PDMS und glass Deckplättchen wird das 3D Raum Kultivieren von Kammern, Sammelbehälter und Mikrokanälen besteht. Die Aussaat Kammer mit Zellkultur gefüllt, während die Aufnahmekammer anfänglich mit zellfreien Medien befüllt. Die Mikrokanäle, die zwischen ihnen herstellen bieten Zell Migration Weg von Aussaat Seite zu empfangenden Seite.

Abbildung 3. BTSC Migration durch Mikrokanal. Obermaterial: Schnappschüsse von Zeitraffer zeigen eine einzelne Zelle (grün markiert) wandert über 400 um von der Aussaat Seite der empfangenden Seite. Die gesamte Fahrt dauert etwa 2 Tage, an denen eine Sequenz von Zellen morphologische Veränderungen. Der Maßstab beträgt 40 um. Untere: eine Karikatur Darstellung der sechs Migration Stufen. Vor-Migrations (i): In Seeder Kammer Spindelform zerteilbaren Zellen allmählich aneinander entlang zu wandern. Die Zellen in der Nähe Mikrokanal Eingang Rennen miteinander durch polarisierende Zellkörper und E xerting Lamellipodien Vorsprung. Initiation (ii): Der wandernde Zelle mit der höchsten Kapazität belegt den Kanal Eingang, während ihre Wettbewerber zurückziehen. Path-Exploration (iii): Die wandernde Zelle Änderungen an einem amoeboid-Modus mit wenig Polarität. Diese Migration Modus ist sehr beweglich und in der Lage, Pfad in alle Richtungen zu erforschen, indem blebbing kleinen Membranausstülpungen. Cruising (iv): Sobald das Migrationspfad bestimmt wird, wandelt die Zelle in eine angepasste amöboiden Modus durch Aufrechterhalten eines zusätzlichen großen Vorsprungs Position nach vorne. Auf diese Weise hält Zelle eine hohe Beweglichkeit sowie eine feste Richtung und Geschwindigkeit. Destination-Exploration (v): Nach Weg-End, verlangsamt sich die Zelle nach unten und entwickelt filopodias den Aufnahmeraum für eine Invasion Ziel zu erkunden. Post-Migration (vi): Nach Eingabe der Aufnahmeraum, dreht Zelle in sternförmige und behält eine hohe Beweglichkeit, aber keine bestimmte Richtung.
"/>
. Abbildung 4 Snapshots der Zeitraffer zeigen den Zyklus der blebbing Aktivität und Membranverformung einer BTSC: (AB). Initiierung; (BD). Expansion; (DF). Rückzug. Die Pfeile und Kurven-Linien repräsentieren die Richtung und Lage der Membranverformung sind. Die Snapshots werden alle 8 Sekunden gesammelt.
Diskussion
Die Mikrofluidik-Vorrichtung und Bild-Aufnahme hier vorgestellte Technik ermöglicht eine visuelle Charakterisierung der zellulären Morphologie während der Migration. Im Vergleich zu bestehenden herkömmlichen Methoden bietet das mikrofluidischen Plattform Vorteile der Wirtschaftlichkeit, hohen Durchsatz und Flexibilität beim Design. Das vorgestellte mikroskopische Visualisierung erlaubt Studie und Aufzeichnung von langfristigen Live Zellmigration. Das Objektiv motorisierten Funktion macht es möglich, mehrere Migrationspfade in einer hohen Bild-Auflösung verfolgen, ohne die Probe.
Während der Montage der Vorrichtung ist der PDMS-Stempel nicht permanent mit dem Deckglas für die Bequemlichkeit der PDL Beschichtung (Schritt 3,4) verklebt ist. Es ist kritisch, um eine gute Abdichtung für den Erfolg dieses Protokoll zu erzielen. Verunreinigungen aus der Herstellung der Vorrichtung, wie Luftblase im Stempel oder Staub / Abfall auf dem Substrat, eingebracht werden gefährden die Verklebung und ergeben Fluid leckt. Daher TREATIng das Gerät in einem staubfrei ist wichtig, Ausfall des Gerätes zu verhindern. Vor der PDL-Beschichtung, die Deckgläschen Salpetersäure behandelt und die PDL-Lösung wird zentrifugiert, um Staub / Abfall zu beseitigen. Wir finden Tesafilm, Alkohol zu spülen und Wasserbad sehr hilfreich bei der Entfernung von Staub / Schmutz von der PDMS-Stempel, wenn ein Reinraum nicht zugänglich ist. Nachdem der PDMS-Stempel in Kontakt mit dem Deckglas, Gewindebohren den Stempel vorsichtig mit einer Pinzette erleichtert die Abdichtung.
BTSCs kann aus menschlichem OP Proben über Sphäre Kultur in Stammzellen Medium, ähnlich wie Kultur von normalen neuralen Stammzellen 10 angereichert werden. BTSCs so angereicherte demonstrieren Stammzell-ähnlichen Eigenschaften, wie die Expression von Stammzellmarkern (CD133, Nestin), um mehrere neuronale Differenzierung Abstammungslinien (Glia und neuronaler) und Tumorinitiation in einem orthotopischen immundefizienten Maus-Modell mit so wenig wie 100 Zellen 18. Obwohl einige Diskussionen gibt es über AufreinigungKation und Wartung von BTSCs 1, 19-21, Kugel-grown BTSCs besser pflegen den Phänotyp und Genotyp der elterlichen Tumor 22-24.
Die unterteilte Raum imitiert die physiologische Umgebung für die Zellwanderung. In unserem Gerät weisen BTSC eine starke Leistung von Migration durch ein size-constrained Raum durch Regulierung zellulärer Morphologie. Unsere Charakterisierung der Zellen morphologische Veränderungen zeigt mode-Transformationen in einer sechsstufigen Sequenz, die eine mögliche neue detaillierte Beschreibung der BTSC Invasion von benachbarten Gehirns modellieren können. In frühen Stadien, gewinnen die Zellen eine erhebliche Menge an Polarität und erzeugen Klebstoff Vorsprünge wirksam verankern sich innerhalb des Mikrokanals. Sobald die Zelle Belegung im Mikrokanal hergestellt wird, wandelt es in ein Cruising-Modus und hält diesen Modus für die gesamte Fahrtstrecke durch einen Mikrokanal. Zu diesem Zeitpunkt halten BTSC hoher Beweglichkeit und konsistente Richtung, sondern Energie zu sparen. InInteressanterweise scheint es, dass eine Mikrokanal einem Cruising-Zelle wird zu einem Zeitpunkt begrenzt, so dass, wenn eine einzige Zelle geht zu diesem Zeitpunkt anderen Zellen Rückzug aus dem Mikrokanal. Dieser Mechanismus dürfte gewährleistet Wirksamkeit der Tumorausbreitung und verhindert Mehrverbrauch von Nährstoffen in Mikrokanal. Nach Abschluss der Migration auf den Mikrokanal, gewinnt eine Zelle seine Neigung für multidirektionale Vorsprünge und die weitere Exploration Invasion Ziele oder neue Migrationspfade. Die Abschottung mikrofluidischen Gerät bietet eine neuartige in vitro Mittel zur Schaffung einer Mikroumgebung für das Studium BTSC Infiltration von Hirnparenchym.
Diese Methode kann leicht auf die Untersuchung von Krebsstammzellen (CSC) und wandernde Zelllinien aus anderen Tumorarten abgeleitet angepasst werden. Kultivieren von Zellen in der mikrofluidischen Vorrichtung kann in jeder modernen Biologie Labor, mit einem Inkubator und Gewebekultur Fachwissen ausgestattet ist durchgeführt werden. Ausgestattet mit einem SU-8 Master PDMSGieß-und Gerätemontage sind möglich mit einigen grundlegenden Ausbildung in Softlithographie. Darüber hinaus kann diese Plattform auch für andere Anwendungen mit integrierender andere funktionelle Module wie Gradientenmischer, Oberflächenstrukturierung, Fluidsteuerung und Mikroelektrode verlängert werden.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
PAC ist teilweise durch eine NIH T32 Stipendium University of Wisconsin Stem Cell Training Program (PA Clark) unterstützt. JSK wurde teilweise durch die HEADRUSH Brain Tumor Forschungsprofessur, Roger Loff Memorial GBM Research Fund und der UW Foundation / Neurochirurgie Brain Tumor Research and Education Fund unterstützt. JCW und YH sind teilweise durch NIH NIBIB 1R01EB009103-01 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Dulbecco modifiziertem Eagle-Medium (DMEM), hohe Glucose | Gibco / Invitrogen | 11965 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Ham-F12 | Gibco / Invitrogen | 31765 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| B27 Ergänzung minus Vitamin A | Gibco / Invitrogen | 12587-010 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Antibiotikum-Antimykotisches (PSA) | Gibco / Invitrogen | 15240 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Epidermal Growth Factor (EGF), rekombinanten humanen | Gibco / Invitrogen | PHG0313 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| basischen Fibroblastenwachstumsfaktor (bFGF), rekombinanten humanen | Gibco / Invitrogen | PHG0021 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Heparin-Natrium-Salz, Darmschleimhaut von Schweinen | Sigma | H1027-250KU | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Laminin (natürliche Maus) | Gibco / Invitrogen | 23017-015 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Accutase | Millipore | SCR005 | Hirntumor Stammzellen (BTSC) Kultur Lieferungen |
| Stammzell-Medium |
| ||
| Basischen Fibroblastenwachstumsfaktor (bFGF) / Heparin |
| ||
| Epidermal Growth Factor (EGF) |
| ||
| Heparin |
| ||
| SU-8 Fotolack | MicroChem | ||
| Silizium-Wafer | WRS Materialien | 3P01-5SSP-INV | |
| Trichlor (1H, 1H, 2H, 2H-Perfluoroctyl) silan | Sigma-Aldrich | 448931 | |
| PDMS Sylgard 184 | Dow Corning | ||
| Laminin | BD Bioscience | 50 ug /ml in PBS-Puffer für die Endkonzentration | |
| Biostation IM | Nikon Instrumente |
Referenzen
- Carke, M. F. Cancer Stem Cells-Perspectives on Current Status and Future Directions. AACR Workshop on Cancer Stem Cells. Cancer Research. 66, 9339-9344 (2006).
- Stupp, R. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352, 987-996 (2005).
- Sahai, E. Mechanisms of cancer cell invasion. Current Opinion in Genetics & Development. 15, 87-96 (2005).
- Shackleton, M., Quintana, E., Fearon, E. R., Morrison, S. J. Heterogeneity in Cancer: Cancer Stem Cells versus Clonal Evolution. Cell. 138, 822-829 (2009).
- Karnoub, A. E. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature. 449, 557-557 (2007).
- Huang, Y., Agrawal, B., Sun, D., Kuo, J. S., Williams, J. C. Microfluidics-based Devices: New Tools for Studying Cancer and Cancer Stem Cell Migration. Biomicrofluidics. 5, (2011).
- Rolli, C. G., Seufferlein, T., Kemkemer, R., Spatz, J. P. Impact of Tumor Cell Cytoskeleton Organization on Invasiveness and Migration: A Microchannel-Based Approach. Plos One. 5, (2010).
- Chung, S. Cell migration into scaffolds under co-culture conditions in a microfluidic platform. Lab on a Chip. 9, 269-275 (2009).
- Irimia, D., Toner, M. Spontaneous migration of cancer cells under conditions of mechanical confinement. Integrative Biology. 1, 506-512 (2009).
- Svendsen, C. N. A new method for the rapid and long term growth of human neural precursor cells. Journal of Neuroscience Methods. 85, 141-152 (1998).
- Clark, P. A. Glioblastoma cancer stem cells exhibit decreased dependence on exogenous growth factors for proliferation and survival. , .
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37, 551-575 (1998).
- Millet, L. J., Stewart, M. E., Sweedler, J. V., Nuzzo, R. G., Gillette, M. U. Microfluidic devices for culturing primary mammalian neurons at low densities. Lab on a Chip. 7, 987-994 (2007).
- Regehr, K. J. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab on a Chip. 9, 2132-2139 (2009).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nature Cell Biology. 9, 1347-1347 (2007).
- Hu, X. D., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-Dependent Dynamic Microtubule Invasion of Dendritic Spines. Journal of Neuroscience. 28, 13094-13105 (2008).
- Vitzthum, L. Study of Na(+)/H(+) exchange-mediated pH(i) regulations in neuronal soma and neurites in compartmentalized microfluidic devices. Integrative Biology. 2, 58-64 (2010).
- Clark, P. A., Treisman, D. M., Ebben, J., Kuo, J. S. Developmental signaling pathways in brain tumor-derived stem-like cells. Developmental Dynamics. 236, 3297-3308 (2007).
- Chen, R. H. A Hierarchy of Self-Renewing Tumor-Initiating Cell Types in Glioblastoma. Cancer Cell. 17, 362-375 (2010).
- Pollard, S. M. Glioma Stem Cell Lines Expanded in Adherent Culture Have Tumor-Specific Phenotypes and Are Suitable for Chemical and Genetic Screens. Cell Stem Cell. 4, 568-580 (2009).
- Lobo, N. A., Shimono, Y., Qian, D., Clarke, M. F. The biology of cancer stem cells. Annual Review of Cell and Developmental Biology. 23, 675-699 (2007).
- Singh, S. K. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Lee, J. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Research. 64, 7011-7021 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten