Method Article
区分するマイクロ流体デバイスとライブセルイメージングを使用した癌幹細胞の移行の評価
* これらの著者は同等に貢献しました
要約
がん幹細胞の移動を調査するための区分するマイクロ流体デバイスが記載されている。この小説のプラットフォームは、生存細胞の微小環境を作成し、生細胞運動の微視的な可視化を可能にします。非常に運動性のがん細胞は、潜在的に、より効果的な将来の治療法につながる積極的な浸潤の分子メカニズムを研究するために隔離されています。
要約
過去40年間、米国は死亡率がわずか5%減少し、その結果、がんの研究に2000億ドル以上を投資した。患者の転帰を改善するための主要な障害は、積極的な癌細胞の浸潤、転移や治療抵抗1に関連付けられた細胞移動のメカニズムの理解不足です。神経膠芽腫多形(GBM)の、最も一般的な原発性悪性成人脳腫瘍2は 、この難しさを例示している。標準的な手術、放射線、化学療法にもかかわらず、患者の生存期間中央値は、隣接する脳と迅速な癌の再発2への積極的なGBMの浸潤による唯一の15ヶ月です。異常な細胞回遊メカニズムと腫瘍微小環境との相互作用は、おそらく3正常細胞からがんを区別しています。したがって、GBMの改善治療アプローチは、癌細胞の移行メカニズムの理解が必要です。最近の研究では、股関節を示唆しているGBMは、脳腫瘍幹細胞(BTSC)内の細胞のTA小さい亜集団は、治療抵抗性、再発の原因かもしれない。 BTSC遊走能のメカニズムだけで1,4特徴付けされ始めている。
目視検査と幾何学的操作、従来の移動アッセイ5に制限があるため、全体的な細胞集団を定量化に限定されています。これとは対照的に、マイクロ流体デバイスは、現代の顕微鏡と6月9日の微小環境を制御できるように、互換性の単一細胞解析を可能にします。
我々は区分するマイクロ流体デバイスを用いて、BTSC移行の詳細な特性のための方法を提示します。室とブリッジマイクロチャネルを受信し、播種室:これらのPDMS製のデバイスが接続された3区画に組織培養環境をキャストします。我々は、両室は4-5ダに対して実行可能BTSCをサポートするために十分なメディアを保持するようにデバイスを合わせたメディア交換なしYS。最初に播種室に導入、高度なモバイルBTSCsが並列収納室にマイクロチャネルをブリッジしかし、移行後に隔離されています。この移行は、脳の隙間の空間を介して癌細胞の広がりをシミュレートします。移行時に細胞形態の位相ライブ映像を複数日に渡って記録されます。高度回遊BTSCしたがって、孤立再度培養し、さらに分析することができます。
区分けは、マイクロフルイディクスBTSCsや他の癌幹細胞の移動挙動を研究するための汎用性の高いプラットフォームになり得る。グラデーションジェネレータ、流体処理、微小電極や他のマイクロ流体モジュールを組み合わせることにより、これらのデバイスはまた、薬剤スクリーニングや疾患の診断6に使用することができます。遊走細胞の積極的な亜集団の分離は分子メカニズムの根底にあるの研究が可能となります。
プロトコル
1。 BTSCの細胞解離
BTSCsは、ニューロスフェアとして、無血清幹細胞培地で増殖させ、既存の文化から派生しています。の文化は、以前10、11に記載されている。
- BTSC由来神経球からの細胞懸濁液を準備します。 BTSC由来ニューロスフェアを15 mlコニカルチューブに回収し、5分間900rpmで遠心分離する。速く遠心せん断及び/又は損傷神経球ができます。上清を吸引し、ニューロスフェア培養は、あらかじめ温めておいたAccutase 0.5mlに再懸濁する。この溶液を、37℃で5〜10分間インキュベートする°Cの神経球が緩むようになります。細胞は機械的にP100のピペットの10月20日穏やかなストロークで破砕され、その後、幹細胞培地1.5mlをAccutaseを中和するために細胞に添加される。
- BTSCsは、その後5分間1300rpmで遠心分離し、幹細胞培地1mlに再懸濁する。
- 50μlのアリコートをsuspensから削除されイオンと細胞計数のためのマイクロ遠心チューブに入れた。トリパンブルー50μlをエッペンドルフチューブに添加し、懸濁液は、細胞計数のために血球計数器に入れられます。
- 細胞計数した後、必要があれば別の幹細胞培地は20,000生細胞/μlの培地の細胞密度を与えるために、BTSC懸濁液に添加される。
2。二層SU-8マスターとPDMSスタンプの成形体の作製(図1を参照)
我々は、マイクロ流体デバイスの組立に不可欠であるSU-8マスターとPDMSスタンプを製作する光リソグラフィとソフトリソグラフィを使用しています。標準手順12よりわずかに異なる、私たちのSU-8マスターは2つの層で構成されています。 3μmの背の高いマイクロチャネルは、250μmの背の高い播種および収容室間に、プロセスの早い段階で、最初に/ボトム層にキャストされた第2 /上層にあります。 2つの培養コンパートメント(マイクロチャネル間の正しい接続のためにはsとチャンバー)、2つの層が正確な位置に整列する必要があります。しかし、第2の層の厚さと不透明度は底の機能へのアクセスを基準光/アライナを阻止するのに十分な大きさ。ここでは、リモートに配置されている基準マーカーとマスクを設計します。第二層を回転させながらこのように、第一層でこれらのマーカーは、選択的に遮断することができる。その結果、機能の両方の層は、1つのマスターで行われ、PDMSスタンプの浅浮き彫りで成形するための準備が整いました。
- デザインと2フォトマスクを準備します。一つのマスクには、2つの基準マーカーと第一層のためのマイクロチャネルアレイ(400μmの長い10〜50μm幅)で構成されています。別のマスクは、第2層用チャンバー(2ミリメートル長いと600μm幅)をシードと受信で構成されています。両方のマスクは、イソプロパノール、空気乾燥で洗浄し、(薄い金属パーツ、コロラド州)透明フィルム上にレーザープリント、(アドビシステムズ社、カリフォルニア州)Illustratorでデザインされています。
- を有する第1の層を作るSU-8フォトレジスト(マイクロケム、マサチューセッツ州)サプライヤーからの製品マニュアルに従って。まず、スピンコートSU-8(5)、3μmの厚いフォトレジストとハンドルウエハ(WRSの材料、カリフォルニア州)は、ソフトベーク続く。フォトレジストは、紫外線にさらされた、ポストベークと開発が続く密着で対応するマスク、その後で硬化です。
- SU-8(2100)、厚さ250μmのスピンコート二層。第一層から基準マーカーをブロッキングから厚いフォトレジストを防止するために、我々は第二層のスピンコーティングの前にスコッチテープで、これらの分野をカバーしています。テープはアライメントの目的のためにマーカーを明らかにするために剥がされる。
- 紫外線露出する第二のマスクを持つ第二の層を。アライメントマーカーが明らかで、それは光マスクアライナを使用して第2のマスクの中にそれらを揃えるために簡単です。フォトレジストの第二の層は紫外線にさらされたと密着で硬化させ、ポストベークと開発が続いた後である。
- 固着防止コートをもたらしマスター。硬化したPDMSの除去を支援するために、SU-8のマスターは、表面をテフロン加工の型のコーティングを作るために蒸着を介してシラン化することができます。単に真空下でトリクロロ(1H、1H、2H、2H-パーフルオロオクチル)シラン溶液を数滴と、少なくとも1時間はデシケーターに入れます。
- マスターとPDMSをモールド。徹底的に10:1の比率で、PDMSシルガード184(ダウ·コーニング、ミシガン州)のプレポリマーをベースとcurerを混ぜる。空気の泡が見えなくなるまで真空脱ガスデシケーターに入れてください。新しい気泡が導入された場合、再びマスクとドガに混合物を注ぐ。それが室温に冷却した後90℃で2時間レベルのホットプレート上で金型を治す、優しくPDMSスタンプを離します。したがって、培養チャネルはPDMSに刻まれ、デバイスのアセンブリのための準備が整いました。外装にキズや着用されるまで、マスターは、成形のための再利用可能です。抗スティックコーティングが粘着性が回復したときに再度実行する必要があります。
3。マイクロ流体デバイスと細胞培養のアセンブリ(図2)
培養細胞へのために、機能彫りPDMSスタンプを同封のチャネルを形成するために、カバーガラスに装着されている。入口と出口は文化/メディアをロードするために作成されます。一方、ガラス基板とPDMSスタンプにクリーンアップやその他の手続きは、細胞の互換性を確保するために必要である。
- 生穴パンチャーを使用してPDMSスタンプを通して貯水池を作る。我々は彼らの直径が6ミリメートルであることを選ぶ。これらの貯水池は、2つの目的のために提供しています。ひとつは、細胞増殖のための余分な栄養素を保持することです。もう一つは、ピペットのロードと真空吸引のアクセスを行うためのものです。
- 30分間のエタノール70%PDMSスタンプを浸して、その後別の10分間脱イオン水ですすいでください。目的は、製造工程中に導入された、とPDMS汚染を架橋していない潜在的な有機残差をクリアすることです。そのような有機溶媒抽出13などより強烈かつ徹底的な洗浄プロセスとソックスレー抽出14は、他の場所で使用されていました。しかし、我々は、BTSC文化の中で、それが不要な発見。
- オートクレーブ(121℃、35分)を使用して、PDMSスタンプを殺菌。このステップでは、さらに、PDMSの架橋反応が完了します。このステップから開始し、ステップ3.6になるまでは、すべての手順を無菌的に取られます。
- PDMSスタンプを、以前にポリ-L-リジンでコーティングされたガラスカバースリップ上にレイアウトされています。デバイス15から17は、その後、37℃で一晩ラミニン溶液を用いてチャネル℃を充填することによってラミニンでコーティングされているラミニンは、デバイスから吸引され、デバイスは幹細胞培地で洗浄する。
- 貯水池やチャンネルにステップ1から細胞懸濁液をロードします。解離された細胞の11μlを1シード貯水池内に配置されます。真空吸引は、必要に応じて、播種チャンバーに細胞を強制的に使用されます。セルの追加の7μlを隣接播種リザーバーを配置されます。注:平均細胞密度は、20,000細胞/μlメディアです。アフトえー5分、播種および受信貯水池はメディアが殺到している。
- 上に0.5〜1ミリメートルプレオートクレーブしたPDMSシートを置きます。 2 PDMS片の間の天然発生表面接着は、細胞培養は、密閉と輸送、インキュベーション及び顕微鏡イメージングの準備ができていきます。
4。 BioStation IM(ニコンインスツルメンツ、メルヴィル、米国)と、BTSC移行の長期タイムラプスイメージング。
カメラを組み合わせることで、ソフトウェアやインキュベーターすべてが1ボックスに、この顕微鏡システムは、日間無妨害の画像細胞培養することが可能になります。また、そのユニークなモータの設計は、対物レンズを移動させ、ポイントを訪問し機能で静止試料ステージを保持します。これは、ハイスループットアッセイの画像平行実験とトラック細胞移動にそれが実用的です。
- プリ平衡温度、湿気および空気供給を安定させるために45分間Biostation IMを。いくつかの水contの加算サンプルチャンバーにained料理は適切な湿度を維持するために使用されます。
- 顕微鏡の試料室にセル完結型のデバイスをロードし、その中心には、マイクロピンセットを使用しています。
- Biostationソフトウェアにフォーカス、位置の点と時間点を設定し、時間経過を起動します。
5。代表の結果:
区分するマイクロ流体デバイスを用いて、癌細胞の遊走の目視検査および特性の例を図3と図4に示されている。セルラインは、BTSCです。我々の現在の設定では、細胞培養の位相画像を連続5日間(図3)のように長くて2秒ごとに(図4)と同じくらいの頻度で発生するように記録することができます。 5日間を超えて、培養培地を除去し栄養補給や廃棄のため交換する必要があります。当社の長期的な時間経過は、形態学的変化に基づいて、その移行時に6セルステージの回転順序を識別します。 illusとして図3にtrated、我々は、(i)は、移行前、(ii)の開始は、(iii)の経路探索、(iv)は、(v)の宛先exloration及び(vi)移行後の巡航としてそれらを記述します。受入室では、紡錘状の細胞は、成長分割と段階的に移行することができますバルクの腫瘍のように、(i)の段階にとどまる。彼らはマイクロチャネルの入り口に近づくと、彼らは接着剤突起を展開し、生成したとき、いくつかの細胞が段階(ii)に進みます。そのうちの一つだけが入場を占有し、移行の方向を探ることができ、段階(iii)に継続できるようになりました。セルが移動方向を決定したら、それは全体のマイクロチャネルを通って運ばれ、安定的かつ高速にマイクロチャネルを介してクルーズに(iv)のステージに進みます。収容室の開放的な空間を探索する段階(v)のマイクロチャネルは、細胞の収入の終わりに、次にステージ(VI)へ。マイクロ流路では、移行する電力は、主に、図4に示すように、活動をブレブ形成によってアメーバのセルと同様に生成されリットル。細胞のブレブ形成と膜変形は完全にここに記録されます。
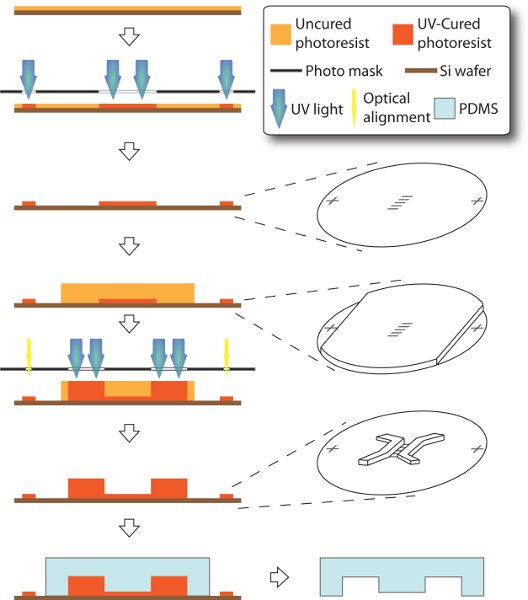
図1:マイクロ流体デバイスの作製の模式図。全体のプロセスは、ソフトリソグラフィーの変更された技術によって、3インチシリコンハンドルウェーハ上に担持される。 3μmの背の高いマイクロチャネルとアライメントマーカーは第一層のように作られています。アライメントマーカーはスコッチテープで覆われている、250μmの厚さのSU-8は、後で厚いフォトレジストによって視力ブロックせずにアライナーをマスクするためにアクセスすることができるように、スピンコートする。これにより、チャンバーの機能は第2の層として作ることができ、正確に第一層に整列。 PDMSスタンプは、最終的に得られたマスターをオフに成形されている。

図2デバイスアセンブリと細胞播種プロセスの模式図。 PDMSとGLで囲まれたお尻のカバーガラスは、3D培養空間がチャンバー、リザーバおよびマイクロチャネルで構成されています。収納室が最初に細胞を含まない培地で満たされている間播種室は、細胞培養で満たされている。それらの間に接続するマイクロチャネルは、受信側に播種側からセル移行証跡を提供します。

図3マイクロチャネルを通じてBTSC移行。アッパー:タイムラプスのスナップショットは、単一のセル(緑色で強調表示されている)播種側から受信側には400μmにわたって移行を示しています。全体の旅は、細胞の形態学的変化のシーケンスを含む、約2日かかります。スケールバーは40μmである。下段:6移行段階の漫画表現を。移行前(ⅰ):播種室では、紡錘形と割り切れる細胞が徐々にお互いに沿って移動。細胞体と電子の偏光によって互いにマイクロチャネル入り口のレースに近い細胞葉状突起をxerting。イニシエーション(ⅱ):競合他社が撤退れながら、最高の能力を持つ遊走細胞は、チャネルの入り口を占めている。経路探査(III):少し極性のアメーバモードへ遊走細胞に変化します。この移行モードでは、非常に運動性と小膜突起をブレブ形成することにより、すべての方向に経路を探索することができます。クルージング(IV):移行パスが決定されると、細胞が前方に見出し追加の大突起を維持することにより、適応アメーバモードに変身。この方法では、細胞は、高い運動性だけでなく、安定した方向と速度を掲げています。デスティネーション·探査(V):パスが終了すると、セルが遅くなり、いかなる侵略ターゲットの収納室を探索するfilopodiasを開発しています。移行後の(VI):収納室を入力した後、細胞は、星形に変わり、高い運動性が、ないと判断の方向を保持します。
"/>
(AB):タイムラプスの図4スナップショットは、BTSCの活性と膜変形をブレブ形成のサイクルを示しています。開始、(BD)拡大;(DF)。後退。矢印やカーブの線はそれぞれ、膜変形の方向と位置を表しています。スナップショットは、8秒ごとに収集されます。
ディスカッション
ここで紹介するマイクロ流体デバイスと画像記録技術は、移行時に細胞形態の視覚的な特徴付けを可能にします。既存の従来の方法に比べて、マイクロ流体プラットフォームは、費用対効果、高いスループットと設計の柔軟性の利点を備えています。提示顕微鏡可視化システムは、長期的な生細胞遊走の研究と記録を可能にします。レンズ電動機能は、サンプルを乱すことなく、高解像度の画像に複数のマイグレーション·パスを追跡することが可能になります。
装置の組立時に、PDMSスタンプを非永久的にPDLをコーティングし(ステップ3.4)の便宜のためにカバーガラスに接着されている。それはこのプロトコルの成功のための良好なシールを達成するために重要です。このような基板上にスタンプやほこり/破片の気泡のようにデバイス製造から導入汚染は、漏れた液で結合し、その結果を危うくすることができます。したがって、treatingの埃の方法でデバイスはデバイスの故障を防ぐために重要です。事前PDL-コーティングに、カバーガラスは、硝酸が扱われ、PDL溶液はダスト/破片を除去するために遠心分離する。クリーンルームにアクセスできない場合、我々は、PDMSスタンプからほこり/破片を除去するのにセロテープ、アルコールすすぎ、水浴は非常に役に立ちまし。 PDMSスタンプは、カバーガラスとの接触を行った後、ピンセットで軽くスタンプをタップするとシールを容易にします。
BTSCsは、幹細胞培地中球の培養を介してヒトの手術室の標本から正常な神経幹細胞の培養液10に似て濃縮することができる。このように濃縮さBTSCsは、このような幹細胞マーカーの発現(CD133、ネスチン)、複数の神経系統への分化(グリアおよびニューロン)、および100としていくつか持つ同所性免疫不全マウスモデルにおける腫瘍イニシエーションとしての幹細胞様の性質を実証セル18。いくつかの議論がpurifiについて存在していますがBTSCs 1、19から21の陽イオンとメンテナンス、球の成長BTSCsは良い親腫瘍22から24の表現型と遺伝子型を維持しています。
コンパートメント化された空間は、細胞遊走のための生理的環境を模倣しています。我々のデバイスでは、BTSCは細胞形態を調節することにより、サイズに制約の空間を介して移行の強力な能力を発揮する。細胞の形態学的変化の我々の特性は、隣接する脳のBTSC侵攻の可能な新しい詳細な説明をモデル化することができる6段階の順序でモード変換を示しています。初期段階では、細胞は極性のかなりの量を得るために、効果的にマイクロ流路内部に自分自身を固定する接着剤の突起を生成します。マイクロチャネル内のセル占有がいったん確立されると、それは巡航モードに変換してマイクロチャネルを通じて全体の旅のために、このモードを維持します。この段階では、BTSCは高い運動性と一貫した方向性を維持するが、エネルギーを節約する。で興味深いことに、マイクロチャネル1は、そのように、一度に1つのクルージングセルに制限されていることが表示されたら、この段階への単一のセルに進み、マイクロチャネルから他の細胞の隠れ家。このメカニズムは、おそらく拡散腫瘍の実効性を確保し、マイクロチャネル内の栄養素の過剰消費を防ぐことができます。マイクロチャネル間の移行を完了した後、細胞は、多方向突起と侵略ターゲットまたは新しいマイグレーション·パスの詳細な探査のためにその傾向を取り戻す。区分するマイクロ流体デバイスは、in vitroでの小説は脳実質のBTSC浸潤を研究するための微小環境を作成することを意味しています。
この方法は簡単に癌幹細胞(CSC)およびその他のタイプの腫瘍由来遊走細胞株の研究に適応することができます。マイクロ流体デバイスにおける培養細胞はインキュベーターと組織培養の専門知識が装備されているすべての近代的な生物学の研究室で行うことができます。 SU-8のマスターは、PDMSを装備キャストや装置アセンブリは、ソフトリソグラフィーにおけるいくつかの基本的なトレーニングで実現可能である。また、このプラットフォームはまた、勾配ミキサー、表面パターニング、流体制御や微小電極などの他の機能モジュールを統合することで、他のアプリケーション用に拡張することができる。
開示事項
特別な利害関係は宣言されません。
謝辞
PACは、部分的にウィスコンシン大学幹細胞トレーニングプログラム(PAクラーク)にNIHのT32の助成金によってサポートされています。 JSKは部分HEADRUSH脳腫瘍研究教授職、ロジャーLOFFメモリアルGBMの研究基金、財団とUW /脳神経外科脳腫瘍研究と教育基金によってサポートされていました。 JCWとYHは部分的にNIHの助成金NIBIB 1R01EB009103-01でサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| ダルベッコ改変イーグル培地(DMEM)、高グルコース | GIBCO /インビトロジェン | 11965 | 脳腫瘍幹細胞(BTSC)文化用品 |
| HamのF12 | GIBCO /インビトロジェン | 31765 | 脳腫瘍幹細胞(BTSC)文化用品 |
| ビタミンB27サプリメントマイナス | GIBCO /インビトロジェン | 12587-010 | 脳腫瘍幹細胞(BTSC)文化用品 |
| 抗生物質抗真菌剤(PSA) | GIBCO /インビトロジェン | 15240 | 脳腫瘍幹細胞(BTSC)文化用品 |
| 上皮増殖因子(EGF)、ヒト組換え | GIBCO /インビトロジェン | PHG0313 | 脳腫瘍幹細胞(BTSC)文化用品 |
| 塩基性線維芽細胞増殖因子(bFGF)の、ヒト組換え | GIBCO /インビトロジェン | PHG0021 | 脳腫瘍幹細胞(BTSC)文化用品 |
| ブタの腸粘膜からヘパリンナトリウム塩、 | シグマ | H1027-250KU | 脳腫瘍幹細胞(BTSC)文化用品 |
| ラミニン(天然マウス) | GIBCO /インビトロジェン | 23017-015 | 脳腫瘍幹細胞(BTSC)文化用品 |
| Accutase | ミリポア | SCR005 | 脳腫瘍幹細胞(BTSC)文化用品 |
| 細胞培地を食い止める |
| ||
| 塩基性線維芽細胞増殖因子(bFGF)のヘパリン/ |
| ||
| 上皮成長因子(EGF) |
| ||
| ヘパリン |
| ||
| SU-8フォトレジスト | マイクロケム | ||
| シリコンハンドルウェーハ | WRSの材料 | 3P01-5SSP-INV | |
| トリクロロ(1H、1H、2H、2H-パーフルオロオクチル)シラン | シグマアルドリッチ | 448931 | |
| PDMSシルガード184 | ダウコーニング | ||
| ラミニン | BD Bioscience社 | 50μgの/最終濃度のPBS緩衝液中 | |
| Biostation IM | ニコンインストゥルメント |
参考文献
- Carke, M. F. Cancer Stem Cells-Perspectives on Current Status and Future Directions. AACR Workshop on Cancer Stem Cells. Cancer Research. 66, 9339-9344 (2006).
- Stupp, R. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352, 987-996 (2005).
- Sahai, E. Mechanisms of cancer cell invasion. Current Opinion in Genetics & Development. 15, 87-96 (2005).
- Shackleton, M., Quintana, E., Fearon, E. R., Morrison, S. J. Heterogeneity in Cancer: Cancer Stem Cells versus Clonal Evolution. Cell. 138, 822-829 (2009).
- Karnoub, A. E. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature. 449, 557-557 (2007).
- Huang, Y., Agrawal, B., Sun, D., Kuo, J. S., Williams, J. C. Microfluidics-based Devices: New Tools for Studying Cancer and Cancer Stem Cell Migration. Biomicrofluidics. 5, (2011).
- Rolli, C. G., Seufferlein, T., Kemkemer, R., Spatz, J. P. Impact of Tumor Cell Cytoskeleton Organization on Invasiveness and Migration: A Microchannel-Based Approach. Plos One. 5, (2010).
- Chung, S. Cell migration into scaffolds under co-culture conditions in a microfluidic platform. Lab on a Chip. 9, 269-275 (2009).
- Irimia, D., Toner, M. Spontaneous migration of cancer cells under conditions of mechanical confinement. Integrative Biology. 1, 506-512 (2009).
- Svendsen, C. N. A new method for the rapid and long term growth of human neural precursor cells. Journal of Neuroscience Methods. 85, 141-152 (1998).
- Clark, P. A. Glioblastoma cancer stem cells exhibit decreased dependence on exogenous growth factors for proliferation and survival. , .
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37, 551-575 (1998).
- Millet, L. J., Stewart, M. E., Sweedler, J. V., Nuzzo, R. G., Gillette, M. U. Microfluidic devices for culturing primary mammalian neurons at low densities. Lab on a Chip. 7, 987-994 (2007).
- Regehr, K. J. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab on a Chip. 9, 2132-2139 (2009).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nature Cell Biology. 9, 1347-1347 (2007).
- Hu, X. D., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-Dependent Dynamic Microtubule Invasion of Dendritic Spines. Journal of Neuroscience. 28, 13094-13105 (2008).
- Vitzthum, L. Study of Na(+)/H(+) exchange-mediated pH(i) regulations in neuronal soma and neurites in compartmentalized microfluidic devices. Integrative Biology. 2, 58-64 (2010).
- Clark, P. A., Treisman, D. M., Ebben, J., Kuo, J. S. Developmental signaling pathways in brain tumor-derived stem-like cells. Developmental Dynamics. 236, 3297-3308 (2007).
- Chen, R. H. A Hierarchy of Self-Renewing Tumor-Initiating Cell Types in Glioblastoma. Cancer Cell. 17, 362-375 (2010).
- Pollard, S. M. Glioma Stem Cell Lines Expanded in Adherent Culture Have Tumor-Specific Phenotypes and Are Suitable for Chemical and Genetic Screens. Cell Stem Cell. 4, 568-580 (2009).
- Lobo, N. A., Shimono, Y., Qian, D., Clarke, M. F. The biology of cancer stem cells. Annual Review of Cell and Developmental Biology. 23, 675-699 (2007).
- Singh, S. K. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Lee, J. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Research. 64, 7011-7021 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved