Method Article
Compartmentalizing 마이크로 유체 장치와 라이브 세포 이미징을 사용하여 암 줄기 세포 마이그레이션 평가
* 이 저자들은 동등하게 기여했습니다
요약
암 줄기 세포 이주를 조사하기위한 compartmentalizing 마이크로 유체 장치가 설명되어 있습니다. 이 소설 플랫폼은 가능한 세포 microenvironment를 생성 및 라이브 세포 운동의 미세 시각화 할 수 있습니다. 높은 운동성 암 세포는 잠재적으로보다 효과적인 미래의 치료로 이어지는 공격적인 침투 분자 메커니즘을 공부 절연되어 있습니다.
초록
지난 40 년 동안 미국은 사망률 만 5 % 감소의 결과로, 암 연구에 억 200여 달러를 투자했습니다. 환자 결과를 개선하기위한 주요 장애물은 공격적인 암 세포 침입, 전이 및 치료 저항 1과 관련된 세포의 이주를 근간 메커니즘의 가난한 이해입니다. Glioblastoma Multiforme (GBM), 가장 널리 주요 악성 성인 뇌 종양이이 어려움을 예시. 표준 수술, 방사선 및 chemotherapies에도 불구하고, 환자의 평균 생존은 인접한 뇌 및 신속한 암 재발이에 적극적인 GBM의 침투로 인해 만 십오개월입니다. 비정상 세포 철새 메커니즘과 종양 microenvironment의 상호 작용 가능성이 세 정상 세포에서 암을 차별화. 따라서, GBM에 대한 치료 방법을 개선하는 것은 암 세포 이주 메커니즘에 대한 이해를 필요로합니다. 최근 작품 THA 제안GBM 내에서 세포의 타 작은 subpopulation, 뇌 종양의 줄기 세포 (BTSC)는 치료 저항 및 재발에 대한 책임 수 있습니다. BTSC 철새 용량의 근간이 메커니즘은 특징 1,4로 시작합니다.
육안 검사 및 기하학적 조작, 기존의 마이그레이션 assays 5 제한으로 인해 전체 세포 인구를 정량화으로 제한됩니다. 반면, 마이크로 유체 장치 때문에 현대적인 현미경과 미세 환경에 6-9 제어와의 호환성의 단일 세포 분석을 허용합니다.
우리는 compartmentalizing 마이크로 유체 장치를 사용하여 BTSC 마이그레이션에 대한 자세한 특성화를위한 방법을 제시한다. 이 PDMS 만든 장치는 세 연결된 구획에 조직 배양 환경을 캐스팅 : 챔버을 퍼 뜨리고 챔버을 받고 microchannels를 연결. 우리 둘 다 방 4-5 다에 대해 가능한 BTSC을 지원하기 위해 충분한 미디어를 개최하는 등의 장치를 맞는미디어 교환없이 YS. 처음 심는 챔버 내로 유입이 높은 모바일 BTSCs는 병렬 수신 챔버에 microchannels를 연결하지만 마이그레이션 후 절연되어 있습니다. 이 마이그레이션은 뇌의 중간 공간을 통해 암 세포의 확산을 시뮬레이션한다. 마이그레이션하는 동안 세포 형태학의 위상 라이브 이미지는 며칠 동안 기록됩니다. 높은 철새 BTSC 따라서, recultured 격리되고, 더 분석 할 수 있습니다.
Compartmentalizing microfluidics는 BTSCs 및 기타 암 줄기 세포의 이동 동작을 연구 할 수있는 다양한 플랫폼이 될 수 있습니다. 기울기 발전기, 유체 취급, 마이크로 전극 및 기타 비유동 모듈을 결합하여 이러한 장치는 약물 검사 및 질병 진단 6 사용하실 수 있습니다. 철새 세포의 공격적인 subpopulation의 절연은 분자 메커니즘의 기초 연구를 수있게 될 것입니다.
프로토콜
1. BTSC의 세포 분리
BTSCs는 neurospheres으로 혈청이없는 줄기 세포 매체에서 재배 기존의 문화에서 파생됩니다. 의 문화는 이전에 10, 11 설명되어 있습니다.
- BTSC - 파생 neurospheres에서 세포 현탁액을 준비합니다. BTSC - 파생 neurospheres로 15 ML 원뿔 튜브에 수집 된 5 분 900 rpm으로 centrifuged 있습니다. 빠른 원심 분리는 전단 및 / 또는 손상 neurospheres 수 있습니다. 표면에 뜨는이 흡입되어 neurosphere 문화는 사전 예열 Accutase의 0.5 ML에 resuspended 있습니다. 이 솔루션은 37 5-10분에 대한 incubated 수 있습니다 ° C neurospheres가 풀어야 할 수 있도록합니다. 셀은 기계적으로 10-20 부드러운 P100의 피펫의 스트로크 한 후 줄기 세포 매체의 1.5 ML은 Accutase을 중화하기 위해 셀에 추가됩니다으로 끝낼 수 있습니다.
- BTSCs 그 다음 5 분 1,300 rpm으로 centrifuged, 그리고 줄기 세포 매체 1 ML에 resuspended 있습니다.
- 50 μl 나누어지는이 suspens에서 제거됩니다이온은, 세포 계산을위한 microcentrifuge 튜브에 배치. trypan 파랑의 50 μl는 Eppendorf 튜브에 추가되고 정지는 셀 계산을위한 hemocytometer에 배치되어 있습니다.
- 셀 계산 한 후 필요한 경우 추가 줄기 세포 매체는 20000 라이브 셀 / μl 미디어의 셀 밀도를 제공 할 수있는 BTSC 정지에 추가됩니다.
2. 이중 계층 스와-8 마스터와 PDMS 스탬프의 성형 제작 (그림 1 참조)
우리는 마이크로 유체 장치의 조립에 필수적인 스와-8 마스터와 PDMS 스탬프를 조작하는 광학 리소그래피와 부드러운 리소그래피를 사용합니다. 표준 절차 12보다 약간 다른, 우리의 스와-8 마스터는 두 층으로 구성되어 있습니다. 250 μm 높이 퍼 뜨리고 및 수신 챔버 두 번째 / 상위 레이어에있는 동안 3 μm 높이 microchannels은 이전 과정에서 아래 / 첫 번째 층에 주조되어 있습니다. 이 문화 구획 (microchannel 사이의 올바른 연결을 위해서는s와 챔버), 두 레이어가 정확하게 위치에 정렬해야합니다. 그러나, 두 번째 층의 두께와 불투명도는 아래 기능을 액세스 광학 / fiducial aligner를 차단 할 수있을만큼 큽니다. 여기 fiducial 마커가 원격 위치하고있는 마스크를 디자인합니다. 두 번째 레이어를 회전하는 동안 따라서, 첫 번째 레이어에서 이러한 마커는 선택적으로 차폐 될 수 있습니다. 그 결과, 기능을 모두 레이어가 하나의 마스터에서 만든되고 PDMS 스탬프의 얕은 돋을 새김으로 성형 준비.
- 디자인 두 사진 마스크를 준비합니다. 한 마스크는 두 fiducial 마커와 첫 번째 층에 microchannels의 배열 (400 μm 길이 10-50 μm 폭)으로 구성되어 있습니다. 또 다른 마스크는 두 번째 레이어 챔버 (2mm 길이 600 μm 폭)을 퍼 뜨리고 및 수신 구성되어 있습니다. 두 마스크가 일러스트 레이터 (어도비, 캘리포니아)에 설계되어, 이소프로판올, 공기 건조로 청소 투명 필름 (얇은 금속 부품, 콜로라도)에 레이저 인쇄.
- 첫 번째 층과 만들기스와-8 포토 레지스트 (MicroChem, 매사추세츠) 공급 업체의 제품 설명서에 따라. 첫째, 스핀 코트 스와-8 (5)의 3 μm 두께의 포토 레지스트와 핸들 웨이퍼 (WRS 자료, 캘리포니아) 소프트 베이킹이 나타납니다. 포토 레지스트는 자외선 노출 후 베이킹 개발에 이어 가까운 접촉에서 해당 마스크와 치료 후입니다.
- 스와-8 (2100) 두께 250 μm와 스핀 코트 두 번째 층. 첫 번째 층에서 fiducial 마커를 차단에서 두꺼운 포토 레지스트를 방지하기 위해, 우리는 두 번째 층의 스핀 코팅하기 전에에 스카치 테이프로 이러한 영역을 다룹니다. 테이프 그런 다음 정렬 목적으로 마커를 나타 내기 위해 벗겨되어 있습니다.
- UV-노출 두 번째 마스크가 두 번째 레이어를. 정렬 마커가 발견으로, 그것은 광학 마스크 aligner를 사용하여 두 번째 마스크에있는 사람들에게 정렬 간단합니다. 포토 레지스트의 두 번째 층은 자외선 노출과 가까이 접촉에서 치료, 사후 제빵 및 개발에 이어 다음입니다.
- 안티 - 스틱 코팅 된 마스터합니다. 치료 PDMS의 제거에 도움이되는 스와-8 마스터는 표면에게 nonstick 형 코팅을 할 수 증착을 통해 silanized 할 수 있습니다. 간단하게 trichloro 여러 드롭스 (1H, 1H, 2H, 2H-perfluorooctyl) 진공 실란 솔루션으로, 적어도 하나의 시간 동안 건조기에 넣으십시오.
- 마스터와 PDMS을 본 뜨는거야. 성 예비 중합체베이스 철저히 10시 1분 비율로 PDMS Sylgard 184 (다우 코닝, 미시간)의 치료자를 섞는다. 공기 방울은 본 적이 될 때까지 진공 degassing을위한 건조기에 넣으십시오. 새로운 기포가 도입되는 경우 다시 마스크와 가스를 제거하다에 혼합물을 부어. 는 실내 온도에 냉각 한 후 90 C.에서 2 시간 동안 레벨 열판에 금형을 치료, 부드럽게 PDMS 스탬프를 놓습니다. 따라서, 배양 채널 PDMS에 새겨진 및 장치의 조립 준비되어 있습니다. 이 금이 간 또는 착용 될 때까지 마스터 성형 재사용합니다. 안티 - 스틱 코팅 끈적 거림이 회복되면 다시 수행해야합니다.
3.마이크로 유체 장치 및 세포 배양의 조립 (그림 2)
문화 셀 위해, 기능 조각 PDMS 스탬프는 동봉 된 채널을 형성하기 위해 유리 coverslip에 부착되어 있습니다. 유입구 및 유출구는 문화 / 미디어를로드하기 위해 생성됩니다. 한편, 청소 및 유리 기판과 PDMS 스탬프를 다른 절차는 셀 호환성을 보장하기 위해 필요합니다.
- 생검 구멍 구멍을 뚫는를 사용하여 PDMS 스탬프를 통해 저수지하십시오. 우리는 직경이 6mm로 선택합니다. 이 저수지는 두 목적을 위해 제공하고 있습니다. 하나는 세포 성장을위한 추가 영양을 보유하는 것입니다. 다른 하나는 피펫 로딩 및 진공 흡인의 액세스입니다.
- 30 분에 에탄올의 70 %에 PDMS 스탬프를 만끽 한 다음 다른 10 분에 드 이온화 물을 씻어. 목적은 제조 과정에서 도입하고, PDMS 오염을 uncrosslinked 잠재적 인 유기 잔차을 취소하는 것입니다. 이러한 유기 추출 13으로 더 강렬하고 철저한 청소 프로세스 와 Soxhlet 추출 (14) 다른 곳에서 사용되었다. 그러나, 우리는 BTSC 문화가 필요 발견했다.
- 압력솥 (121 ° C, 35 분)를 사용하여 PDMS 스탬프를 검사. 이 단계는 더 PDMS의 crosslink 반응을 완성합니다. 이 단계에서 시작하여 단계 3.6까지 모든 절차는 무균 방식으로 촬영하고 있습니다.
- PDMS 스탬프 그런 다음 이전에 폴리-L-라이신으로 코팅 된 유리 coverslip에 놓여 있습니다. 15-17 장치는 다음 37 번 박 laminin 솔루션과 채널 ° C.를 작성하여 laminin으로 코팅되어 있습니다 Laminin은 장치에서 흡입되고 장치가 줄기 세포 매체로 세척합니다.
- 저수지 및 채널에 1 단계에서 세포 현탁액을로드합니다. dissociated 세포 11 μl 한 심는 저장소에 배치됩니다. 진공 흡인이 필요한 경우, 시딩 챔버에 세포를 강제하는 데 사용됩니다. 셀의 추가 7 μl은 인접한 심는 저장소를 배치하고 있습니다. 참고 : 평균 셀 밀도는 20,000 세포 / μl 미디어입니다. 고물에어 5 분 심는 및 수신 저수지는 미디어와 물이 차고 있습니다.
- 상단에 0.5-1 mm 사전 autoclaved PDMS 시트를 놓습니다. 이 PDMS 조각 사이의 자연 - 발생 표면 부착은 세포 배양은 밀폐 및 운송, 부화 및 미세 이미지 준비 할 것입니다.
4. BioStation IM (니콘 인스트루먼트 Inc의, 멜빌, USA)와 BTSC 이주의 장기 시간 경과 영상.
카메라를 결합, 소프트웨어 및 보육 모든 한 상자 안에서,이 미세 시스템은 일없이 방해와 이미지 세포 배양에이 가능합니다. 또한, 독특한 모터 설계 목적 렌즈를 이동하고 포인트 방문 기능에 고정 샘플 단계를 유지합니다. 이 높은 처리량 분석에 이미지 병렬 실험을 추적 세포 운동하는 것이 실용적 수 있습니다.
- 사전 평형 온도, 수분, 공기 공급을 안정화시키기 위해 45 분 동안 Biostation의 IM합니다. 여러 물 cont의 추가샘플 챔버에서 ained 요리는 적절한 습도를 유지하는 데 사용됩니다.
- 현미경의 샘플 챔버에 휴대가 가능한 장치를로드하고, 센터는 마이크로 핀셋을 사용합니다.
- Biostation 소프트웨어의 초점, 위치 - 포인트 및 시간 포인트를 설정하고 시간 경과를 시작합니다.
5. 대표 결과 :
compartmentalizing 마이크로 유체 장치를 사용하여 암 세포 이주의 육안 검사 및 특성의 예는 그림 3과 그림 4에 설명되어 있습니다. 세포 라인은 BTSC입니다. 현재 설치로는, 세포 배양의 위상 이미지는 지속적으로 오일 (그림 3)과 같은 긴 매 2 초 (그림 4)처럼 자주로에 대해 기록 할 수 있습니다. 오일 외에도, 문화 미디어가 삭제 영양 보충 및 폐기물에 대한 교체해야합니다. 우리의 장기 시간 경과는 형태학의 변화에 근거하여 마이그레이션하는 동안 여섯 세포 단계의 회전 순서를 식별합니다. illus으로그림 3 trated, 우리는 (i) 사전 마이그레이션하고, (ii) 개시은 (III) 경로 - 탐험, (IV)가, (V) 대상 - exloration와 (VI) 후 이주를 주행로에 대해 설명합니다. 수신 챔버에서 스핀들 모양의 세포는 성장 나누어 점진적으로 마이그레이션 할 수 있습니다 대량 종양에서와 같이 무대은 (i)에있어. 그들은 microchannel 입구에 접근함에 따라, 몇 전지는 무대를 진행 (II)는 접착제 돌출부를 확장하고 생성 할 때. 그 중 하나가 입구를 점유하고 마이그레이션 방향을 탐색 할 수 무대 (3)으로 이동 할 수 있습니다. 셀 마이그레이션 방향을 결정하면, 그것은 전체 microchannel을 통해 수행됩니다 지속적으로 높은 속도에서 microchannel을 통해 크루즈에 (IV) 단계로 진행. 단계 (VI) 그 다음에 챔버를받은 열린 공간을 탐험하고,하는 단계 (V)에 microchannel, 셀 수익의 끝에서. microchannel에서 마이그레이션 전력은 대부분,도 4에 도시 된 바와 같이 활동을 blebbing하여 amoeboid cel과 비슷 생성리터. 셀 blebbing와 막 변형이 완전히 여기에 기록됩니다.
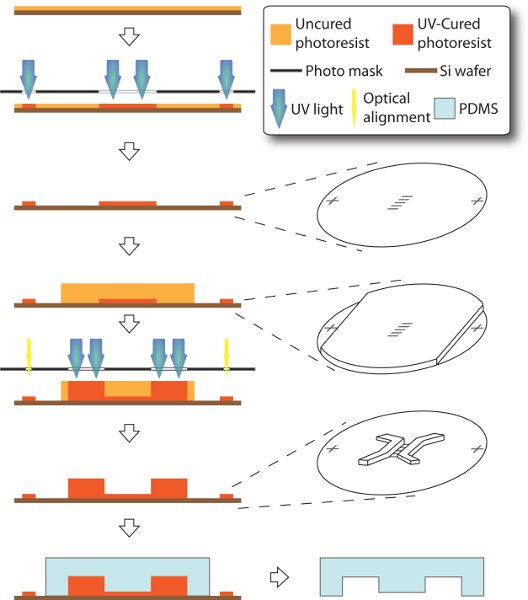
그림 1. 마이크로 유체 장치의 제조의 설계도. 전체 과정은 소프트 리소그래피의 수정 기술을 통해 3 인치 실리콘 핸들 웨이퍼에 수행됩니다. 3 μm 높이 microchannels 및 정렬 마커는 첫 번째 레이어로 구성되어 있습니다. 정렬 마커는 스카치 테이프로 가득하는 동안 다음 250 μm 두께 스와-8은 나중에 두꺼운 포토 레지스트에 의해 시력을 차단하지 않고 aligner를 마스크에 액세스 할 수 있습니다 것과 같은, 스핀 - 코팅입니다. 따라서, 챔버 기능은 두 번째 레이어로 만들 수하고 정확하게 첫 번째 레이어에 정렬. PDMS 스탬프는 결국 결과 마스터를 성형하고 있습니다.

그림 2. 장치 어셈블리 및 세포 심는 과정의 설계도. PDMS와 GL에 의해 둘러싸여엉덩이 coverslip은 3D 배양 공간이 챔버, 저수지 및 microchannels로 구성되어 있습니다. 수신 챔버가 처음 셀 - 무료 미디어로 가득되는 동안 시딩 챔버는 세포 배양으로 가득합니다. 그들 사이에 연결 microchannels는 측면을받는에 심는 측에서 셀 마이그레이션 길을 제공합니다.

microchannel을 통해 그림 3. BTSC 마이그레이션. 어퍼 : 시간 경과의 스냅 샷은 하나의 셀 (녹색으로 강조 표시) 시딩 측에서 수신 측에 400 μm를 통해 마이그레이션을 보여줍니다. 전체 여행은 세포 형태학의 변경 순서를 포함, 약 2 일이 소요됩니다. 규모 바는 40 μm이다. 밑으로 여섯 가지 마이그레이션 단계의 만화 표현합니다. 사전 마이그레이션는 (i) : 시딩 챔버에서 스핀들 - 모양 dividable 세포는 점차 서로 함께 마이그레이션. 전지 본체 및 전자 편광으로 서로 microchannel 입학 경주 근처에있는 세포 lamellipodia의 돌출부를 xerting. 가입 (II) : 경쟁이 후퇴하는 동안 최고 용량과 철새 셀 채널 입구에 자리 잡고 있습니다. 경로 - 탐구 (III) : 약간의 극성과 amoeboid 모드로 철새 셀 변경됩니다. 이 마이그레이션 모드는 매우 운동성 작은 막 돌출부를 blebbing하여 모든 방향으로 경로를 탐색 할 수 있습니다. 크루즈 (IV) : 마이그레이션 경로가 결정되면, 세포 앞으로 제목 추가 큰 돌출부를 유지하여 적응 amoeboid 모드로 변환합니다. 이 방법은 셀은 높은 운동성뿐만 아니라 지속적으로 방향과 속도를지지. 대상 - 탐색 (V) : 경로 엔드시, 셀은 속도가 느려 및 공격 대상에 대한 수신 챔버를 둘러 filopodias을 개발하고 있습니다. 후 마이그레이션 (VI) : 수신 챔버를 입력 한 후 셀은 별 모양으로 변하기 높은 운동성 있지만 결정 방향을 유지합니다.
"/>
. (AB) : 시간 경과의 그림 4 스냅 샷은 BTSC의 활동과 막 변형을 blebbing의 사이클을 보여줍니다. 개시 (BD). 확장 (DF). 철회. 화살표와 곡선 - 라인 방향과 막 변형의 위치, 각각을 나타냅니다. 스냅 샷은 모든 팔초를 수집하고 있습니다.
토론
여기에 제시된 마이크로 유체 장치와 이미지 레코딩 기술은 마이그레이션하는 동안 세포 형태의 시각적 특성 수 있습니다. 기존의 기존의 방법에 비해, 마이크로 유체 플랫폼은 비용 효율성, 높은 처리량 및 설계 유연성의 장점을 제공합니다. 제시 미세 시각화 시스템은 장기 라이브 세포 이주의 연구와 기록을 할 수 있습니다. 렌즈 모터 기능은 샘플을 방해하지 않으면 서 이미지 해상도가 높은 여러 마이그레이션 경로를 추적 할 수있게.
장치의 조립 동안 PDMS 스탬프은 비 영구적으로 PDL 코팅의 편의 (단계 3.4)의 유리 coverslip에 접착합니다. 그것은이 프로토콜의 성공을 위해 좋은 인감를 달성하는 것이 중요합니다. 예를 기판에 도장이나 먼지 / 파편에 기포와 같은 장치 제조,에서 도입 오염 누출 유체의 결합과 결과를 위태롭게 할 수 있습니다. 따라서, treatiNG는 먼지없는 방식으로 장치는 장치 실패를 방지하는 것이 중요합니다. 이전 PDL 코팅에, 유리 coverslips는 질산이 취급하고 PDL 솔루션은 먼지 / 파편을 제거하기 위해 centrifuged 있습니다. 클린 룸에 액세스 할 수없는 경우 우리는, 알코올 린스, 스카치 테이프를 찾고, PDMS 스탬프의 먼지 / 이물질 제거에 물통 매우 도움이. PDMS 스탬프가 유리 coverslip과 접촉 한 후 핀셋으로 부드럽게 우표를 활용하면 인감을 용이하게한다.
BTSCs은 10 정상적인 신경 줄기 세포의 문화와 비슷한 줄기 세포 매체의 영역 문화를 통해 인간의 운영 객실 표본에서 풍부하게 할 수 있습니다. 이러한 방식으로 풍부한 BTSCs는 줄기 세포 마커의 표현 (CD133, nestin), 여러 신경 lineages (glial 및 neuronal)에 차별화, 100처럼 몇과 orthotopic immunodeficient 마우스 모델에서 종양 개시 등의 줄기 세포와 같은 속성을 보여줍니다 세포 18. 일부 논쟁이 purifi에 대해 존재하지만양이온과 BTSCs 1 19-21의 정비, 영역 자체 BTSCs 더 부모 종양 22-24의 표현형 및 유전자형을 유지합니다.
compartmentalized 공간은 셀 마이그레이션에 대한 생리적 환경을 모방 한 것이 었지요. 우리 장비에서 BTSC 세포 형태를 조절하여 크기 제약이 공간을 통해 이전의 강한 능력을 나타냅니다. 세포 형태학의 변화 우리의 특성은 인접한 뇌의 BTSC 침략의 가능한 새로운 자세한 설명을 모델링 할 수 있습니다 여섯 단계 순서 모드 - 변환을 나타냅니다. 초기 단계에서 전지 극성의 상당한 금액을 얻을 수 있으며 효율적으로 microchannel 내부에 자신을 고정 접착제 돌출부를 생성합니다. microchannel에서 셀 수용 인원이 이루어지면, 그것은 주행 모드로 변환하고 microchannel을 통해 전체 여행을 위해이 모드를 유지합니다. 이 단계에서, BTSC 높은 운동성하고 일관된 방향을 유지하지만, 에너지를 절약. 에terestingly, 그것은 microchannel 하나 그러한 한 번에 하나의 크루즈 세포로 제한되어 나타나면이 단계에 단세포 진행, microchannel에서 다른 세포의 휴양지. 이 메커니즘은 가능성이 확산 종양의 효율성을 보장하고 microchannel에 영양 overconsumption을 방지합니다. microchannel에서 마이그레이션을 완료 한 후, 셀 multidirectional 돌출부와 공격 대상 또는 새 마이그레이션 경로에 대한 자세한 탐사의 성향에 회복합니다. compartmentalizing 마이크로 유체 장치는 체외에서 소설은 뇌 실질의 BTSC 침투를 공부에 microenvironment을 만드는 것을 의미합니다.
이 방법은 쉽게 암 줄기 세포 (CSC) 및 기타 종양 유형에서 파생 된 철새 세포 라인의 연구에 적용 할 수 있습니다. 마이크로 유체 장치에서 배양 세포는 보육 및 조직 문화 전문 지식을 갖추고 있습니다 모든 현대 생물학 실험실에서 수행 할 수 있습니다. 스와-8 마스터, PDMS가 장착주조 및 장치 조립은 부드러운 리소그래피의 일부 기본 훈련 가능합니다. 또한이 플랫폼은 또한 그라데이션 믹서, 표면 패터닝, 유체 제어 및 microelectrode과 같은 다른 기능 모듈을 통합으로 다른 응용 프로그램 연장 될 수 있습니다.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
PAC는 부분적으로 위스콘신 줄기 세포 연수 프로그램 (PA 클락)의 대학에 NIH T32 교부금으로 지원됩니다. JSK는 부분적으로 HEADRUSH의 뇌 종양 연구 교수, 로저 Loff 기념 GBM 연구 기금과 UW 재단 / 신경 외과 뇌 종양 연구 및 교육 기금에 의해 지원되었다. JCW와 YH는 부분적으로 NIH 보조금 NIBIB 1R01EB009103-01에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 |
| Dulbecco의 수정 이글 배지 (DMEM), 높은 혈당 | Gibco / Invitrogen | 11,965 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| 햄의 F12 | Gibco / Invitrogen | 31,765 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| B27 보충 마이너스 비타민 A | Gibco / Invitrogen | 12587-010 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| 항생제 - Antimycotic (PSA) | Gibco / Invitrogen | 15,240 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| 표피 성장 인자 (EGF), 인간 재조합 | Gibco / Invitrogen | PHG0313 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| 기본 섬유 아세포 성장 인자 (bFGF), 인간 재조합 | Gibco / Invitrogen | PHG0021 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| 돼지의 장 점막에서 헤파린 나트륨 소금, | 시그마 | H1027-250KU | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| Laminin (천연 마우스) | Gibco / Invitrogen | 23017-015 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| Accutase | Millipore | SCR005 | 뇌 종양의 줄기 세포 (BTSC) 문화 용품 |
| 셀 매체를 줄기 |
| ||
| 기본 섬유 아세포 성장 인자 (bFGF) / 헤파린 |
| ||
| 표피 성장 인자 (EGF) |
| ||
| 헤파린 |
| ||
| 스와-8 포토 레지스트 | MicroChem | ||
| 실리콘 핸들 웨이퍼 | WRS 자료 | 3P01-5SSP - 인보이스 | |
| trichloro (1H, 1H, 2H, 2H-perfluorooctyl) 실란 | 시그마 - 알드리치 | 448931 | |
| PDMS Sylgard 184 | 다우 코닝 | ||
| laminin | Bioscience BD | 50 μg /최종 농도에 대한 PBS 버퍼에 ML | |
| Biostation IM | 니콘 악기 |
참고문헌
- Carke, M. F. Cancer Stem Cells-Perspectives on Current Status and Future Directions. AACR Workshop on Cancer Stem Cells. Cancer Research. 66, 9339-9344 (2006).
- Stupp, R. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352, 987-996 (2005).
- Sahai, E. Mechanisms of cancer cell invasion. Current Opinion in Genetics & Development. 15, 87-96 (2005).
- Shackleton, M., Quintana, E., Fearon, E. R., Morrison, S. J. Heterogeneity in Cancer: Cancer Stem Cells versus Clonal Evolution. Cell. 138, 822-829 (2009).
- Karnoub, A. E. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature. 449, 557-557 (2007).
- Huang, Y., Agrawal, B., Sun, D., Kuo, J. S., Williams, J. C. Microfluidics-based Devices: New Tools for Studying Cancer and Cancer Stem Cell Migration. Biomicrofluidics. 5, (2011).
- Rolli, C. G., Seufferlein, T., Kemkemer, R., Spatz, J. P. Impact of Tumor Cell Cytoskeleton Organization on Invasiveness and Migration: A Microchannel-Based Approach. Plos One. 5, (2010).
- Chung, S. Cell migration into scaffolds under co-culture conditions in a microfluidic platform. Lab on a Chip. 9, 269-275 (2009).
- Irimia, D., Toner, M. Spontaneous migration of cancer cells under conditions of mechanical confinement. Integrative Biology. 1, 506-512 (2009).
- Svendsen, C. N. A new method for the rapid and long term growth of human neural precursor cells. Journal of Neuroscience Methods. 85, 141-152 (1998).
- Clark, P. A. Glioblastoma cancer stem cells exhibit decreased dependence on exogenous growth factors for proliferation and survival. , .
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37, 551-575 (1998).
- Millet, L. J., Stewart, M. E., Sweedler, J. V., Nuzzo, R. G., Gillette, M. U. Microfluidic devices for culturing primary mammalian neurons at low densities. Lab on a Chip. 7, 987-994 (2007).
- Regehr, K. J. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab on a Chip. 9, 2132-2139 (2009).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nature Cell Biology. 9, 1347-1347 (2007).
- Hu, X. D., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-Dependent Dynamic Microtubule Invasion of Dendritic Spines. Journal of Neuroscience. 28, 13094-13105 (2008).
- Vitzthum, L. Study of Na(+)/H(+) exchange-mediated pH(i) regulations in neuronal soma and neurites in compartmentalized microfluidic devices. Integrative Biology. 2, 58-64 (2010).
- Clark, P. A., Treisman, D. M., Ebben, J., Kuo, J. S. Developmental signaling pathways in brain tumor-derived stem-like cells. Developmental Dynamics. 236, 3297-3308 (2007).
- Chen, R. H. A Hierarchy of Self-Renewing Tumor-Initiating Cell Types in Glioblastoma. Cancer Cell. 17, 362-375 (2010).
- Pollard, S. M. Glioma Stem Cell Lines Expanded in Adherent Culture Have Tumor-Specific Phenotypes and Are Suitable for Chemical and Genetic Screens. Cell Stem Cell. 4, 568-580 (2009).
- Lobo, N. A., Shimono, Y., Qian, D., Clarke, M. F. The biology of cancer stem cells. Annual Review of Cell and Developmental Biology. 23, 675-699 (2007).
- Singh, S. K. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Lee, J. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Galli, R. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Research. 64, 7011-7021 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유