Method Article
Подготовка и использование инфицированных ВИЧ-1 Первичная CD4 + Т-клеток в качестве клеток-мишеней в естественных киллеров сотовый Цитотоксические Анализы
В этой статье
Резюме
Цитотоксичности для измерения естественных киллеров ячейки литической борьбе с ВИЧ-инфицированные клетки ограничена чистотой клеток-мишеней. Мы демонстрируем здесь изоляции высокой степени очистки населения ВИЧ-1-инфицированных первичных Т-клеточных взрывов, воспользовавшись способностью ВИЧ-1 с до нижнего модулировать CD4.
Аннотация
Natural killer (NK) cells are a vital component of the innate immune response to virus-infected cells. It is important to understand the ability of NK cells to recognize and lyse HIV-1 infected cells because identifying any aberrancy in NK cell function against HIV-infected cells could potentially lead to therapies that would enhance their cytolytic activity. There is a need to use HIV-infected primary T-cell blasts as target cells rather then infected-T-cell lines in the cytotoxicity assays. T-cell lines, even without infection, are quite susceptible to NK cell lysis. Furthermore, it is necessary to use autologous primary cells to prevent major histocompatibility complex class I mismatches between the target and effector cell that will result in lysis. Early studies evaluating NK cell cytolytic responses to primary HIV-infected cells failed to show significant killing of the infected cells 1,2. However, using HIV-1 infected primary T-cells as target cells in NK cell functional assays has been difficult due the presence of contaminating uninfected cells 3. This inconsistent infected cell to uninfected cell ratio will result in variation in NK cell killing between samples that may not be due to variability in donor NK cell function. Thus, it would be beneficial to work with a purified infected cell population in order to standardize the effector to target cell ratios between experiments 3,4. Here we demonstrate the isolation of a highly purified population of HIV-1 infected cells by taking advantage of HIV-1's ability to down-modulate CD4 on infected cells and the availability of commercial kits to remove dead or dying cells 3-6. The purified infected primary T-cell blasts can then be used as targets in either a degranulation or cytotoxic assay with purified NK cells as the effector population 5-7. Use of NK cells as effectors in a degranulation assay evaluates the ability of an NK cell to release the lytic contents of specialized lysosomes 8 called "cytolytic granules". By staining with a fluorochrome conjugated antibody against CD107a, a lysosomal membrane protein that becomes expressed on the NK cell surface when the cytolytic granules fuse to the plasma membrane, we can determine what percentage of NK cells degranulate in response to target cell recognition. Alternatively, NK cell lytic activity can be evaluated in a cytotoxic assay that allows for the determination of the percentage of target cells lysed by release of 51Cr from within the target cell in the presence of NK cells.
протокол
1. Изоляция по правам CD4 + Т-клеток из периферической крови (см. рисунок 1)
- Периферической венозной крови (от 40 до 60 мл) собирается в Vacutainer Трубки, содержащие гепарин натрия (Becton Дикенсон).
- Периферической крови, затем переведен из Vacutainer Трубы до 50 мл конические пробирки полистирола (20 мл крови в трубку).
- RosetteSep CD4 + T-Cell изоляции реагента (StemCell технологий) добавляется в 1 мл объемом не более 20 мл крови в 50 мл трубки и хорошо перемешивают.
- Затем смесь выдерживают при температуре 20-25 ° С в течение 20 минут.
- Через 20 минут, кальция и магния, свободного (CMF) фосфатным буферным раствором [PBS (Hyclone] л / 2% тепла инактивированной (56 ° С в течение 30 минут) эмбриональной телячьей сыворотки [FBS (Hyclone)] добавляется к смеси Для достижения конечного объема 40 мл.
- Разбавленной смеси (30 мл), затем слой поверх 15 мл лимфоцитов Средний Разделение [LSM (Cellgro)] в 50 мл свежего полистирола конических труб.
- 50 мл трубы затем центрифугировали при 1200 х г в течение 20 минут с вынул.
- 50 мл трубы удаляют из центрифуги осторожно, чтобы взаимодействие между МНК и среднего не нарушается. Клетки на границе собраны с 10 мл пипеткой и помещали в 50 мл свежего полистирола конических труб.
- Собрал интерфейсы разбавляют PBS т / 2% ЭТС до конечного объема 50 мл.
- 50 мл пробирки с разбавленным интерфейсы центрифугировали при 1200 х г в течение 10 минут с тормозом.
- После центрифугирования супернатанты наддува и гранулы ресуспендировали в 10 мл PBS т / 2% ЭТС.
- Клеточные суспензии, которые затем объединяются в один 50 мл коническую трубку и разбавляют до 50 мл PBS с ж / 2% FBS.
- Трубка, содержащая сводный клеточной суспензии центрифугируют при 300 х г в течение 10 минут, чтобы удалить все оставшиеся LSM.
- Супернатант отсасывают и гранулы затем ресуспендировали в 10 мл RPMI-1640 (Hyclone), содержащей 10% FBS, 100 ед / мл пенициллина, 100 мкг / мл стрептомицина (Hyclone) и 2 мМ L-глутамина (CellGro ) (RPMI-полно) и подсчитывали использованием гемоцитометра.
- Концентрация очищенного CD4 + Т-клеток доводят до 3х10 6 / мл RPMI-полной.
- CD4 + 'с, затем стимулировали путем культивирования их anti-CD3/anti-CD28 связан с бисером [T-Cell Expansion Kit (Miltenyi Biotec)] на три бусины на ячейку отношения в течение 72 часов при 37 ° С в 5% С0 2 увлажненный инкубатора.
2. Заражение CD4 + Т-клеток с ВИЧ-1 (см. рисунок 1)
- Сотовые суспензии, содержащей стимулировали CD4 + T-клетки, удаляются из культуры пластины и рассчитывал использованием гемоцитометра.
- CD4 + T-клеток (~ 2x10 6) добавляют в 15 мл коническую трубку для использования в качестве неинфицированных контроля.
- Остальная часть CD4 + T-клеточной суспензии помещают в 50 мл коническую трубку для инфекции.
- Пробирки, содержащие CD4 + Т-клеточные суспензии центрифугируют при 300 х г в течение 10 минут и супернатант культуры всасывается.
- Вынужденное CD4 + Т-клеток ресуспендируют непосредственно в культуре жидкости, содержащие вирусные частицы, а затем спин-инфицированных при 1200 х г в течение 2 часов при температуре 20-25 ° C 9. Обычно мы инфицировать CD4 + Т-клеток при множественности заражения (МВД) от 5 для репликации дефицитный штамм ВИЧ (например, DHIV-3) или МВД 0,01 для репликации компетентным вирусом (например, ВИЧ-1 NL4 / 3) . Конечный объем не имеет значения, но трубы должны быть сбалансированы для центрифугирования. Polybrene (Santa Cruz) добавляется в культуральной жидкости до spinfection в конечной концентрации 10 мкг / мл.
- После завершения spinfection, супернатанты удаляют и клетки ресуспендировали при плотности клеток 3х10 6 / мл в RPMI-полной дополнен 100 ЕД / мл ИЛ-2. Инфицированных и неинфицированных клетках культуры в течение 72 часов, если репликация вируса некомпетентных была использована для заражения клетки или 5-7 дней, если репликация вируса компетентных была использована для заражения клетки. СМИ следует менять каждые 48 часов, в течение культуре.
3. Изоляция по правам естественных клеток-киллеров из периферической крови
- Периферической венозной крови (~ 100 мл) собирается из того же донора используется для изоляции CD4 + Т-клеток в Vacutainer Трубки, содержащие гепарин натрия (Becton Дикенсон).
- Затем кровь передается от Vacutainer Трубы в 50 мл конические пробирки в 20 мл аликвоты.
- Vacutainer Трубы затем промывают 8 мл CMF Хэнкс сбалансированном солевом растворе [HBSS (Hyclone)] и моет переданы 50 мл conicals containiнг 20 мл периферической крови. В результате объем в каждой 50 мл коническую составляет 35 мл.
- Разбавленной крови, затем слой поверх 15 мл LSM в свежем 50 мл коническую трубку и труб центрифугировали при 400 х г в течение 30 минут с вынул.
- Трубы осторожно удаляют из центрифуги и в результате взаимодействия между МНК и среднего собирают из каждой пробирки с использованием 10 мл пипеткой и помещали в 50 мл свежего конических труб.
- Клеточные суспензии, которые один раз промывали CMF HBSS (центрифугировали при 400 х г в течение 15 минут с тормозом).
- После первой стирки супернатанты удаляются, и в результате гранулы объединены в единый 50 мл конические и дважды промывают HBSS CMF (центрифугировали при 30 х г в течение 10 минут с тормозом), чтобы удалить все оставшиеся LSM.
- После последнего вымыть осадок resupended в 10 мл буфера для лизиса ACK (150 мМ NH 4 Cl, 1,0 мМ KHCO 3 и 0,1 мМ ЭДТА рН 7,3) и инкубировали при комнатной температуре (20-25 ° С) в течение 5 минут. Этот шаг необходим для того, чтобы удалить загрязнения эритроцитов из мононуклеарных клеток периферической крови (МКПК).
- Через 10 мин. 40 мл PBS CMF добавляется к клеточной суспензии для того, чтобы остановить лизис реакции.
- Трубки с клеточной суспензии содержащей РВМС и лизированных эритроцитов затем центрифугировали при 300 х г в течение 10 минут с тормозом.
- Супернатант удаляют, а осадок ресуспендируют в 5 мл PBS с 2% ЭТС и 2 мМ EDTA и подсчитывали использованием гемоцитометра.
- Естественных киллеров (NK) Затем клетки изолированы от РВМС использованием НК Kit изолятор [негативный отбор-человека (Miltenyi Biotec)] в соответствии с инструкциями производителя.
- Проточные от колонны собраны в 15 мл пробирки и трубы центрифугировали при 300 х г в течение 10 минут с тормозом.
- Супернатанты удаляются и гранулы ресуспендировали. Ресуспендировали гранулы объединены в одну трубку в общем объеме 1 мл среды Искова изменения Дульбеко [IMDM (Gibco)] с добавлением 10% АВ + тепла инактивированной (56 ° С в течение 30 минут) сыворотки крови человека (ГС) и подсчитывали с hemacytometer.
- Объем клеточной суспензии регулируется с IMDM w/10% HS, так что конечная плотность НК клеток 3х10 6 / мл. Суспензии клеток делится пополам. Один набор натуральных киллеров получает 200 Ед / мл рекомбинантного человеческого интерлейкина-2. Другой набор клеток остается в среде без цитокинов лечения.
- NK клеточных культурах затем инкубировали в течение ночи при температуре 37 ° C, 5% СО 2
- В результате NK клетки затем использованы в качестве эффекторных клеток как для анализа CD107a дегрануляции или 51 Cr релиз анализа.
4. Очистка ВИЧ-1 инфицированных клеток (см. рисунок 1)
- Культуры жидкости, содержащие инфицированные клетки удаляются из пластин и центрифугировали при 300 х г в течение 10 минут с тормозом.
- Супернатант отсасывают и гранулы ресуспендировали в 2 мл ФСБ с 2% ЭТС и 2 мМ ЭДТА и клеток рассчитывали на гемоцитометра.
- Зараженные клетки, которые не содержат ВИЧ-1 являются изолированными от тех, которые укрывают вирус, воспользовавшись тем, что ВИЧ-1 модулирует вниз CD4. Для этой цели CD4 положительных Комплект изоляции (Invitrogen) используется в соответствии с инструкциями производителя, за исключением, что одна-CD4 бусину на ячейку отношение используется.
- При снятии CD4 + T-клетки, отмершие клетки удаляются из очищенной клеточной популяции укрывательство вирусов с помощью мертвого Kit Удаление Cell (Miltenyi Biotec) в соответствии с инструкциями производителя.
- Проточный следующие мертвых удаления ячейки в столбцах центрифугируют при 300 х г в течение 10 минут с тормозом. Супернатант удаляют, гранулы ресуспендировали в 1 мл RPMI-полной и ячейки учитываются.
- Очищенной инфицированных клеток в настоящее время готова к использованию в качестве мишеней в анализе CD107a дегрануляции или 51 Cr релиз анализа.
5. CD107a дегрануляции анализ (см. Рисунок 2)
- Культур НК ячейки удаляются из пластин и клеточной суспензии учитывается.
- Суспензий НК ячейки центрифугировали при 300 х г в течение 10 минут с тормозом.
- NK клетки ресуспендировали в RPMI-полной и окончательной концентрации доводят до 10 6 кл / мл.
- Суспензии клеток от изолированной инфицированных и неинфицированных Т-клеток, генерируемых в вышеупомянутые шаги центрифугируют при 300 х г в течение 10 минут с тормозом.
- Супернатанты удаляются и гранулы ресуспендировали в RPMI-полной в 2х10 6 кл / мл.
- К562 клетки используются как положительные клетки-мишени контроль, так как они очень восприимчивы к НК лизиса. Тон клетки центрифугировали при 300 х г в течение 10 минут с тормозом, супернатанты удаляются и гранулы ресуспендировали в RPMI-полной в 2х10 6 кл / мл
- В 96-V дном и пластины 100 ПДК цели и 100 мкл эффекторов добавляются в скважинах.
- Хорошо, содержащий 100 mcLof эффекторов и 100 мкл среды без клетки-мишени будет использоваться для неспецифической дегрануляции NK клеток.
- Для каждой лунки 10 mcLFITC-сопряженных анти-CD107a (BDIS) добавляется.
- Пластина затем центрифугировали при 20 х г в течение 2 минут с тормозом.
- Центрифугировали пластины инкубировали в течение 4 часов при 37 ° C и 5% СО 2.
- После инкубации пластина центрифугируют при 400 х г в течение 5 минут с тормозом.
- Супернатант удаляется из гранул.
- Каждая скважина затем окрашивали следующие панели флуорохромом конъюгированных антител на льду в течение 20 минут в общей сложности 100 mcLof потока буфера (PBS т / 2% ЭТС и 0,1% NaN 3)
- anti-CD3/14/20 [Pacific Blue-сопряженных (Biolegend)]
- анти-CD56 [APC (Biolegend)]
- После 20 минут инкубации, 200 мкл буфера потока добавляется в каждую лунку и пластину центрифугируют при 400 х г в течение 5 минут с тормозом.
- Потоком буфер затем тщательно атмосферный из каждой лунки, используя 2 мл аспирационной пипетки оснащен 200 кончик микропипеткой мкл, удостоверившись, чтобы не потревожить осадок.
- Шаг 15 и 16 повторяют еще раз.
- Пеллеты ресуспендировали в 200 мкл 1% параформальдегида в СЦМ PBS. Клеточные суспензии, затем переведен в потоке труб.
- Общий объем доводят до 300 мкл, добавив ~ 100 мкл 1% параформальдегида в СЦМ PBS в каждую пробирку.
- События (2х10 4), соответствующих натуральных киллеров собираются потока цитометр использованием FACS DIVA (BDIS) программное обеспечение для сбора и проанализированы с помощью потока Джо программное обеспечение (TreeStar).
6. CD107a Память стратегии (см. Рисунок 3)
- Одноместный ворота ячейки создаются с помощью вперед высота рассеяния (FSC-H) в зависимости от ширины разброса вперед (FSC-W) сюжета.
- Для участка размером в сравнении с зернистостью стороны ФСБ против рассеяния (SSC) сюжет создан на одном ворота клетки. Обычно лимфоциты обладают относительно низкой детализации и средних размеров ячейки.
- Клеток лимфоцитов ворот, затем нанесены на точку участок CD3/14/20 окрашенных клеток по сравнению с CD56 окрашенных клеток к воротам на NK клетки опуская моноцитов (CD14), Т-клетки (CD3) и В-клеток ( CD20).
- CD56 поз закрытого населения, то оценка для CD107a.
- NK клетки без групповых целей используется для установки ворот для того, что считается CD107a отрицательным.
7. 51 Cr выпуска анализ (см. рисунок 4)
- Зараженные клетки-мишени помечены 125 МТПП 51 Cr (Perkin Elmer) в saline/10 6 клеток в течение 2 часов в общей сложности 500 мкл при 37 ° С и 5% СО 2. В качестве положительного контроля 10 6 клеток К562 помечены 100 МТПП 51 Cr в течение 2 часов в общей сложности 500 мкл при 37 ° С и 5% СО 2. Общий объем доводят до 500 мкл с RPMI-полной. Объем 51 Cr добавлены к клеткам-мишеням рассчитывается здесь: (http://las.perkinelmer.com/Catalog/RadCalculator.htm?Mode=RadioactivityCalculator)
- Хотя клетками-мишенями являются маркировка, ранее изолированные NK клетки удаляются от культуры и подсчитаны. Клеточные культуры содержащих НК клетки центрифугировали при 300 х г в течение 10 минут с тормозами на.
- Гранулы содержащих НК клетки ресуспендировали в RPMI-полной и разбит на 3 трубы. Плотность клеток регулируется до 10 5 / мл в одной из труб 2.5x10 5 / мл во второй трубки и 5x10 5 / мл в третьей трубы.
- Маркированный цели клетки удаляются из инкубатора и 4,5 мл RPMI-полной добавляют в каждую пробирку. Трубы затем центрифугировали при 300 х GF или 10 минут.
- Супернатант сливают осторожно, чтобы не мешать гранул в контейнер для жидких радиоактивных отходов.
- Шаги 4 и 5 повторяются два раза больше, чтобы удалить все непоглощенной 51 Cr. Супернатанты с третьего мытья можно выбрасывать в контейнер для нерадиоактивных жидких отходов.
- Маркированный цели затем ресуспендировали в RPMI-полной, окончательной плотность клеток из 10 5 / мл.
- 100 мкл меченых цели аликвоты в лунки 96-у-дно и пластины для конечного числа ячейка 10 4 клетки-мишени / лунку.
- Table1 пример типичный вариант для 51 анализа выпуска Cr. Каждая группа будет сделано в трех экземплярах.
31 2 4 5 6 7 8 9 K562 E: T (1:1) K562 E: T (1:1) K562 E: T (1:1) K562 E: T (2,5:1) K562 E: T (2,5:1) K562 E: T (2,5:1) K562 E: T (5:1) K562 E: T (5:1) K562 E: T (5:1) B Пользовательский интерфейс E: T (1:1) Пользовательский интерфейс E: T (1:1) Пользовательский интерфейс E: T (1:1) Пользовательский интерфейс E: T (2,5:1) Пользовательский интерфейс E: T (2,5:1) Пользовательский интерфейс E: T (2,5:1) Пользовательский интерфейс E: T (5:1) Пользовательский интерфейс E: T (5:1) Пользовательский интерфейс E: T (5:1) C Инфицированных ВИЧ-1 E: T (1:1) Инфицированных ВИЧ-1 E: T (1:1) Инфицированных ВИЧ-1 E: T (1:1) Инфицированных ВИЧ-1 E: T (2,5:1) Инфицированных ВИЧ-1 E: T (2,5:1) Инфицированных ВИЧ-1 E: T (2,5:1) Инфицированных ВИЧ-1 E: T (1:1) Инфицированных ВИЧ-1 E: T (1:1) Инфицированных ВИЧ-1 E: T (1:1) D E F К562 спонтанного выделения К562 спонтанного выделения К562 спонтанного выделения Пользовательский интерфейс спонтанного выделения Пользовательский интерфейс спонтанного выделения Пользовательский интерфейс спонтанного выделения Инфицированных ВИЧ-1 Спонтанное выпуска Инфицированных ВИЧ-1 Спонтанное выпуска Инфицированных ВИЧ-1 Спонтанное выпуска G К562 Максимальный выпуска К562 Максимальный выпуска К562 Максимальный выпуска Пользовательский интерфейс Максимальная выпуска Пользовательский интерфейс Максимальная выпуска Пользовательский интерфейс Максимальная выпуска Инфицированных ВИЧ-1 выпуска Maxmum Инфицированных ВИЧ-1 выпуска Maxmum Инфицированных ВИЧ-1 выпуска Maxmum - 100 ПДК выше NK клеточные суспензии добавляют в каждую лунку содержащие клетки-мишени.
- 100 мкл цели будут добавлены в соответствующие лунки, в которых эффекторные клетки отсутствуют для максимальной и спонтанные группы релизе. Спонтанные группы релиз инкубируют с дополнительно 100 мкл RPMI-полной.
- 96-луночного планшета центрифугируют при 20 х г в течение 2 минут с тормозом.
- Центрифугировали пластина затем инкубируют при 37 ° С и 5% CO 2 в течение 4 часов.
- После 4-часовой инкубации 5 ПДК 1:10 разбавление эритроциты человека в RPMI-полной добавляется в каждую лунку, кроме максимального скважин релизе.
- 100 мкл 10% додецилсульфата натрия добавляется к максимальной скважин релизе.
- Пластины центрифугируют при 400 х г в течение 5 минут, чтобы гранулы клеток.
- 100 мкл бесклеточной супернатант собирают из каждой лунки и помещены в отдельный гамма-счетчик труб (Perkin Elmer). Трубы помещаются в 2470 Автоматический счетчик Gamma (Perkin Elmer). Размере 51 Cr, присутствующих в культуральной жидкости измеряется как импульсов в минуту от среднего показателя 2-х минутах чтения.
- Графы в минуту (CPM) показания образцов и контролей используются для расчета конкретных% лизиса, используя следующее уравнение:
[(Экспериментальная CPM - средняя цена за тысячу показов спонтанной) / (средняя максимальная цена за тысячу показов - CPM означает спонтанное)] х 100
8. Представитель Результаты:

Рисунок 1. Шаги, участвующих в изоляции естественных клеток-киллеров и поколения ВИЧ-1-инфицированных клеток-мишеней из периферической крови.
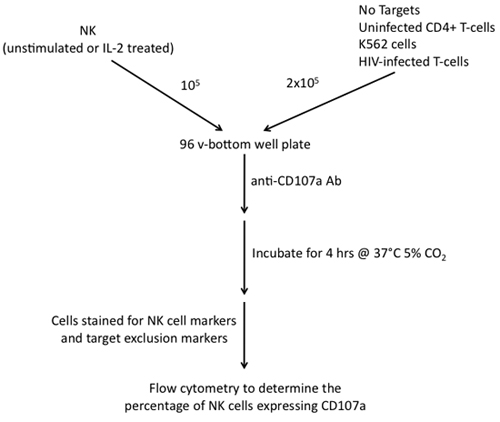
Рисунок 2. Шаги, участвующих в строительстве анализа CD107a дегрануляции NK использованием клеток эффекторов и клеток К562, неинфицированным CD4 + Т-клеток и инфицированных ВИЧ-1 Т-клеток в качестве мишеней.
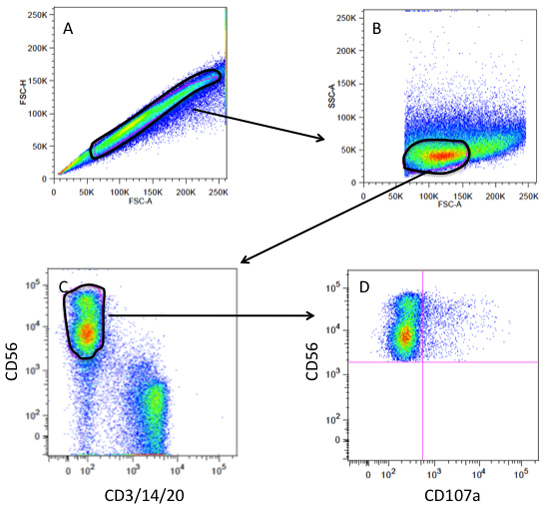
Рисунок 3. Проточная цитометрия-литниковой стратегии анализа дегрануляции CD107a. () Память на отдельные клетки и исключая скопления или дублеты на участке FSC-(вперед площадь разброса) против FSC-H (вперед высота разброс). (B) Одноместный ворота клетка на графике как FSC-против SSC (сторона разброс) литниковой на популяции лимфоцитов. (C) лимфоцитов ворот на графике как CD3/14/20(Т-клеток, моноцитов, В-клетки) против CD56 (NK клеток), стробирование по CD56 поз andCD3/14/20 нег населения (НК ворота). (D) Н. К. ворот на графике как CD107a против CD56 для визуализации NK клеток, которые degranulated (CD107a POS).
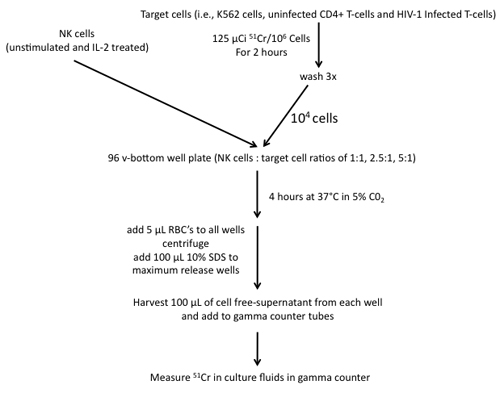
Рисунок 4. Шаги, участвующих в строительстве 51 Cr релиз анализа использования NK клеток эффекторов и клеток К562, неинфицированным CD4 + Т-клеток и инфицированных ВИЧ-1 Т-клеток в качестве мишеней.

Рисунок 5. Представитель результатов оценки цитотоксической реакции естественных киллеров против ВИЧ-1-инфицированных клеток. (А) НК-клеток оценивали по их способности дегрануляции без цели и в ответ на К562 элементов, первичных CD4 + Т-клеток и ВИЧ-инфицированных первичных Т-клеток по оценке процент NK-клеток, экспрессирующих поверхности CD107a. Номеров в каждом квадранте представляют процент от общего числа NK клеток. Б) НК-клетками оцениваются по их способности лизировать клеток К562, неинфицированным CD4 + Т-клеток и ВИЧ-1-инфицированных Т-клеток в 51 Анализ выпуска Cr при различных эффекторных ячейки клетки-мишени соотношения (E: T).
Обсуждение
Если все сделано правильно анализы, описанные в этом протоколе должны обеспечить репрезентативную картину НК способность клетки к дегрануляции против и лизиса инфицированных ВИЧ-1 клеток (см. рисунок 5). НК ячейки дегрануляции в ответ на ВИЧ-инфицированные клетки и НК лизис клетки ВИЧ-инфицированные клетки должно быть прямо пропорционально 10. Надежные результаты для двух НК ячейки функциональные тесты для измерения цитотоксических по борьбе с ВИЧ-инфицированные клетки зависят от изоляции высокой степени очистки НК клеток, а также высокой степени очистки населению зараженных клеток. Очистив НК-клеток и ВИЧ-1 инфицированных клеток имеют решающее значение для достижения довольно точно эффектора для клетки-мишени отношение. Кроме того, удаление омертвевших и апоптоза клеток из популяции клеток-мишеней важно до 51 Cr маркировки или инкубации с эффекторных клеток. 51 Cr могут быть усвоены клеток, которые подвергаются апоптозу, как наличие мертвых или апоптоза клеток при шаге маркировки изотопа приведет к высокой спонтанной релиза и будет искажать рассчитывается% конкретным лизиса. Более того, наличие мертвых или апоптоза клеток может вызвать НК дегрануляции клетка в результате аномально высоким уровнем экспрессии CD107a. Точные пипетки необходимо при удалении бесклеточной супернатанты следующие инкубации NK клеток и клеток-мишеней в 51 анализах Cr релиза, а различия в объеме супернатант удален из каждой параллельной также приведет к высокой стандартных отклонений. Изменения могут быть сделаны к этим протоколам оценить роль специфических рецепторов NK в запуске НК лизис клетки ВИЧ-инфицированных клеток путем инкубации эффекторов или цели до принятия совместного культуры с антагонистическими антител со специфическими рецепторами или лигандами 6,11. Цитокинов обработанных NK клеток (например, IL-2, Ил-15) могут быть использованы для оценки функциональности вынужденного киллеров 12. Кроме того, антитела зависимой цитотоксичности ячейки анализы могут быть выполнены с использованием этих протоколов. Анти-ВИЧ-антитела (например, анти-gp120) могут быть добавлены к клеткам-мишеням для признания НК ячейки низким сродством Fc рецептор CD16 13. Эти анализы, хотя и созданы для измерения НК ячейки цитотоксических по борьбе с ВИЧ-инфицированные клетки, также могут быть изменены, чтобы оценить возможности NK клеток продуцировать цитокины следующие ВИЧ-инфицированной клетки признание. Хотя мы описали в этом протоколе использование в пробирке инфицированные клетки, как клетки-мишени, мы недавно описал поколения клеток-мишеней у пациентов, инфицированных ВИЧ. Это требует изоляции CD4 + Т-клеток, затем расширение клеток в течение двух недель после стимуляции с митогены в присутствии интерлейкина-2 11. После двухнедельного периода расширения, протоколы, описанные в этой статье, используются для изоляции клеток-мишеней.
Раскрытие информации
Материалы
| Name | Company | Catalog Number | Comments |
| Vaccutainer Tubes (Sodium Heparin) | BD Biosciences | 367874 | |
| RosetteSep CD4+ T-cell Isolation Kit | Stem Cell Technologies | 15062 | |
| CMF PBS | Hyclone | SH30256.01 | |
| FBS | Hyclone | 10437-028 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| RPMI-1640 | Hyclone | SH30096.01 | |
| Penicillin / Streptomycin | Hyclone | SV30010 | |
| L-glutamine | Cellgro | 25-005-Cl | |
| T-cell Expansion Kit | Miltenyi Biotec | 130-091-441 | |
| CMF HBSS (1x) | Hyclone | SH30588.01 | |
| 0.5M EDTA | 46-034-Cl | ||
| NK Cell Negative Isolation Kit | Miltenyi Biotec | 130-092-657 | |
| IMDM | GIBCO, by Life Technologies | 12440-046 | |
| CD4+ Positive Isolation Kit | Invitrogen | 113.31D | |
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Polybrene | Santa Cruz Biotechnology, Inc. | sc-134220 | |
| CD3 PacificBlue | BD Biosciences | 558117 | |
| CD14 PacificBlue | Biolegend | 325616 | |
| CD20 PacificBlue | Biolegend | 302328 | |
| CD56 APC | Biolegend | 318310 | |
| CD69 PE | BD Biosciences | 555531 | |
| CD107a FITC | BD Biosciences | 555800 | |
| 51Chromium | PerkinElmer, Inc. | NEZ030002MC | |
| Gamma Counter Tubes | PerkinElmer, Inc. | 1270-401 | |
| 2470 Automatic Gamma Counter | PerkinElmer, Inc. | 2470-0050 | |
| FACS Diva | BD Biosciences | 643629 | |
| FlowJo | Tree Star, Inc. | FJ-9-1YR |
Ссылки
- Ruscetti, F. W. Analysis of effector mechanisms against HTLV-I- and HTLV-III/LAV-infected lymphoid cells. J Immunol. 136, 3619-3624 (1986).
- Zheng, Z. Y., Zucker-Franklin, D. Apparent ineffectiveness of natural killer cells vis-a-vis retrovirus-infected targets. J Immunol. 148, 3679-3685 (1992).
- Ferrari, G. Clade B-based HIV-1 vaccines elicit cross-clade cytotoxic T lymphocyte reactivities in uninfected volunteers. Proc Natl Acad Sci U S A. 94, 1396-1401 (1997).
- Shankar, P. Impaired function of circulating HIV-specific CD8(+) T cells in chronic human immunodeficiency virus infection. Blood. 96, 3094-3101 (2000).
- Ward, J. HIV-1 Vpr triggers natural killer cell-mediated lysis of infected cells through activation of the ATR-mediated DNA damage response. PLoS Pathog. 5, e1000613-e1000613 (2009).
- Ward, J. HIV modulates the expression of ligands important in triggering natural killer cell cytotoxic responses on infected primary T-cell blasts. Blood. 110, 1207-1214 (2007).
- Bonaparte, M. I., Barker, E. Killing of human immunodeficiency virus-infected primary T-cell blasts by autologous natural killer cells is dependent on the ability of the virus to alter the expression of major histocompatibility complex class I molecules. Blood. 104, 2087-2094 (2004).
- Stinchcombe, J. C., Griffiths, G. M. Secretory mechanisms in cell-mediated cytotoxicity. Annu Rev Cell Dev Biol. 23, 495-517 (2007).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. J Virol. 74, 10074-10080 (2000).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294, 15-22 (2004).
- Fogli, M. Lysis of endogenously infected CD4+ T cell blasts by rIL-2 activated autologous natural killer cells from HIV-infected viremic individuals. PLoS Pathog. 4, e1000101-e1000101 (2008).
- Tomescu, C., Chehimi, J., Maino, V. C., Montaner, L. J. NK cell lysis of HIV-1-infected autologous CD4 primary T cells: requirement for IFN-mediated NK activation by plasmacytoid dendritic cells. J Immunol. 179, 2097-2104 (2007).
- Ward, J. P., Bonaparte, M. I., Barker, E. HLA-C and HLA-E reduce antibody-dependent natural killer cell-mediated cytotoxicity of HIV-infected primary T cell blasts. Aids. 18, 1769-1779 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены