Method Article
Herstellung und Verwendung von HIV-1 infizierten primären CD4 + T-Zellen als Zielzellen in der natürlichen Killerzellen Zytotoxische Assays
In diesem Artikel
Zusammenfassung
Zytotoxizitätsassays auf natürlichen Killerzellen lytische Reaktionen auf HIV-infizierten Zellen zu messen ist durch die Reinheit der Zielzellen beschränkt. Wir zeigen hier die Isolierung eines hochgereinigten Bevölkerung von HIV-1 infizierten primären T-Zell-Blasten durch die Nutzung von HIV-1 s Fähigkeit, down-Modulation CD4.
Zusammenfassung
Natürliche Killerzellen (NK)-Zellen sind ein wichtiger Bestandteil der angeborenen Immunantwort auf Virus-infizierte Zellen. Es ist wichtig, die Fähigkeit der NK-Zellen zu erkennen und zu lysieren HIV-1 infizierten Zellen, weil die Identifizierung jeder aberrancy in NK-Zell-Funktion gegen HIV-infizierten Zellen könnte möglicherweise zu Therapien, die ihre zytolytische Aktivität zu erhöhen führen würde verstehen. Es ist notwendig, um HIV-infizierte primäre T-Zell-Blasten als Zielzellen eher dann infizierten-T-Zell-Linien in der Zytotoxizitätsassays verwenden. T-Zell-Linien, auch ohne Infektion, sind sehr anfällig für NK-Zell-Lyse. Darüber hinaus ist es notwendig, autologe primäre Zellen verwenden, um Haupthistokompatibilitätskomplex Klasse I Diskrepanzen zwischen Soll-und Effektor-Zelle, in Lyse Ergebnis zu verhindern. Frühe Studien, die NK-Zelle zytolytische Antworten auf primären HIV-infizierten Zellen keine signifikanten Abtötung der infizierten Zellen 1,2 zeigen. Allerdings mit HIV-1 infizierten primären T-Zellen als Zielzellen in NK-Zellen funktionelle Assays wurde schwierig, da das Vorhandensein von kontaminierenden nicht infizierten Zellen 3. Dieser Widerspruch infizierten Zelle zu Zelle infiziert Verhältnis wird in Variation in NK-Zellen töten zwischen den Proben, die möglicherweise nicht durch Schwankungen in Spender NK-Zell-Funktion führen. So wäre es von Vorteil sein, mit einer gereinigten infizierte Zellpopulation zu arbeiten, um den Effektor zu standardisieren, um Zell-Verhältnissen zwischen 3,4 Experimente Ziel. Hier zeigen wir die Isolierung eines hochgereinigten Bevölkerung von HIV-1 infizierten Zellen durch die Nutzung von HIV-1 die Fähigkeit down-Modulation CD4 auf infizierten Zellen und die Verfügbarkeit von kommerziellen Kits zu entfernen tote oder sterbende Zellen 3-6. Das gereinigte infizierten primären T-Zell-Blasten können dann als Ziele entweder in einer Degranulation oder zytotoxische Assay mit gereinigten NK-Zellen als Effektor-Population 5-7 verwendet werden. Verwendung von NK-Zellen als Effektoren in einer Degranulation Test bewertet die Fähigkeit eines NK-Zellen, die lytische Inhalte spezialisiert Lysosomen 8, genannt "zytolytische Granulat" freizugeben. Durch Färbung mit einem Fluorochrom konjugierte Antikörper gegen CD107a, eine lysosomale Membranprotein, ausgedrückt auf der NK-Zell-Oberfläche, wenn die zytolytische Granulat zur Plasmamembran verschmelzen wird, können wir bestimmen, welcher Prozentsatz der NK-Zellen degranulieren in Reaktion auf Zell-Erkennung Ziel. Alternativ können NK-Zell-lytischen Aktivität in einem zytotoxischen Assay, dass für die Ermittlung des Prozentsatzes der Zielzellen durch Freisetzung von 51 Cr aus der Zielzelle in Gegenwart von NK-Zellen lysiert ermöglicht ausgewertet werden.
Protokoll
1. Isolierung humaner CD4 + T-Zellen aus dem peripheren Blut (siehe Abbildung 1)
- Peripheren venösen Blut (40 bis 60 ml) ist in Vacutainer gesammelt Röhrchen mit Natrium-Heparin (Becton Dickenson).
- Das periphere Blut wird dann von der Vacutainer übertragen Tubes auf 50 mL Polystyrol konische Röhrchen (20 ml Blut pro Röhrchen).
- RosetteSep CD4 + T-Zell-Isolation-Reagenz (StemCell Technologies) in einer 1 ml Volumen nicht mehr als 20 ml Blut in ein 50 ml-Tube und gut gemischt aufgenommen.
- Das Gemisch wird dann bei 20-25 ° C für 20 Minuten inkubiert.
- Nach 20 Minuten, Calcium und Magnesium-free (CMF) Phosphat-gepufferter Kochsalzlösung [PBS (HyClone] w / 2% hitzeinaktiviertem (56 ° C für 30 Minuten) Rinderfötenserum [FBS (HyClone)] ist, fügte der Mischungen Um dies zu erreichen ein Volumen von 40 mL.
- Die verdünnten Mischungen (30 ml) werden dann oben auf 15 ml Lymphozyten-Trennmedium geschichtet [LSM (CellGro)] in 50 mL frisches Polystyrol konischen Rohren.
- Die 50-ml-Röhrchen werden dann bei 1200 x g für 20 Minuten mit ausgeschalteter Bremse zentrifugiert.
- Die 50-ml-Röhrchen sind aus der Zentrifuge vorsichtig entfernt, so dass die Schnittstelle zwischen dem LSM und mittlere nicht gestört wird. Die Zellen an der Schnittstelle sind mit einer 10 ml Pipette gesammelt und an die frische 50 ml Polystyrol konischen Rohren.
- Die gesammelten Schnittstellen werden mit PBS w / 2% FBS auf ein Endvolumen von 50 ml verdünnt.
- Die 50 ml-Röhrchen mit der verdünnten Schnittstellen sind bei 1200 x g für 10 Minuten mit der Bremse zentrifugiert.
- Nach der Zentrifugation werden die Überstände abgesaugt und die Pellets resuspendiert in 10 ml PBS w / 2% FBS.
- Die Zellsuspensionen werden dann in einem 50 mL konischen Rohr kombiniert und verdünnt auf 50 ml mit PBS w / 2% FBS.
- Das Rohr mit dem kombinierten Zellsuspension wird bei 300 x g für 10 Minuten zentrifugiert, um alle verbleibenden LSM entfernen.
- Der Überstand wird abgesaugt und das Pellet wird dann in 10 ml RPMI-1640 Medium (HyClone) resuspendiert, das 10% FBS, 100 U / ml Penicillin, 100 mcg / ml Streptomycin (HyClone) und 2 mM L-Glutamin (CellGro ) (RPMI-complete) und zählte mit einer Zählkammer.
- Die Konzentration von gereinigten CD4 + T-Zellen wird dann auf 3x10 6 / ml mit RPMI-complete angepasst.
- CD4 + 's werden dann durch Kultivierung von ihnen mit anti-CD3/anti-CD28 gekoppelt Perlen [T-Zell-Expansion Kit (Miltenyi Biotec)] bei einer drei Perlen pro Zelle-Verhältnis für 72 Stunden bei 37 ° C in einer 5% C0 2 befeuchtet stimuliert Inkubator.
2. Die Infektion von CD4 + T-Zellen mit HIV-1 (siehe Abbildung 1)
- Zell-Suspension, die stimuliert CD4 + T-Zellen aus der Kultur Platte entfernt und gezählt unter Verwendung einer Zählkammer.
- CD4 + T-Zellen (~ 2x10 6) sind mit einem 15 mL konischen Rohr für den Einsatz als nicht infizierte Kontrolle aufgenommen.
- Der Rest der CD4 + T-Zell-Suspension wird in einen 50 mL konischen Rohr für eine Infektion gegeben.
- Die Rohre mit den CD4 + T-Zell-Suspensionen werden bei 300 x g für 10 Minuten und der Kulturüberstand zentrifugiert wird abgesaugt.
- Angeregt CD4 + T-Zellen werden direkt in Nährlösungen mit Virionen resuspendiert und anschließend bei 1200 x g für 2 Stunden bei 20-25 ° C 9-infiziert zu spinnen. In der Regel haben wir infizieren CD4 + T-Zellen bei einer Multiplizität der Infektion (MOI) von 5 für eine replikationsdefizient HIV-Stamm (zB DHIV-3) oder einer MOI von 0,01 für eine Replikation zuständige Virus (zB HIV-1 NL4 / 3) . Das endgültige Volumen ist unwichtig, aber Rohre müssen für die Zentrifugation ausgeglichen werden. Polybrene (Santa Cruz) ist die Nährflüssigkeit vor spinfection in einer Endkonzentration von 10 mcg / ml zugegeben.
- Nach Abschluss der spinfection werden Überstände entfernt und die Zellen bei einer Zelldichte von 3x10 6 / ml in RPMI-komplett mit 100 U / mL IL-2 ergänzt resuspendiert. Die infizierten und nicht infizierten Zellen sind Kultur für 72 Stunden, wenn ein Replikations-inkompetent Virus wurde verwendet, um die Zelle oder 5-7 Tage, wenn ein Replikations-kompetente Virus benutzt wurde, um die Zellen zu infizieren infizieren. Die Medien sollten alle 48 Stunden während der Kultur geändert werden.
3. Isolierung von humanen natürlichen Killerzellen aus dem peripheren Blut
- Peripheren venösen Blut (~ 100 ml) ist vom selben Spender verwendet, um die CD4 + T-Zellen in Vacutainer isolieren gesammelt Röhrchen mit Natrium-Heparin (Becton Dickenson).
- Das Blut wird dann von der Vacutainer übertragen Tubes in 50 ml konische Röhrchen in 20 mL Aliquots.
- Die Vacutainer Die Rohre werden dann mit 8 ml CMF Hanks Balanced Salt Solution [HBSS (Hyclone)] gewaschen und die Waschungen werden die 50 ml konische containi übertragenng der 20 ml peripheres Blut. Das resultierende Volumen in je 50 ml konisch ist 35 mL.
- Das verdünnte Blut wird dann auf der Oberseite von 15 ml LSM in ein frisches 50 mL konischen Rohr und die Röhrchen bei 400 x g für 30 Minuten mit der Bremse abzentrifugiert geschichtet.
- Die Rohre sind sorgfältig aus der Zentrifuge entfernt und der entstandene Schnittstelle zwischen dem LSM und Medium ist aus jedem Röhrchen mit einer 10 ml Pipette entnommen und platziert in frische 50 ml konische Röhrchen.
- Die Zellsuspensionen werden einmal mit CMF HBSS (zentrifugiert bei 400 x g für 15 Minuten mit der Bremse auf) gewaschen.
- Nach der ersten Wäsche die Überstände entfernt und die resultierenden Pellets werden kombiniert in einem einzigen konischen 50 ml und zweimal mit CMF HBSS (zentrifugiert bei 30 x g für 10 Minuten mit der Bremse), um alle verbleibenden LSM entfernen.
- Nach der letzten Waschung wird das Pellet in 10 ml ACK-Lysepuffer resupended (150 mM NH 4 Cl, 1,0 mM KHCO 3 und 0,1 mM EDTA pH 7,3) resuspendiert und bei Raumtemperatur (20-25 ° C) für 5 Minuten. Dieser Schritt ist notwendig, um verunreinigende Erythrozyten aus dem peripheren Blut mononukleären Zellen (PBMC) zu entfernen notwendig.
- Nach 10 min. 40 ml CMF PBS ist es, die Zellsuspension gegeben, um die Lyse Reaktion zu stoppen.
- Das Rohr mit der Zellsuspension mit den PBMC und lysierten Erythrozyten wird dann bei 300 x g für 10 Minuten mit der Bremse zentrifugiert.
- Der Überstand wird entfernt und das Pellet in 5 ml PBS mit 2% FBS und 2 mM EDTA und zählte mit einem Hämozytometer resuspendiert.
- Die natürlichen Killerzellen (NK)-Zellen werden dann aus den PBMC mit einem NK-Zell-Isolation Kit [negative Selektion-human (Miltenyi Biotec)] nach den Anweisungen des Herstellers isoliert.
- Die Flow-Through aus den Spalten sind in 15ml-Röhrchen gesammelt und die Rohre sind bei 300 x g für 10 Minuten mit der Bremse zentrifugiert.
- Die Überstände werden entfernt und die Pellets resuspendiert. Die resuspendierten Pellets werden in einem Rohr in einem Gesamtvolumen von 1 ml Iscove-Modified Dulbecco Medium [IMDM (Gibco)] kombiniert mit 10% AB + Hitze inaktiviert (56 ° C für 30 Minuten) Humanserum (HS) und zählte mit einem Hämazytometer.
- Das Volumen der Zellsuspension mit IMDM w/10% HS so eingestellt, dass die endgültige Dichte von NK-Zellen 3x10 6 / ml ist. Die Zellsuspension wird in zwei Hälften geteilt. Eine Gruppe von NK-Zellen erhält 200 U / ml rekombinantes humanes Interleukin-2. Die andere Gruppe von Zellen in Medium ohne Zytokin Behandlung verlassen.
- Die NK-Zell-Kulturen werden dann über Nacht bei 37 ° C, 5% CO 2 inkubiert
- Die daraus resultierende NK-Zellen werden dann als Effektor-Zellen entweder für eine CD107a Degranulation Assay oder 51 Cr-Freisetzungs-Assay verwendet.
4. Reinigung von HIV-1 infizierten Zellen (siehe Abbildung 1)
- Die Kultur Medien mit infizierten Zellen werden von den Platten entfernt und zentrifugiert bei 300 x g für 10 Minuten mit der Bremse auf.
- Der Überstand wird abgesaugt und die Pellets werden in 2 ml PBS mit 2% FBS und 2 mM EDTA und Zellen auf einer Zählkammer gezählt resuspendiert.
- Infizierte Zellen, die keine HIV-1 entfernt sind von denen, die das Virus Hafen durch die Nutzung der Tatsache, dass HIV-1 nach unten moduliert CD4 isoliert. Zu diesem Zweck CD4 Positive Isolation Kit (Invitrogen) wird nach den Anweisungen des Herstellers mit der Ausnahme, dass man a-CD4 bead pro Zelle Verhältnis verwendet wird.
- Nach dem Entfernen der CD4 + T-Zellen werden die abgestorbenen Zellen aus dem gereinigten Zellpopulation beherbergen das Virus mit einem Dead Cell Removal Kit (Miltenyi Biotec) nach den Anweisungen des Herstellers entfernt.
- Die Flow-Through folgenden tote Zelle Entfernung in Spalten ist bei 300 x g für 10 Minuten mit der Bremse zentrifugiert. Der Überstand wird abgenommen, resuspendierten Pellets in 1 ml RPMI-complete und die Zellen werden gezählt.
- Das gereinigte infizierten Zellen sind nun bereit für den Einsatz als Ziele in einem CD107a Degranulation Assay oder 51 Cr-Freisetzungs-Assay.
5. CD107a Degranulation Assay (siehe Abbildung 2)
- NK-Zell-Kulturen werden aus Platten entfernt und die Zellsuspension wird gezählt.
- NK-Zell-Suspensionen werden bei 300 x g für 10 Minuten mit der Bremse zentrifugiert.
- NK-Zellen werden in RPMI-complete resuspendiert und die Endkonzentration bis 10 6 Zellen / ml eingestellt.
- Zellsuspensionen aus den isolierten und nicht infizierten T-Zellen in der oben genannten Schritte erzeugt werden bei 300 x g für 10 Minuten mit der Bremse zentrifugiert.
- Überstände entfernt und Pellets in RPMI-complete bei 2x10 6 Zellen / ml resuspendiert.
- K562-Zellen werden als positive Kontrolle Zielzellen verwendet, da sie sehr anfällig für NK-Lyse werden. Ter Zellen bei 300 x g für 10 Minuten mit der Bremse auf zentrifugiert werden Überstände entfernt und Pellets in RPMI-complete bei 2x10 6 Zellen / ml
- In einer 96-V-Boden-Well-Platte 100 mcl von Zielen und 100 mcl Effektoren werden in die Vertiefungen gegeben.
- Ein gut mit 100 mcLof Effektoren und 100 ul Medium ohne Zielzellen werden für nicht-spezifische NK-Zell-Degranulation verwendet werden.
- Zu jeder gut 10 mcLFITC-konjugierten anti-CD107a (BDIS) zugegeben wird.
- Die Platte wird dann bei 20 x g für 2 Minuten mit der Bremse zentrifugiert.
- Die zentrifugiert Platte wird 4 Stunden bei 37 ° C und 5% CO 2 inkubiert.
- Nach der Inkubation wird die Platte bei 400 x g für 5 Minuten mit der Bremse zentrifugiert.
- Der Überstand wird aus dem Pellet entfernt.
- Jedes der gut ist dann mit der folgenden Gruppe von Fluorochrom-konjugierten Antikörpern auf Eis für 20 Minuten in insgesamt 100 mcLof flow-Puffer (PBS w / 2% FBS und 0,1% NaN 3) gebeizt
- anti-CD3/14/20 [Pacific Blue-konjugierten (Biolegend)]
- anti-CD56 [APC (Biolegend)]
- Nach dem 20 Minuten Inkubation werden 200 ul der Strömung Puffer in jede Vertiefung gegeben und die Platte wird bei 400 x g für 5 Minuten mit der Bremse zentrifugiert.
- Der Durchfluss-Puffer wird dann sorgfältig aus jeder Vertiefung mit einer 2 mL Absaugen Pipette mit einem 200 mcl Mikropipette Spitze ausgestattet wobei er darauf achtete nicht auf das Pellet stören abgesaugt.
- Schritt 15 und 16 sind noch einmal wiederholt.
- Pellets werden in 200 ul von 1% Paraformaldehyd in CMF PBS resuspendiert. Die Zellsuspensionen werden dann zu fließen Röhrchen überführt.
- Das Gesamtvolumen beträgt bis zu 300 mcl indem ~ 100 mcl von 1% Paraformaldehyd in CMF PBS in jedes Röhrchen gebracht.
- Die Ereignisse (2x10 4) entsprechend NK-Zellen werden durch ein Durchflusszytometer mit dem FACS DIVA (BDIS) Software zur Erfassung und Analyse mittels Flow-Jo-Software (TreeStar) gesammelt.
6. CD107a Gating-Strategie (siehe Abbildung 3)
- Einzel-Zell-Tore werden mit einem forward scatter Höhe (FSC-H) vs Vorwärtsstreuung Breite (FSC-W) Plot.
- Für die Größe im Vergleich zu Granularität Plot FSC vs side scatter (SSC) Grundstück befindet sich in der einzelnen Zelle Tor geschaffen. Typischerweise Lymphozyten haben relativ niedrige Granularität und mittlere Zellgröße.
- Die Zellen in den Lymphozyten-Gate werden dann in einem Dot-Plot von CD3/14/20 gefärbten Zellen vs CD56 gefärbten Zellen auf Tor auf der NK-Zellen aufgetragen, während das Weglassen Monozyten (CD14), T-Zellen (CD3) und B-Zellen ( CD20).
- Die CD56 pos gated Bevölkerung wird dann für CD107a ausgewertet.
- Die NK-Zellen ohne Ziele Gruppe wird verwendet, um die Tore für das, was als CD107a negativ eingestellt.
7. 51 Cr-Freisetzungs-Assay (siehe Abbildung 4)
- Infizierte Zielzellen werden mit 125 MCCI 51 Cr (Perkin Elmer) in saline/10 6 Zellen für 2 Stunden in insgesamt 500 mcl beschriftet bei 37 ° C und 5% CO 2. Als positive Kontrolle 10 6 K562-Zellen mit 100 MCCI 51 Cr für 2 Std. in insgesamt 500 mcl beschriftet bei 37 ° C und 5% CO 2. Das Gesamtvolumen beträgt bis zu 500 MCL mit RPMI-complete gebracht. Das Volumen von 51 Cr zu den Zielzellen aufgenommen wird hier berechnet: (http://las.perkinelmer.com/Catalog/RadCalculator.htm?Mode=RadioactivityCalculator)
- Während Zielzellen Kennzeichnung, sind zuvor isolierte NK-Zellen aus der Kultur entfernt und gezählt. Zellkulturen, die NK-Zellen werden bei 300 x g für 10 Minuten mit den Bremsen auf zentrifugiert.
- Pellets, die NK-Zellen werden in RPMI-complete resuspendiert und aufgeteilt in 3 Röhren. Die Zelldichte auf 10 5 / ml in einer Röhre, 2.5x10 5 / ml in der zweiten Röhre und 5x10 5 / ml in das dritte Rohr angepasst.
- Labeled Ziele Zellen aus dem Inkubator entfernt und 4,5 ml RPMI-Abschluss in jedes Röhrchen gegeben. Die Rohre werden dann bei 300 x gf oder 10 Minuten lang zentrifugiert.
- Überstand wird vorsichtig ab, um nicht die Pellets in einen Behälter für radioaktive Abwässer stören gegossen.
- Schritte 4 und 5 sind zwei weitere Male wiederholt, um alle absorbierte 51 Cr zu entfernen. Überstände aus dem dritten Waschen kann der in einem Behälter für nicht-radioaktive Flüssigkeit entsorgt werden.
- Labeled Ziele werden dann in RPMI-complete, um eine endgültige Zelldichte von 10 5 / ml resuspendiert.
- 100 mcl der markierten Ziele sind in die Vertiefungen einer 96-V-Boden-Well-Platte für eine endgültige Zellzahl von 10 4 Zielzellen / well aliquotiert.
- Tabelle 1 ist ein Beispiel für eine typische Konfiguration für eine 51 Cr-Freisetzungs-Assay. Jede Gruppe ist in dreifacher Ausfertigung durchgeführt.
1 2 3 4 5 6 7 8 9 A K562 E: T (1:1) K562 E: T (1:1) K562 E: T (1:1) K562 E: T (2,5:1) K562 E: T (2,5:1) K562 E: T (2,5:1) K562 E: T (5:1) K562 E: T (5:1) K562 E: T (5:1) B UI E: T (1:1) UI E: T (1:1) UI E: T (1:1) UI E: T (2,5:1) UI E: T (2,5:1) UI E: T (2,5:1) UI E: T (5:1) UI E: T (5:1) UI E: T (5:1) C HIV-1 infizierten E: T (1:1) HIV-1 infizierten E: T (1:1) HIV-1 infizierten E: T (1:1) HIV-1 infizierten E: T (2,5:1) HIV-1 infizierten E: T (2,5:1) HIV-1 infizierten E: T (2,5:1) HIV-1 infizierten E: T (1:1) HIV-1 infizierten E: T (1:1) HIV-1 infizierten E: T (1:1) D E F K562 spontane Freisetzung K562 spontane Freisetzung K562 spontane Freisetzung UI spontane Freisetzung UI spontane Freisetzung UI spontane Freisetzung HIV-1 infizierten spontane Freisetzung HIV-1 infizierten spontane Freisetzung HIV-1 infizierten spontane Freisetzung G K562 maximale Freisetzung K562 maximale Freisetzung K562 maximale Freisetzung UI maximale Freisetzung UI maximale Freisetzung UI maximale Freisetzung HIV-1 infizierten Maxmum Veröffentlichung HIV-1 infizierten Maxmum Veröffentlichung HIV-1 infizierten Maxmum Veröffentlichung - 100 mcl der oben genannten NK-Zell-Suspensionen werden zu jeder Vertiefung mit Zielzellen aufgenommen.
- 100 mcl Ziele sind mit entsprechenden Vertiefungen, in denen Effektor-Zellen fehlen für die maximale und spontane Freisetzung Gruppen hinzugefügt. Die spontane Freisetzung Gruppe ist mit einem zusätzlichen 100 mcl von RPMI-complete inkubiert.
- Die 96-Well-Platte wird bei 20 x g für 2 Minuten mit der Bremse zentrifugiert.
- Die Platte wird dann zentrifugiert bei 37 ° C und 5% CO 2 für 4 Stunden.
- Nach der 4-stündigen Inkubation 5 mcl einer 1:10 Verdünnung des menschlichen roten Blutkörperchen in RPMI-Abschluss in jede Vertiefung mit Ausnahme der maximalen Freisetzung Vertiefungen gegeben.
- 100 mcl von 10% Natriumdodecylsulfat ist es, die maximale Freisetzung Vertiefungen gegeben.
- Die Platte wird bei 400 x g für 5 Minuten auf Pellet die Zellen zentrifugiert.
- 100 mcl zellfreier Überstand aus jeder Vertiefung entnommen und platziert in separate Gamma-Counter-Röhrchen (Perkin Elmer). Die Rohre werden in A 2470 Automatic Gamma Counter (Perkin Elmer) platziert. Der Betrag von 51 Cr in der Nährflüssigkeit als Zählungen pro Minute aus dem Durchschnitt einer 2-Minuten-Lektüre gemessen.
- Counts pro Minute (CPM) Lesarten der Proben und Kontrollen werden verwendet, um die% spezifische Lyse unter Verwendung der folgenden Gleichung berechnen:
[(Experimentelle CPM - meine spontane CPM) / (Mittelwert der maximalen CPM - meine spontane CPM)] x 100
8. Repräsentative Ergebnisse:

Abbildung 1. Schritte bei der Isolierung von natürlichen Killerzellen beteiligt und die Generierung von HIV-1 infizierten Zielzellen aus dem peripheren Blut.
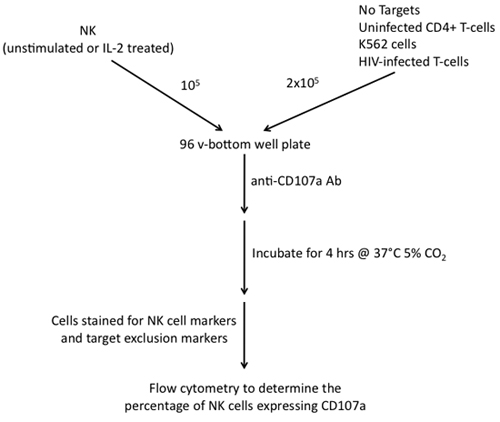
Abbildung 2. Schritte in den Bau einer CD107a Degranulation Assay unter Verwendung von NK-Zellen als Effektoren und K562-Zellen, nicht infizierten CD4 + T-Zellen und HIV-1-infizierten T-Zellen als Ziele beteiligt.
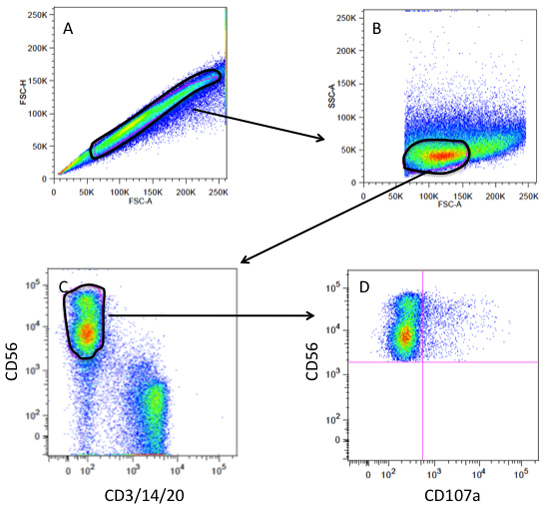
Abbildung 3. Durchflusszytometrie-Gating-Strategie für eine CD107a Degranulation Assay. (A) Gating an einzelnen Zellen und ohne Klumpen oder Dubletten auf einem Grundstück von FSC-A (forward scatter Bereich) vs FSC-H (forward scatter Höhe). (B) Einzelzelle Tor aufgetragen als FSC-A vs SSC (side scatter) Gating auf die Lymphozyten-Population. (C) Lymphozyten-Gate aufgetragen als CD3/14/20(T-Zellen, Monozyten, B-Zellen) vs CD56 (NK-Zellen) Gating auf dem CD56 pos andCD3/14/20 neg Bevölkerung (NK Tor). (D) NK Tor aufgetragen als CD107a vs CD56 auf NK-Zellen, die degranulierte (CD107a pos) haben zu visualisieren.
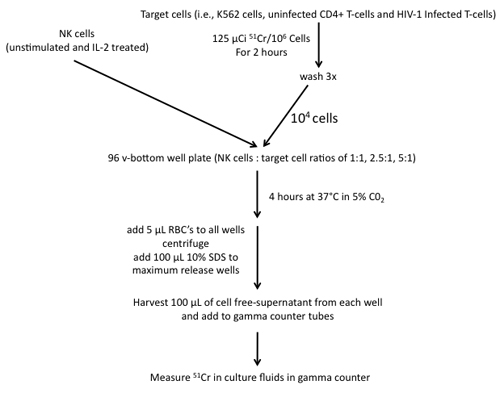
Abbildung 4. Schritte in den Bau eines 51 Cr-Freisetzungs-Assay unter Verwendung von NK-Zellen als Effektoren und K562-Zellen, nicht infizierten CD4 + T-Zellen und HIV-1-infizierten T-Zellen als Ziele beteiligt.

Abbildung 5. Repräsentative Ergebnisse für die Beurteilung der zytotoxischen Reaktion der natürlichen Killerzellen gegen HIV-1 infizierten Zellen. (A) NK-Zellen wurden für ihre Fähigkeit, ohne Ziele und als Reaktion auf K562-Zellen degranulieren ausgewertet, primäre CD4 + T-Zellen und HIV-infizierten primären T-Zellen wie durch den Prozentsatz der NK-Zellen, die zum Ausdruck Oberfläche CD107a beurteilt. Die Zahlen in jedem Quadranten repräsentieren den Prozentsatz aller NK-Zellen. T): B) NK-Zellen sind bekannt für ihre Fähigkeit, K562-Zellen, nicht infizierten CD4 + T-Zell-und HIV-1-infizierten T-Zellen in einem 51 Cr-Freisetzungs-Assay lysieren bei verschiedenen Effektor-Zelle zu Zelle Verhältnisse (E Ziel ausgewertet.
Diskussion
Wenn es richtig gemacht die Tests in diesem Protokoll beschriebenen sollte ein repräsentatives Bild der NK-Zellen die Fähigkeit, gegen degranulieren und lysieren HIV-1 infizierten Zellen (siehe Abbildung 5). NK-Zell-Degranulation in Reaktion auf HIV-infizierten Zellen und der NK-Zellen Lyse HIV-infizierten Zellen sollten direkt proportional 10. Zuverlässige Ergebnisse für die beiden NK-Zell-funktionellen Assays, zytotoxische Reaktionen auf HIV-infizierten Zellen zu messen sind abhängig von der Isolierung von hochreinem NK-Zellen sowie ein hochreines Bevölkerung von infizierten Zellen. Nachdem gereinigt NK-Zellen und HIV-1 infizierten Zellen sind von entscheidender Bedeutung für die Erreichung der eine ziemlich genaue Effektor-Verhältnisses Ziel. Ebenso ist das Entfernen von toten und apoptotischen Zellen aus dem Ziel-Zell-Populationen vor 51 Cr Kennzeichnung oder der Inkubation mit den Effektorzellen wichtig. 51 Cr kann durch Zellen, die Apoptose sind als das Vorhandensein von toten oder apoptotischen Zellen während der Isotopenmarkierung Schritt verinnerlicht werden wird in eine hohe spontane Freisetzung führen und den berechneten% spezifische Lyse zu verzerren. Darüber hinaus kann das Vorhandensein von toten oder apoptotischen Zellen auslösen NK-Zell-Degranulation was zu ungewöhnlich hohen CD107a Ausdruck. Präzise Pipettieren ist notwendig, wenn das Entfernen der zellfreien Überstände nach der Inkubation von NK-Zellen und Zielzellen in der 51 Cr-Release Assays, da die Unterschiede in der Lautstärke der Überstand aus jeder Wiederholung entfernt und wird in hohen Standardabweichungen führen. Änderungen können auf dieser Protokolle vorgenommen werden, um die Rolle spezifischer NK-Rezeptoren bei der Auslösung von NK-Zellen die Lyse von HIV-infizierten Zellen durch Inkubation der Effektoren oder Ziele vor Co-Kultur mit antagonistischen Antikörpern an spezifische Rezeptoren oder Liganden 6,11 zu bewerten. Zytokin-behandelten NK-Zellen (zB IL-2, IL-15) kann verwendet werden, um die Funktionalität der stimulierten NK Zellen 12 zu bewerten. In ähnlicher Weise können Antikörper-abhängige zelluläre Zytotoxizität erfolgt über diese Protokolle werden. Anti-HIV-Antikörper (zB Anti-gp120) an den Zielzellen für die Erkennung durch die NK-Zelle mit niedriger Affinität Fc-Rezeptor CD16 13 hinzugefügt werden. Diese Assays, obwohl bis zu NK-Zelle zytotoxische Reaktionen auf HIV-infizierten Zellen zu messen, kann auch geändert werden, um die Fähigkeit der NK-Zellen, Zytokine zu folgenden HIV-infizierten Zelle Anerkennung produzieren zu messen. Obwohl wir in diesem Protokoll beschrieben die Verwendung von in vitro infizierten Zellen als Zielzellen haben wir kürzlich die Erzeugung von Ziel-Zellen von Patienten mit HIV infiziert beschrieben. Dies erfordert die Isolierung von CD4 + T-Zellen durch Ausdehnung der Zellen über einen Zeitraum von zwei Wochen nach Stimulation durch Mitogene in Anwesenheit von Interleukin-2 11 gefolgt. Nach der zweiwöchigen Periode der Expansion werden die Protokolle in diesem Artikel beschrieben wird verwendet, um die Zielzellen zu isolieren.
Offenlegungen
Materialien
| Name | Company | Catalog Number | Comments |
| Vaccutainer Tubes (Sodium Heparin) | BD Biosciences | 367874 | |
| RosetteSep CD4+ T-cell Isolation Kit | Stem Cell Technologies | 15062 | |
| CMF PBS | Hyclone | SH30256.01 | |
| FBS | Hyclone | 10437-028 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| RPMI-1640 | Hyclone | SH30096.01 | |
| Penicillin / Streptomycin | Hyclone | SV30010 | |
| L-glutamine | Cellgro | 25-005-Cl | |
| T-cell Expansion Kit | Miltenyi Biotec | 130-091-441 | |
| CMF HBSS (1x) | Hyclone | SH30588.01 | |
| 0.5M EDTA | 46-034-Cl | ||
| NK Cell Negative Isolation Kit | Miltenyi Biotec | 130-092-657 | |
| IMDM | GIBCO, by Life Technologies | 12440-046 | |
| CD4+ Positive Isolation Kit | Invitrogen | 113.31D | |
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Polybrene | Santa Cruz Biotechnology, Inc. | sc-134220 | |
| CD3 PacificBlue | BD Biosciences | 558117 | |
| CD14 PacificBlue | Biolegend | 325616 | |
| CD20 PacificBlue | Biolegend | 302328 | |
| CD56 APC | Biolegend | 318310 | |
| CD69 PE | BD Biosciences | 555531 | |
| CD107a FITC | BD Biosciences | 555800 | |
| 51Chromium | PerkinElmer, Inc. | NEZ030002MC | |
| Gamma Counter Tubes | PerkinElmer, Inc. | 1270-401 | |
| 2470 Automatic Gamma Counter | PerkinElmer, Inc. | 2470-0050 | |
| FACS Diva | BD Biosciences | 643629 | |
| FlowJo | Tree Star, Inc. | FJ-9-1YR |
Referenzen
- Ruscetti, F. W. Analysis of effector mechanisms against HTLV-I- and HTLV-III/LAV-infected lymphoid cells. J Immunol. 136, 3619-3624 (1986).
- Zheng, Z. Y., Zucker-Franklin, D. Apparent ineffectiveness of natural killer cells vis-a-vis retrovirus-infected targets. J Immunol. 148, 3679-3685 (1992).
- Ferrari, G. Clade B-based HIV-1 vaccines elicit cross-clade cytotoxic T lymphocyte reactivities in uninfected volunteers. Proc Natl Acad Sci U S A. 94, 1396-1401 (1997).
- Shankar, P. Impaired function of circulating HIV-specific CD8(+) T cells in chronic human immunodeficiency virus infection. Blood. 96, 3094-3101 (2000).
- Ward, J. HIV-1 Vpr triggers natural killer cell-mediated lysis of infected cells through activation of the ATR-mediated DNA damage response. PLoS Pathog. 5, e1000613-e1000613 (2009).
- Ward, J. HIV modulates the expression of ligands important in triggering natural killer cell cytotoxic responses on infected primary T-cell blasts. Blood. 110, 1207-1214 (2007).
- Bonaparte, M. I., Barker, E. Killing of human immunodeficiency virus-infected primary T-cell blasts by autologous natural killer cells is dependent on the ability of the virus to alter the expression of major histocompatibility complex class I molecules. Blood. 104, 2087-2094 (2004).
- Stinchcombe, J. C., Griffiths, G. M. Secretory mechanisms in cell-mediated cytotoxicity. Annu Rev Cell Dev Biol. 23, 495-517 (2007).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. J Virol. 74, 10074-10080 (2000).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294, 15-22 (2004).
- Fogli, M. Lysis of endogenously infected CD4+ T cell blasts by rIL-2 activated autologous natural killer cells from HIV-infected viremic individuals. PLoS Pathog. 4, e1000101-e1000101 (2008).
- Tomescu, C., Chehimi, J., Maino, V. C., Montaner, L. J. NK cell lysis of HIV-1-infected autologous CD4 primary T cells: requirement for IFN-mediated NK activation by plasmacytoid dendritic cells. J Immunol. 179, 2097-2104 (2007).
- Ward, J. P., Bonaparte, M. I., Barker, E. HLA-C and HLA-E reduce antibody-dependent natural killer cell-mediated cytotoxicity of HIV-infected primary T cell blasts. Aids. 18, 1769-1779 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten