Method Article
Préparation et utilisation de VIH-1 primaires CD4 + T-cellules comme cellules cibles dans des cellules tueuses naturelles Tests cytotoxiques
Dans cet article
Résumé
Des essais de cytotoxicité à mesurer les réponses des cellules tueuses naturelles lytique aux cellules infectées est limitée par la pureté des cellules cibles. Nous démontrons ici l'isolement d'une population hautement purifiée de VIH-1 primaires de cellules T explosions en profitant de la capacité du VIH-1 s à bas moduler CD4.
Résumé
Natural killer (NK) sont une composante essentielle de la réponse immunitaire innée au virus des cellules infectées. Il est important de comprendre la capacité des cellules NK de reconnaître et de lyser le VIH-1 des cellules infectées parce identifier toute aberration dans la fonction des cellules NK contre les cellules infectées pourrait potentiellement mener à des thérapies qui permettraient d'améliorer leur activité cytolytique. Il est nécessaire d'utiliser infectés par le VIH des cellules T primaires explosions comme cellules cibles infectées plutôt que-lignées de lymphocytes T dans les tests de cytotoxicité. Lignées cellulaires T, même sans infection, sont très sensibles à la lyse des cellules NK. Par ailleurs, il est nécessaire d'utiliser des cellules autologues primaires pour prévenir les grandes classes complexe majeur d'histocompatibilité, je inadéquation entre la cible et de cellules effectrices qui se traduira par la lyse. Les premières études évaluant les réponses des cellules NK cytolytiques primaires aux cellules infectées a échoué à montrer tuant significative de l'1,2 cellules infectées. Cependant, en utilisant le VIH-1 primaires de cellules T comme cellules cibles des cellules NK dans les dosages fonctionnels a été difficile en raison de la présence de cellules non infectées contaminent 3. Cette cellule infectée incompatibles ratio de cellules non infectées se traduira par la variation de tuer des cellules NK entre les échantillons qui peuvent ne pas être dû à la variabilité en fonction des donneurs de cellules NK. Ainsi, il serait bénéfique de travailler avec une population de cellules infectées purifiée afin d'uniformiser l'effecteur à la cible cellulaire ratios entre les expériences 3,4. Ici nous démontrons l'isolement d'une population hautement purifiée de VIH-1 des cellules infectées en prenant avantage de la capacité du VIH-1 à bas moduler CD4 sur les cellules infectées et la disponibilité de kits commerciaux pour enlever les cellules mortes ou mourantes 3-6. Le purifiée infectés primaires de cellules T explosions peuvent ensuite être utilisés comme cibles soit dans une dégranulation ou dosage cytotoxique des cellules NK purifiées que la population effectrice 5-7. Utilisation des cellules NK comme effecteurs dans un essai de dégranulation évalue la capacité d'une cellule NK pour libérer le contenu lytique des lysosomes spécialisés 8 appelées «granules cytolytiques". Par coloration avec un anticorps conjugué contre le fluorochrome CD107a, une protéine membranaire lysosomale qui devient exprimé à la surface des cellules NK cytolytiques lorsque les granulés fusionner à la membrane plasmique, nous pouvons déterminer quel est le pourcentage de cellules NK dégranulent en réponse à la reconnaissance des cellules cibles. Alternativement, l'activité lytique des cellules NK peut être évaluée dans un essai cytotoxique qui permet la détermination du pourcentage de cellules cibles lysées par la libération de 51 Cr au sein de la cellule cible, en présence de cellules NK.
Protocole
1. Isolement des CD4 + humains cellules T du sang périphérique (voir Figure 1)
- Le sang veineux périphérique (40 à 60 ml) est recueilli dans Vacutainer Tubes contenant de l'héparine de sodium (Becton Dickinson).
- Le sang périphérique est alors transféré du Vacutainer Tubes de 50 tubes en polystyrène mL conique (20 ml de sang par tube).
- RosetteSep CD4 + réactif d'isolement des lymphocytes T (StemCell Technologies) est ajouté dans un volume de 1 mL à pas plus de 20 ml de sang dans un tube de 50 ml et on mélange bien.
- Le mélange est ensuite mis à incuber à 20-25 ° C pendant 20 minutes.
- Après 20 minutes, le calcium et le magnésium libre (CMF) du tampon phosphate salin [PBS (HyClone] w / 2% inactivé à la chaleur (56 ° C pendant 30 minutes) de sérum bovin fœtal [FBS (Hyclone)] est ajouté à des mélanges afin d'atteindre un volume final de 40 ml.
- Les mélanges diluée (30 ml) sont ensuite superposées à 15 ml de milieu de séparation de lymphocytes [LSM (Cellgro)] dans l'eau douce des tubes en polystyrène de 50 ml conique.
- Les tubes de 50 ml sont ensuite centrifugé à 1200 x g pendant 20 minutes avec le frein off.
- Les tubes de 50 ml sont retirés de la centrifugeuse avec soin, afin que l'interface entre le LSM et moyennes n'est pas perturbé. Les cellules à l'interface sont recueillies avec une pipette de 10 ml et placés dans de nouveaux tubes en polystyrène de 50 ml conique.
- Les interfaces recueillies sont diluées avec FBS PBS w / 2% à un volume final de 50 ml.
- Les tubes de 50 ml contenant les interfaces dilué sont centrifugés à 1200 x g pendant 10 minutes avec le frein à.
- Après centrifugation, les surnageants sont aspirés et les culots remis en suspension dans 10 ml de PBS w / 2% de FBS.
- Les suspensions cellulaires sont ensuite combinés en un seul tube conique de 50 mL et dilué à 50 ml avec du PBS w / 2% de FBS.
- Le tube contenant la suspension cellulaire combinée est centrifugée à 300 x g pendant 10 minutes pour enlever tous les RMLL restantes.
- Le surnageant est aspiré et le culot est alors remis en suspension dans 10 ml de milieu RPMI-1640 (Hyclone) contenant 10% de FBS, 100 U / ml de pénicilline, 100 mcg / ml de streptomycine (Hyclone) et 2 mM de L-glutamine (Cellgro ) (RPMI-complet) et comptés en utilisant un hématimètre.
- La concentration de protéine purifiée de cellules T CD4 + cellules est alors ajustée à 3x10 6 / ml avec du RPMI-complet.
- CD4 + 's sont alors stimulées par les cultivant avec anti-CD3/anti-CD28 couplés à des billes [T-Cell Expansion Kit (Miltenyi Biotec)] à un ratio de trois perles par la cellule pendant 72 heures à 37 ° C dans un 5% de C0 2 humidifié incubateur.
2. L'infection des cellules CD4 + T-cellules avec le VIH-1 (voir Figure 1)
- Suspension cellulaire contenant CD4 + stimulés cellules T sont retirés de la plaque de culture et comptées en utilisant un hématimètre.
- T CD4 + cellules (~ 2x10 6) sont ajoutés à un tube de 15 ml conique pour l'utiliser comme un contrôle non infectés.
- Le reste de l'lymphocytes T CD4 +-suspension est placée dans un tube conique de 50 ml d'infection.
- Les tubes contenant les cellules CD4 + T-cell suspensions sont centrifugées à 300 x g pendant 10 minutes et le surnageant de culture est aspiré.
- Stimulé CD4 + T-cellules sont resuspendues directement dans les liquides de culture contenant des virions et ensuite spin-infectés à 1200 x g pendant 2 heures à 20-25 ° C 9. Typiquement, nous infectent T CD4 + cellules à une multiplicité d'infection (MOI) de 5 pour une réplication des souches du VIH déficient (par exemple, DHIV-3) ou une MOI de 0,01 pour un virus compétent pour la réplication (par exemple, le VIH-1 NL4 / 3) . Le volume final est sans importance, mais les tubes doivent être équilibrés pour la centrifugation. Polybrène (Santa Cruz) est ajouté au liquide de culture avant spinfection à une concentration finale de 10 mcg / ml.
- À la fin du spinfection, surnageants sont prélevés et les cellules remises en suspension à une densité cellulaire de 3x10 6 / ml dans du RPMI-complet supplémenté avec 100 U / ml d'IL-2. Les cellules infectées et non infectées sont la culture pendant 72 heures si un virus réplication incompétents a été utilisé pour infecter la cellule ou 5-7 jours si un virus compétent pour la réplication a été utilisé pour infecter les cellules. Les médias devraient être changés toutes les 48 heures pendant la culture.
3. Isolement des cellules tueuses naturelles humaines du sang périphérique
- Le sang veineux périphérique (~ 100 ml) sont collectées à partir du même donneur utilisée pour isoler les cellules T CD4 + cellules dans Vacutainer Tubes contenant de l'héparine de sodium (Becton Dickinson).
- Le sang est ensuite transféré du Vacutainer Tubes dans 50 ml tubes coniques de 20 ml aliquotes.
- Le Vacutainer Les tubes sont ensuite lavées avec 8 ml de FMC Hanks Balanced Salt Solution [HBSS (Hyclone)] et les lavages sont transférés à l'containi 50 ml Coniquesng les 20 ml de sang périphérique. Le volume résultant dans chaque conique 50 ml est de 35 mL.
- Le sang dilué est ensuite superposées à 15 ml de LSM dans un endroit frais 50 ml tube conique et les tubes centrifugés à 400 x g pendant 30 minutes avec le frein off.
- Les tubes sont soigneusement retirés de la centrifugeuse et l'interface en résulte entre le LSM et moyennes est récoltée de chaque tube en utilisant une pipette de 10 ml et placés dans de nouveaux tubes coniques de 50 ml.
- Les suspensions cellulaires sont lavées une fois avec HBSS CMF (centrifugé à 400 x g pendant 15 minutes avec le frein à).
- Après le premier lavage les surnageants sont prélevés et les pastilles obtenues sont combinées en une seule conique de 50 ml et lavées deux fois avec HBSS CMF (centrifugé à 30 g pendant 10 minutes avec le frein à) pour supprimer tous les RMLL restantes.
- Après le dernier lavage du culot est resupended dans 10 ml de tampon de lyse ACK (150 mM de NH 4 Cl, 1,0 mM de KHCO3 et 0,1 mM EDTA pH 7,3) et incubées à température ambiante (20-25 ° C) pendant 5 min. Cette étape est nécessaire afin d'éliminer les érythrocytes contaminer à partir des cellules mononucléées du sang périphérique (PBMC).
- Après 10 min. 40 ml de PBS CMF est ajouté à la suspension cellulaire afin d'arrêter la réaction de lyse.
- Le tube avec la suspension cellulaire contenant les hématies lysées PBMC et est ensuite centrifugé à 300 x g pendant 10 minutes avec le frein à.
- Le surnageant est éliminé et le culot est resuspendu dans 5 ml de PBS avec 2% de FBS et 2 mM d'EDTA et comptées en utilisant un hématimètre.
- Les tueuses naturelles (cellules NK) sont ensuite isolés à partir des PBMC en utilisant un kit d'isolation des cellules NK [sélection-humain négatif (Miltenyi Biotec)] selon les instructions du fabricant.
- Le flux continu des colonnes sont collectées dans des tubes de 15ml et les tubes sont centrifugés à 300 x g pendant 10 minutes avec le frein à.
- Les surnageants sont éliminés et les culots remis en suspension. Les culots remis en suspension sont combinés dans un seul tube dans un volume total de 1 ml de milieu Iscove Dulbecco modifié par [IMDM (Gibco)] complété avec 10% AB + inactivé par la chaleur (56 ° C pendant 30 minutes) sérum humain (SH) et a compté avec une hématimètre.
- Le volume de suspension cellulaire est ajustée avec HS IMDM w/10% de sorte que la densité finale des cellules NK est 3x10 6 / ml. La suspension cellulaire est divisé en deux. Un ensemble de cellules NK reçoit 200 U / ml de recombinant interleukine-2 humaine. L'autre ensemble de cellules est laissé dans un milieu sans traitement à la cytokine.
- Les cultures de cellules NK sont ensuite incubés pendant une nuit à 37 ° C CO, 5% 2
- Les cellules NK résultant sont ensuite utilisées comme cellules effectrices soit pour un test de dégranulation CD107a ou 51 test de libération de Cr.
4. Purification du VIH-1 des cellules infectées (voir Figure 1)
- Les fluides de culture contenant des cellules infectées sont retirés des plaques et centrifugé à 300 x g pendant 10 minutes avec le frein à.
- Le surnageant est aspiré et les boulettes sont remises en suspension dans 2 mL de PBS avec 2% de FBS et 2 mM d'EDTA et les cellules comptées sur un hématimètre.
- Les cellules infectées qui ne contiennent pas le VIH-1 sont isolés loin de ceux qui hébergent le virus en prenant avantage du fait que le VIH-1 module bas de CD4. Pour cette CD4 objectif kit isolation positive (Invitrogen) est utilisé conformément aux instructions du fabricant, à l'exception que l'on a-CD4 par rapport perles cellule est utilisée.
- Lors du retrait de la numération des CD4 + T-cellules, les cellules mortes sont retirées de la population de cellules purifiées porteurs du virus en utilisant un kit de Dead Cell renvoi (Miltenyi Biotec) selon les instructions du fabricant.
- Le flux continu après l'enlèvement des cellules mortes dans les colonnes est centrifugé à 300 x g pendant 10 minutes avec le frein à. Le surnageant est éliminé, culots remis en suspension dans 1 ml de RPMI-complet et les cellules sont comptées.
- Les cellules purifiées infectés sont maintenant prêts à être utilisés comme cibles dans un test de dégranulation CD107a ou 51 test de libération de Cr.
5. Assay dégranulation CD107a (voir Figure 2)
- Des cultures de cellules NK sont retirés de plaques et de la suspension de cellules est compté.
- Suspensions de cellules NK sont centrifugés à 300 x g pendant 10 minutes avec le frein à.
- Les cellules NK sont remis en suspension dans du RPMI-complet et la concentration finale ajustée à 10 6 cellules / ml.
- Les suspensions cellulaires de l'isolés infectés et non infectés cellules T générées dans les étapes ci-dessus sont centrifugés à 300 x g pendant 10 minutes avec le frein à.
- Les surnageants sont retirés et remis en suspension dans du RPMI granulés-complet à 2x10 6 cellules / ml.
- K562 sont utilisés comme cellules cibles positives de contrôle, car ils sont très sensibles à la lyse NK. TIl cellules sont centrifugées à 300 x g pendant 10 minutes avec le frein à, les surnageants sont retirés et remis en suspension dans du RPMI granulés-complet à 2x10 6 cellules / ml
- Dans un 96-V-fond ainsi la plaque 100 mcL des cibles et des effecteurs 100 MCL sont ajoutés aux puits.
- Un puits contenant 100 et 100 effecteurs mcLof mcL de milieu sans cellules cibles seront utilisées pour les non-spécifiques dégranulation des cellules NK.
- Pour chaque puits 10 mcLFITC conjugué anti-CD107a (BDIS) est ajouté.
- La plaque est ensuite centrifugé à 20 g pendant 2 minutes avec le frein.
- La plaque est incubée centrifugé pendant 4 heures à 37 ° C et 5% de CO 2.
- Après incubation, la plaque est centrifugée à 400 x g pendant 5 minutes avec le frein à.
- Le surnageant est retiré de la pastille.
- Chaque puits est ensuite coloré avec le panneau suivant de fluorochrome anticorps conjugués sur la glace pendant 20 minutes dans un total de 100 tampons de flux mcLof (PBS w / 2% de FBS et 0,1% NaN 3)
- anti-CD3/14/20 [Pacific Blue-conjugué (Biolegend)]
- anti-CD56 [APC (Biolegend)]
- Après l'incubation de 20 minutes, 200 mcL de tampon de flux est ajouté à chaque puits et la plaque est centrifugée à 400 x g pendant 5 minutes avec le frein à.
- Le tampon de flux est alors soigneusement aspiré de chaque puits en utilisant une pipette de 2 mL aspiration munie d'une douille 200 micropipette mcL tout en s'assurant de ne pas perturber le culot.
- Étape 15 et 16 sont répétées une fois de plus.
- Les pellets sont remis en suspension dans 200 mcL de paraformaldéhyde 1% dans PBS CMF. Les suspensions cellulaires sont ensuite transférés dans des tubes de flux.
- Le volume total est porté à 300 mcL en ajoutant ~ 100 mcL de paraformaldéhyde 1% au FCM PBS dans chaque tube.
- Les événements (2x10 4) correspondant aux cellules NK sont collectées par un cytomètre en flux utilisant le DIVA FACS (BDIS) du logiciel d'acquisition et analysées à l'aide de flux Jo logiciel (TreeStar).
6. Stratégie Gating CD107a (voir Figure 3)
- Portes de cellules individuelles sont créées en utilisant une hauteur diffusion vers l'avant (FSC-H) Largeur vs diffusion vers l'avant (FSC-W) intrigue.
- Pour tracer la taille par rapport granularité un scatter FSC secondaires vs (SSC) intrigue est créée sur la porte cellule unique. Typiquement les lymphocytes ont une granularité relativement faible et moyenne taille de la cellule.
- Les cellules lymphocytaires dans la grille sont alors tracées dans un nuage de points d'CD3/14/20 cellules colorées vs CD56 cellules colorées à la porte sur les cellules NK tout en omettant les monocytes (CD14), les lymphocytes T (CD3) et cellules B ( CD20).
- La population CD56 POS gated est ensuite évaluée CD107a.
- Les cellules NK, sans groupe de cibles est utilisé pour définir les portes pour ce qui est considéré CD107a négative.
7. 51 Essai de libération de Cr (voir Figure 4)
- Cellules cibles infectées sont étiquetés avec 125 MCCI 51 Cr (Perkin Elmer) dans saline/10 6 cellules pendant 2 heures dans un total de 500 mcL à 37 ° C et 5% de CO 2. Comme contrôle positif 10 6 cellules K562 sont marquées avec 100 MCCI 51 Cr pendant 2 heures dans un total de 500 mcL à 37 ° C et 5% de CO 2. Le volume total est porté à 500 mcL avec du RPMI-complet. Le volume de 51 Cr ajouté aux cellules cibles est calculée ici: (http://las.perkinelmer.com/Catalog/RadCalculator.htm?Mode=RadioactivityCalculator)
- Alors que les cellules cibles sont l'étiquetage, précédemment isolé les cellules NK sont retirés de la culture et comptées. Les cultures de cellules contenant les cellules NK sont centrifugés à 300 x g pendant 10 minutes avec les freins.
- Des pastilles contenant les cellules NK sont remises en suspension dans du RPMI-complet et divisé en trois tubes. La densité cellulaire est ajustée à 10 5 / ml dans un tube, 2.5x10 5 / ml dans le deuxième tube et 5x10 5 / mL dans le troisième tube.
- Cellules marquées cibles sont retirés de l'incubateur et 4,5 mL de RPMI-complet est ajouté à chaque tube. Les tubes sont ensuite centrifugés à 300 x GF ou 10 minutes.
- Le surnageant est versé hors soin de ne pas déranger le culot dans un conteneur pour les déchets liquides radioactifs.
- Les étapes 4 et 5 sont répétées deux fois plus pour éliminer tous les non absorbé 51 Cr. Surnageants de la troisième lavage peuvent être éliminés dans un conteneur pour les déchets non radioactifs liquides.
- Cibles marquées sont ensuite remises en suspension dans du RPMI-complète à une densité cellulaire finale de 10 5 / ml.
- 100 MCL de cibles marquées sont aliquotées dans des puits d'une plaque de 96 puits à fond en V pour un certain nombre final de cellules de 10 4 cellules cibles / puits.
- Table1 est un exemple de configuration typique pour un essai de 51 Cr communiqué. Chaque groupe se fait en trois exemplaires.
1 2 3 4 5 6 7 8 9 Une K562 E: T (1:1) K562 E: T (1:1) K562 E: T (1:1) K562 E: T (2.5:1) K562 E: T (2.5:1) K562 E: T (2.5:1) K562 E: T (5:1) K562 E: T (5:1) K562 E: T (5:1) B IU E: T (1:1) IU E: T (1:1) IU E: T (1:1) IU E: T (2.5:1) IU E: T (2.5:1) IU E: T (2.5:1) IU E: T (5:1) IU E: T (5:1) IU E: T (5:1) C VIH-1 E Infected: T (1:1) VIH-1 E Infected: T (1:1) VIH-1 E Infected: T (1:1) VIH-1 E Infected: T (2.5:1) VIH-1 E Infected: T (2.5:1) VIH-1 E Infected: T (2.5:1) VIH-1 E Infected: T (1:1) VIH-1 E Infected: T (1:1) VIH-1 E Infected: T (1:1) D E F K562 libération spontanée K562 libération spontanée K562 libération spontanée UI libération spontanée UI libération spontanée UI libération spontanée VIH-1 Release infectés spontanée VIH-1 Release infectés spontanée VIH-1 Release infectés spontanée G K562 libération maximale K562 libération maximale K562 libération maximale UI libération maximale UI libération maximale UI libération maximale VIH-1 Release Maxmum infectés VIH-1 Release Maxmum infectés VIH-1 Release Maxmum infectés - 100 mcL des suspensions au-dessus des cellules NK sont ajoutés à chaque puits contenant les cellules cibles.
- 100 mcL de cibles sont ajoutés aux puits correspondant dans lequel les cellules effectrices sont absents pour les groupes de libération maximale et spontanée. Le groupe libération spontanée est incubée avec un supplément de 100 mcL de RPMI-complet.
- La plaque de 96 puits est centrifugé à 20 g pendant 2 minutes avec le frein.
- La plaque est ensuite centrifugé incubées à 37 ° C et 5% de CO 2 pendant 4 heures.
- Après les 4 heures d'incubation 5 mcL d'une dilution 1:10 de globules rouges humains en RPMI-complet est ajouté à chaque puits sauf le puits libération maximale.
- 100 MCL de dodécyl sulfate de sodium 10% est ajouté aux puits libération maximale.
- La plaque est centrifugée à 400 x g pendant 5 minutes pour culotter les cellules.
- 100 MCL de acellulaire surnageant est récolté de chaque puits et placés dans séparés compteur gamma tubes (Perkin Elmer). Les tubes sont placés dans un comptoir 2470 Gamma automatique (Perkin Elmer). Le montant de 51 Cr présents dans le liquide de culture est mesurée en coups par minute à partir de la moyenne d'une lecture de 2 minutes.
- Lectures coups par minute (CPM) des échantillons et des contrôles sont utilisés pour calculer le% de lyse spécifique en utilisant l'équation suivante:
[(Expérimental CPM - moyenne de CPM spontanée) / (moyenne de CPM maximum - moyenne spontanée CPM)] x 100
8. Les résultats représentatifs:

Figure 1. Les étapes de l'isolement des cellules tueuses naturelles et la production du VIH-1 des cellules cibles infectées par le sang périphérique.
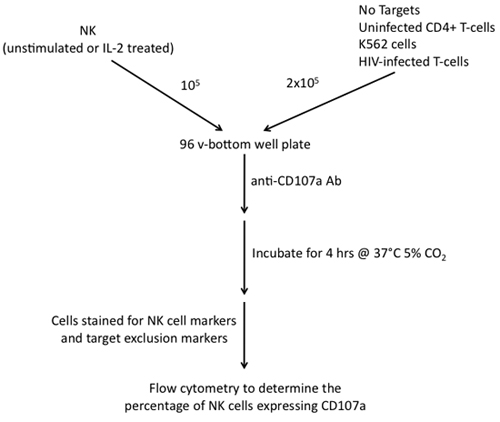
Figure 2. Étapes impliquées dans la construction d'un test de dégranulation des cellules NK CD107a utilisant comme effecteurs et les cellules K562, CD4 non infectés + T-cellules et le VIH-1 T-cellules cibles.
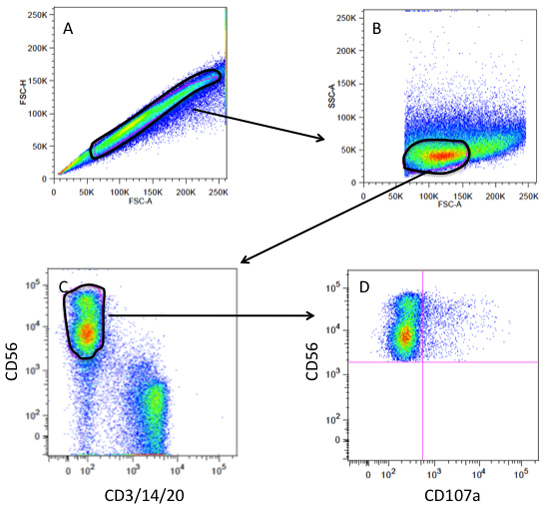
Figure 3. Cytométrie en flux gating stratégie pour un test de dégranulation CD107a (A). Gating sur les cellules individuelles et des bouquets excluant ou doublets sur une parcelle de FSC-A (zone de diffusion vers l'avant) vs FSC-H (hauteur diffusion vers l'avant). (B) porte cellule unique tracée comme FSC-A vs SSC (Side Scatter) gating sur la population des lymphocytes. (C) porte lymphocytes tracées comme CD3/14/20(Cellules T, les monocytes, les cellules B) vs CD56 (cellules NK) gating sur le CD56 POS andCD3/14/20 la population neg (NK porte). (D) NK porte tracées comme CD107a vs CD56 de visualiser les cellules NK qui ont dégranulés (CD107a POS).
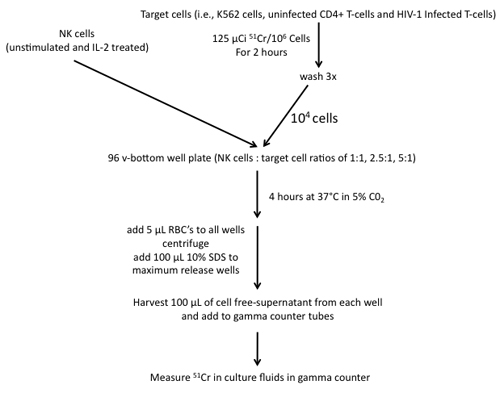
Figure 4. Étapes impliquées dans la construction d'un dosage de 51 Cr communiqué utilisant des cellules NK effecteurs et les cellules K562, CD4 non infectés + T-cellules et le VIH-1 T-cellules cibles.

Figure 5. Les résultats représentatifs pour l'évaluation de la réponse cytotoxique des cellules tueuses naturelles contre le VIH-1 des cellules infectées. (A) Les cellules NK ont été évalués pour leur capacité à dégranulent sans objectifs et en réponse aux cellules K562, CD4 + primaires des cellules T et infectés par le VIH primaires de cellules T évaluée par le pourcentage de cellules NK qui CD107a surface de l'exprimer. Les chiffres dans chaque quadrant représente le pourcentage du total des cellules NK. B) Les cellules NK sont évalués pour leur capacité à lyser les cellules K562, CD4 non infectés + T-cell et le VIH-1 T-cellules dans un dosage de 51 Cr communiqué à des cellules effectrices de cibler différents ratios cellule (E: T).
Discussion
Une fois fait correctement les analyses décrites dans ce protocole devrait donner une image représentative de la capacité des cellules NK à l'encontre dégranulent et Lyse VIH-1 des cellules infectées (voir figure 5). Dégranulation des cellules NK dans la réponse au VIH des cellules infectées et les cellules NK lyse des cellules infectées par le VIH doit être directement proportionnelle 10. Des résultats fiables pour les deux dosages de cellules NK fonctionnelles pour mesurer les réponses cytotoxiques pour les cellules infectées par le VIH sont dépendants de l'isolement des cellules NK hautement purifié ainsi que d'une population hautement purifiée de cellules infectées. Ayant purifié les cellules NK et le VIH-1 des cellules infectées sont essentielles pour la réalisation d'un effecteur assez précis pour objectif de ratio de cellules. De même, l'élimination des cellules mortes et l'apoptose des populations de cellules cibles est importante avant 51 Cr étiquetage ou l'incubation avec les cellules effectrices. 51 Cr peut être internalisé par les cellules qui subissent l'apoptose comme la présence de cellules mortes ou apoptotiques pendant l'étape de marquage isotopique donnera lieu à un communiqué de haute spontanée et de fausser la lyse% calculé spécifiques. Par ailleurs, la présence de cellules mortes ou apoptotiques peuvent déclencher la dégranulation des cellules NK résultant en des niveaux anormalement élevés d'expression CD107a. Pipetage précis est nécessaire pour retirer les surnageants acellulaires après incubation des cellules NK et les cellules cibles dans les 51 tests de libération de Cr, comme des différences dans le volume de surnageant retiré de chaque répétition et se traduira par haute déviations standard. Des modifications peuvent être apportées à ces protocoles pour évaluer le rôle des récepteurs spécifiques dans le déclenchement de NK NK lyse des cellules infectées par le VIH des cellules en incubant les effecteurs ou les cibles avant de co-culture avec des anticorps antagonistes des récepteurs spécifiques ou ligands 6,11. Cytokine-traitée cellules NK (par exemple, l'IL-2, IL-15) peut être utilisé pour évaluer la fonctionnalité des cellules NK stimulées 12. De même, les anticorps des dosages de cytotoxicité cellulaire dépendante peut être effectuée en utilisant ces protocoles. Anticorps anti-VIH (par exemple, anti-gp120) peuvent être ajoutés à des cellules cibles pour la reconnaissance par les récepteurs des cellules NK CD16 faible affinité Fc 13. Ces tests, bien que mis en place pour mesurer les réponses des cellules NK cytotoxiques pour les cellules infectées par le VIH, peut également être modifiée pour mesurer la capacité des cellules NK à produire des cytokines après la reconnaissance des cellules infectées par le VIH. Bien que nous avons décrit dans ce protocole l'utilisation de cellules in vitro infectées que les cellules cibles, nous avons récemment décrit la génération des cellules cibles de patients infectés par le VIH. Cela nécessite l'isolement des cellules T CD4 + cellules suivie d'une expansion des cellules sur une période de deux semaines après stimulation par des mitogènes, en présence d'interleukine-2 11. Après la période de deux semaines d'expansion, les protocoles décrits dans cet article sont utilisés pour isoler les cellules cibles.
Déclarations de divulgation
matériels
| Name | Company | Catalog Number | Comments |
| Vaccutainer Tubes (Sodium Heparin) | BD Biosciences | 367874 | |
| RosetteSep CD4+ T-cell Isolation Kit | Stem Cell Technologies | 15062 | |
| CMF PBS | Hyclone | SH30256.01 | |
| FBS | Hyclone | 10437-028 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| RPMI-1640 | Hyclone | SH30096.01 | |
| Penicillin / Streptomycin | Hyclone | SV30010 | |
| L-glutamine | Cellgro | 25-005-Cl | |
| T-cell Expansion Kit | Miltenyi Biotec | 130-091-441 | |
| CMF HBSS (1x) | Hyclone | SH30588.01 | |
| 0.5M EDTA | 46-034-Cl | ||
| NK Cell Negative Isolation Kit | Miltenyi Biotec | 130-092-657 | |
| IMDM | GIBCO, by Life Technologies | 12440-046 | |
| CD4+ Positive Isolation Kit | Invitrogen | 113.31D | |
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Polybrene | Santa Cruz Biotechnology, Inc. | sc-134220 | |
| CD3 PacificBlue | BD Biosciences | 558117 | |
| CD14 PacificBlue | Biolegend | 325616 | |
| CD20 PacificBlue | Biolegend | 302328 | |
| CD56 APC | Biolegend | 318310 | |
| CD69 PE | BD Biosciences | 555531 | |
| CD107a FITC | BD Biosciences | 555800 | |
| 51Chromium | PerkinElmer, Inc. | NEZ030002MC | |
| Gamma Counter Tubes | PerkinElmer, Inc. | 1270-401 | |
| 2470 Automatic Gamma Counter | PerkinElmer, Inc. | 2470-0050 | |
| FACS Diva | BD Biosciences | 643629 | |
| FlowJo | Tree Star, Inc. | FJ-9-1YR |
Références
- Ruscetti, F. W. Analysis of effector mechanisms against HTLV-I- and HTLV-III/LAV-infected lymphoid cells. J Immunol. 136, 3619-3624 (1986).
- Zheng, Z. Y., Zucker-Franklin, D. Apparent ineffectiveness of natural killer cells vis-a-vis retrovirus-infected targets. J Immunol. 148, 3679-3685 (1992).
- Ferrari, G. Clade B-based HIV-1 vaccines elicit cross-clade cytotoxic T lymphocyte reactivities in uninfected volunteers. Proc Natl Acad Sci U S A. 94, 1396-1401 (1997).
- Shankar, P. Impaired function of circulating HIV-specific CD8(+) T cells in chronic human immunodeficiency virus infection. Blood. 96, 3094-3101 (2000).
- Ward, J. HIV-1 Vpr triggers natural killer cell-mediated lysis of infected cells through activation of the ATR-mediated DNA damage response. PLoS Pathog. 5, e1000613-e1000613 (2009).
- Ward, J. HIV modulates the expression of ligands important in triggering natural killer cell cytotoxic responses on infected primary T-cell blasts. Blood. 110, 1207-1214 (2007).
- Bonaparte, M. I., Barker, E. Killing of human immunodeficiency virus-infected primary T-cell blasts by autologous natural killer cells is dependent on the ability of the virus to alter the expression of major histocompatibility complex class I molecules. Blood. 104, 2087-2094 (2004).
- Stinchcombe, J. C., Griffiths, G. M. Secretory mechanisms in cell-mediated cytotoxicity. Annu Rev Cell Dev Biol. 23, 495-517 (2007).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. J Virol. 74, 10074-10080 (2000).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294, 15-22 (2004).
- Fogli, M. Lysis of endogenously infected CD4+ T cell blasts by rIL-2 activated autologous natural killer cells from HIV-infected viremic individuals. PLoS Pathog. 4, e1000101-e1000101 (2008).
- Tomescu, C., Chehimi, J., Maino, V. C., Montaner, L. J. NK cell lysis of HIV-1-infected autologous CD4 primary T cells: requirement for IFN-mediated NK activation by plasmacytoid dendritic cells. J Immunol. 179, 2097-2104 (2007).
- Ward, J. P., Bonaparte, M. I., Barker, E. HLA-C and HLA-E reduce antibody-dependent natural killer cell-mediated cytotoxicity of HIV-infected primary T cell blasts. Aids. 18, 1769-1779 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon