Method Article
Экспериментальные модели для изучения пигментного эпителия сетчатки физиологии и патофизиологии
В этой статье
Резюме
Мы предоставляем воспроизводимый метод для культивирования сливной монослоев человеческого плода пигментного эпителия сетчатки клетки (hfRPE) клетки, которые обладают морфологии, физиологии, полярность, и белка и моделей экспрессии генов взрослых родной ткани. Эта работа была распространена на животных моделях различных заболеваний глаз.
Аннотация
Мы разработали процедуру культуре клеток, которые могут производить в больших количествах сливной монослоев первичных человеческих эмбриональных пигментного эпителия сетчатки (hfRPE) культур с морфологических, физиологических и генетических особенностей родного человека НПП. Эти hfRPE клеточных культурах выставка тяжелых пигментация, и электронной микроскопии показывают обширные апикальной мембраны микроворсинок. Соединительного комплексов были определены с иммунофлюоресценции маркировки различных белков плотно перехода. Эпителиальные полярности и функции этих легко воспроизводимые первичных культур напоминают ранее изученных млекопитающих моделей родной НПП, в том числе человека. Эти результаты были распространены по разработке терапевтических вмешательств в нескольких животных моделях человеческих заболеваний глаз. Мы сосредоточились на стратегии для удаления ненормальное накопление жидкости в сетчатке или субретинальной пространства. Внеклеточной субретинальной пространство отделяет наружные сегменты фоторецепторов и апикальной мембраны ПЭС и имеет решающее значение для поддержания сетчатки вложений и целый ряд ПЭС / сетчатки взаимодействий.
протокол
1. Эмбриональной ткани человека
Все ткани человека соответствующих исследований следующим принципам Хельсинкской декларации и NIH институциональных наблюдательный совет. Плод глаза получаются независимые сводника, Advanced Bioscience ресурсов (ABR, Аламеда, штат Калифорния), от случайных доноров на 16 до 22 недель беременности, размещенных в RPMI-1640 средах, содержащих труб (предоставляется ABR), упакованные на льду, и выступил ночь услуг приоритет. Ткани сохраняют жизнеспособность до 48 часов после энуклеации.
2. Средний культуре клеток
MEM-альфа изменение среды (Sigma-Aldrich) используется в качестве базовой среды для подготовки 5% и 15% сыворотки средах для культивирования клетки ПЭС (ПЭС среды; Таблица 1 ниже).
| Имя | Сигма | Гибко | Количество | Хранение |
| MEM, альфа модификации | M-4526 | 500 мл | +4 ° C | |
| N1 дополнения | N-6530 | 5 мл | +4 ° C | |
| Пенициллин-стрептомицин | 15140-148 | 5 мл | -20 ° C | |
| GlutaMax - Я | 35050 | 5 мл | -20 ° C | |
| Номера для незаменимых аминокислот | M-7145 | 5 мл | +4 ° C | |
| THT * | -80 ° C | |||
| Таурин | T-0625 | 125 мг | ||
| Гидрокортизон | H-0396 10 | 10 мкг | ||
| Трийод-thyronin | T-5516 | 0,0065 мкг | ||
| Фетальной телячьей сыворотки ** | 5% или 15% | -80 ° C |
Таблица 1. Человеческого плода НПП Средний Компоненты для подготовки 500 мл среды
* ТНТ производится путем растворения таурин-гидрокортизон-трийод-thyronin в 1 1,5 мл PBS, прежде чем принимать среды. Несколько аликвоты производятся и хранятся при температуре -80 ° С до упрощения культивирования подготовки питательной среды.
** Фетальной телячьей сыворотки не получено от Sigma-Aldrich или Gibco.
Фетальной телячьей сыворотки, использованные при приготовлении средств массовой информации получают из Атланты биологические препараты (Norcross, GA). Каждая бутылка сыворотки инактивированной тепла (56 ° С в течение 1 час) перед использованием. Чтобы обеспечить согласованность клеточных культур большое количество сыворотки от той же партии приобретаются и хранятся в -20 ° С, пока они не используются для приготовления средства массовой информации. Редко посеянных клеток из конкретной партии hfRPE клетки выращиваются в 24 - или 12 - луночных планшетах в течение нескольких недель в среде, содержащей 20% FBS из разных партий. Быстро растущих melanated клеток с самой классической НПП морфологии (булыжник) указывают соответствующие сыворотке много, что может быть использовано для клеточных культур.
Среду клеточной культуры также содержит: N1 дополнения (Sigma-Aldrich) 1:100 мл / мл, GlutaMax / пенициллин стрептомицин 1:100 мл / мл (Gibco), и несущественные аминокислот раствором кислоты (Sigma-Aldrich) 1:100 мл / мл. Кроме того, гидрокортизон (20 мкг / л), таурин (250 мг / л), и трийод-thyronin (0,013 мкг / л) (ТНТ) получают путем растворения впереди этих трех компонентов в ФБР, чтобы конечная концентрация 1:500 (мл / мл). Аликвоты THT хранятся при температуре 80 ° С до добавлены НПП среды.
3. Культуре клеток
По получении, неповрежденные глобусы промывают в противогрибковым антибиотиком решение (разбавляют до 10X;.. Кот не 15240-096; Invitrogen) + гентамицин (1 мг / мл) в течение от 3 до 5 минут (рисунок 1 ниже). 
Рисунок 1. После инкубации антибиотики смывается дважды среде, такой как HBSS или PBS. Один глаз миру в то время, переносится на 10 см блюдо Петри с покрытием Sylgard-184 (WPI) и закрепляется 27G иглы. Использование четких SidePort нож (Alcon) разрез делается через склеру ниже ресничного тела (1 / 3 расстояния от глаз экватора к передней поверхности). Этот разрез используется для запуска круговым вырезом для снятия передней части глаза. Это сокращение производится с использованием карбида вольфрама покрытием изогнутые ножницы диафрагма с одним лезвием зубчатые (ФСТ). До удаления передней части глаза, разрез производится через стекловидное тело, чтобы избежать отключения тetina от РПЭ у заднего полюса. После передней части глаза удаляют, задний полюс инкубируют с dispase-I решение (2 ед / мл, кошка не 04942086001;.. Roche Diagnostics, Indianapolis, IN) в 5% сыворотки среде, содержащей в течение 40-60 минут в 37 ° С-5% СО 2. После лечения dispase, задний полюса передаются HBSS в чашках Петри с силиконовой прокладки (Sylgard 184; Dow Corning, Midland, MI) и разрезать на квадранты или больше частей, чтобы сгладить достаточно тканей. Затем сетчатка осторожно удалить пинцетом. Single-слоев клеток ПЭС были снимают в листах и собираются непосредственно в холодную трипсина-EDTA (Gibco, # 25200-056) решение. После РПЭ собирается, трубы с тканями в трипсина-EDTA опечатаны и переданы на водяной бане в течение 10-15 минут при температуре 37 ° C. Через 10 мин инкубации, трубы энергично встряхивают в отдельных ПЭС на мелкие кластеры. Если разделение не является полным, трубы помещаются обратно в водяной бане в течение еще 5 минут. После трипсина-EDTA инкубация, трубы на предмет наличия возможных не-растворенных смешанных кластеров клеток. Любые наблюдаемые кластеры удалить с помощью тонкой стеклянной наконечником пипетки Пастера. После спиннинг вниз (1,4 мин на клинической центрифуге в течение 4 минут), hfRPE клетки ресуспендировали в 15% СМИ ПЭС и затем положить в Primaria колбы (например: кошка не 08-772-45; Fisher Scientific, Питтсбург, штат Пенсильвания.. ). Эта среда заменяется через 1 день с 5% сыворотки содержащих НПП среде, и последующие изменения были сделаны через каждые 2 до 3 дней. После 3-х до 4 недель, клетки стали сливной и равномерно пигментированные. Затем они трипсином в 0,25% трипсина-EDTA от 10 до 15 минут, ресуспендировали в 15% сыворотки содержащих НПП культуре клеток средних и посеяны на ясно вставками культуре клеток на 150 до 200 тыс. клеток на лунку (Transwell; Corning Costar, Корнинг, Нью-Йорк), используя 12-мм вставками, 0,4-мкм поры, полиэстер мембран (например: кошка не 07-200-161, Fisher Scientific)... Перед посевом, скважины были покрыты человека внеклеточного матрикса (10 мкг в 150 мкл HBSS на лунку, кошка не 354237,.. BD Biosciences, Франклин озер, штат Нью-Джерси) и лечение с УФ-излучением в капюшоне на 2 часа. В некоторых случаях, трипсинизации процедура повторялась во второй раз, для сбора клеток, которые не оторваться спустя первые трипсинизации. И тот же протокол (за исключением покрытия с ECM) был использован для культуры клеток на колбы для создания P1 популяцию клеток. Эти клетки были использованы в экспериментах, когда они имели полное сопротивление тканей ≥ 200 Ω • см 2 и были равномерно пигментированные.
Пожалуйста, нажмите здесь для большего рисунке 1 .
4. Шаг за шагом процедуры
- Подготовка 12-луночного планшета с несколькими решениями (на каждый глаз 4 скважины нужно):
- добавить 10x антибиотик противогрибкового раствора - 1 а / глаз
- добавить PBS / HBSS решение для полоскания - 2 скважины / глаз
- добавить dispase решение - 1 а / глаз
- Подготовка рассекает чашки Петри при распаковке 5 игл фиксации и наполняя его HBSS
- Распакуйте глаза и поместить их в антибиотик-противогрибкового решение в течение 3-5 минут (подготовлен в шаге 1)
- Промыть глаза в двух скважинах (подготовлен в шаге 1) с PBS / HBSS, а затем передавать их на вскрытии блюдо.
- Trim чрезмерной мышечной и соединительной ткани вокруг глаз
- Использование игл 27G безопасный (придавить к кремнию базы) глаза в рассекает блюдо приведения их в пути, где роговица вверх.
- Использование SidePort ножом сделать надрез роговицы ниже, где круговым вырезом начнется
- Использование диафрагмы ножницами сделать обвести глаза, то, используя тот же ножницами прорезать стекловидное тело и поднять переднюю часть глаз подальше.
Примечание: с шагом от 3 до 8 избежать чрезмерного механического давления на глазное яблоко. - Передача открытым глазом в раствор dispase (подготовлен в шаге 1)
- Инкубируйте глаз кубок за 40-60 минут при температуре 37 ° C с 5% CO 2
- Замените HBSS решение в рассекает блюдо с новым.
- Передача глаз от dispase решение рассекает блюдо.
- Позиция глаза в чашку Петри (глазное яблоко чашку вверх) и закрепите с двумя 27G иглы.
- Аккуратно поднимите частично отделена сетчатки и использование сетчатки ножницами вырезать сетчатку от зрительного нерва. Отменить сетчатки.
- Использование диафрагмы ножницами сделать один разрез от периферии глаза на зрительный нерв.
- Используя все пять игл 27G сгладить глаза решений НПП слой хорошо растягивается.
- Использование сетчатки ножницы совершать круговые обвести зрительного нерва разделения НПП слой от привязанности к зрительному нерву.
Примечание: шаги 13-17 может быть сделано при малом увеличении или без стереомикроскопа - Отрегулируйте стереомикроскопа с увеличением 250xили более, а найти край НПП лист близко к зрительному нерву вдоль разреза сделаны диафрагмы ножницами.
- Использование двух щипцов мембраны отдельных РПЭ-Бруха из хориоидеи слой ткани. Это может потребовать нескольких попыток найти область по краю, где подключение ПЭС и сосудистой оболочки слабее.
- Место НПП листов в холодную трипсина-EDTA раствора в 15 мл трубки
- После РПЭ собираются, кепка и передача трубки с тканями в трипсина-EDTA в водяной бане в течение 10-15 мин при 37 ° C.
- Через 10 мин инкубации, энергично встряхнуть 15 мл труб отделить ПЭС на мелкие кластеры. Если разделение не является полным, место трубы обратно в водяной бане в течение еще 5 минут.
- Проверьте трубы для возможной не-растворенных смешанных кластеров клеток. Любые наблюдаемые кластеры должны быть удалены с помощью тонкой стеклянной наконечником пипетки Пастера.
- Спином вниз (1,4 мин на клинической центрифуге в течение 4 минут) hfRPE соты, удалить супернатант и вновь приостановить клеток в 15% РПЭ СМИ (9 мл общего числа)
- Поместите 3 мл клеточной суспензии в Primaria колб добавляют 2 мл свежей 15% СМИ НПП, место колбу в инкубаторе до следующего дня (37 ° C, 5% СО 2)
5. Представитель Результаты
Функциональная проверка hfRPE культуре клеток
В предыдущих экспериментах мы использовали эти первичные культуры, чтобы определить выражение, поляризация и функции белков плазмы мембранного транспорта и выявления конкретных сигнальных путей, которые регулируют функции НПП 1-11 Эти характеристики, как они накапливаются обеспечить проверку набор свойств, которые могут быть применены в каждую ячейку поколения. Экспериментов приведены ниже идентифицировать белки, которые определяют трансэпителиальная транспорт жидкости и целостности трансклеточной пути. Эти эксперименты в пробирке были проверены на животных моделях сетчатки повторного прикрепления 6.
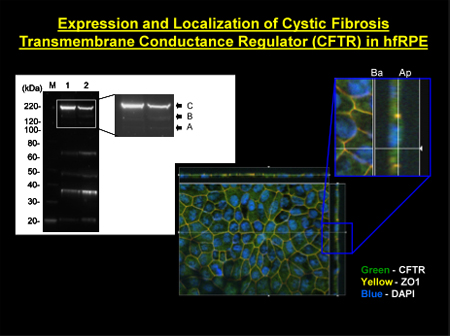
Рисунок 2. Локализация CFTR в клетках hfRPE Левая верхняя панель. МВТР был обнаружен в hfRPE клеток с использованием мембраны обогащенный экстрактами. М, маркер молекулярного веса; переулок 1, основных зрелых (группа С) и незрелые (полосы А и В) Центр нижней панели: иммунофлюоресценции локализацию CFTR (зеленая этикетка) Вверху справа панели: увеличенный вид сечения через плоскость г показывать.. максимальной интенсивности проекции через Z-оси. ZO-1 (помечены красным) служит маркером жесткий стык разграничения апикальной и базолатеральной стороны РПЭ. DAPI (синий) этикетки ядер, расположенных близко к базальной мембране. ZO-1 выглядит как желтый / оранжевый, так как ее красная этикетка перекрывает зеленую флуоресценцию от CFTR.
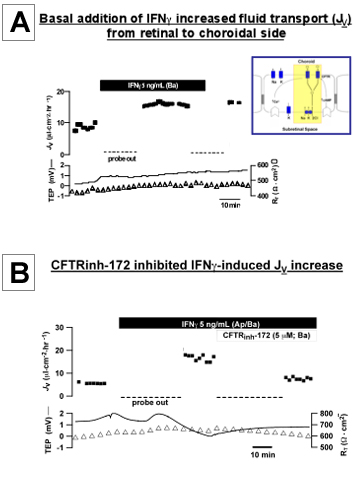
Рисунок 3. IFNγ вызванные физиологическими изменениями в hfRPE. Добавлением IFNγ к базисной ванны увеличился трансэпителиальная транспорта жидкости (J у) через монослой начального, культивируемых клетках hfRPE J г на графике как функция времени в верхнем следа и чистой жидкости. поглощения (апикальной к базальным ванны), отмечается положительное значение; трансэпителиальная потенциал (ТЭП) и полное сопротивление тканей (R T) показаны как функция времени в нижней следов. B: Добавление CFTRinh-172 (5 мкМ) к базисной ванны тормозится IFNγ-стимулированных J г увеличится.
Ниже приведен пример животной модели экспериментов, подтверждающих hfRPE в пробирке выводы. В этом эксперименте, искусственно созданных отслойки сетчатки значительно снизилась после добавления IFNg на поверхность глаза внешность (рис. 4, Б). Этот эффект может быть частично заблокирован: (1) Кроме того цАМФ блокаторы (рис. 4Д), (2) полностью заблокирован после того блокаторов ЯК + цАМФ. Изображения ниже, получены с использованием октября сканера.

Рисунок 4. В естественных условиях эксперименты сетчатки отряда. Процедур для этих экспериментов в естественных условиях были ранее подробно описаны 6. В этих экспериментах сетчатки отряды были созданы в глаза крыс путем инъекции 0.5-3 мкл раствора изменение PBS в субретинальной пространства (СГД), в одиночку или с сочетанием ЯК-СТАТ и ингибиторов ПКА пути. Каждый эксперимент был начальный период управления 40-70 мин после создания отслойки сетчатки. В это время, скорость изменения объема пузырь был измерен, чтобы застраховать пузырь стабильности. Оптической когерентной томографии томография (Институт прикладной физики, русский академии наук, Нижний Новгород, Россия) был использован для измерения времени, ход изменения объема в СГД.
Время ходе повторного вложения т.UME изменения измерялась оптической когерентной томографии (ОКТ). Октябрь изображения с 4-х различных экспериментов (панели слева; н.э.), которые показывают изменение отряд размеров (стрелки, В и D) после добавления IFNγ к передней поверхности за 40-70 мин. Панели А и В показывают, что IFNγ увеличился Jv от контроля скорости (≈ 2 мкл • см 2 • ч -1) до 14 и 12 мкл • см 2 • ч-1, соответственно. После добавления ЯК-СТАТ пути и ПКА ингибиторы (С и D), IFNγ - индуцированного поглощения ставки были значительно снижены до 0,2 и 7,9 мкл • см 2 • ч-1, соответственно. Стрелки указывают границы пузырь для сравнения с области заключены в пунктирную линию, (начиная с объема). Правая часть рисунка: верхняя панель-резюме измеряется ставки Jv из нескольких экспериментов; средняя панель-фильм ( нажмите здесь ), нижняя панель-3D разделы эксперимента обобщены в Б. Псевдоцвет в синий указывает пространственные масштабы отряд при £ = 0 и 40 мин после добавления INFγ.
Все эксперименты на животных были проведены в соответствии с Ассоциацией по исследованиям в области зрения и офтальмологии заявлении. Протокол был одобрен уходу и использованию животных комитета Национального института здоровья.
Обсуждение
В настоящей работе мы описываем дополнительные изменения наших ранее опубликованных методов 3, предназначенные для упорядочения несколько шагов, необходимых для получения последовательной hfRPE первичных культур с большего числа доступных ячеек в глаза. Каждое изменение в первоначальной процедуре была тщательно протестирована в нескольких физиологии и молекулярной биологии эксперименты для того, чтобы изменения не вводить артефакты и быть постоянно проверяется многих других лабораториях с помощью этих клеток. Наконец, дополнительные эксперименты были проведены для сравнения в результатах лабораторных аналогичные возмущения в животных моделях.
Раскрытие информации
Благодарности
Мы благодарим членов лаборатории Джеффри Adijanto, Тина Банзон, Жун Ли, Ван Цинь, Congxiao Чжан Цзин Чжао, Конни Чжи, Awais Зия, Наталья Струнникова за помощью в характеризующие эти клеточных культурах. Особая благодарность Цзинь Чжао, Конни Чжи, и Тина Банзон за помощь в поддержании большие запасы клеточных культурах.
Работа выполнена при поддержке Национального института здоровья Внутренние исследовательской программы.
Материалы
Инструментов, необходимых для вскрытия протоколов
- Стерео микроскоп - любые доступные с рабочим увеличении x250 необходимое для вскрытия
- Пройдя блюдо - например, Кимбл 100 х 20 мм # 23062 (по одному на рассечение) любого источника
- Sylgard 184 - WPI Кат. # SYLG184 *
* Для подготовки рассекает блюдо следовать Sylgard 184 включены смешивания инструкции, залить смешанной жидкости эластомера в чашке Петри для формирования 5-8мм слой. Разрешить эластомера вылечить, по крайней мере 24 часов. Блюдо с вылечил эластомера можно стерилизовать с использованием 70% этанола и повторно использовать несколько раз (~ 100 раз) - 27 G иглы BD PrecissionGlide 1 ¼ длины (5 на рассечение) любого источника
- HBSS 1X раствор, содержащий кальций и магний соли - GIBCO Cat # 14025 500 мл (хорошо для нескольких вскрытия).
- Ирис ножницы карбида зубчатым лезвием, изогнутые - ФСТ Cat # 14559-11 (один).
- Сетчатки ножницы - Катена Cat # К4-5300 (один).
- Пинцет - например, Дюмон Пинцет # 5 с полированными советов от Cat WPI # 500085 (2 штуки).
- Sideport нож - Alcon, четких 1 мм, два конических, угловой Cat # 8065921540.
- Одноразовая пробирка 15 мл - (по одной на каждый глаз) любого источника
- Пастера стеклянную пипетку - (по одному на рассечение) любого источника
- Пластина 12 хорошо (по одному на рассечение) любого источника
- Primaria 25 см 2 колбы - (2-3 на каждый глаз) любого источника
Ссылки
- Bharti, K., Miller, S. S., Arnheiter, H. The new paradigm: Retinal pigment epithelium cells generated from embryonic stem cells or induced pluripotent cells. Pigment Cell & Melanoma Research. , .
- Strunnikova, N. V., Maminishkis, A., Barb, J. J., Wang, F., Zhi, C., Sergeev, Y., Chen, W., Edwards, A. O., Stambolian, D., Abecasis, G., Swaroop, A., Munson, P. J., Miller, S. S., S, S. Transcriptome analysis and molecular signature of human retinal pigment epithelium. Hum Mol Genet. 19 (12), 2468-2486 (2010).
- Miller, S. S., Maminishkis, A., Li, R., Adijanto, J. Chapter 184: Phototransduction: RPE transport Retina Phototransduction: RPE transport. Encyclopedia of the Eye. , 2540-2540 (2010).
- Bryant, D. M., Mostov, K. E. From cells to organs: Building polarized tissue. Nature Reviews. Molecular Cell Biology. 9 (11), 887-901 (2008).
- Maminishkis, A., Chen, S., Jalickee, S., Banzon, T., Shi, G., Wang, F. E., Ehalt, T., Hammer, J. A., Miller, S. S. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47, 3612-3624 (2006).
- Shi, G., Maminishkis, A., Banzon, T., Jalickee, S., Li, R., Hammer, J., Miller, S. S. Control of chemokine gradients by the retinal pigment epithelium. Invest Ophthalmol Vis Sci. 49, 4620-4630 (2008).
- Economopoulou, M., Hammer, J., Wang, F. E., Fariss, R., Maminishkis, A., Miller, S. S. Expression, localization, and function of junctional adhesion molecule-C (JAM-C) in human retinal pigment epithelium. Invest Ophthalmol Vis Sci. 50 (3), 1454-1463 (2008).
- Li, R., Maminishkis, A., Banzon, T., Wan, Q., Jalickee, S., Chen, S., Miller, S. S. IFN{gamma} Regulates Retinal Pigment Epithelial Fluid Transport. Am J Physiol Cell Physiol. 297, C1452-C1465 (2009).
- Li, R., Maminishkis, A., Wang, F. E., Miller, S. S. PDGF-C and -D induced proliferation/migration of human RPE is abolished by inflammatory cytokines. Invest Ophthalmol Vis Sci. 48, 5722-5732 (2007).
- Maminishkis, A., Jalickee, S., Blaug, S. A., Rymer, J., Yerxa, B. R., Peterson, W. M., Miller, S. S. The P2Y(2) receptor agonist INS37217 stimulates RPE fluid transport in vitro and retinal reattachment in rat. Invest Ophthalmol Vis Sci. 43, 3555-3566 (2002).
- Wang, F. E., Zhang, C., Maminishkis, A., Dong, L., Zhi, C., Li, R., Zhao, J., Majerciak, V., Gaur, A. B., Chen, S. MicroRNA-204/211 alters epithelial physiology. FASEB J. 24, (2010).
- Adijanto, J., Banzon, T., Jalickee, S., Wang, N. S., Miller, S. S. CO2-induced ion and fluid transport in human retinal pigment epithelium. J Gen Physiol. 133, 603-622 (2009).
- Li, R., Maminishkis, A., Zahn, G., Vossmeyer, D., Miller, S. S. Integrin alpha5beta1 mediates attachment, migration, and proliferation in human retinal pigment epithelium: relevance for proliferative retinal disease. Invest Ophthalmol Vis Sci. 50, 5988-5996 (2009).
- Peterson, W. M., Meggyesy, C., Yu, K., Miller, S. S. Extracellular ATP activates calcium signaling, ion, and fluid transport in retinal pigment epithelium. J Neurosci. 17, 2324-2337 (1997).
- Voloboueva, L. A., Liu, J., Suh, J. H., Ames, B. N., Miller, S. S. R)-alpha-lipoic acid protects retinal pigment epithelial cells from oxidative damage. Invest Ophthalmol Vis Sci. 46, 4302-4310 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены