Method Article
Experimentelle Modelle für das Studium der retinalen Pigmentepithelzellen Physiologie und Pathophysiologie
In diesem Artikel
Zusammenfassung
Wir bieten eine reproduzierbare Methode zur Kultivierung konfluente Monolayer von menschlichen fetalen retinalen Pigmentepithelzellen (hfRPE) Zellen, die Morphologie, Physiologie, Polarität und Protein-und Genexpression von adulten nativen Gewebe aufweisen. Diese Arbeit hat zu einem Tiermodell verschiedener Augenerkrankungen erweitert worden.
Zusammenfassung
Wir haben eine Zellkultur Verfahren, das große Mengen an konfluente Monolayer von primären humanen fötalen retinalen Pigmentepithels (hfRPE) Kulturen mit morphologischen, physiologischen und genetischen Eigenschaften des nativen humanen RPE produzieren kann entwickelt. Diese hfRPE Zellkulturen weisen schwere Pigmentierung und Elektronenmikroskopie zeigen umfangreiche apikalen Membran Mikrovilli. Die junctional Komplexe wurden mit Immunfluoreszenz Kennzeichnung von verschiedenen Tight Junction-Proteine identifiziert. Epitheliale Polarität und Funktion dieser leicht reproduzierbar primären Kulturen ähneln zuvor Säugetieren Modelle von nativen RPE, einschließlich der menschlichen untersucht. Diese Ergebnisse wurden durch die Entwicklung von therapeutischen Interventionen in mehreren Tiermodellen für menschliche Auge Krankheit verlängert. Wir haben uns auf Strategien zur Beseitigung von abnormalen Flüssigkeitsansammlung in der Netzhaut oder subretinalen Raum konzentriert. Die extrazelluläre subretinalen Raum trennt die Photorezeptor äußeren Segmente und der apikalen Membran des RPE und ist entscheidend für die Aufrechterhaltung der Netzhaut-Anhänge und eine ganze Reihe von RPE / Netzhaut-Interaktionen.
Protokoll
1. Humane, fötale Gewebe
Alle menschlichen Gewebe Forschung folgt den Grundsätzen der Deklaration von Helsinki und der NIH Institutional Review Board. Fetal Augen sind von einem unabhängigen Auftraggeber, Advanced Bioscience Resources (ABR, Alameda, CA) erhalten, aus zufälligen Spender bei 16 bis 22 Wochen der Schwangerschaft, in RPMI-1640 Medium mit Röhren (von ABR) gestellt, auf Eis gepackt, und geliefert von einem über Nacht Priorität Lieferservice. Gewebe lebensfähig bleiben bis zu 48 Stunden nach der Enukleation.
2. Zellkulturmedium
MEM-alpha modifiziertes Medium (Sigma-Aldrich) als Basismedium verwendet werden, um 5% vorbereiten und 15% Serum-haltigen Medien für die Kultivierung von RPE-Zellen (RPE Medium; Tabelle 1 unten).
| Name | Sigma | Gibco | Betrag | Lagerung |
| MEM, Alpha-Modifikation | M-4526 | 500 mL | +4 ° C | |
| N1 ergänzen | N-6530 | 5 mL | +4 ° C | |
| Penicillin-Streptomycin | 15140-148 | 5 mL | -20 ° C | |
| Glutamax - I | 35050 | 5 mL | -20 ° C | |
| Nicht essentielle Aminosäuren | M-7145 | 5 mL | +4 ° C | |
| THT * | -80 ° C | |||
| Taurin | T-0625 | 125 mg | ||
| Hydrocortison | H-0396 10 | 10 ug | ||
| Triiod-thyronin | T-5516 | 0,0065 pg | ||
| Rinderfötenserum ** | 5% oder 15% | -80 ° C |
Tabelle 1. Humanem fötalen RPE Medium Komponenten zur Darstellung von 500 mL Medium
* THT wird durch Auflösen von Taurin-Hydrocortison-Triiod-thyronin in 1 1,5 mL PBS, bevor Sie das Medium aus. Mehrere Aliquots hergestellt und bei -80 ° C bis Kultivierung Vorbereitung des Kulturmediums zu vereinfachen.
** Fötales Rinderserum ist nicht von Sigma-Aldrich oder Gibco erhalten.
Rinderfötenserum in Medien Herstellung verwendet wird aus Atlanta Biologicals (Norcross, GA) erhalten. Jede Flasche des Serums hitzeinaktiviertem (56 ° C für 1 Stunde) vor dem Gebrauch. Um sicherzustellen, Zellkultur Konsistenz große Mengen an Serum aus der gleichen Charge gekauft und in -20 ° C bis sie für die Vorbereitung von Medien verwendet werden. Oder 12 - - Well-Platten für ein paar Wochen in Medien mit 20% FBS aus verschiedenen Chargen dünn gesät Zellen aus einer bestimmten Charge von hfRPE Zellen sind in 24 angewachsen. Der am schnellsten wachsende melanated Zellen mit den meisten klassischen RPE Morphologie (Kopfsteinpflaster) deuten auf eine geeignete Serum viel, dass für die Zellkultur eingesetzt werden können.
Zellkulturmedium enthält außerdem: N1 Supplement (Sigma-Aldrich) 1:100 mL / mL, Glutamax / Penicillin-Streptomycin 1:100 mL / mL (Gibco) und essentielle Aminosäure-Lösung (Sigma-Aldrich) 1:100 mL / mL. Darüber hinaus Hydrocortison (20 ug / L), Taurin (250 mg / L) und Triiod-thyronin (0,013 g / L) (THT) ist vor durch Auflösen dieser drei Komponenten in PBS bis zu einer Endkonzentration von 1:500 vorbereitet (ml / ml). Aliquots von THT sind bei 80 ° C gelagert, bis auf die RPE zugesetzt.
3. Cell Culture
Nach Erhalt intakt sind Globen in der Antibiotika-Antimykotikum-Lösung gespült (verdünnt auf 10X;.. Kat.-Nr. 15240-096; Invitrogen) plus Gentamicin (1 mg / mL) für 3 bis 5 Minuten (Abbildung 1 unten). 
Abbildung 1. Nach der Inkubation Antibiotika off zweimal mit Medium wie HBSS oder PBS gespült. Ein Auge Globus an der Zeit ist, 10 cm Petrischale mit beschichtet mit Sylgard-184 (WPI) übertragen und gesichert mit 27G Nadeln. Mit Clearcut Sideport Messer (Alcon) wird ein Schnitt durch die Lederhaut unter dem Ziliarkörper (3.1 der Entfernung vom Auge Äquator an der vorderen Fläche) hergestellt. Dieser Schnitt wird verwendet, um einen kreisförmigen Schnitt zur Entfernung der vorderen Augenabschnitt zu starten. Dieser Schnitt erfolgt mit einem Wolfram-Karbid beschichtet gebogenen Iris Schere mit einem Messer Wellenschliff (FST). Vor der Entfernung des vorderen Teil des Auges, ist ein Schnitt durch den Glaskörper, um zu verhindern Lösen der retina aus der RPE am hinteren Pol. In 5% Serum enthaltenden Medium für 40-60 Minuten; Nach dem vorderen Teil des Auges entfernt wird, wird der hintere Pol mit Dispase-I-Lösung (.. Roche Diagnostics, Indianapolis, IN 2 U / mL, Kat. Nr. 04942086001) inkubiert in 37 ° C-5% CO 2. Nach Dispase Behandlung werden die hinteren Pole eine HBSS in Petrischalen mit Silikon-Polsterung (Sylgard 184; Dow Corning, Midland, MI) übertragen und seziert in Quadranten oder größere Stücke ausreichend abflachen Gewebe. Dann wird die Netzhaut ist vorsichtig mit einer Pinzette entfernt. Einzel-Zell-RPE-Schichten wurden aus in Blätter geschält und direkt in kaltes Trypsin-EDTA (Gibco, # 25200-056)-Lösung gesammelt. Nach dem RPE erhoben werden, sind Rohre mit Gewebe in Trypsin-EDTA versiegelt und in Wasserbad für 10-15 Minuten bei 37 ° C. Nach 10 Minuten Inkubation werden die Rohre kräftig geschüttelt, um RPE in kleinen Gruppen zu trennen. Wenn die Trennung nicht vollständig ist, werden die Rohre wieder in Wasserbad für weitere 5 Minuten gesetzt. Nach Trypsin-EDTA Inkubation werden die Rohre für möglich un-gelösten gemischt Zellhaufen inspiziert. Jede beobachtete Cluster entfernt werden mit feinen Spitzen Glas Pasteur Pipette. Nach Abzentrifugieren (1,4 Umdrehungen pro Minute auf klinischen Zentrifuge für 4 min), sind hfRPE Zellen in 15% RPE Medien resuspendiert und dann in Flaschen Primaria (Beispiel: Kat.-Nr. 08-772-45; Fisher Scientific, Pittsburgh, PA.. ). Dieses Medium ist nach 1 Tag mit 5% Serum-haltigen RPE Medium ersetzt, und nachträgliche Änderungen vorgenommen wurden alle 2 bis 3 Tagen. Nach 3 bis 4 Wochen wurde die Zellen konfluent und gleichmäßig pigmentiert. Sie werden dann in 0,25% Trypsin-EDTA für 10 bis 15 Minuten mit Trypsin behandelt, in 15% Serum-haltigen RPE Zellkulturmedium resuspendiert und ausgesät auf klare Zellkultureinsätzen bei 150 bis 200K Zellen pro Well (Transwell; Corning Costar, Corning, NY), mit 12-mm Durchmesser Einsätze, 0,4-um Poren-, Polyester-Membranen (Beispiel: Kat.-Nr. 07-200-161, Fisher Scientific)... Vor der Aussaat wurden die Vertiefungen mit menschlichen extrazellulären Matrix (.. 10 ug in 150 ul HBSS pro Loch, Kat. Nr. 354237; BD Biosciences, Franklin Lakes, NJ) beschichtet und gehärtet mit UV-Licht in der Motorhaube für 2 Stunden. In einigen Fällen wurde die Trypsinierung Verfahren für ein zweites Mal wiederholt, um die Zellen, die nicht nach dem ersten Trypsinierung habe lösen zu sammeln. Das gleiche Protokoll (ohne Beschichtung mit ECM) wurde zur Kultivierung von Zellen auf den Flaschen verwendet, um die P1 Population von Zellen zu generieren. Diese Zellen wurden in Experimenten verwendet werden, wenn sie insgesamt Gewebewiderstand von ≥ 200 Ω • cm 2 hatten und gleichmäßig pigmentiert.
Bitte hier klicken für ein größeres Bild 1 .
4. Step by Step Procedures
- Bereiten 12-Well-Platte mit mehreren Lösungen (für jedes Auge 4 Brunnen erforderlich):
- add 10x Antibiotika Antimykotika-Lösung - 1 gut / Auge
- add PBS / HBSS-Lösung für Spülen - 2 Brunnen / Auge
- add Dispase-Lösung - 1 gut / Auge
- Bereiten Sie sezieren Petrischale mit dem Auspacken 5 Fixierung Nadeln und füllte es mit HBSS
- Entpacken Sie die Augen und legen Sie sie in Antibiotika-Antimykotikum-Lösung für 3-5 Minuten (hergestellt in Schritt 1)
- Spülen Sie die Augen in zwei Brunnen (hergestellt in Schritt 1) mit PBS / HBSS, übertragen Sie sie anschließend zu zerlegen Gericht.
- Trim übermäßigen Muskel-und Bindegewebe um das Auge herum
- Mit 27G Nadeln sichern (Pin auf Silizium-Basis) in den Augen seziert Gericht passen sie in einer Weise, wo Hornhaut nach oben zeigt.
- Mit Sideport Messer machen Schnitt unterhalb Hornhaut, wo Rundschnitt beginnt
- Mit Iris Schere machen um das Auge herum geschnitten, dann mit derselben Schere durch Glaskörper schneiden und heben vorderen Teil des Auges entfernt.
Hinweis: in den Schritten 3 bis 8 vermeiden übermäßige mechanische Druck auf Augapfel. - Transfer offenen Auges in Dispase-Lösung (hergestellt in Schritt 1)
- Inkubieren Augenmuschel für 40-60 Minuten bei 37 ° C mit 5% CO 2
- Ersetzen HBSS-Lösung in Sezieren Schüssel mit frischem eins.
- Transfer-Auge von Dispase Lösung Sezieren Gericht.
- Position Auge in Petrischale (Augapfel Tasse nach oben) und mit zwei 27G Nadeln.
- Heben teilweise getrennt Netzhaut und mit Retina-Schere Netzhaut weg von den Sehnerv. Discard Netzhaut.
- Mit Iris Schere machen einen Einschnitt von der Peripherie des Auges in Richtung des Sehnervs.
- Mit allen fünf 27G Nadeln flach Auge macht RPE Schicht schön gestreckt.
- Mit der Netzhaut Schere machen kreisförmigen Schnitt um Sehnerv Trennung RPE-Schicht von der Bindung an Sehnerv.
Hinweis: Schritte 13-17 können mit geringer Vergrößerung oder ohne Stereo-Mikroskop durchgeführt werden - Passen Stereomikroskop 250x Vergrößerungoder mehr und finden Rand des RPE Blatt in der Nähe des Sehnervs entlang der Schnittlinie von Iris Schere gemacht.
- Mit zwei Zangen separaten RPE-Bruch-Membran von der Aderhaut Gewebeschicht. Sie kann verlangen, ein paar Versuche, entlang der Kante, wo die Verbindung von RPE und Aderhaut am schwächsten ist zu finden.
- Legen Sie RPE Blatt in kaltes Trypsin-EDTA-Lösung in 15 ml-Röhrchen
- Nach dem RPE, Kappe und Transfer Rohre mit Gewebe in Trypsin-EDTA in Wasserbad für 10-15min gesammelt werden, bei 37 ° C.
- Nach 10 min Inkubation, kräftig schütteln 15 ml Röhrchen RPE in kleinen Gruppen zu trennen. Wenn die Trennung nicht vollständig ist, statt Röhren wieder in Wasserbad für weitere 5 Minuten.
- Überprüfen Sie die Rohre für möglich un-gelösten gemischt Zellhaufen. Jeder beobachtet Clustern sollten entfernt mit feinen Spitzen Glas Pasteurpipette werden.
- Spin down (1,4 Umdrehungen pro Minute auf klinischen Zentrifuge für 4 min) hfRPE Zellen zu entfernen Überstand und resuspendieren Zellen in 15% RPE Medien (9 mL insgesamt)
- Legen Sie 3 ml Zellsuspension in Primaria Flaschen 2 mL frisches 15% RPE Medien, statt Kolben in Inkubator bis zum nächsten Tag (37 ° C, 5% CO 2)
5. Repräsentative Ergebnisse
Funktionelle Validierung von hfRPE Zellkultur
In früheren Experimenten haben wir diese primären Kulturen verwendet, um den Ausdruck, Polarisation und Funktion der Plasmamembran Transportproteine ermitteln und die spezifische Signalwege, die RPE-Funktion zu regulieren 1-11 Diese Eigenschaften, wie sie gesammelt sind, stellen eine Validierung von Eigenschaften, die angewendet werden können zu jeder Zelle Generation. Die Experimente im Folgenden zusammengefasst identifizieren die Proteine, die transepithelialen Transport von Flüssigkeiten und die Integrität des parazellulären Weg zu bestimmen. Diese in-vitro-Experimente wurden in einem Tiermodell der Netzhaut wieder Wiederbefestigung 6 wurde bestätigt.
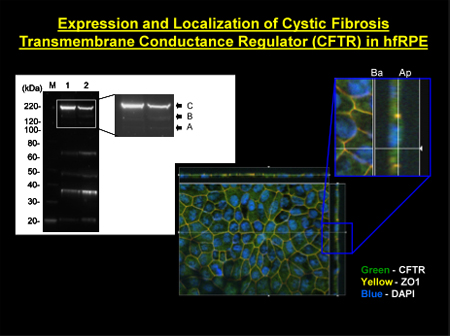
Abbildung 2. Lokalisierung von CFTR in hfRPE Zellen Left oberen Platte:. CFTR wurde in hfRPE Zellen mit Membran-angereicherten Extrakten nachgewiesen. M, Molekulargewichtsmarker, Spur 1, große reifen (Band C) und unreife (Bänder A und B) Center unten: Immunfluoreszenz Lokalisation von CFTR (grünes Etikett) Top rechte Tafel: vergrößerte Querschnittsansicht durch die z-Ebene zeigen.. Maximum-Intensitäts-Projektion durch die z-Achse. ZO-1 (gekennzeichnet als rot) dient als Tight Junction-Marker Abgrenzung apikalen und basolateralen Seiten des RPE. DAPI (blau) beschriftet die Kerne in der Nähe der Basalmembran. ZO-1 wird als gelb / orange, seit seiner roten Etikett Überschneidungen grüne Fluoreszenz von CFTR.
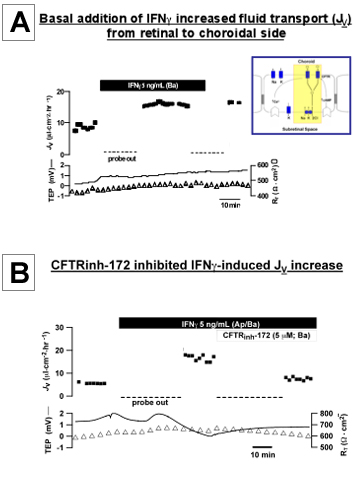
Abbildung 3. IFNy-induzierten physiologischen Veränderungen in hfRPE A:. Zugabe von IFN &ggr; auf die basale Bad erhöhten transepithelialen Transport von Flüssigkeiten (J v) über Monoschicht von primären, kultivierten Zellen hfRPE J v als Funktion der Zeit in der oberen Kurve und Netto-Flüssigkeit aufgetragen. Absorption (apikal basal Bad) ist durch positive Werte angegeben; transepithelialen Potenzial (TEP) und Gesamt-Widerstand des Gewebes (R T) als Funktion der Zeit in der unteren Spuren gezeichnet. B: Zugabe von CFTRinh-172 (5 pM), um die basale Bad hemmte die IFNy-stimulierte J v erhöhen.
Unten ist ein Beispiel für Tiermodell Experimente bestätigt hfRPE in vitro-Befunde. In diesem Experiment wurde künstlich geschaffen Netzhautablösung deutlich nach Zugabe von IFNg nach außen Augenoberfläche (Abbildung 4 A, B) reduziert. Dieser Effekt kann teilweise durch blockiert werden: (1) Zugabe von cAMP-Blocker (Abbildung 4D), (2) vollständig nach Zugabe von JAK + cAMP-Blocker blockiert. Bilder unten sind unter Verwendung Oktober Scanner.

Abbildung 4. In vivo Netzhautablösung Experimente. Die Verfahren für diese in vivo Experimente wurden bereits im Detail 6 beschrieben. In diesen Experimenten wurden Netzhautablösungen in Ratte Auge durch Injektion von 0,5-3 ul modifizierter PBS-Lösung in den subretinalen Raum (SRS), allein oder mit einer Kombination von JAK-STAT-und PKA-Inhibitoren geschaffen. Jedes Experiment hatte eine erste Kontrolle Zeitraum von 40-70 min nach der Erstellung der Netzhautablösung. Während dieser Zeit war die Änderungsrate der Blase Volumen gemessen, um bleb Stabilität zu gewährleisten. Optische Kohärenz Tomographie (Institut für Angewandte Physik der Russischen Akademie der Wissenschaften, Nischni Nowgorod, Russland) wurde verwendet, um den zeitlichen Verlauf der Änderung der Lautstärke in SRS messen.
Der zeitliche Verlauf der re-attachment volume Änderung wurde durch die optische Kohärenztomographie (OCT) gemessen. OCT-Bilder aus 4 verschiedenen Experimenten (Platten auf der linken Seite; AD), dass eine Veränderung in Ablösung Größen zeigen (Pfeile in A, B und D) nach der Zugabe von IFN &ggr; an der vorderen Fläche für 40-70 min. Die Abbildungen A und B zeigen, dass IFNy Jv erhöhte sich von seiner Kontrolle Rate (≈ 2 ul • cm 2 • h -1), um 14 und 12 ul • cm 2 • h-1 bzw.. Nach Zugabe von JAK-STAT Signalweg und PKA-Inhibitoren (C und D), die IFNy - induzierte Absorption lagen deutlich auf 0,2 und 7,9 reduziert ul • cm 2 • h-1 bzw.. Die Pfeile zeigen die Grenze der Blase zum Vergleich mit dem Bereich innerhalb der gestrichelten Linie umgeben, (ab Band). Rechten Seite von Abbildung: top panel-Zusammenfassung der gemessenen Jv Raten von mehreren Experimenten, Mitteltafel-Film ( hier klicken ); unteren Panel-3D Abschnitte des Experiments in B. Pseudofarben in blau zusammengefasst zeigt die räumliche Ausdehnung der Ablösung zum Zeitpunkt t = 0 und 40 min nach der Zugabe von INFγ.
Alle Tierexperimente wurden in Übereinstimmung mit der Association for Research in Vision and Ophthalmology Aussage durchgeführt. Das Protokoll wurde von der Animal Care und Verwenden des Ausschusses der National Institutes of Health zugelassen.
Diskussion
In den vorliegenden Experimenten beschreiben wir zusätzliche Änderungen unserer bereits veröffentlichten Techniken 3 ausgelegt, mehrere Schritte notwendig, um konsistente hfRPE primären Kulturen mit einer höheren Anzahl von verfügbaren Zellen pro Auge produzieren zu rationalisieren. Jede Änderung in der ursprünglichen Verfahren wurde rigoros in mehreren Physiologie und Molekularbiologie Experimenten getestet, um sicherzustellen, dass die Änderungen nicht vorstellen Artefakte und wird ständig von vielen anderen Labors die Verwendung dieser Zellen getestet. Schließlich wurden weitere Experimente die In-vitro-Ergebnisse auf ähnliche Störungen vergleichen in Tiermodellen durchgeführt.
Offenlegungen
Danksagungen
Wir danken Lab Mitglieder Jeffrey Adijanto, Tina Banzon, Rong Li, Qin Wan, Congxiao Zhang, Jing Zhao, Connie Zhi, Awais Zia, Natalia Strunnikova um Hilfe bei der Charakterisierung dieser Zellkulturen. Besonderer Dank geht an Jing Zhao, Connie Zhi und Tina Banzon für ihre Hilfe bei der Aufrechterhaltung große Bestände von Zellkulturen.
Diese Arbeit wurde von den National Institutes of Health Intramural Research Program unterstützt.
Materialien
Instruments benötigt für die Präparation Protokoll
- Stereo-Mikroskop - jeder mit arbeiten Vergrößerung x250 für die Präparation benötigt
- Dissecting Gericht - zB Kimble 100 x 20 mm # 23062 (eine pro-Dissektion) jeder beliebigen Quelle
- Sylgard 184 - WPI Cat. # SYLG184 *
* Zur Vorbereitung Sezieren Gericht folgen Sylgard 184 enthalten Mischanleitung, pour gemischte Flüssigkeit Elastomer in Petrischale bis 5-8mm bilden. Lassen Elastomer für mindestens 24 Stunden aushärten. Dish mit ausgehärteten Elastomeren kann sterilisiert mit 70% Ethanol und wieder verwendet werden können (~ 100 mal) - 27 G Nadeln von BD PrecissionGlide 1 ¼ Länge (5 pro Sektion) einer beliebigen Quelle
- HBSS 1X Lösung mit Ca und Mg-Salze - GIBCO Cat # 14025 500ml (gut für mehrere Sektionen).
- Iris Schere Hartmetall Wellenschliff, gebogen - FST Cat # 14559-11 (eins).
- Retinal Schere - Katena Cat # K4-5300 (eins).
- Pinzetten - z. B. Dumont Pinzette # 5 mit polierten Tipps von WPI Cat # 500085 (2 Stück).
- Sideport Messer - Alcon, Clearcut 1mm, Dual Bevel, abgewinkelt Cat # 8065921540.
- Zentrifugenröhrchen 15ml - (einer pro Auge) einer beliebigen Quelle
- Pasteur Glaspipette - (einer pro-Dissektion) jeder beliebigen Quelle
- Die Platte 12 auch (einer pro-Dissektion) jeder beliebigen Quelle
- Primaria 25cm 2-Kolben - (2-3 pro Auge) einer beliebigen Quelle
Referenzen
- Bharti, K., Miller, S. S., Arnheiter, H. The new paradigm: Retinal pigment epithelium cells generated from embryonic stem cells or induced pluripotent cells. Pigment Cell & Melanoma Research. , .
- Strunnikova, N. V., Maminishkis, A., Barb, J. J., Wang, F., Zhi, C., Sergeev, Y., Chen, W., Edwards, A. O., Stambolian, D., Abecasis, G., Swaroop, A., Munson, P. J., Miller, S. S., S, S. Transcriptome analysis and molecular signature of human retinal pigment epithelium. Hum Mol Genet. 19 (12), 2468-2486 (2010).
- Miller, S. S., Maminishkis, A., Li, R., Adijanto, J. Chapter 184: Phototransduction: RPE transport Retina Phototransduction: RPE transport. Encyclopedia of the Eye. , 2540-2540 (2010).
- Bryant, D. M., Mostov, K. E. From cells to organs: Building polarized tissue. Nature Reviews. Molecular Cell Biology. 9 (11), 887-901 (2008).
- Maminishkis, A., Chen, S., Jalickee, S., Banzon, T., Shi, G., Wang, F. E., Ehalt, T., Hammer, J. A., Miller, S. S. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47, 3612-3624 (2006).
- Shi, G., Maminishkis, A., Banzon, T., Jalickee, S., Li, R., Hammer, J., Miller, S. S. Control of chemokine gradients by the retinal pigment epithelium. Invest Ophthalmol Vis Sci. 49, 4620-4630 (2008).
- Economopoulou, M., Hammer, J., Wang, F. E., Fariss, R., Maminishkis, A., Miller, S. S. Expression, localization, and function of junctional adhesion molecule-C (JAM-C) in human retinal pigment epithelium. Invest Ophthalmol Vis Sci. 50 (3), 1454-1463 (2008).
- Li, R., Maminishkis, A., Banzon, T., Wan, Q., Jalickee, S., Chen, S., Miller, S. S. IFN{gamma} Regulates Retinal Pigment Epithelial Fluid Transport. Am J Physiol Cell Physiol. 297, C1452-C1465 (2009).
- Li, R., Maminishkis, A., Wang, F. E., Miller, S. S. PDGF-C and -D induced proliferation/migration of human RPE is abolished by inflammatory cytokines. Invest Ophthalmol Vis Sci. 48, 5722-5732 (2007).
- Maminishkis, A., Jalickee, S., Blaug, S. A., Rymer, J., Yerxa, B. R., Peterson, W. M., Miller, S. S. The P2Y(2) receptor agonist INS37217 stimulates RPE fluid transport in vitro and retinal reattachment in rat. Invest Ophthalmol Vis Sci. 43, 3555-3566 (2002).
- Wang, F. E., Zhang, C., Maminishkis, A., Dong, L., Zhi, C., Li, R., Zhao, J., Majerciak, V., Gaur, A. B., Chen, S. MicroRNA-204/211 alters epithelial physiology. FASEB J. 24, (2010).
- Adijanto, J., Banzon, T., Jalickee, S., Wang, N. S., Miller, S. S. CO2-induced ion and fluid transport in human retinal pigment epithelium. J Gen Physiol. 133, 603-622 (2009).
- Li, R., Maminishkis, A., Zahn, G., Vossmeyer, D., Miller, S. S. Integrin alpha5beta1 mediates attachment, migration, and proliferation in human retinal pigment epithelium: relevance for proliferative retinal disease. Invest Ophthalmol Vis Sci. 50, 5988-5996 (2009).
- Peterson, W. M., Meggyesy, C., Yu, K., Miller, S. S. Extracellular ATP activates calcium signaling, ion, and fluid transport in retinal pigment epithelium. J Neurosci. 17, 2324-2337 (1997).
- Voloboueva, L. A., Liu, J., Suh, J. H., Ames, B. N., Miller, S. S. R)-alpha-lipoic acid protects retinal pigment epithelial cells from oxidative damage. Invest Ophthalmol Vis Sci. 46, 4302-4310 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten