Method Article
網膜色素上皮生理学と病態の研究のための実験的モデル
要約
我々は、形態学、生理学、極性、および成人のネイティブ組織の蛋白質と遺伝子の発現パターンを示すことを人間の胎児の網膜色素上皮細胞(hfRPE)細胞の培養コンフルエントな単層のための再現可能な方法を提供する。この作品は、いくつかの眼疾患の動物モデルに拡張されています。
要約
我々は、天然のヒトRPEの形態学的、生理学的および遺伝的特性を持つ主なヒト胎児網膜色素上皮(hfRPE)文化のコンフルエントな単層を大量に作り出すことができる細胞培養の手順を開発しました。これらhfRPE細胞培養は、大量の色素沈着を示し、電子顕微鏡では、豊富な頂端膜の微絨毛を示す。接合部複合体は、様々なタイトジャンクションタンパク質の免疫蛍光ラベリングと同定された。これらを簡単に再現可能な初代培養の上皮極性と機能は密接に以前にヒトを含むネイティブRPEの哺乳動物モデルを、研究に似ています。これらの結果は、人間の眼疾患のいくつかの動物モデルにおける治療的介入の開発によって拡張されました。我々は、網膜や網膜下腔の異常な体液の蓄積を除去するための戦略に焦点を当てている。細胞外網膜下腔は、感光体の外側のセグメントとRPEの頂端側細胞膜を分離し、網膜添付ファイルのメンテナンスとRPE /網膜の相互作用の全体をホストするための非常に重要です。
プロトコル
1。人間の胎児の組織
すべての人間の組織に関連する研究はヘルシンキ宣言およびNIHの機関審査委員会の教義に従っています。胎児の目は氷の上にパックされたチューブを(ABRによって提供される)を含むRPMI - 1640培地に置かれた妊娠16〜22週でのランダムドナー、、から、独立した売春斡旋人、高度なバイオ資源(ABR、アラメダ、カリフォルニア州)によって得られる、とされています一晩優先配信サービスによって配信。組織は摘出後に実行可能な最大48時間のまま。
2。細胞培養培地
MEM -α改変培地(Sigma - Aldrich)を5%及びRPE細胞の培養は15%血清含有培地(下記の表1 RPE培地)を調製するための基本培地として使用されます。
| の名前 | シグマ | ギブコ | 量は | ストレージ |
| MEM、アルファ修正 | M - 4526 | 500 mLの | +4 ° C | |
| N1サプリメント | N - 6530 | 5 mLの | +4 ° C | |
| ペニシリン - ストレプトマイシン | 15140-148 | 5 mLの | -20 ° C | |
| グルタミン - I | 35050 | 5 mLの | -20 ° C | |
| 非必須アミノ酸 | M - 7145 | 5 mLの | +4 ° C | |
| THT * | -80 ° C | |||
| タウリン | T - 0625 | 125 mgの | ||
| ヒドロコルチゾン | H - 0396 10 | 10μgの | ||
| トリヨードthyronin | T - 5516 | 0.0065μgの | ||
| ウシ胎児血清** | 5パーセントまたは15% | -80℃の |
表1。 500mLの培地の調製のためのヒト胎児RPEの培地成分
* THTは、培地を作る前に1 1.5 mLのPBSでタウリン-ヒドロコルチゾン - トリヨードthyroninを溶解することによって行われます。複数のアリコートを-80℃で作られ、保存されています° Cで培養液の培養の準備を簡素化する。
**ウシ胎児血清はSigma - Aldrichまたはギブコから入手されていません。
メディアの準備のために使用されるウシ胎児血清は、アトランタバイオ(ノークロス、ジョージア州)から取得されます。血清の各ボトルは、使用する前に(56℃1時間のための)不活化熱です。彼らはメディアの製造のために使用されるまで、同一ロットからの血清の細胞培養の一貫性、大量性を確保するために購入し、-20℃で保存されています。別のロットから20%FBSを含む培地で数週間のためにウェルプレート - または12 - hfRPE細胞の特定のバッチからまばらに播種された細胞を24で栽培されています。最も古典的なRPEの形態(敷石)と最も急速に成長してmelanated細胞は細胞培養に使用できる適切な血清ロットを示している。
細胞培養の培地にも含まれています:N1サプリメント(Sigma - Aldrich)を1:100 mLの/ mLの、グルタミン/ペニシリン - ストレプトマイシン1:100 mLの/ mLの(Gibco社)、および非必須アミノ酸溶液(Sigma - Aldrich)を1:100 mLの/をmLの。加えて、ヒドロコルチゾン(20μg/ Lの)、タウリン(250 mg / L)を、とトリヨード- thyronin(0.013μg/ Lの)(THT)は1:500の最終濃度になるようにPBSでこれらの3つのコンポーネントを溶解することによって先に用意されています(ml / ml)と。 RPE培地に添加するまで、THTのアリコートを80℃で保存されています。
3。細胞の文化
3〜5分(下記の図1)のプラスゲンタマイシン(1 mg / mLの)領収書に、無傷の地球儀は(Invitrogen社;カタログ番号15240から096。。10倍に希釈)抗生物質抗真菌剤溶液で洗浄する。 
図1。インキュベーションの抗生物質は、HBSSまたはPBSなどの培地で2回洗い流したされた後。一度に片方の眼の世界は、Sylgard - 184(WPI)でコーティングした10cmペトリ皿に移し、27G針で固定されています。皆伐即したナイフ(アルコン社)を使用して切開は毛様体(前面に目の赤道からの距離の1 / 3)以下の強膜を介して行われます。この切開は、前眼部を除去するための円形のカットを開始するために使用されます。このカットは、1つのブレード鋸歯状(FST)とタングステンカーバイドコーティングされた湾曲した虹彩のはさみを使って行われます。眼の前部分の除去に先立って、カットは、rを切り離す避けるために硝子体を介して行われる後極でのRPEからetina。 (。。2 U / mLの、カタログ番号04942086001、ロシュダイアグノスティックス、インディアナポリス、IN)眼の前方部分が除去された後、後極はディスパーゼ- Iの溶液と共にインキュベートされる40〜60分に5%血清を含む培地で37 ° C - 5%CO 2。ディスパーゼ処理後、後部の極は、シリコンのパディングを持つペトリ皿にHBSS(Sylgard 184、ダウコーニング、ミッドランド、MI)に転送され、象限または十分に組織をフラット化してより大きな部分に解剖。その後、網膜は、静かにピンセットで除去する。シングルセルRPE層はシートに剥離し、冷トリプシン- EDTA(ギブコ、#25200〜056)溶液中に直接採取された。 RPEが収集された後、トリプシン- EDTAで組織を持つチューブは37℃10-15分のために水浴中に密封され、転送され、℃のインキュベーションの10分後、チューブを精力的に小さなクラスターにRPEを分離するために振とうする。分離が完了していない場合、チューブは、別の5分間水浴中に戻って配置されます。トリプシン- EDTAのインキュベーション後、試験管を可能な限り非溶解混合細胞クラスターのために検査されます。どんな観測されたクラスターが細かい先端がガラスパスツールピペットを用いて除去される。 (4分のための臨床遠心1.4回転)スピンダウン後、hfRPE細胞は15%のRPEのメディアに再懸濁しているし、Primariaフラスコ(例入れ:カタログ番号08-772-45、フィッシャーサイエンティフィック、ピッツバーグ、ペンシルバニア州。。 )。この培地を、5%血清を含むRPEの培地で1日後に交換され、そしてその後の変更は2〜3日ごとに行われた。 3〜4週間後、細胞がコンフルエントと一様に色素となった。彼らは、15%血清含有RPE細胞培養の培地に再懸濁し、1ウェルあたり150〜200K細胞(トランスウェルで明確な細胞培養インサートに播種、10〜15分間0.25%トリプシン- EDTAでトリプシン処理し、コーニングコースター、 12 mm径のインサートを使用してニューヨーク州コーニング)、、0.4ミクロン孔、ポリエステル膜(例:。。カタログ番号07-200-161、フィッシャーサイエンティフィック)。播種前に、井戸は人間の細胞外マトリックス(。。ウェルあたり150μLHBSS中の10μg、カタログ番号354237、BD Biosciences社、フランクリンレイクス、ニュージャージー州)でコーティングされ、2時間のフードにUV光で硬化。いくつかのケースでは、トリプシン処理の手順は、最初にトリプシン処理した後、デタッチしていない細胞を収集するため、二度目の繰り返された。同じプロトコル(ECMでコーティングを除く)は、細胞のP1の人口を生成するためにフラスコで培養細胞に使用されていました。彼らは≥200Ω•cm 2の総組織の抵抗を持っていて、一様に色素沈着したときに、これらの細胞を実験に使用した。
4。段階的な手順
- 複数の解決策(それぞれの目に対して必要に応じて4ウェル)を12ウェルプレートを準備します。
- 10倍の抗生物質抗真菌ソリューションを追加 - 1も/目
- すすぎのためにPBS / HBSS溶液を追加 - 2井戸/目を
- ディスパーゼのソリューションを追加 - 1も/目を
- 5固定針を開梱し、HBSSで塗りつぶすことにより、ペトリ皿を解剖準備
- アンパック目と3〜5分(ステップ1で調製した)のために抗生物質 - 抗真菌剤溶液中にそれらを置く
- PBS / HBSSで2つの井戸で目を(ステップ1で調製した)洗い流した後、解剖皿に移す。
- トリム過度の筋肉と目の周りの結合組織
- セキュリティで保護された27G針(シリコンベースに突き止める)角膜が上を向く方法でそれらを整列させる解剖皿に目を使う。
- 即したナイフを使用すると、円形のカットが開始される角膜下に切開を加えること
- 使用して虹彩のはさみは、硝子体を切ってと離れて目の前方部分を持ち上げると同じハサミを使って、目の周りに予選通過。
注:ステップ3〜8は眼球への過度の機械的な圧力を避ける。 - ディスパーゼ溶液中に開いている目を移す(ステップ1で調製)
- 37℃で40〜60分のためにアイカップをインキュベート° Cで5%CO 2
- 新鮮なもので皿を解剖にHBSS溶液を交換してください。
- ディスパーゼ溶液から解剖皿に目を移す。
- 位置は、ペトリ皿の眼(眼球のコップが上を向く)と2つの27G針で固定します。
- 静かに部分的に分離された網膜を持ち上げ、網膜ハサミを使用すると、視神経から網膜をカット。網膜を捨てる。
- アイリスのはさみを使用すると、視神経に向かって眼の周囲から一切開を行います。
- 5つすべての27G注射針を使用すると、きれいに伸ばして目を作るRPE層を平坦化。
- 網膜はさみを使用すると、添付ファイルから視神経にRPE層を分離する視神経の周りに円形のカットを行います。
注:ステップ13から17は、低倍率でまたはステレオ顕微鏡なしで行うことができます。 - 250倍の倍率の実体顕微鏡を調整します。以上と虹彩ハサミによるカットに沿って視神経に近いRPEシートのエッジを見つける。
- two鉗子脈絡膜組織層とは別のRPE -ブルッフの膜を使用する。それは、RPEと脈絡膜の接続が最も弱いものであるエッジに沿った領域を見つけるためにいくつかの試みが必要になる場合があります。
- 15 mLの試験管に冷トリプシン- EDTA溶液にRPEのシートを置きます
- RPEの後に37℃で10 15分のために水浴中にトリプシン- EDTAの組織で、キャップと熱管を集めている℃を
- インキュベーションの10分後、精力的に小さなクラスターにRPEを分離するために15 mLの試験管を振る。分離が完了していない場合、別の5分間水浴に戻しチューブを置きます。
- 可能な非溶解混合細胞クラスターのためのチューブを点検します。どんな観測されたクラスターが細かい先端がガラスパスツールピペットを用いて削除する必要があります。
- (4分のための臨床遠心1.4回転)hfRPE細胞をスピンダウン、15%RPEメディア(9 mLの合計)で上清を除去し、再サスペンド細胞
- Primariaフラスコに細胞懸濁液3 mLを入れて次の日まで、新鮮な15%のRPEのメディア、インキュベーターに場所のフラスコの2 mLを加える(37℃、5%CO 2)
5。代表的な結果
hfRPE細胞培養の機能検証
以前の実験では、細胞膜輸送タンパク質の発現、偏光と機能を決定し、それらが適用されるプロパティセットの検証を提供蓄積されるとRPEの機能を1月11日これらの特性を制御する特定のシグナル伝達経路を同定するためにこれらの一次培養を使用している各セルの世代へ。実験では、上皮流体の輸送と細胞間隙経路の完全性を決定するタンパク質を同定以下にまとめる。 in vitroの実験で 、これらは、網膜再再付着6の動物モデルで検証されています。
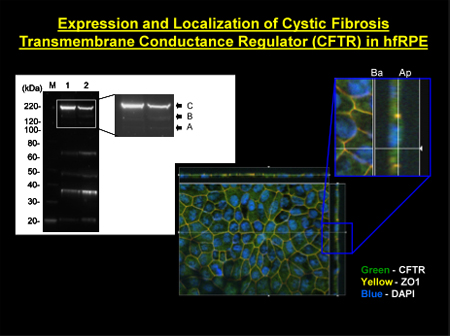
図2。 hfRPE細胞におけるCFTRの局在 左上部パネル:。CFTRが膜濃縮エキスを使用してhfRPE細胞で検出された。 M、分子量マーカー、 レーン1、センター下部パネルの主要な成熟(バンドC)と未熟な(とBバンド):CFTRの免疫局在(緑ラベル) 右上のパネル:表示のz平面を介して拡大断面図。。 z軸を介して最大強度投影。 ZO - 1は、(赤のラベル)RPE細胞の先端および側底側面の輪郭を描くタイトジャンクションのマーカーとして機能します。 DAPI(青)は原子核に近い基底膜にあるラベルを付けます。 ZO - 1は、その赤いラベルと重なるCFTRから緑色蛍光以来、のような黄色/オレンジ色が表示されます。
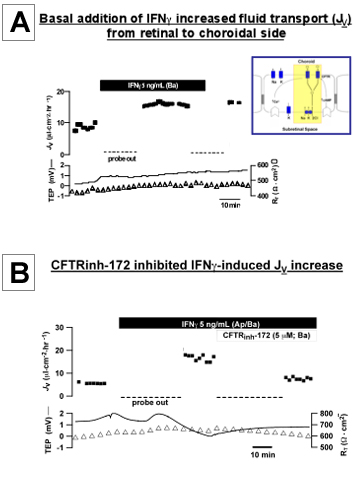
図3。 hfRPEにおけるIFNγによって誘導される生理的変化:。基底風呂にIFNγを追加するには、プライマリ、培養hfRPE細胞の単層を介して上皮流体の輸送(J V)を増加J vは上のトレースに時間の関数と純流体としてプロットされます。吸収(基底槽に心尖部)が正の値で示されます。経上皮電位(TEP)との合計組織の抵抗は、(R、T)ボトムトレースに時間の関数としてプロットされています。 B:基底槽へCFTRinh - 172(5μM)の添加によりIFNγ刺激によるJ Vの増加を抑制した。
下記のin vitroでの調査結果で hfRPEを確認する動物モデル実験の例です。この実験では、人工的に作成された網膜剥離が著しく(図4、B)外部の眼の表面にIFNgを添加した後に減少した。この効果は、部分的にによってブロックすることができます:cAMPのブロッカー(図4D)の(1)に加え、(2)完全にJAK + cAMPのブロッカーの添加後にブロック。以下の画像は、OCTのスキャナを使用して取得されます。

図4。 生体網膜剥離の実験では。vivo実験で 、これらの手順は、以前に詳細6に記載されている。これらの実験では、網膜剥離は、単独でまたはJAK - STATおよびPKA経路の阻害剤の組み合わせと、網膜下腔(SRS)に変更されたPBS溶液の0.5から3μLの注入によるラットの眼で作成されていました。各実験は、網膜剥離の作成後に40〜70分の初期制御周期を持っていた。この時間の間に、ブレブ体積の変化率は、ブレブ安定性を確保するために測定した。光コヒーレンストモグラフィイメージングは(応用物理学研究所、ロシア科学アカデミー、ニージニーノブゴロド、ロシア)SRSの体積変化の時間経過を測定するために使用されていました。
再付着巻の時間的経過UMEの変更は、光コヒーレンストモグラフィ(OCT)により測定した。 40〜70分間前面にIFNγを添加した後剥離の大きさの変化(A、B、およびDの矢印)を示し、4種類の実験(AD左側のパネル)からOCTは、画像。 IFNγは、そのコントロール率(≈2μlの•cm 2で •時間-1)〜14日に合弁会社を増加し、それぞれ12μL•cm 2と •HR - 1、ていることとBのパネルが展示。 JAK - STAT経路とPKA阻害剤(CとD)、IFNγの添加後-誘起吸収率が有意に0.2と7.9に減少したμL•cm 2と •HR - 1、それぞれ。矢印は、破線で囲まれた領域、(開始量)との比較のためにブレブの境界を示している。図の右側に:いくつかの実験から測定されたJV率のトップパネルの要約、(パネル-映画真ん中はここをクリック )、青でBの擬似カラーでまとめた実験の下部パネル- 3Dのセクションでは、t = 0で剥離の空間的な範囲を示し、 INFγの添加後40分。
全ての動物実験は、ビジョンと眼科文の研究のための協会に準拠して実施された。プロトコルは、国立衛生研究所の動物実験委員会によって承認された。
ディスカッション
本実験では、我々は目ごとに使用可能な細胞の高い数字と一致してhfRPE初代培養を生産するために必要な複数の手順を合理化するために設計された私たちの以前に発行されたtechniques 3の追加の変更を説明します。元のプロシージャ内の各変更は、厳密に変更がアーチファクトを導入せず、継続的にこれらの細胞を使って多くの他のラボでテストされていることを保証する複数の生理学と分子生物学の実験において試験した。最後に、追加の実験が動物モデルで同様の摂動をin vitroでの結果を比較するために実施した。
開示事項
謝辞
我々は、これらの細胞培養を特徴づけるの助けのためのラボはメンバージェフリーAdijanto、ティナBanzon、容里、秦ワン、Congxiao張静趙、コニー志、Awaisジア、ナタリアStrunnikovaに感謝。細胞培養の大型株を維持する上で彼らの助けのための静趙、コニー志、そしてティナBanzonに感謝。
この作品は、健康学内研究プログラムの国立研究所によってサポートされていました。
資料
解剖のプロトコルに必要な計測器
- ステレオ顕微鏡 - 解剖に必要な作業倍率X250で利用可能な任意の
- 解剖皿 - などキンブル100 × 20ミリメートル#23062(郭ごとに)任意のソース
- Sylgard 184 - WPI猫。 #SYLG184 *
*料理がSylgard 184はミキシングの指示に含まれる従っ解剖準備するには、5〜8ミリメートルの層を形成するために、ペトリ皿に混合液エラストマーを注ぐ。エラストマーは、少なくとも24時間のために治すことができます。硬化エラストマーと料理を70%エタノールおよび再利用を複数回(〜100倍)を使用して滅菌することができる - BD PrecissionGlide 1から27 Gの針¼の長さ(解剖あたり5)任意のソース
- CaおよびMgの塩を含有するHBSS 1Xソリューション - GIBCOカタログ番号14025 500ミリリットル(複数の解剖のための良い)。
- アイリスはさみ炭化物鋸歯状刃、曲面 - FST猫#14559から11(一)。
- 網膜はさみ - Katena猫#K4 - 5300(いずれか)。
- 鉗子 - などデュモンピンセット#5 WPIの猫から洗練されたヒントと#500085(2個)。
- 即したナイフ - アルコン、皆伐さ1mm、重ベベル、傾斜カタログ番号8065921540。
- チューブの15ミリリットルを遠心 - (眼ごとに)任意のソース
- パスツールガラスピペット - (郭ごとに)任意のソース
- ウェルプレート12(郭ごとに)任意のソース
- Primaria 25センチメートル2フラスコ- (眼あたり2-3)任意のソース
参考文献
- Bharti, K., Miller, S. S., Arnheiter, H. The new paradigm: Retinal pigment epithelium cells generated from embryonic stem cells or induced pluripotent cells. Pigment Cell & Melanoma Research. , .
- Strunnikova, N. V., Maminishkis, A., Barb, J. J., Wang, F., Zhi, C., Sergeev, Y., Chen, W., Edwards, A. O., Stambolian, D., Abecasis, G., Swaroop, A., Munson, P. J., Miller, S. S., S, S. Transcriptome analysis and molecular signature of human retinal pigment epithelium. Hum Mol Genet. 19 (12), 2468-2486 (2010).
- Miller, S. S., Maminishkis, A., Li, R., Adijanto, J. Chapter 184: Phototransduction: RPE transport Retina Phototransduction: RPE transport. Encyclopedia of the Eye. , 2540-2540 (2010).
- Bryant, D. M., Mostov, K. E. From cells to organs: Building polarized tissue. Nature Reviews. Molecular Cell Biology. 9 (11), 887-901 (2008).
- Maminishkis, A., Chen, S., Jalickee, S., Banzon, T., Shi, G., Wang, F. E., Ehalt, T., Hammer, J. A., Miller, S. S. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47, 3612-3624 (2006).
- Shi, G., Maminishkis, A., Banzon, T., Jalickee, S., Li, R., Hammer, J., Miller, S. S. Control of chemokine gradients by the retinal pigment epithelium. Invest Ophthalmol Vis Sci. 49, 4620-4630 (2008).
- Economopoulou, M., Hammer, J., Wang, F. E., Fariss, R., Maminishkis, A., Miller, S. S. Expression, localization, and function of junctional adhesion molecule-C (JAM-C) in human retinal pigment epithelium. Invest Ophthalmol Vis Sci. 50 (3), 1454-1463 (2008).
- Li, R., Maminishkis, A., Banzon, T., Wan, Q., Jalickee, S., Chen, S., Miller, S. S. IFN{gamma} Regulates Retinal Pigment Epithelial Fluid Transport. Am J Physiol Cell Physiol. 297, C1452-C1465 (2009).
- Li, R., Maminishkis, A., Wang, F. E., Miller, S. S. PDGF-C and -D induced proliferation/migration of human RPE is abolished by inflammatory cytokines. Invest Ophthalmol Vis Sci. 48, 5722-5732 (2007).
- Maminishkis, A., Jalickee, S., Blaug, S. A., Rymer, J., Yerxa, B. R., Peterson, W. M., Miller, S. S. The P2Y(2) receptor agonist INS37217 stimulates RPE fluid transport in vitro and retinal reattachment in rat. Invest Ophthalmol Vis Sci. 43, 3555-3566 (2002).
- Wang, F. E., Zhang, C., Maminishkis, A., Dong, L., Zhi, C., Li, R., Zhao, J., Majerciak, V., Gaur, A. B., Chen, S. MicroRNA-204/211 alters epithelial physiology. FASEB J. 24, (2010).
- Adijanto, J., Banzon, T., Jalickee, S., Wang, N. S., Miller, S. S. CO2-induced ion and fluid transport in human retinal pigment epithelium. J Gen Physiol. 133, 603-622 (2009).
- Li, R., Maminishkis, A., Zahn, G., Vossmeyer, D., Miller, S. S. Integrin alpha5beta1 mediates attachment, migration, and proliferation in human retinal pigment epithelium: relevance for proliferative retinal disease. Invest Ophthalmol Vis Sci. 50, 5988-5996 (2009).
- Peterson, W. M., Meggyesy, C., Yu, K., Miller, S. S. Extracellular ATP activates calcium signaling, ion, and fluid transport in retinal pigment epithelium. J Neurosci. 17, 2324-2337 (1997).
- Voloboueva, L. A., Liu, J., Suh, J. H., Ames, B. N., Miller, S. S. R)-alpha-lipoic acid protects retinal pigment epithelial cells from oxidative damage. Invest Ophthalmol Vis Sci. 46, 4302-4310 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved