Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Visão Geral
Fonte: Thomas Chaffee1, Thomas S. Griffith2,3,4, e Kathryn L. Schwertfeger1,3,4
1 Departamento de Medicina de Laboratório e Patologia, Universidade de Minnesota, Minneapolis, MN 55455
2 Departamento de Urologia, Universidade de Minnesota, Minneapolis, MN 55455
3 Centro de Câncer Maçônico, Universidade de Minnesota, Minneapolis, MN 55455
4 Center for Imunology, University of Minnesota, Minneapolis, MN 55455
Análises patológicas de seções teciduais podem ser utilizadas para obter uma melhor compreensão da estrutura tecidual normal e contribuir para a compreensão dos mecanismos da doença. Biópsias teciduais, seja de pacientes ou de modelos in vivo experimentais, são frequentemente preservadas por fixação em formalina ou paraformaldeído e incorporação em cera de parafina. Isso permite que o armazenamento a longo prazo e os tecidos sejam seccionados. Os tecidos são cortados em seções finas (5 μm) usando um microtome e as seções são aderidas a lâminas de vidro. As seções teciduais podem ser manchadas com anticorpos, que permitem a detecção de proteínas específicas dentro das seções teciduais. A coloração com anticorpos conjugados a fluoroforos (também conhecidos como fluorochromes) - compostos que emitem luz em comprimentos de onda específicos quando excitados por um laser - é conhecida como imunofluorescência. A capacidade de detectar proteínas dentro de uma seção pode fornecer informações como heterogeneidade do tipo celular dentro do tecido, ativação de vias específicas de sinalização e expressão de biomarcadores. Dependendo dos fluoroforos utilizados e do tipo de microscópio disponível para análise, podem ser utilizadas múltiplas cores, o que permite a análise multiplexada dos alvos.
O protocolo a seguir descreve as etapas básicas envolvidas na coloração da imunofluorescência das seções de tecido incorporado parafina. É importante notar que este protocolo não incluirá detalhes sobre a fixação de tecido, processo de incorporação de parafina ou secção dos tecidos. Uma vez que os tecidos são seccionados e colocados em lâminas de vidro, eles são reidratados através de uma série de incubações de etanol classificado (EtOH). As seções são incubadas com um reagente bloqueador para reduzir a ligação não específica de anticorpos à seção tecidual. As seções são então incubadas com um anticorpo primário que pode ou não ser rotulado diretamente com um fluoróforo. Se o anticorpo primário não for rotulado diretamente, as seções são então incubadas com um anticorpo secundário rotulado com um fluoróforo. Diferentes anticorpos podem exigir diferentes condições de coloração, assim estão incluídas sugestões de otimização de anticorpos. Após a lavagem para remover todos os anticorpos desvinculados, os slides são montados com mídia contendo DAPI para rotular fluorescentemente o núcleo. Uma vez que a mídia de montagem secou, os slides podem ser imagens usando um microscópio com lasers que podem detectar os diferentes fluoroforos.
Procedimento
1. Configuração
- O protocolo de coloração típico envolve as seguintes etapas:
- Re-hidratando as seções teciduais nas lâminas usando uma série de etanols classificados.
- Incubando as seções teciduais com um tampão de bloqueio, o que ajudará a bloquear a ligação não específica de anticorpos ao tecido e reduzir a fluorescência de fundo.
- Removendo o tampão de bloqueio e incubando a seção em anticorpos primários, momento em que o anticorpo ligará seu alvo peptídeo.
- Removendo o anticorpo primário e lavando extensivamente as seções em tampão de lavagem.
- Incubando as seções com anticorpos secundários para permitir a vinculação ao anticorpo primário, se o anticorpo primário não for diretamente rotulado com um fluoróforo e um anticorpo secundário for necessário.
- Lavando o anticorpo secundário dos slides.
- Montar os slides em meios de montagem e permitir que eles sequem antes da visualização em um microscópio fluorescente.
- São necessários os seguintes itens: porta-slides (vidro ou plástico), frascos, pipetas, caneta pap, câmara úmida, deslizamentos de tampa e mídia de montagem com DAPI.
- Xileno é usado para a reidratação de slides. O xileno é perigoso e deve ser usado em um capuz de fumaça, juntamente com EPI apropriado, incluindo luvas e um jaleco.
- Receitas para buffers, soluções e reagentes
-
Etanols classificados
Etanol - 160 mL 200 prova EtOH e 40mL ddH2O
Etanol - 140 mL 200 prova EtOH e 60mL ddH2O -
Solução de recuperação de antígenos
Citrato de sódio de 10 mM, pH 6.0 -
Tampão de bloqueio
100 μL Soro de animal hospedeiro do qual o anticorpo secundário foi feito
900 μL 1X PBS
Nota: Este é o volume de 10 seções; ajustar o volume para cerca de 100 μL tampão por seção, conforme necessário. - Tampão de lavagem (1X PBS)
-
Etanols classificados
2. Protocolo
- Reidratação com xileno e etanol
- Coloque slides em um suporte de slides e, em seguida, submere os slides na solução de isômeros 100% xileno, garantindo que os slides estejam totalmente cobertos com solução.
- Incubar lâminas nos isômeros de 100% xileno por 3 min. Repita duas vezes para um total de 3 incubações separadas. Certifique-se de limpar o rack de slides com uma toalha de papel antes de transferir para uma nova solução para minimizar a contaminação.
Nota: Recomenda-se que essas incubações sejam realizadas em três recipientes separados. - Incubar slides em 100% EtOH por 2 min. Repita duas vezes para um total de 3 incubações separadas.
Nota: Recomenda-se que essas incubações sejam realizadas em três recipientes separados. - Incubar slides em 95% EtOH por 2 min.
- Incubar slides em 80% EtOH por 2 min.
- Incubar slides em 70% EtOH por 2 min.
- Incubar slides em 1X PBS por 5 min.
- (Opcional) Recuperação de antígenos para epítopos desmascarados reconhecidos pelo anticorpo primário
Nota 1: Este procedimento é altamente dependente do anticorpo utilizado e recomenda-se que sejam realizados procedimentos iniciais de otimização para determinar a exigência de recuperação de antígenos.
Nota 2: Este procedimento não foi realizado com a coloração F4/80 mostrada abaixo. A exigência de recuperação de antígenos deve ser otimizada a cada novo anticorpo.- Coloque slides em um suporte de deslizamento de plástico ou vidro resistente ao calor e certifique-se de que o rack esteja cheio de lâminas para garantir uma distribuição uniforme do calor. Slides em branco podem ser usados se houver menos amostras do que ranhuras no rack.
- Coloque rack em 1000 mL de solução de unmasking de antígeno em béquer 2L - 10 mL antígeno ungindo estoque para 990mL de água.
- Micro-ondas em alta por 20 minutos no total, certifique-se de que os slides permaneçam cobertos com água.
- Resfrie slides por 20 minutos no béquer.
- Lave o rack de slides em suportes de slides contendo ddH2O por 5 min cada. Repita duas vezes para um total de 3 incubações separadas usando ddH2O fresco cada vez. Os slides podem ser lavados no mesmo suporte de lâmina durante cada lavagem.
- Incubar slides em 1X PBS por 5 min.
- Seções circulares com uma caneta pap. Isso permitirá o uso de um volume mínimo de tampões necessários para cobrir as seções teciduais. Não permita que as seções de tecido sequem.
- Adicione o buffer de bloqueio a cada seção. A quantidade de tampão necessária para cobrir a seção varia dependendo do tamanho da seção, mas pode variar de 25-500 μL. Tampão suficiente deve ser usado para formar uma conta que cubra toda a superfície da seção, incluindo as bordas.
Nota: A escolha do tampão de bloqueio pode variar dependendo do anticorpo que está sendo usado. Por exemplo, 10% de soro do animal hospedeiro no qual o anticorpo secundário foi criado pode ser usado para reduzir a ligação não específica do anticorpo secundário (por exemplo, o soro de cabra normal pode ser usado se o anticorpo secundário foi criado em cabra). A otimização do buffer de bloqueio deve ser realizada para cada anticorpo primário. Para colorar seções de tumor mamário com F4/80, foi utilizado 0,1 ml de soro de cabra 10% normal na PBS. - Incubar as seções no bloqueio de tampão em uma câmara umidificada por 1 hora à temperatura ambiente ou 4°C até 24 horas. A câmara umidificada garante que as seções não sequem.
- Remova o tampão de bloqueio drenando-o do slide. Alternativamente, o tampão de bloqueio pode ser removido usando uma pipeta, embora tome cuidado para não tocar na seção com a ponta da pipeta.
- Diluir o anticorpo primário no bloqueio do buffer.
Nota: A diluição correta precisará ser determinada para cada anticorpo e tipo de amostra. A otimização incluiria a realização de uma série de diluições para identificar a coloração ideal. Para colorir seções de tumores mamários com F4/80, as seções de tecido foram incubadas durante a noite a 4°C em 0,1 mL de anticorpo anti-F4/80 diluído 1:100 em 1% de soro de cabra normal na PBS. - Adicione o anticorpo primário a cada seção e incuba em uma câmara umidificada por até 16 horas (durante a noite) a 4°C. Deixe pelo menos uma seção no buffer de bloqueio sem anticorpo primário para servir como controle, o que ajudará a identificar a ligação não específica pelo anticorpo secundário.
- Escorra o anticorpo primário ou bloqueie o buffer da seção e lave as seções com PBS colocando slides no rack de slides e colocando em um suporte de slides com 1x PBS. Lave 3 vezes por 10 minutos cada vez.
- Diluir o anticorpo secundário 1:200 no buffer de bloqueio. A diluição pode ser otimizada dependendo do anticorpo secundário.
- Adicione o anticorpo secundário a todas as seções, incluindo o controle, e incubar por 1 hora em uma câmara umidificada protegida da luz.
- Drene o anticorpo secundário das seções e lave 3 vezes em PBS por 10 minutos cada vez.
- Adicione 2-3 gotas de mídia de montagem contendo DAPI nos slides e coloque uma mancha de cobertura nas amostras. Se a mídia de montagem não for um tipo de mídia de secagem rápida, pode ser necessário selar as bordas do slide com cera de parafina derretida ou polimento de unhas para evitar vazamentos e manter as amostras a longo prazo.
- Deixe os slides secarem durante a noite no escuro e imagem as seções usando um microscópio fluorescente.
3. Análise e Resultados de Dados
- Seções manchadas são analisadas usando um microscópio fluorescente. Os detalhes específicos da captura e análise da imagem dependerão das especificações do microscópio e do software utilizado para realizar a análise. Normalmente, as imagens podem ser tiradas como imagens de cores únicas e sobrepostas para gerar imagens multicolorires. Por cento de células positivas podem ser quantificadas contando o número de células manchadas positivamente e dividindo-se pelo número total de células manchadas de DAPI dentro de uma seção. Para a coloração F4/80 das seções de tumor mamário, utilizando-se o software Leica Application Suite, versão 3.8, sob a guia Acquire e no modo de aquisição de Sobreposição de Imagem, FORAM ambos habilitados DAPI e RFP. Exposição, Ganho e Gama foram ajustados (20,0 ms, 1,0x e 1,53, respectivamente, para DAPI e 944,2 ms, 1,0x e 1,08, respectivamente, para RFP), embora isso varie entre os experimentos. O botão Acquire Overlay foi usado para criar imagens sobrepostas das exposições DAPI e RFP.
- A imagem abaixo (Figura 1) mostra um exemplo de imagem de imunofluorescência de uma seção de tumor manchada com F4/80, que detecta um antígeno em macrófagos e outras células mielóides. A seção foi montada usando mídia de montagem contendo DAPI e os núcleos são mostrados em azul.
Resultados
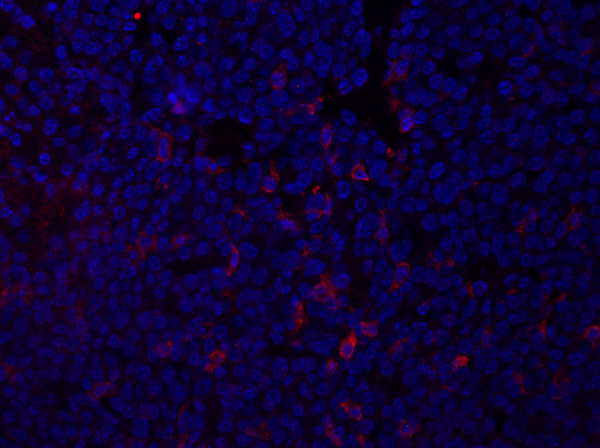
Figura 1: Mancha F4/80 de uma seção de tumor mamário. Após a fixação, um tumor mamário do rato foi seccionado e manchado com anti-F4/80 e montado usando uma mídia de montagem contendo DAPI. A coloração é mostrada pela mancha f4/80 da superfície celular em vermelho. Clique aqui para ver uma versão maior desta figura.
Os dados obtidos a partir da imagem fornecerão informações sobre a intensidade e localização da expressão da proteína de interesse dentro da seção tecidual. Dependendo da proteína ser examinada, esses dados também poderiam fornecer informações sobre a frequência de populações celulares específicas dentro da seção tecidual. Isso pode ser quantificado contando o número de células manchadas positivamente e comparando com a população celular total.
Aplicação e Resumo
A imunofluorescência permite a investigação da expressão proteica e localização no contexto de uma seção tecidual. Essa técnica pode ser usada para entender como os tecidos mudam no contexto da doença, examinando a localização de proteínas ou número celular em tecidos normais e doentes. Alterações na localização ou nos padrões de expressão podem ser determinadas e ligadas a atributos específicos das amostras.
Referências
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Pular para...
Vídeos desta coleção:

Now Playing
Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Immunology
53.6K Visualizações

Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Immunology
92.7K Visualizações

Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Immunology
22.8K Visualizações

Ensaios ELISA: Indireto, Sanduíche e Competitivo
Immunology
237.2K Visualizações

Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Immunology
28.4K Visualizações

Imunohistoquímica e imunocitoquímica: imageamento de tecidos via microscopia de luz
Immunology
78.6K Visualizações

Geração de anticorpos: produzindo anticorpos monoclonais usando hibridomas
Immunology
43.4K Visualizações

Microscopia confocal de fluorescência: uma técnica para determinar a localização de proteínas em fibroblastos de camundongos
Immunology
43.0K Visualizações

Técnicas Baseadas em Imunoprecipitação: Purificação de Proteínas Endógenas Usando Esferas de Agarose
Immunology
87.4K Visualizações

Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Immunology
24.1K Visualizações

Transferência de células adotivas: introduzindo esplenócitos de camundongos doadores para um camundongo hospedeiro e avaliando o sucesso via FACS
Immunology
22.2K Visualizações

Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Immunology
151.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados