Microscopie à fluorescence : coloration par immunofluorescence des sections de tissus inclus en paraffine
Vue d'ensemble
Source : Thomas Chaffee1, Thomas S. Griffith2,3,4, et Kathryn L. Schwertfeger1,3,4
1 Département de médecine de laboratoire et de pathologie, Université du Minnesota, Minneapolis, MN 55455
2 Département d'urologie, Université du Minnesota, Minneapolis, MN 55455
3 Centre du cancer maçonnique, Université du Minnesota, Minneapolis, MN 55455
4 Center for Immunology, Université du Minnesota, Minneapolis, MN 55455
Les analyses pathologiques des sections de tissu peuvent être employées pour obtenir une meilleure compréhension de la structure normale de tissu et pour contribuer à notre compréhension des mécanismes de la maladie. Les biopsies tissulaires, provenant de patients ou de modèles in vivo expérimentaux, sont souvent conservées en fixant dans la formaline ou le paraformaldéhyde et en s'intégrant dans la cire de paraffine. Cela permet un stockage à long terme et la section des tissus. Les tissus sont coupés en fines sections (5 m) à l'aide d'un microtome et les sections sont adhérences à des lames de verre. Les sections de tissus peuvent être tachées avec des anticorps, qui permettent la détection de protéines spécifiques dans les sections de tissu. La coloration avec des anticorps conjugués aux fluorophores (également connu sous le nom de fluorochromes) - composés qui émettent de la lumière à des longueurs d'onde spécifiques lorsqu'il est excité par un laser - est connu sous le nom d'immunofluorescence. La capacité de détecter des protéines dans une section peut fournir des informations telles que l'hétérogénéité de type cellulaire dans le tissu, l'activation de voies de signalisation spécifiques, et l'expression des biomarqueurs. Selon les fluorophores utilisés et le type de microscope disponible pour l'analyse, plusieurs couleurs peuvent être utilisées, ce qui permet l'analyse multiplexée des cibles.
Le protocole suivant décrit les étapes de base impliquées dans la coloration d'immunofluorescence des sections incorporées de tissu de paraffine. Il est important de noter que ce protocole n'inclura aucun détail sur la fixation du tissu, le processus d'enracinement de paraffine, ou la section des tissus. Une fois que les tissus ont été sectionnés et placés sur des lames de verre, ils sont réhydratés par une série d'incubations d'éthanol gradué (EtOH). Les sections sont incubées avec un réactif de blocage pour réduire la liaison non spécifique de l'anticorps à la section tissulaire. Les sections sont ensuite incubées avec un anticorps primaire qui peut ou non être directement étiqueté avec un fluorophore. Si l'anticorps primaire n'est pas étiqueté directement, les sections sont ensuite incubées avec un anticorps secondaire étiqueté avec un fluorophore. Différents anticorps peuvent exiger des conditions de coloration différentes, de ce fait, des suggestions pour l'optimisation des anticorps sont incluses. Après le lavage pour enlever tous les anticorps non liés, les diapositives sont montées avec des supports contenant DAPI pour étiqueter fluorescentement le noyau. Une fois que le support de montage a séché, les diapositives peuvent être imaginées à l'aide d'un microscope avec des lasers qui peuvent détecter les différents fluorophores.
Procédure
1. Mise en place
- Le protocole de coloration typique comporte les étapes suivantes :
- Réhydrater les sections de tissu sur les diapositives à l'aide d'une série d'éthanols classés.
- Incuber les sections tissulaires à l'aide d'un tampon de blocage, ce qui aidera à bloquer la liaison non spécifique de l'anticorps au tissu et à réduire la fluorescence de fond.
- Suppression du tampon de blocage et incubation de la section dans l'anticorps primaire, au moment où l'anticorps liera sa cible peptide.
- Enlever l'anticorps primaire et laver les sections abondamment dans un tampon de lavage.
- Incuber les sections avec un anticorps secondaire pour permettre la liaison à l'anticorps primaire, si l'anticorps primaire n'est pas directement étiqueté avec un fluorophore et un anticorps secondaire est nécessaire.
- Laver l'anticorps secondaire des diapositives.
- Montage des diapositives dans des supports de montage et leur permettant de sécher avant la visualisation sur un microscope fluorescent.
- Les articles suivants sont nécessaires : porte-diapositives (verre ou plastique), bocaux, pipettes, stylo pap, chambre humide, pochettes de couverture et supports de montage avec DAPI.
- Xylène est utilisé pour la réhydratation des diapositives. Le xylène est dangereux et doit être utilisé dans une hotte de fumée avec PPE approprié, y compris des gants et une blouse de laboratoire.
- Recettes pour tampons, solutions et réactifs
-
Éthanols classés
Éthanol - 160 mL 200 preuve EtOH et 40mL ddH2O
Éthanol - 140 mL 200 preuve EtOH et 60mL ddH2O -
Solution de récupération d'antigène
10 mm de citrate de sodium, pH 6.0 -
Blocage du tampon
Sérum de 100 L provenant d'un animal hôte à partir duquel l'anticorps secondaire a été fabriqué
900 L 1X PBS
Note: Il s'agit du volume pour 10 sections; ajuster le volume d'environ 100 l'amorti par section, au besoin. - Tampon de lavage (1X PBS)
-
Éthanols classés
2. Protocole
- Réhydratation avec xylènes et éthanols
- Placez les glissières dans un porte-diapositives, puis submergez les glissières dans la solution 100% Xylène isomers, en veillant à ce que les diapositives soient entièrement recouvertes de solution.
- Incuber des glissières dans les isovers 100% Xylène pendant 3 min. Répétez deux fois pour un total de 3 incubations distinctes. Assurez-vous d'essuyer le porte-glisseur avec une serviette en papier avant de transférer à une nouvelle solution pour minimiser la contamination.
Note: Il est recommandé que ces incubations soient effectuées dans trois contenants distincts. - Incuber les toboggans en 100% EtOH pendant 2 min. Répétez deux fois pour un total de 3 incubations distinctes.
Note: Il est recommandé que ces incubations soient effectuées dans trois contenants distincts. - Incuber les toboggans en 95% EtOH pendant 2 min.
- Incuber les toboggans en 80% EtOH pendant 2 min.
- Incuber les toboggans en 70% EtOH pendant 2 min.
- Incuber les diapositives en 1X PBS pendant 5 min.
- (Facultatif) Récupération d'antigène pour démasquer les épitopes reconnus par l'anticorps primaire
Note 1 : Cette procédure dépend fortement de l'anticorps utilisé et il est recommandé que les procédures initiales d'optimisation soient effectuées pour déterminer l'exigence de récupération d'antigène.
Note 2 : Cette procédure n'a pas été effectuée avec la coloration F4/80 montrée ci-dessous. L'exigence de récupération d'antigène doit être optimisée avec chaque nouvel anticorps.- Placez les glissières dans un porte-glissière en plastique ou en verre résistant à la chaleur, et assurez-vous que la grille est remplie de glissières pour assurer une distribution uniforme de la chaleur. Des diapositives vierges peuvent être utilisées s'il y a moins d'échantillons que de fentes dans le rack.
- Placez le support dans 1000 mL de solution antigène démasquée dans le bécher 2L - 10 mL d'antigène démasquant le stock à 990mL d'eau.
- Cuire au micro-ondes à puissance élevée pendant 20 minutes au total, assurez-vous que les lames restent couvertes d'eau.
- Refroidir les lames pendant 20 minutes dans le bécher.
- Laver le toboggan dans des supports de glissière contenant ddH2O pendant 5 min chacun. Répétez deux fois pour un total de 3 incubations distinctes à l'aide de ddH2O frais à chaque fois. Les glissières peuvent être lavées dans le même porte-diapositive s'est lavée à chaque lavage.
- Incuber les diapositives en 1X PBS pendant 5 min.
- Cercle sections avec un stylo pap. Cela permettra l'utilisation d'un volume minimal de tampons nécessaires pour couvrir les sections de tissu. Ne laissez pas les sections de tissu se dessécher.
- Ajouter un tampon de blocage à chaque section. La quantité de tampon nécessaire pour couvrir la section varie en fonction de la taille de la section, mais peut varier de 25 à 500 l. Un tampon suffisant devrait être utilisé pour former une perle qui couvre toute la surface de la section, y compris les bords.
Note: Le choix de la mémoire tampon de blocage peut varier en fonction de l'anticorps utilisé. Par exemple, 10 % de sérum de l'animal hôte dans lequel l'anticorps secondaire a été élevé peut être utilisé pour réduire la liaison non spécifique de l'anticorps secondaire (par exemple, le sérum de chèvre normal peut être utilisé si l'anticorps secondaire a été élevé dans la chèvre). L'optimisation du tampon de blocage doit être effectuée pour chaque anticorps primaire. Pour tacher les sections mammaires de tumeur avec F4/80, 0.1 ml de sérum normal de chèvre de 10% dans PBS a été employé. - Incuber les sections en bloquant le tampon dans une chambre humidifiée pendant 1 heure à température ambiante ou 4 oC jusqu'à 24 heures. La chambre humidifiée assure que les sections ne se dessèchent pas.
- Retirez le tampon de blocage en le vidant de la glissière. Alternativement, le tampon de blocage peut être enlevé à l'aide d'une pipette, bien que prendre soin de ne pas toucher la section avec la pointe de pipette.
- Diluer l'anticorps primaire en bloquant le tampon.
Note: La dilution correcte devra être déterminée pour chaque type d'anticorps et d'échantillon. L'optimisation comprendrait l'exécution d'une série de dilutions pour identifier les taches optimales. Pour tacher les sections mammaires de tumeur avec F4/80, des sections de tissu ont été incubées pendant la nuit à 4 oC dans l'anticorps anti-F4/80 de rat de 0.1 mL dilué 1:100 dans le sérum normal de chèvre de 1% dans PBS. - Ajouter l'anticorps primaire à chaque section et incuber dans une chambre humidifiée jusqu'à 16 heures (nuit) à 4 oC. Laissez au moins une section dans le tampon de blocage sans anticorps primaire pour servir de contrôle, ce qui aidera à identifier la liaison non spécifique par l'anticorps secondaire.
- Égoutter l'anticorps primaire ou bloquer le tampon de la section, et laver les sections avec PBS en plaçant des diapositives dans un support de diapositives et en plaçant dans un support de diapositive avec 1x PBS. Laver 3 fois pendant 10 min à chaque fois.
- Diluer l'anticorps secondaire 1:200 en bloquant le tampon. La dilution peut être optimisée en fonction de l'anticorps secondaire.
- Ajouter l'anticorps secondaire à toutes les sections, y compris le contrôle, et couver pendant 1 heure dans une chambre humidifiée protégée de la lumière.
- Égoutter l'anticorps secondaire des sections et laver 3 fois en PBS pendant 10 min à chaque fois.
- Ajouter 2-3 gouttes de support de montage contenant DAPI sur les diapositives et placer un bordereau sur les échantillons. Si le support de montage n'est pas un type de milieu à séchage rapide, il peut être nécessaire de sceller les bords de la glissière avec de la cire de paraffine fondue ou du vernis à ongles pour prévenir les fuites et maintenir les échantillons à long terme.
- Laissez les diapositives sécher toute la nuit dans l'obscurité et imagez les sections à l'aide d'un microscope fluorescent.
3. Analyse des données et résultats
- Les sections tachées sont analysées à l'aide d'un microscope fluorescent. Les détails spécifiques de la capture et de l'analyse d'image dépendront des spécifications du microscope et du logiciel utilisé pour effectuer l'analyse. En règle générale, les images peuvent être prises comme des images en une seule couleur et superposées pour générer des images multicolores. Pourcentage de cellules positives peuvent être quantifiées en comptant le nombre de cellules tachées positivement et en divisant par le nombre total de cellules tachées de DAPI dans une section. Pour la coloration F4/80 des sections de tumeur mammaire, à l'aide du logiciel Leica Application Suite, version 3.8, sous l'onglet Acquire et en mode d'acquisition de la pariation d'images, DAPI et RFP ont tous deux été activés. L'exposition, le gain et le gamma ont été ajustés (20,0 ms, 1,0x et 1,53 respectivement pour le DAPI et 944,2 ms, 1,0x et 1,08 respectivement pour la DP), bien que cela varie d'une expérience à l'autre. Le bouton Acquire Overlay a été utilisé pour créer des images de la perceur des expositions DAPI et DFP.
- L'image ci-dessous (Figure 1) montre un exemple d'image d'immunofluorescence d'une section tumorale tachée de F4/80, qui détecte un antigène sur les macrophages et autres cellules myéloïdes. La section a été montée à l'aide de supports de montage contenant du DAPI et les noyaux sont représentés en bleu.
Résultats
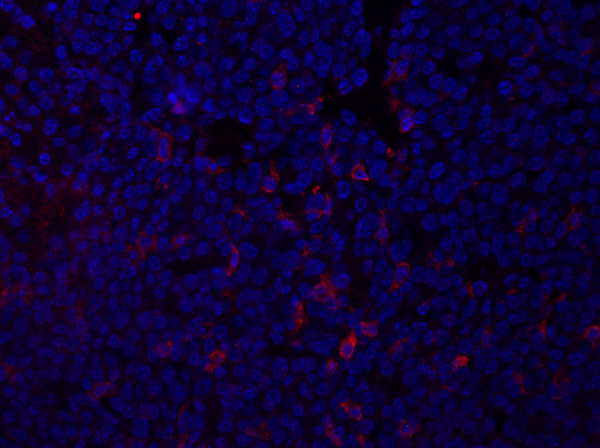
Figure 1: coloration F4/80 d'une section de tumeur mammaire. Après fixation, une tumeur mammaire de souris a été sectionnée et souillée avec anti-F4/80 et monté utilisant un support de montage DAPI-contenant. La coloration est montrée par la surface de la cellule F4/80 coloration en rouge. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Les données obtenues à partir de l'imagerie fourniront de l'information sur l'intensité et la localisation de l'expression de la protéine d'intérêt dans la section tissulaire. Selon la protéine examinée, ces données pourraient également fournir des informations sur la fréquence de populations cellulaires spécifiques dans la section tissulaire. Cela peut être quantifié en comptant le nombre de cellules tachées positivement et en comparant avec la population cellulaire totale.
Applications et Résumé
L'immunofluorescence permet d'enquêter sur l'expression et la localisation des protéines dans le contexte d'une section tissulaire. Cette technique peut être utilisée pour comprendre comment les tissus changent dans le contexte de la maladie en examinant la localisation des protéines ou le nombre de cellules dans les tissus normaux et malades. Les changements dans la localisation ou dans les modèles d'expression peuvent être déterminés et liés à des attributs spécifiques des échantillons.
References
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Microscopie à fluorescence : coloration par immunofluorescence des sections de tissus inclus en paraffine
Immunology
53.6K Vues

Cytométrie en flux et tri cellulaire activé par fluorescence (FACS) : isolement des lymphocytes B spléniques
Immunology
92.6K Vues

Tri cellulaire magnétique (MACS) : isolement des lymphocytes T thymiques
Immunology
22.7K Vues

Tests ELISA : Indirect, en sandwich et par compétition
Immunology
236.9K Vues

Test ELISPOT : Détection des splénocytes sécrétants l'IFNgamma
Immunology
28.3K Vues

Immunohistochimie et immunocytochimie : Imagerie tissulaire par microscopie optique
Immunology
78.5K Vues

Génération d'anticorps monoclonaux à l'aide d'hybridomes
Immunology
43.4K Vues

Microscopie confocale à fluorescence : une technique pour localiser les protéines dans les fibroblastes de souris
Immunology
43.0K Vues

Techniques basées sur l'immunoprécipitation : purification des protéines endogènes à l'aide de billes d'agarose
Immunology
87.4K Vues

Analyse du cycle cellulaire : utilisation de la coloration CFSE et de la cytométrie de flux pour évaluer la prolifération des lymphocytes T CD4 et CD8 après stimulation
Immunology
24.1K Vues

Transfert adoptif de cellules : introduction de splénocytes d'une souris donneuse vers une souris hôte et évaluation du taux de succès au FACS
Immunology
22.1K Vues

Test de mort cellulaire : libération du chromium pour mesurer la cytotoxicité
Immunology
151.4K Vues