Espectroscopia de ressonância paramagnética eletrônica (EPR)
Visão Geral
Fonte: David C. Powers, Tamara M. Powers, Texas A&M
Neste vídeo, aprenderemos os princípios básicos por trás da Ressonância Paramagnética Eletrônica (EPR). Usaremos espectroscopia EPR para estudar como o tolueno dibutylhydroxy (BHT) se comporta como um antioxidante na autoxidação de aldeídos alifáticos.
Princípios
Fundamentos da EPR:
EPR é uma técnica espectroscópica que se baseia em fenômenos físicos semelhantes como a espectroscopia de ressonância magnética nuclear (NMR). Enquanto a RMN mede as transições de spin nuclear, a EPR mede as transições de spin de elétrons. O EPR é usado principalmente para estudar moléculas paramagnéticas, que são moléculas com elétrons não analisados. Lembre-se que um elétron tem um número quântico de spin, s = 1/2, que tem componentes magnéticos ms = 1/2 e ms = -1/2. Na ausência de um campo magnético, a energia dos dois estadosm s são equivalentes. No entanto, na presença de um campo magnético aplicado(B0),o momento magnético do elétron se alinha com o campo magnético aplicado e, como resultado, os estados ms tornam-se não-degenerados(Figura 1). A diferença de energia entre o estado m s depende da força do campo magnético(Equação 1). Isso é chamado de efeito Zeeman.
E = m2geμBB 0 (Equação 1)
onde ge é o fator g,que é 2.0023 para um elétron livre e μB é o ímã bohr.
Em um determinado campo magnético, B0, a diferença de energia entre os dois estadosm s é dada pela Equação 2.
ΔE = E1/2 — E-1/2 = geμBB 0 = hυ (Equação 2)
Um elétron se move entre os dois estadosapósa emissão ou absorção de um fóton com energia ΔE =hυ. Equação 2 se aplica a um único elétron livre. No entanto, semelhante à forma como a mudança química em 1H NMR depende do ambiente químico do átomo de H, os elétrons dentro das moléculas não se comportam da mesma forma que um elétron isolado. O gradiente de campo elétrico da molécula influenciará o campo magnético eficaz, dado pela Equação 3.
Beff = B0(1 — σ) (Equação 3)
onde σ é o efeito dos campos locais, que podem ser um valor positivo ou negativo.
Conectando a Equação 3 na Equação 2,podemos definir o fator gpara um elétron não pago em uma determinada molécula como g = ge(1 - σ), o que simplifica a equação geral para:
hυ = gμBB 0(Equação 4)
Durante o experimento EPR, a frequência é varrida, mais comumente na região do micro-ondas variando de 9.000-10.000 MHz, e o campo é mantido constante em aproximadamente 0,35 T, permitindo o cálculo de g. Experimentalmente determinando g usando EPR fornece informações sobre a estrutura eletrônica de uma molécula paramagnética.
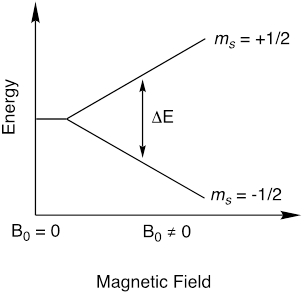
Figura 1. Divisão de estados de momento magnético, ms,na presença de um campo magnético.
Aplicação do EPR:
Neste experimento, usaremos espectroscopia de EPR para investigar a química dos antioxidantes. O2, que compreende ~ 21% da atmosfera da Terra, é um forte oxidante. Apesar de seu potencial de agir como um oxidante, O2 é um trigêmeo de estado terrestre e, portanto, só reage muito lentamente com a maioria das moléculas orgânicas. Uma reação importante, embora muitas vezes indesejada, mediada por O2 é a autoxidação. Na química da autoxidação, O2 inicia processos radicais em cadeia, que podem consumir rapidamente moléculas orgânicas. A Figura 2 ilustra uma autoxidação comum, na qual os aldeídos são oxidados a ácidos carboxílicos.
Prevenir a química da autoxidação é importante para evitar a decomposição de muitos materiais orgânicos comuns, como plásticos, e um grande campo se desenvolveu em torno da identificação de antioxidantes eficazes para inibir a autoxidação. Um mecanismo pelo qual os antioxidantes podem funcionar é reagindo com os intermediários radicais para inibir processos radicais em cadeia. Como espécies radicais têm spins não pagos, a EPR é uma ferramenta valiosa para entender a química dos antioxidantes. Neste experimento, usaremos espectroscopia EPR para explorar o papel do BHT como um antioxidante na autoxidação de aldeídos alifáticos.
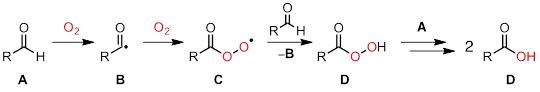
Figura 2. A autoxida de aldeído prossegue através de um mecanismo de cadeia radical.
Procedimento
1. Autoxidação de Butyraldeído
- Prepare uma solução de butiradeído (100 mgs) e CoCl2·6H2O (1 mg) em 1,2-dicloroetano (DCE) (4 mL) em um frasco de cintilação de 20 mL. Adicione uma barra de meximento magnética e encaixe o frasco com um septo de borracha.
- Conecte o barril de uma seringa de plástico de 1 mL a um pequeno pedaço de tubo de borracha. Insira a tubulação de borracha em um balão de látex e fixe o balão no tubo com um elástico e fita elétrica. Infle um balão de látex com O2.
- Insira a agulha do balão O2 no frasco de reação. Insira uma segunda agulha no septo e purgue o espaço da cabeça do vaso de reação com O2.
- Usando uma placa de mexida, mexa a reação à temperatura ambiente por 4h sob uma atmosfera O2.
- Concentre a mistura de reação usando um evaporador rotativo e tome um espectro de 1H NMR do resíduo oleoso resultante no CDCl3.
2. Usando BHT como antioxidante para a autoxidação de Butyraldeído
Configure dois frascos como descrito abaixo. Um será usado para analisar a distribuição do produto e outro será usado na etapa 3 para espectroscopia EPR.
- Prepare uma solução de butildeído (100 mgs) e CoCl2·6H2O (1 mg) em DCE (4 mL) em um frasco de cintilação de 20 mL. Adicione BHT (10 mg) à solução. Adicione uma barra de meximento magnética e encaixe o frasco com um septo de borracha.
- Conecte o barril de uma seringa de plástico de 1 mL a um pequeno pedaço de tubo de borracha. Insira a tubulação de borracha em um balão de látex e fixe o balão no tubo com um elástico e fita elétrica. Infle um balão de látex com O2.
- Insira a agulha do balão O2 no frasco de reação. Insira uma segunda agulha no septo e purgue o espaço da cabeça do vaso de reação com O2.
- Usando uma placa de mexida, mexa a reação à temperatura ambiente por 4h sob uma atmosfera O2.
- Concentre a mistura de reação usando um evaporador rotativo e tome um espectro de 1H NMR do resíduo oleoso resultante no CDCl3.
3. Medindo os espectros de EPR
- Ligue o espectrômetro EPR e deixe o instrumento aquecer por 30 minutos. Configure uma aquisição de EPR com os seguintes parâmetros: campo central 3.345 G, largura de varredura 100 G, tempo de varredura 55 s, tempo constante de 10 ms, potência MW 5 mW, modulação de 100 kHz e amplitude de modulação 1 G.
- Meça um espectro EPR de um tubo EPR vazio para garantir que não haja sinais de fundo do tubo EPR ou do ressonador de instrumentos.
- Prepare uma solução de BHT em DCE em um porta-luvas n2. Transfira 0,5 mL da solução para um tubo de EPR e meça o espectro EPR da BHT utilizando os parâmetros de aquisição estabelecidos na etapa 3.1.
- Transfira 0,5 mL da solução de reação adicionada bht da Etapa 2 para um tubo EPR e adquira e espectro EPR utilizando os parâmetros de aquisição estabelecidos na Etapa 3.1.
Resultados
A autoxidação de butyraldeído proporciona ácido butírico. O espectro de 1H NMR obtido a partir da reação realizada no Passo 1 mostra a falta de uma ressonância C-H aldeídica e a presença das ressonâncias esperadas do ácido butírico. Em contraste, a RMN obtida a partir da mistura de reação da etapa 2 (com BHT adicionado) exibe sinais consistentes com butyraldeído, sem ácido butírico presente. A partir desses dados, observamos que o butyraldeído serviu como um antioxidante na autoxida de aldeído.
O papel do BHT na inibição da autoxida de aldeído é iluminado pelos espectros de EPR obtidos de BHT e de BHT adicionados à reação de autoxidato de aldeído. BHT é uma molécula orgânica diamagnética, o que significa que não há elétrons não pagos. Assim, o espectro EPR do BHT não exibe sinais. Em contraste, o espectro EPR da reação de autoxidação na qual o BHT foi adicionado exibe um forte padrão de quatro forrados, consistente com um radical orgânico. Esse espectro surge porque a ligação O-H da BHT é fraca e na presença de radicais gerados durante a autoxidação, a transferência de átomos de H a partir do BHT sacia o mecanismo de cadeia radical e gera um radical estável centrado em O.
Aplicação e Resumo
Neste experimento, exploramos o papel dos antioxidantes na inibição da química da autoxidação. Sondamos o mecanismo de inibição usando espectroscopia de EPR, que revelou que o BHT serve como um antioxidante, saciando intermediários radicais reativos via transferência de átomos de H.
Moléculas com elétrons não ressarciantes podem ser desafiadoras para caracterizar por NMR e, portanto, a espectroscopia EPR frequentemente fornece informações úteis e complementares sobre essas espécies. A espectroscopia de EPR é uma técnica experimental que é frequentemente usada para detectar e caracterizar radicais orgânicos. Além disso, complexos inorgânicos paramagnéticos também exibem frequentemente espectros de EPR que podem ser instrutivos para caracterização. Espectros experimentais de EPR delineiam o fator gdo elétron não perdurado, que fornece informações sobre a estrutura eletrônica do centro paramagnético. Além disso, os giros nucleares dos núcleos com um elétron não verificado, bem como núcleos vizinhos também influenciam o momento magnético de um elétron, dando origem à divisão adicional dos estados ms e múltiplas linhas no espectro EPR. O acoplamento hiperfine e super-hiperfino resultante fornece mais informações sobre a estrutura eletrônica da molécula.
Além de caracterizar espécies orgânicas e inorgânicas de casca aberta, a sensibilidade requintada da espectroscopia de EPR é fundamental para a aplicação a sistemas bioinorgânicos, onde a concentração de cofatores metálicos é baixa. Os espectros EPR são rotineiramente usados em química bioinorgânica para fornecer informações diretas sobre as estruturas e estados de oxidação de íons metálicos no coração das enzimas.
Pular para...
Vídeos desta coleção:

Now Playing
Espectroscopia de ressonância paramagnética eletrônica (EPR)
Inorganic Chemistry
25.6K Visualizações

Síntese de um metaloceno de Ti(III) usando a técnica da linha de Schlenk
Inorganic Chemistry
31.7K Visualizações

GloveBox e Sensores de Impurezas
Inorganic Chemistry
18.7K Visualizações

Purificação do ferroceno por sublimação
Inorganic Chemistry
54.8K Visualizações

O Método Evans
Inorganic Chemistry
68.8K Visualizações

Difração de Raios-X de Monocristais e de Pó
Inorganic Chemistry
105.2K Visualizações

Espectroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizações

Interação Ácido-Base de Lewis em Ph3P-BH3
Inorganic Chemistry
39.0K Visualizações

Estrutura do ferroceno
Inorganic Chemistry
79.8K Visualizações

Aplicação da Teoria dos Grupos à Espectroscopia de IV
Inorganic Chemistry
45.9K Visualizações

Teoria do Orbital Molecular (TOM)
Inorganic Chemistry
35.5K Visualizações

Pás de Roda Quádrupla com Ligação Metal-Metal
Inorganic Chemistry
15.4K Visualizações

Células solares sensibilizadas por corante
Inorganic Chemistry
16.0K Visualizações

Síntese de um Complexo de Cobalto(II) Transportador de Oxigênio
Inorganic Chemistry
51.8K Visualizações

Iniciação fotoquímica de reações de polimerização radical
Inorganic Chemistry
17.1K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados