Células de combustível de membrana de troca de prótons
Visão Geral
Fonte: Laboratórios de Margaret Workman e Kimberly Frye - Universidade Depaul
Os Estados Unidos consomem uma grande quantidade de energia – a taxa atual é de cerca de 97,5 quadrilhões de BTUs anualmente. A grande maioria (90%) dessa energia vem de fontes de combustível não renováveis. Essa energia é utilizada para eletricidade (39%), transporte (28%), indústria (22%) e uso residencial/comercial (11%). Como o mundo tem um fornecimento limitado dessas fontes não renováveis, os Estados Unidos (entre outros) estão expandindo o uso de fontes de energia renovável para atender às necessidades energéticas futuras. Uma dessas fontes é o hidrogênio.
O hidrogênio é considerado uma fonte potencial de combustível renovável, porque atende a muitos critérios importantes: está disponível no mercado interno, tem poucos poluentes nocivos, é eficiente em energia e é fácil de aproveitar. Embora o hidrogênio seja o elemento mais abundante no universo, ele só é encontrado em forma composta na Terra. Por exemplo, é combinado com oxigênio na água como H2O. Para ser útil como combustível, ele precisa estar na forma de gás H2. Portanto, se o hidrogênio deve ser usado como combustível para carros ou outros eletrônicos, o H2 precisa ser feito primeiro. Assim, o hidrogênio é frequentemente chamado de "porta-energia" em vez de "combustível".
Atualmente, a maneira mais popular de fazer gás H2 é a partir de combustíveis fósseis, através da reforma a vapor de hidrocarbonetos ou gaseificação de carvão. Isso não reduz a dependência de combustíveis fósseis e é intensivo em energia. Um método menos utilizado é por eletrólise da água. Isso também requer uma fonte de energia, mas pode ser uma fonte renovável, como energia eólica ou solar. Na eletrólise, a água (H2O) é dividida em suas partes componentes, gás hidrogênio (H2) e gás oxigênio (O2), através de uma reação eletroquímica. O gás hidrogênio feito através do processo de eletrólise pode então ser usado em uma célula de combustível de Membrana de Troca de Prótons (PEM), gerando uma corrente elétrica. Esta corrente elétrica pode ser usada para alimentar motores, luzes e outros dispositivos elétricos.
Princípios
Parte I deste experimento envolve a geração de gás hidrogênio através da eletrólise. Na eletrólise, a água é dividida em suas partes componentes, hidrogênio e oxigênio, através da seguinte reação eletroquímica:
2 H2O(l) → 2 H2(g) + O2(g)
Há duas vezes mais moléculas de hidrogênio produzidas que moléculas de oxigênio. Essa reação não acontece espontaneamente e precisa de uma fonte de energia elétrica, por exemplo,um painel solar. Esta é uma reação de redução de oxidação. Esses tipos de reações químicas podem ser divididas em duas partes: a reação de oxidação e a reação de redução. São chamadas de meias reações. Na meia reação de oxidação, elétrons são liberados. Na redução da meia reação, os elétrons são aceitos.
Oxidação: 2 H2O(l) → O2(g) + 4 H+(aq) + 4 e-
Redução: 4 H+(aq) + 4 e- → 2 H2(g)
O gás hidrogênio pode ser coletado e armazenado para uso posteriormente em uma célula de combustível (PEM)(Figura 1).
A parte II deste experimento envolve o uso do gás hidrogênio armazenado como combustível para produzir eletricidade para alimentar um ventilador. A célula de combustível usada neste experimento é uma célula de combustível PEM. A célula de combustível PEM é como uma bateria, na forma de criar eletricidade através de uma reação química que envolve a transferência de elétrons. Na célula de combustível PEM, as reações da metade são as seguintes:
Oxidação: 2 H2(g) → 4 H+(aq) + 4 e-
Redução: 4 H+(aq) + O2(g) + 4 e- → 2 H2O(l)
A reação geral é: 2 H2(g) + O2(g) → 2 H2O(l) + energia
Essas meias reações ocorrem nos eletrodos (condutores por onde passa a eletricidade). Na célula de combustível PEM, há dois eletrodos: um ânodo e um cátodo. A oxidação ocorre no ânodo. A redução ocorre no cátodo. Então, na célula de combustível PEM no ânodo, o gás hidrogênio é oxidado, e elétrons são liberados no circuito. No cátodo, o gás oxigênio é reduzido e a água é formada. Na célula de combustível PEM, uma membrana de troca de prótons separa os dois eletrodos. Esta membrana permite que prótons (H+) fluam, mas impede que elétrons entrem na membrana. Assim, os elétrons são forçados a fluir através do circuito elétrico(Figura 2).

Figura 1: Diagrama de um eletrólito.
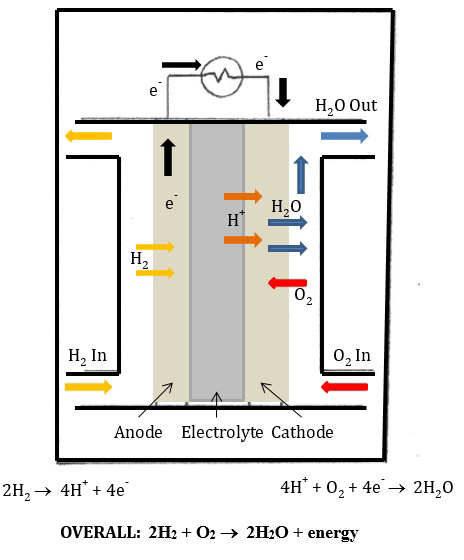
Figura 2: Célula de combustível PEM.
Procedimento
1. Usando o eletrólito para produzir gás hidrogênio
- Configuração do eletrólito (Figura 3).
- Configure os cilindros de coleta de gás, certificando-se de que o nível de água destilada no cilindro externo esteja na marca 0(Figura 4).
- Conecte o eletrólito aos cilindros de coleta de gás(Figura 5).
- Conecte um painel solar ao eletrólito usando fios de jumper e exponha à luz solar direta(Figura 6). Note, se o tempo não estiver cooperando naquele dia, use uma lâmpada com uma lâmpada para simular o sol.
- O gás H2 e O2 começa a entrar nos cilindros internos(Figura 7). Monitore o volume de cada gás produzido em intervalos de 30 s, utilizando a balança marcada no cilindro externo. Leva aproximadamente 10 minutos para encher o cilindro interno com gás H2.
- Quando o cilindro interno está completamente cheio de gás H2, algumas bolhas devem emergir do cilindro interno, eventualmente atingindo a superfície. Neste ponto, desconecte o painel solar do eletrólito e feche o cincher no tubo de gás H2, de modo que nenhum gás H2 escape. Observe que há o dobro de gás hidrogênio produzido como gás oxigênio, como previsto na equação química equilibrada.
2. Célula de combustível
- Configuração de uma célula de combustível(Figura 8).
- Desconecte a tubulação de gás H2 do eletrólito e conecte-a à célula de combustível.
- Conecte a célula de combustível a um ventilador (ou uma luz LED, se um ventilador não estiver disponível (Figura 9)) e solte o cinch no tubo de gás H2 (Figura 10). O ventilador deve começar a girar. Se não, pressione a válvula de purga na célula de combustível para fazer o gás fluir.
- O ventilador continua girando até que todo o gás H2 seja consumido. Isso deve durar aproximadamente 5 minutos.

Figura 3: Uma foto do eletrólito.

Figura 4: Cilindros de coleta de gás com níveis de água destilados iguais a 0.

Figura 5: Uma imagem do eletrólito conectado aos cilindros de coleta de gás.

Figura 6: O painel solar conectado ao eletrólito com fios de jumper.

Figura 7: Um exemplo do gás entrando nos cilindros.

Figura 8: Uma imagem de uma célula de combustível.

Figura 9: A célula de combustível conectada a uma luz LED em vez de um ventilador.

Figura 10: O eletrólito conectado com a célula de combustível, que está conectada com o ventilador.
Resultados
Durante o procedimento de eletrólise, o hidrogênio e o gás oxigênio são gerados uma vez que o painel solar é conectado e exposto à luz solar. Leva aproximadamente 10 minutos para gerar gás H2 suficiente para encher o cilindro interno(Tabela 1). Note que há duasvezes mais H 2 gerado como O2, como visto na equação equilibrada:
2 H2O(l) → 2 H2(g) + O2(g)
Uma vez que o gás H2 é gerado e o tubo é conectado à célula de combustível, a célula de combustível gera eletricidade e faz com que o ventilador gire. Isso dura aproximadamente 10 min em um cilindro completo de gás H2.
| Tempo (s) | Hidrogênio gerado (mL) | Oxigênio Gerado (mL) |
| 0 | 0 | 0 |
| 30 | 4 | 2 |
| 60 | 8 | 4 |
| 90 | 10 | 6 |
| 120 | 12 | 6 |
| 150 | 14 | 6 |
| 180 | 14 | 8 |
| 210 | 16 | 8 |
| 240 | 18 | 8 |
| 270 | 20 | 10 |
| 300 | 22 | 10 |
| 330 | 22 | 10 |
| 360 | 24 | 12 |
| 390 | 24 | 12 |
| 420 | 26 | 12 |
| 450 | 26 | 14 |
| 480 | 28 | 14 |
| 510 | 28 | 14 |
| 540 | 28 | 14 |
| 570 | 30 | 16 |
| 600 | 30 | 16 |
Tabela 1: Tempo necessário para gerar diferentes quantidades de hidrogênio e oxigênio
Aplicação e Resumo
Hidrogênio é um combustível flexível. Pode ser produzido no local em pequenas quantidades para uso local ou em grandes quantidades em uma instalação centralizada. O hidrogênio pode então ser usado para produzir eletricidade apenas com água como subproduto (desde que uma fonte renovável de energia, como uma turbina eólica, foi usada para gerar o gás hidrogênio). Por exemplo, em Boulder, Colorado, o projeto Wind2H2 tem turbinas eólicas e painéis solares conectados a eletrólitos que produzem gás hidrogênio a partir da água e, em seguida, armazena-lo para ser usado em sua estação de abastecimento de hidrogênio.
Este processo também pode ser usado para fazer os carros funcionarem com gás hidrogênio (H2) em vez de combustíveis fósseis. Se uma célula de combustível PEM for instalada em um carro, a eletricidade pode ser usada para fazer o motor funcionar. O único escapamento seria água (H2O). Do ponto de vista da poluição do ar, isso é vantajoso. Existem muitos protótipos de carros a célula de combustível sendo desenvolvidos por grandes fabricantes de automóveis. Devido à quantidade de espaço atualmente necessária para armazenar os tanques de hidrogênio comprimido em um veículo, as células de combustível de hidrogênio são vistas principalmente nos ônibus. Ônibus com células de combustível podem ser encontrados em vários países ao redor do mundo. Existem algumas questões tecnológicas que precisam ser tratadas antes que os carros com células de combustível sejam uma alternativa viável aos carros com motores de combustão interna, incluindo fornecer mais infraestrutura, reduzir custos e um aumento do uso de fontes de energia renovável ao fabricar gás H2.
Além disso, as células de combustível de hidrogênio podem ser usadas no lugar de baterias para coisas como câmeras de vídeo e rádios. Um exemplo é o dispositivo UPP, que é um power pack portátil baseado na tecnologia de célula de combustível de hidrogênio que pode ser usado para carregar dispositivos compatíveis com USB.
Pular para...
Vídeos desta coleção:

Now Playing
Células de combustível de membrana de troca de prótons
Environmental Science
22.2K Visualizações

Identificação de árvores: como usar uma chave dicotômica
Environmental Science
81.4K Visualizações

Levantamento de Árvores: Método de Amostragem Trimestral Centrada em Pontos
Environmental Science
49.6K Visualizações

Uso de SIG para Investigar Florestas Urbanas
Environmental Science
12.8K Visualizações

Biocombustíveis: Produzindo Etanol a partir de Material Celulósico
Environmental Science
53.7K Visualizações

Testes para alimentos geneticamente modificados
Environmental Science
90.1K Visualizações

Turbidez e Sólidos Totais em Águas Superficiais
Environmental Science
35.9K Visualizações

Oxigênio dissolvido em Águas Superficiais
Environmental Science
56.0K Visualizações

Nutrientes em Ecossistemas Aquáticos
Environmental Science
39.2K Visualizações

Medição de Ozônio Troposférico
Environmental Science
26.5K Visualizações

Determinação de NOx no escapamento do automóvel usando espectroscopia UV-VIS
Environmental Science
30.4K Visualizações

Análise de chumbo do solo usando espectroscopia de absorção atômica
Environmental Science
126.2K Visualizações

Análise de Carbono e Nitrogênio de Amostras Ambientais
Environmental Science
29.6K Visualizações

Análise de Nutrientes do Solo: Nitrogênio, Fósforo e Potássio
Environmental Science
216.3K Visualizações

Análise de Populações de Minhocas no Solo
Environmental Science
16.6K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados